Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.8 no.1 Trujillo 2017
http://dx.doi.org/10.17268/sci.agropecu.2017.01.03
ARTÍCULOS ORIGINALES
Detección temprana de resistencia a Mycosphaerella fijiensis en genotipos locales de Musáceas en Ecuador
Early detection of resistance to Mycosphaerella fijiensis in local genotypes of Musa in Ecuador
Galo Cedeño García1,*; Carmen Suarez Capello2; Danilo Vera Coello3; Carlo Fadda4; Devra Jarvis4; Paola de Santis4
1 Escuela Superior Politécnica Agropecuaria de Manabí "Manuel Félix López", Campus Politécnico El Limón, Calceta, Manabí, Ecuador.
2 Facultad de Ciencias Agrarias, Universidad Técnica Estatal de Quevedo, Campus "Manuel Haz Álvarez", Av. Quito km. 11/2 vía a Santo Domingo de los Tsáchilas, Quevedo, Los Ríos, Ecuador.
3 Departamento de Protección Vegetal, Estación Experimental Tropical Pichilingue, Instituto Nacional de Investigaciones Agropecuarias, km. 5 vías Quevedo – El Empalme, Quevedo, Los Ríos, Ecuador.
4 Científicos Senior de Bioversity International. Via dei Tre Denari, 472/a 00057 Maccarese, Rome, Italy.
Resumen
El objetivo de la investigación fue determinar la reacción de 14 genotipos de musáceas frente a Mycosphaerella fijensis, agente causal de la Sigatoka negra. Se condujeron dos experimentos en el Departamento de Protección Vegetal de la Estación Experimental Pichilingue del Instituto Nacional de Investigaciones Agropecuarias (INIAP), Ecuador. Los genotipos evaluados fueron: banano Orito (AA), Guineo de jardín, Williams, Filipino, Gros Michel, Mulato y Morado, del genoma (AAA), y los plátanos Limeño, Maqueño, Dominico, Dominico-Hartón, Dominico gigante, Dominico negro y Barraganete, del genoma AAB. Se usaron dos métodos de inoculación: a) in vitro sobre fragmentos de hoja con una suspensión de conidios y b) inoculación de plántulas de ocho semanas de edad con una suspensión micelial. En el primer caso se midió el periodo de incubación (PI) y el número de lesiones a los 14 y 20 días después de la inoculación (DDI). En invernadero, se registró el PI, tiempo de evolución de síntomas (TES) y tiempo de desarrollo de la enfermedad (TDE). Se determinaron diferencias estadísticas significativas (p ≤ 0,05) para todas las variables evaluadas; los cultivares Orito (AA) y Limeño (AAB) calificaron como resistentes, mientras que todos los demás fueron susceptibles, aunque mostraron un rango de variabilidad en la respuesta a las inoculaciones.
Palabras clave: cultivares de Musa; inoculación; inóculo; resistencia; biodiversidad.
Abstract
The aim of this research was to determine resistance reaction of 14 Musa genotypes against Mycosphaerella fijensis, causal agent of Black Sigatoka disease. Two experiments were conducted in laboratory and shadehause at Pichilingue research Station from the National Institute of Agricultural Research (INIAP), Ecuador. Genotypes considered were: Orito (AA), Guineo de jardín, Williams, Filipino, Gross Mitchel, Mulato and Morado, (AAA); Limeño, Maqueño, Dominico, Dominico-Hartón, Dominico gigante, Dominico negro and Barraganete from the AAB genome. Two inoculation methods were used to asses’ resistance: a) in vitro inoculation over leaf fragments with a conidial suspension, and b) inoculation of eight weeks old seedlings with a mycelial suspension of the fungus. In the first case, the incubation period (IP) and the number of lesions at 14 and 20 days after inoculation (DDI) were measured. For in vitro trial, the incubation period (IP) and the number of leaf lesions 14 and 20 days after inoculation (DDI) were measured, and for seedlings, PI, period of symptoms evolution (TES) and time for disease development (TDE) were recorded. Statistically significant (p ≤ 0.05) differences were found for all variables. Cultivars Orito (AA) and Limeño (AAB) qualify as resistant while all the others were susceptible, though response to inoculation within the latter group showed a range of variability.
Keywords: Musa cultivars, inoculatión, inóculum, resistance, biodiversity.
1. Introducción
La Sigatoka negra (Mycosphaerella fijiensis Morelet.), es la enfermedad foliar más destructiva en musáceas, está considerada entre las ocho enfermedades que amenazan la seguridad alimentaria mundial y la del banano como principal especie fruticola tropical (Panissi, 2010; Álvarez et al., 2013; Drenth y Guest, 2016). El patógeno destruye el área foliar por efecto de la excreción de la fitotoxina "juglone", interrumpiendo el trasporte de electrones en las membranas del cloroplasto, provocando necrosis del tejido foliar (El Handrami et al., 2005; Amari et al., 2011). Además, se ha demostrado la activación de genes por parte del hongo durante el proceso patogénico con musáceas (Hidalgo et al., 2016; Noar y Daub, 2016a; Noar y Daub, 2016b).
La enfermedad reduce significativamente la eficiencia fotosintética y, en consecuencia, afecta el llenado de frutos, reduce el tamaño y peso del racimo con la consiguiente merma en la producción del cultivo (Hidalgo et al., 2006; Rodríguez y Cayón, 2008). La enfermedad también se manifiesta en la maduración prematura de frutos en campo o en el trayecto a mercados de destino, dando lugar a la "pulpa cremosa", que representa el principal riesgo de pérdida al que se enfrentan productores y exportadores de la fruta (Guzmán et al., 2013). Esto como consecuencia del reducido número de hojas funcionales a floración y cosecha (Rodríquez et al., 2012).
Existen diversos métodos para el control de Sigatoka negra, entre los cuales el químico y cultural son mayormente usados (Guzmán et al., 2013; Chillet et al., 2013;). Sin embargo, a pesar de un uso intenso de prácticas culturales, el control eficaz de Sigatoka negra se basa en el uso de agroquímicos, lo cual es preocupante por el incremento de casos de perdida de sensiblidad del patógeno hacia fungicidas (Silveira et al., 2014; Aguilar et al., 2014; Fabiane et al., 2015). Actualmente, se cuantifican entre 15 y 60 aplicaciones anuales de fungicidas para el combate de Sigatoka negra, lo que representa el 78% de la inversión total de pesticidas utilizados en la producción de musáceas (Pérez, 2013). Desde el punto de vista preventivo, económico y ambiental, la resistencia genética de cultivares es el método con mayor eficacia y sostenibilidad para control de Sigatoka negra (Cuéllar et al., 2010; Sánchez et al., 2016; Arango et al., 2016); sin embargo, debido a su naturaleza, el desarrollo de resistencia genética en Musa spp es muy difícil debido a la reproducción vegetativa característica de todos los cultivares de musaceas y es necesario incorporar otras tácticas de control como alternativa o complemento del control químico, tales como el control biológico, la nutrición e inducción de resistencia (Aguirre et al., 2015; Sagratzki et al., 2015; Marcano et al., 2016).
En este contexto, se vienen desarrollando investigaciones relacionadas al uso de la diversidad genética intra-específica local, como nueva herramienta para manejar plagas y enfermedades, puesto que a mayores niveles de biodiversidad intraespecífica en una parcela, se dispone de mayores fuentes de resistencia (Marcillo, 2014). Recientes estudios han demostrado que la mezcla intra-específica de cultivares con diferentes niveles de resistencia (monocultivos heterogéneos), limita el desarrollo de enfermedades al reducir el tejido susceptible de uno de los cultivares, dado que el movimiento de inóculo desde una planta susceptible a otra, se ve obstaculizado por la presencia de plantas resistentes (Jarvis et al., 2011; Mulumba et al., 2012; Tuo Seydou et al., 2017). Con la finalidad de implementar sistemas de siembra intra-específicos en la producción comercial de musáceas como una estrategia más del Manejo Integral Fitosanitario, es necesario conocer los niveles de resistencia a Sigatoka negra presentes en cultivares locales de banano y plátano. La detección de niveles de resistencia a Sigatoka negra en condiciones de campo, es muy costosa y extensa, por lo cual se han implementado métodos tempranos de evaluación en condiciones controladas, a través de inoculaciones artificiales (Alvarado et al., 2003; Acosta et al., 2004), lo que ha permitido simplificar procesos de selección principalmente para programas de mejoramiento genético (Kumakech et al., 2015). Lamentablemente, en Musa spp, estos esfuerzos han estado dirigidos prácticamente a un solo cultivar, el Cavendish, aunque con resultados relativos (Giménez y Colmenares, 2004; Cuéllar et al., 2010). Con el fin de romper la uniformidad del monocultivo de Musa en manos de pequeños productores es necesario conocer los niveles de respuesta de todas las opciones a disposición del productor, en relación a la enfermedad. identificando tempranamente genotipos promisorios con características de resistencia.
Investigaciones describen diversas metodologías de inoculación artificial de M. fijiensis, entre las cuales destaca la de Pérez et al. (2006a) y Pérez et al. (2006b), quienes inocularon conidios de M. fijiensis en fragmentos de hoja in vitro de clones de banano y plátano para determinar resistencia, y la agresividad de cepas de M. fijiensis nativas de Cuba. Otra metodología de evaluación temprana, quizás la más usada, es la inoculación de M. fijiensis en vitroplantas a nivel de invernadero, donde se descartan los genotipos susceptibles (Abadie et al., 2008; Cuéllar et al., 2010). Por otra parte, desde que se descubrió que juglone es la principal toxina que produce M. fijiensis durante su proceso patogénico, se utiliza como fuente de inóculo para seleccionar tempranamente genotipos resistentes a la enfermedad (Giménez y Colmenares, 2004; El Handrami et al., 2005; Amari et al., 2011).
En este contexto, el objetivo del presente estudio fue identificar el grado de tolerancia y/o resistencia de varios genotipos de musáceas presentes en Ecuador al ataque de Sigatoka negra, mediante metodologías de evaluación temprana.
2. Materiales y métodos
El experimento se desarrolló en el laboratorio e invernadero del Departamento Nacional de Protección Vegetal de la Estación Experimental Tropical Pichilingue, del Instituto Nacional de Investigaciones Agropecuarias (INIAP), Quevedo, Ecuador. Se realizaron dos ensayos separados, uno in vitro a nivel de laboratorio, donde se inoculó M. fijiensis sobre fragmentos de hoja y otro a nivel de invernadero realizando la inoculación en vitroplantas de ocho semanas de edad.
Genotipos evaluados
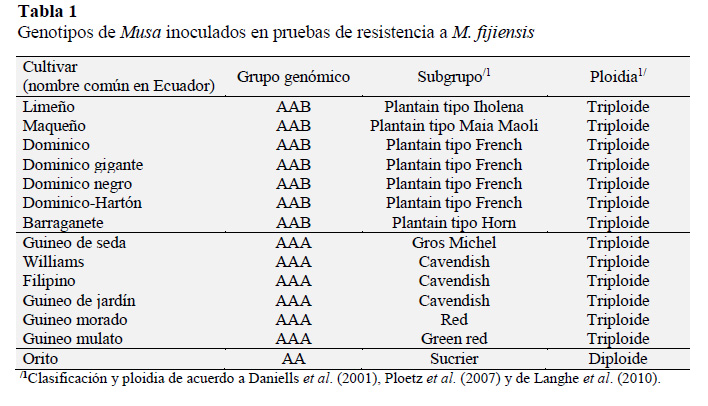
Se evaluaron catorce genotipos locales de musáceas, siete pertenecientes al grupo genómico AAB, seis al AAA y uno al AA (Tabla 1).
Origen y preparación del inóculo
Para ambos ensayos, el inóculo se obtuvo a partir de aislamientos monoascospóricos M. fijiensis. Para el ensayo in vitro, se utilizó como fuente de inóculo una suspensión conidial que fue ajustada a una concentración de 40 conidios mL-1, según lo propuesto por Pérez et al. (2006a). Para el ensayo de invernadero, el inóculo fue una suspensión de micelio y esporas (UFC), obtenido mediante maceración y filtrado de colonias procedentes de cultivos monoascopóricos. En ambos casos la suspensión fue ajustada a 105 UFC mL-1, según la concentración propuesta por Alvarado et al. (2003), Acosta et al. (2004) y Leiva et al. (2010). El contaje se realizó con la cámara de Newbauer.
Origen y preparación del material vegetal
Algunos de los cultivares a probarse están ampliamente disponibles en fincas; sin embargo, en este estudio se probaron cultivares menos conocidos y difíciles de conseguir en la edad y condiciones que se necesitaban, por lo que se decidió multiplicar todos los cultivares por cultivo de tejido en el laboratorio de biotecnología de la Estación Experimental Tropical Pichilingue del INIAP.
Ensayo in vitro (fragmentos de hoja)
Para el ensayo in vitro se utilizó una modificación de la metodología propuesta por Pérez et al. (2006a): se colectaron limbos foliares correspondientes a la hoja N° 1 completamente expandida, en plántulas de ocho semanas de edad. De esta hoja se cortaron fragmentos de 3,5 x 3,5 cm. A continuación se lavaron con agua destilada estéril, y se colocaron en placas de Petri conteniendo agar-agua semilíquido (2 g de agar.L-1 de agua) + 40 μg.mL-1 de benzimidazol, lo cual fue estandarizado en ensayos previos al experimento, dado que Pérez et al. (2006a) utilizaron agar-agua sólido. Los fragmentos se colocaron en contacto con el medio agar-agua semilíquido por el lado adaxial (haz). Para evitar que los extremos del fragmento se separen del agar, Pérez et al. (2006a) recomiendan colocar sobre cada fragmento, una lámina transparente plástica estéril del mismo tamaño interior de la placa, dejando solamente un cuadrado de 3 x 3 cm para realizar las inoculaciones. Sin embargo, en pruebas previas de ajuste, se estableció que utilizando agar-agua semilíquido es suficiente para evitar que los extremos del fragmento de hoja se separen del agar, por lo cual no fue necesario utilizar la lámina plástica transparente.
La superficie expuesta del fragmento de hoja (envés) se inoculó con 100 μL de la suspensión conidial (40 conidias mL-1), utilizando una micro pipeta automática, y luego se distribuyó el inóculo sobre la superficie del fragmento con un pincel esterilizado. Realizada la inoculación, las placas Petri fueron selladas con parafilm y colocadas en una cámara climatizada a 26 °C bajo luz fluorescente, hasta observar la aparición de síntomas y completar el registro de datos. Se registró el periodo de incubación (PI), que comprende desde la inoculación hasta la aparición del primer síntoma (pizca E1). También se registró el tiempo de evolución de los síntomas (TES), que comprende desde la aparición del primer síntoma o estado E1 hasta el estado E6 de la enfermedad, según la escala de Fouré (1985) (Figura 1). Además, se contabilizó diariamente el número de lesiones que aparecieron sobre los fragmentos a los 14 y 20 días después de la inoculación. Se utilizó un diseño completamente aleatorizado (DCA) con ocho repeticiones por tratamiento. El análisis de datos se realizó a través del ANOVA, y la separación de medias con la prueba de Tukey (p ≤ 0,05). Se utilizó para el análisis estadístico el paquete estadístico Infostat Profesional versión 2008.
Ensayo en invernadero
En invernadero se siguió la metodología propuesta por Leiva et al. (2010). Se utilizaron plántulas de ocho semanas de edad, las cuales crecieron en macetas plásticas de 1 kg de capacidad, sobre sustrato compuesto por compost, arena y cascarilla de arroz en relación 4:3:3. Siete días antes de la inoculación, las plantas fueron colocadas en un cuarto de inoculación a condiciones de humedad (90%) y sometidas a luz constante para dar condiciones óptimas de desarrollo del patógeno y causar infección, puesto que la luz es necesaria para el proceso patogénico de M. fijiensis (Beltrán et al., 2014). Antes de la inoculación, se agregó 1% de gelatina a la suspensión de micelio con la finalidad de que el inóculo se fije a la superficie de la hoja (Leiva et al., 2010). Inmediatamente, la suspensión de micelio se aplicó con un pincel en toda la lámina foliar de la cara abaxial (envés) de las tres hojas más jóvenes completamente extendidas. Se dejó secar la superficie inoculada por dos horas, y luego se mantuvo la humedad relativa entre 90-100%, por medio de micro-nebulizadores que se accionaban cada 15 minutos por 15 segundos. Esta humedad se mantuvo constante durante los primeros tres días, posteriormente oscilaba por encima del 80%, hasta la aparición de síntomas y desarrollo completo de la enfermedad. En cada cultivar se evaluaron los siguientes parámetros:
Periodo de incubación (PI): tiempo entre la inoculación y la aparición de las primeras lesiones (pizca) por el envés de la hoja, según la escala de Fouré (1985).
Tiempo de evolución de síntomas (TES): número de días entre la aparición de los primeros síntomas (pizca) y la aparición del último estadio de la enfermedad (manchas grisáceas), según la escala de Fouré (1985).
Tiempo de desarrollo de la enfermedad (TDE): tiempo considerado desde la inoculación hasta la aparición del estado más avanzado de la enfermedad (mancha grisácea), según la escala de Fouré (1985).
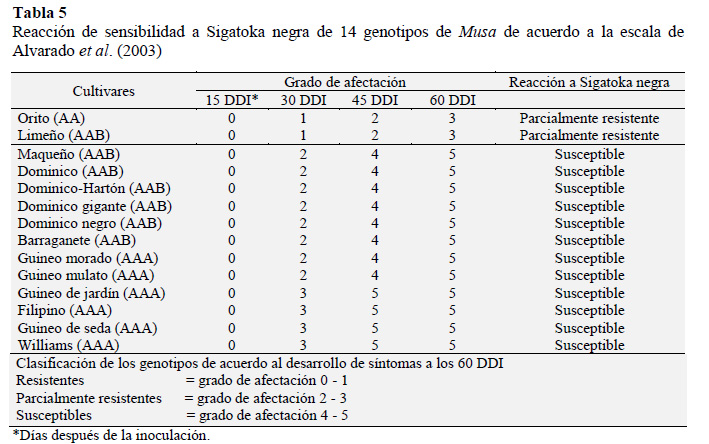
Finalmente, se evaluó a los 15, 30, 45 y 60 días después de la inoculación, el grado de afectación en cada cultivar asignándole el correspondiente nivel de resistencia, según la escala propuesta por Alvarado et al. (2003) (Tabla 2).
Para la fase de invernadero, se utilizó un diseño completamente aleatorizado (DCA) con ocho repeticiones por tratamiento (genotipos). El análisis de datos se realizó a través del ANOVA, y la separación de medias con la prueba de Tukey (p ≤ 0,05). Se utilizó para el análisis estadístico Infostat Profesional Versión 2008.
3. Resultados y discusión
Ensayo in vitro (fragmentos de hoja)
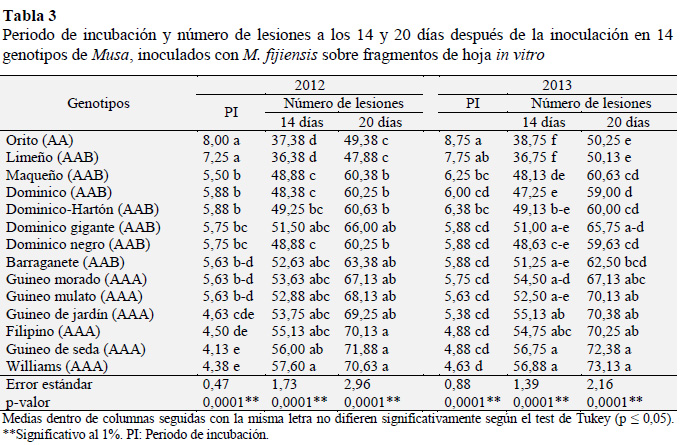
Las variables periodo de incubación y número de lesiones a los 14 y 20 días mostraron diferencias altamente significa- tivas (p ≤ 0,01) en ambos periodos de evaluación (Tabla 3). Los resultados bajo condiciones in vitro evidencian que los cultivares Orito (AA) y Limeño (AAB) presentan mayor tolerancia a la enfermedad, al mostrar un periodo de incubación más largo y menor cantidad de lesiones a los 14 y 20 días después de la inoculación (Tabla 3). En contraste, los clones de banano Guineo de jardín, Williams, Guineo de seda y Filipino todos con el genoma AAA, presentaron mayores niveles de susceptibilidad a la enfermedad, al presentar mayor número de lesiones y un periodo de incubación relativamente corto.
Por su parte, los clones de plátano Maqueño, Barraganete, Dominico-Hartón, Dominico, Dominico negro y Dominico gigante todos con el genoma AAB, junto a los clones de banano Guineo morado y mulato con el genoma AAA, mostraron un comportamiento intermedio, en cuanto a periodo de incubación y número de lesiones (Tabla 3).
Los resultados obtenidos en el presente experimento concuerdan con los reportes de Pérez et al. (2006a), quienes observaron más de 90 lesiones en fragmentos de hoja del cultivar Gran Enano (altamente susceptible), en contraste a las 23 lesiones observadas en FHIA-02 (parcialmente resistente) durante el mismo periodo de evaluación. Similar tendencia fue observada por Pérez et al. (2006b) a los 14 y 20 días después de la inoculación con dos cepas M. fijiensis sobre fragmentos de hojas de los mismos cultivares reportados por Pérez et al. (2006a).
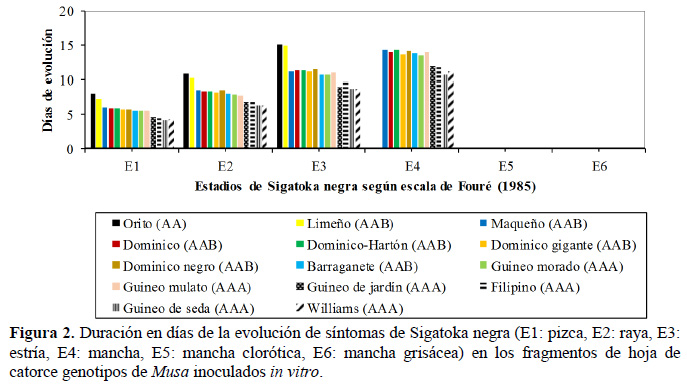
Con el promedio de las dos épocas de evaluación (2012 y 2013) se graficó la dinámica de evolución de síntomas de Sigatoka negra sobre fragmentos de hoja, lo cual evidencia mayor tolerancia de los cultivares Orito (AA) y Limeño (AAB), dado que en ambos genotipos se alcanzó como máximo hasta el estado E3 de la enfermedad, que ocurrió alrededor de los 14 – 15 DDI, tiempo en el cual se detuvo la evolución de los síntomas (Figura 2). En contraste, los cultivares de banano Guineo de jardín, Filipino, Guineo de seda y Williams todos con el genoma AAA mostraron alta susceptibilidad al patógeno, puesto que el estado E3 se alcanzó en un tiempo tres veces inferior al de los anteriores. Los cultivares de banano Guineo morado (AAA) y Guineo mulato (AAA), junto a los cultivares de plátano AAB mostraron un tiempo de evolución de síntomas intermedio (Figura 2).
Los resultados se asemejan a los reportados por Pérez et al. (2006a), quienes observaron sobre fragmentos de hojas, que el cultivar Gran Enano (altamente susceptible) alcanzó el estado E5 de la enfermedad durante el tiempo de evaluación, mientras que en cultivares parcialmente resistentes como los FHIA- 02, FHIA-23, FHIA-18 y FHIA-21 el estado E5 no fue alcanzado y el estado E3 fue dos veces mayor con respecto a Gran Enano. Por su parte, Giménez y Colmenares (2004) con otra metodología de inoculación in vitro basada en las toxinas de M. fijiensis, observaron altos índices de toxicidad en banano Williams (altamente susceptible) a concentraciones de 0,05 µg•mL-1, mientras que los cultivares Yangambi km 5 y FHIA-21 (resistentes) fueron tolerantes a las toxinas, en concentración de 50 µg mL-1.
En consecuencia, los resultados obtenidos junto a los reportados por los autores mencionados, validan la potencialidad de las metodologías de inoculación artificial in vitro para la evaluación temprana de reacciones de resistencia de diferentes clones de musáceas.
Ensayo en invernadero (vitroplantas)
En ambos periodos de evaluación (2012 y 2013), las variables PI, TES y TDE mostraron diferencias altamente significativas (p ≤ 0,01). El banano Orito (AA) y el plátano Limeño (AAB) fueron estadísticamente iguales, pero difieren al resto de cultivares. Ambos se destacaron por un mayor nivel de tolerancia a la enfermedad, al alcanzar valores de 25 y 24 días de PI, 50 y 48 días para TES y 76 y 71 días para TDE, que son periodos más prolongados en comparación a los demás cultivares (Tabla 4). Por el contrario, los cultivares de banano guineo de jardín, Williams, Filipino y Gros Michel, todos con el genoma AAA, se agruparon en un rango de significancia común, al alcanzar un PI entre los 16 y 17 días, TES entre los 36 y 37 días y completaron el TDE entre los 43 y 48 días, que son tiempos relativamente cortos y reflejan mayor susceptibilidad a la enfermedad. Por su parte los cultivares de banano Mulato y Morado (AAA), junto a los demás cultivares de plátano AAB mostraron valores intermedios de PI, TES y TDE en relación a los demás clones descritos (Tabla 4).
Los resultados se asemejan a los de Molina y Castaño (2003) quienes observaron menor tiempo en PI, TES y TDE en los clones Gros Michel y Dominico-Hartón considerados susceptibles y mayor PI, TES y TDE en los clones FHIA-01, FHIA-17 y FHIA-21 que son clones tolerantes a Sigatoka negra. Resultados similares fueron hallados por Acosta et al. (2004) quienes observaron menor TES y TDE en el banano Gran Enano (altamente susceptible) en contraste al FHIA-18 (resistente) que presento mayor TES y TDE bajo condiciones de casa de cultivo. Asimismo, Divine et al. (2011) y Leiva et al. (2015) reportaron resultados muy acordes a los hallados en este estudio. En este contexto, la importancia de los resultados hallados radica, en que el método de inoculación en invernadero con suspensión de micelio fue eficaz para discriminar resistencia tem- prana entre cultivares de banano y plátano a Sigatoka negra.
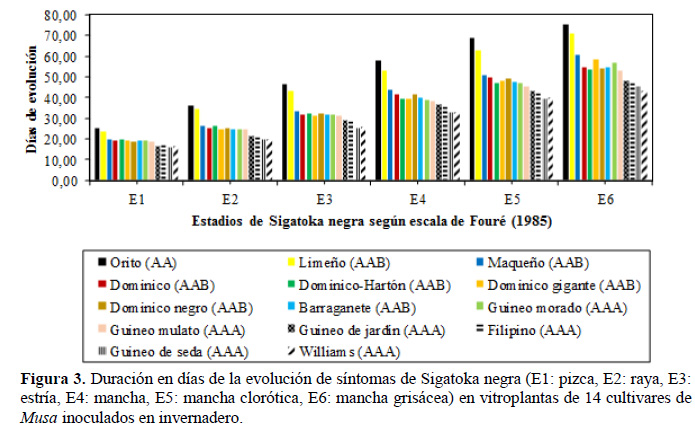
Con el promedio de las dos épocas de evaluación (2012 y 2013), se graficó la evolución de síntomas de Sigatoka negra para los diferentes genotipos evaluados a nivel de invernadero (Figura 3). Los cultivares de banano Orito (AA) y plátano Limeño (AAB) alcanzaron todos los estados evolutivos de la enfermedad en un mayor periodo de tiempo, que comprendió entre los 71 y 76 días, lo cual refleja mayor tolerancia al patógeno. En contraste los cultivares de banano Gros Michel, guineo de jardín, Filipino y Williams del genoma AAA, alcanzaron el máximo estado evolutivo alrededor del día 45, lo que demuestra la alta susceptibilidad de estos clones a Sigatoka negra. Los cultivares de banano Mulato y Morado del genoma AAA presentaron estados evolutivos similares a los demás cultivares de plátano AAB, los mismos que mostraron una reacción intermedia a la enfermedad al alcanzar el máximo estado de desarrollo de la enfermedad (E6) entre los 54 – 60 días después de la inoculación.
Lo hallado coincide a lo reportado por Leiva et al. (2002) quienes observaron el estado E5 de la enfermedad a las ocho semanas después de la inoculación en el banano Gran Enano (considerado como altamente susceptible), mientras que el clon FHIA-18 (parcialmente resistente) alcanzó el estado E3 en el mismo periodo tiempo. Similar situación reportó Alvarado et al. (2003) que registraron el estado E4 en banano Gran Naine (susceptible) a los 60 días después de la inoculación, en contraste a los cultivares FHIA-01, FHIA- 18 y FHIA-21 (parcialmente resistentes) que alcanzaron el estado E2 en el mismo tiempo de evolución, lo cual concuerda a lo reportado por Acosta et al. (2004) para los clones Gran Naine y FHIA-18. De acuerdo a la escala de evaluación de Alvarado et al. (2003), los cultivares de banano Orito (AA) y de plátano Limeño (AAB) se comportaron como parcialmente resistentes a Sigatoka negra, mientras que el resto de cultivares mostraron susceptibilidad (Tabla 5). La reacción de resistencia parcial hallada para el plátano Limeño (AAB), coincide a lo descrito por Mourichon et al. (2000) quienes mencionan que los plátanos del subgrupo Iholena como el Limeño, muestran una resistencia parcial a la enfermedad.
En banano Orito (AA) los resultados se asemejan a los encontrados por Cuellar et al. (2010) en banano sedita (AA), quienes hallaron una reacción de resistencia intermedia hacia la virulencia de varias cepas de M. fijiensis en condiciones de invernadero. Por su parte Daniells (2000) describe a los bananos diploides del subgrupo Sucrier (AA) como sensibles a Sigatoka negra, sin embargo, menciona que esta respuesta varietal puede variar de acuerdo al ambiente y a la virulencia de cepas del patógeno. Esto coincide a lo reportado por Vera (2003), quien observó diferentes niveles de virulencia entre cepas de M. fijiensis aisladas de banano y plátano y provenientes de varios ambientes de Ecuador. Por otra parte, informes de Jones (1993) describen al banano Sucrier (AA) como resistente a Sigatoka negra. De manera opuesta, otros autores mencionan a bananos diploides del subgrupo Sucrier como sensibles a la enfermedad, aunque en un grado menor a los del subgrupo Cavendish y French Plantain (Giménez y Colmenares, 2004; Amari et al., 2011). La Figura 4 muestra el grado de daño por M. fijiensis a los 60 días después de la inoculación en 14 genotipos de musáceas bajo condiciones de invernadero.
La resistencia parcial mostrada por los cultivares Orito (AA) y Limeño (AAB) a Sigatoka negra, puede estar en función a componentes anatómicos, histológicos y bioquímicos encontrados en otros cultivares con resistencia a la enfermedad (Torres et al., 2009; Leiva et al., 2015). En este sentido, Valerio et al. (2002) y Hernández et al. (2006) observaron que los cultivares resistentes están asociados a mayores grosores cuticulares y epidérmicos, así como también a una menor densidad estomática, lo cual podría dificultar la invasión y colonización del tejido foliar. Sin embargo, resultados posteriores obtenidos por Sánchez et al. (2010) demuestran que los componentes anatómicos no están completamente relacionados a la resistencia o susceptibilidad de cultivares a Sigatoka negra. Desde el punto de vista bioquímico El Hadrami et al. (2005) y Amari et al. (2011) mencionan que la resistencia puede estar asociada a una mayor expresión de antioxidantes con alta afinidad a las especies de oxigeno reactivo (ROS), que se producen durante la interacción Musa – Mycosphaerella, lo cual se relaciona a mayor tolerancia a la enfermedad.
Sin embargo, en base a los resultados obtenidos en el presente estudio, no se puede asegurar que estas características anatómicas y bioquímicas estén presentes en los cultivares Orito (AA) y Limeño (AAB), por lo tanto, solo es posible hipotetizar que ocurre algo cercano a lo descrito en los trabajos mencionados. Es necesario realizar investigaciones encaminadas a estudiar la interacción de los cultivares Orito y Limeño con Sigatoka negra, desde el punto de vista estructural y bioquímico.
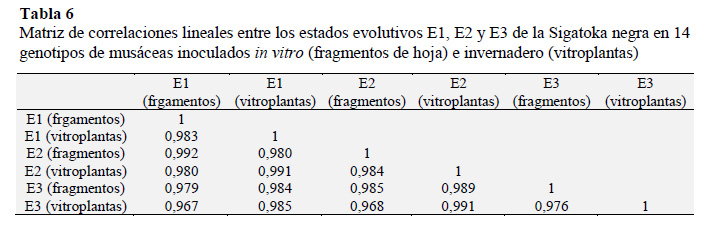
El desarrollo de estados evolutivos E1, E2 y E3 de la enfermedad mostró correlación
positiva significativa entre ambas método- logías de inoculación (Tabla 6), lo cual sugiere que ambos métodos tienen potencial para discriminar resistencia temprana en cultivares de banano y plátano. Esto coincide a lo expuesto por Pérez et al. (2006a), quienes describen que la dinámica de evaluación de síntomas en los fragmentos de hoja correspondió con la expresión de los síntomas en campo.
No fue posible evaluar en los fragmentos de hoja el tiempo de evolución de los síntomas completamente (TES) ni el desarrollo total de la enfermedad (TDE) dado el corto periodo de sobrevivencia en verde que presentaron los fragmentos
(alrededor de 18 – 22 días), lo cual concuerda a lo descrito por Pérez et al. (2006a) y Pérez et al. (2006b).
Por lo anterior, se debería hacer ajustes al protocolo para alargar la longevidad de los fragmentos, o utilizar otras metodologías de evaluación temprana como las reportadas por Giménez y Colmenares (2004) y Amari et al. (2011) donde se utiliza las toxinas del patógeno como inóculo para discriminar resistencia temprana en genotipos de musaceas. Finalmente, estos resultados sugieren que los cultivares Orito (AA) y Limeño (AAB) muestran buen potencial para ser recomendados en el establecimiento de sistemas de producción basados en mezclas intra-específicas de variedades resistentes y susceptibles, con la finalidad de reducir fuente de inoculo y altos niveles de severidad de Sigatoka negra. En este sentido, Zhu et al. (2000), Castilla et al. (2003), Altieri y Nicholls (2004), Didelot et al. (2007), Mulumba et al. (2012) y Jarvis et al. (2011) sugieren que el establecimiento de monocultivos heterogéneos (mezcla varietal) incrementa el uso de la diversidad genética local y disminuye el impacto de plagas y enfermedades sobre los cultivos, así como de agroquímicos sobre los diversos agro-ecosistemas.
4. Conclusiones
El banano Orito (AA) y el plátano Limeño (AAB) mostraron mayor nivel de resistencia a Sigatoka negra. La metodología de inoculación temprana sobre fragmentos de hoja se correlacionó positivamente con la inoculación en vitroplantas, por lo que ambas técnicas pueden ser utilizadas en la detección temprana de resistencia.
No fue posible evaluar el ciclo completo de la enfermedad en fragmenteos de hoja, por lo que se recomienda realizar ajustes al procolo para incrementar la vida en verde de los fragmentos. Los cultivares Orito (AA) y Limeño (AAB) se presentan como una oportunidad para ser explotados en sistemas intra-específicos de producción de musáceas.
Agradecimientos
A Bioversity International (Research for Development in Agricultural and tree biodiversity) por el apoyo financiero en el marco del proyecto "Conservación y uso de la diversidad genética cultivada para el control de plagas en apoyo a la agricultura sostenible".
Referencias bibliográficas
Abadie, C.; Zapater, M.; Pignolet, L.; Carlier, J.; Mourichon, X. 2008. Artificial inoculation on plants and banana leaf pieces with Mycosphaerella spp., responsible for Sigatoka leaf spot diseases. Fruits 63(5): 319 – 323. [ Links ]
Acosta, M.; Alvarado, Y.; Cruz, M.; Leiva, M.; Roque, B. 2004. Evaluación en casa de cultivo de la respuesta a la Sigatoka negra de dos cultivares de Musa mediante la inoculación artificial de suspensiones conidiales de Pseudocercospora fijiensis. Biotecnología Vegetal 4(2): 77 – 84. [ Links ]
Aguilar, A.; García, A.; Odrizola, O.; Macedo, G.; Ogura, T.; Manzo, G.; James, A.; Islas, I.; Beltrán, M. 2014. Chemical management in fungicide sensivity of Mycosphaerella fijiensis collectedfrom banana fields in México. Brazilian Journal of Microbiology 45(1): 359 – 364. [ Links ]
Aguirre, S.; Piraneque, N.; Rodríguez, J. 2015. Relationship between the nutritional status of banana plants and black sigatoka severity in the Magdalena region of Colombia. Agronomía Colombiana 33(3): 348 – 355. [ Links ]
Alvarado, Y.; Leiva, M.; Dita, M.; Acosta, M.; Cruz, M.; Portal, N.; Gómez, R.; García, L.; Bermúdez, I.; Padrón, J. 2003. Early Evaluation of black leaf streak resistance by using mycelial suspensions of Mycosphaerella fijiensis. In: Jacome L., Lepoivre P., Marin D., Ortiz R., Romero R., and Escalant J.V. Mycosphaerella leaf spot diseases of bananas: present status and outlook. Montpellier, France, INIBAP. [ Links ]
Álvarez, E.; Pantoja, A.; Gañán, L.; Ceballos, G. 2013. Estado del arte y opciones de manejo del Moko y la Sigatoka negra en América Latina y el Caribe. CIAT – FAO. Cali, Colombia. 40 pp. [ Links ]
Amari, E.; Dick, E.; Kone, D.; Abo, K.; Kobenan, K. 2011. Response to juglone toxic effect in various genotypes of banana (Musa AA, AAA, AAB, AAAA, AAAB). Agronomie Africaine 23(3): 247 – 258. [ Links ]
Altieri, M.; Nicholls, C. 2004. Biodiversity and pest management in agroecosystems 2nd ed. Binghamton, USA. Food Products Press. [ Links ]
Arango, R.; Diaz, C.; Dhillon, B.; Aerts, A.; Carlier, J.; Crane, C.; de Jong, T.; de Vries, I.; Dietrich, R.; Farmer, A.; Fortes, C.; García, S.; Guzmán, S.; Hamelin, R.; Lindquist, E.; Mehrabi, R.; Quiros, O.; Schmutz, J.; Shapiro, H.; Reynolds, E.; Scalliet, G.; Souza, M.; Stergiopoulus, I.; Van der Lee, T.; De wit, P.; Zapater, M.; Zwiers, L.; Grigoriev, I.; Goodwin, S.; Kema, G. 2016. Combating a Global Threat to a Clonal Crop: Banana Black Sigatoka Pathogen Pseudocercospora fijiensis (Synonym Mycosphaerella fijiensis) Genomes Reveal Clues for Disease Control. PLoS Genet 12(8): 1 – 36. [ Links ]
Beltrán, M.; Prado, F.; Oliveira, M.; Ortíz, D.; Scalfo, A.; Pessoa, A.; Medeiros, M.; White, J.; Di Mascio, P. 2014. Singlet Molecular Oxygen Generation by Light- Activated DHN-Melanin of the Fungal Pathogen Mycosphaerella fijiensis in Black Sigatoka Disease of Bananas. PLOS ONE 9(3): 1 – 15. [ Links ]
Castilla, N.; Vera-Cruz, C.; Mew, T. 2003. Using rice cultivars mixtures: a sustainable approach for managing diseases and increasing yield. Mini Review. IRRN 28(2): 5 – 11. [ Links ]
Cuéllar, A.; Álvarez, E.; Castaño, J. 2010. Evaluación de Resistencia de Genotipos de Plátano y Banano a la Sigatoka Negra (Mycosphaerella fijiensis Morelet.). Rev.Fac.Nal.Agr. Medellín 64(1): 5853-5865. [ Links ]
Chillet, M.; Castelan, F.; Abadie, C.; Hubert, O.; De Bellaire, L. 2013. Necrotic leaf removal, a key component of integrated management of Mycospaerella leaf spot diseases to improve the quality of banana: the case of Sigatoka disease. Fruits 68: 271 – 277. [ Links ]
Daniells, J. 2000. ¿Qué variedad de banano debo cultivar?. InfoMusa 9(1): 31 – 33. [ Links ]
Daniells, J.; Jenny, C.; Karamura, D.; Tomekpe, K. 2001. Musalogue: a catalogue of Musa germplasm. Diversity in the genus Musa (E. Arnaud and S. Sharrock, compil.). International Network for the Improvement of Banana and Plantain, Montpellier, France. 213 p. [ Links ]
de Langhe, E.; Hribova, E.; Carpentier, S.; Dolezel, J.; Swennen, R. 2010. Did backcrossing contribute to the origin of hybrid edible bananas. Annals of Botany 106: 849 – 857. [ Links ]
Drenth, A.; Guest, D. 2016. Fungal and oomycete diseases of tropical tree fruit crops. Annu. Rev. Phytopathol. 54: 373 – 395. [ Links ]
Divine, T., Dominic, F.; Ivo, L. 2011. Evaluation of varietal response to black Sigatoka caused by Mycosphaerella fijiensis Morelet in banana nursery. Int. Res. J. Plant Sci. 2(10): 299 – 304. [ Links ]
Didelot, F.; Brun, L.; Parisi, L. 2007. Effects of cultivar mixtures on scab control in apple orchards. Plant Pathology 56: 1014 – 1022. [ Links ]
El Handrami, E.; Kone, D.; Lepoivre, P. 2005. Effect of juglone on active oxygen species and antioxidant enzymes in susceptible and partially resistant banana cultivars to black leaf streak disease. European Journal of Plant Pathology 113(3): 241-254. [ Links ]
Fabiane, D., Bart, F.; Robert, M. 2015. Sigatoka Disease Complex of Banana in Brazil: Management Practices and Future Directions. Outlooks on Pest Management 26(2): 78 – 81. [ Links ]
Fouré, E. 1985. Black leaf streak disease of bananas and plantains (Mycosphaerella fijiensis Morelet), study of the symptoms and stages of the disease in Gabon. Irfa, Paris. [ Links ]
Giménez, C.; Colmenares, M. 2004. Evaluación in vitro de la resistencia a las toxinas de Mycosphaerella fijiensis en Musa spp. Ciencia 12(4): 251 – 257. [ Links ]
Guzmán, M.; Orosco, M.; Pérez, V. 2013. Las enfermedades Sigatoka de las hojas del banano: dispersión, impacto y evolución de las estrategias de manejo en América Latina y el Caribe. En: Memorias de la XX Reunión Internacional ACORBAT, 9 – 13 de Septiembre 2013, Fortaleza, Ceará, Brasil. [ Links ]
Hernández, Y.; Portillo, F.; Portillo, M.; Navarro, C.; Rodríguez, M.; Velazco, J. 2006. Densidad estomática en materiales de plátano (Musa AAB, AAAB y ABB) susceptibles y resistentes a Sigatoka Negra (Mycosphaerella fijiensis, Morelet). Rev. Fac. Agron. (LUZ) 23: 292 – 297. [ Links ]
Hidalgo, M.; Tapia, A.; Rodríguez, W.; Serrano, E. 2006. Efecto de la Sigatoka negra (Mycosphaerella fijiensis) sobre la fotosíntesis y transpiración foliar del banano (Musa sp. AAA, cv. Valery). Agronomía Costarricense 30(1): 35-41. [ Links ]
Hidalgo, W.; Chandran, J.; Menezes, R.; Otálvaro, F. and Schneider, B. 2016. Phenylphenalenones protect banana plants from infection by Mycosphaerella fijiensis and are deactivated by metabolic conversion. Plant. Cell. Environ. 39(39): 492 – 513. [ Links ]
Jarvis, D.; Hodgkin, T.; Sthapit, B.; Fadda, C.; López, I. 2011. An Heuristic Framework for Identifying Multiple Ways of Supporting the Conservation and Use of Traditional Crop Varieties within the Agricultural Production System. Critical Reviews in Plant Science 30: 125 – 176. [ Links ]
Jones D. 1993. Evaluating banana and plantain for reaction to black leaf streak disease in the South Pacific. Tropical Agriculture 70: 39-44. [ Links ]
Kumakech, A.; Lyngs, H.; Edema, R.; Okori, P. 2015. Efficient screening procedure for black Sigatoka disease of banana. African Crop Science Journal 23(4): 387 – 397. [ Links ]
Leiva, M.; Dita, M.; Alvarado, Y.; Acosta, M.; García, L.; Bermúdez, I. 2002. Empleo de diferentes inóculos de Mycosphaerella fijiensis Morelet en condiciones de invernadero para evaluar el comportamiento de dos cultivares de banano. InfoMusa 11(2): 41 – 42. [ Links ]
Leiva, M.; Alvarado, Y.; Acosta, M.; Cruz, M.; Sánchez, C.; Roque, B. 2010. Protocolo para la inoculación artificial de plantas de Musa spp. con Mycosphaerella fijiensis y evaluación de su respuesta mediante variables epifitiológicas y componentes de resistencia. Biotecnología vegetal 10(2): 79 – 88. [ Links ]
Leiva, M.; Alvarado, Y.; Acosta, M.; Cruz, M.; Roque, B.; Mena, E. 2015. Components of resistance to assess Black Sigatoka response in artificially inoculated Musa genotypes Rev. Protección Vegetal 30: 60 – 69. [ Links ]
Marcano, I.; Díaz, C.; Seco, V.; Urbano, B.; González, F. 2016. Induced Systemic Resistance Could Explain the Reduction in the Incidence of Black Sigatoka (Mycosphaerella fijiensis) in Banana Plants Inoculated with Bacteria Isolated from Banana Tree Roots in the Dominican Republic. In: González-Andrés F., James E. (eds) Biological Nitrogen Fixation and Beneficial Plant-Microbe Interaction. Springer, Cham. [ Links ]
Marcillo, J. 2014. Contribución económica de la biodiversidad intraespecífica: Caso Musas spp., en El Carmen y La Maná a nivel del pequeño productor. Editora Académica Española, Madrid, España. 192 pp. [ Links ]
Mourichon, X.; Lepoivre, P.; Carlier, J. 2000. Host – Pathogens interactions. Chapter 2. Fungal disease of follaje. In: disease of banana. 67 – 72 pp. [ Links ]
Molina, O.; Castaño, J. 2003. Análisis de algunos componentes de resistencia en los híbridos de banano y plátano FHIA 01, FHIA 17 y FHIA 21 a las Sigatokas negra (Mycosphaerella fijiensis Morelet) y amarilla (M. musicola Leach). Rev. Acad. Colomb. Cienc. 27(103): 181 – 190. [ Links ]
Mulumba, J.; Nankya, R.; Adokorach, J.; Kiwuka, C.; Fadda, C.; De Santis, P.; Jarvis, D. 2012. A riskminimizing argument for traditional crop varietal diversity use to reduce pest and disease damage in agricultural ecosystems of Uganda. Agriculture, Ecosystems and Environment 157: 70 – 86. [ Links ]
Noar, R.; Daub, M. 2016a. Transcriptome sequencing of Mycosphaerella fijiensis during association with Musa acuminata reveals candidate pathogenicity genes. BMC Genomics 17(690): 1 – 25. [ Links ]
Noar, R.; Daub, M. 2016b. Bioinformatics Prediction of Polyketide Synthase Gene Clusters from Mycosphaerella fijiensis. PLoS ONE 11(7): 1 – 31. [ Links ]
Panissi, E. 2010. Armed and dangerous. Science 327: 804-805. [ Links ]
Pérez, L.; Pérez, M.; Jiménez, M.; Jama, M. 2006a. Ensayo en fragmentos de hojas de bananos y plátanos (Musa spp.) para el estudio a nivel monocíclico de la evolución de los síntomas de la Sigatoka negra causada por Mycosphaerella fijiensis Morelet. Fitosanidad 10(1): 3 – 9. [ Links ]
Pérez, M.; Pérez, L.; Trujillo, R.; Betancourt, D. 2006b. Variabilidad de Mycosphaerella fijiensis Morelet., estabilidad de la resistencia a Sigatoka negra de los clones híbridos de la FHIA. Fitosanidad 10: 37 – 47. [ Links ]
Pérez, L. 2013. Estrategias para reducir el uso de agroquímicos en bananos y plátanos. En: Memorias de la XX Reunión Internacional ACORBAT, 9 – 13 de Septiembre 2013, Fortaleza, Ceará, Brasil. [ Links ]
Ploetz, R.; Kepler, A.; Daniells, J.; Nelson, S. 2007. Banana and plantain—an overview with emphasis on Pacific island cultivars, ver. 1. In: Elevitch, C.R. (ed.). Species Profiles for Pacific Island Agroforestry. Permanent Agriculture Resources (PAR), Hōlualoa, Hawai‘i. Disponible en: http://www.ctahr.hawaii.edu/sustainag/extn_pub/fruitp ubs/Banana-plantain-overview.pdf
Rodríguez, A.; Cayón, G. 2008. Efecto de Mycosphaerella fijiensis sobre la fisiología de la hoja de banano. Agronomía Colombiana 26(2): 256-265. [ Links ]
Rodríguez, C.; Cayón, D.; Mira, J. 2012. Effect of Number of Functional Leaves at Flowering on Yield of Banana Grand Naine (Musa AAA Simmonds). Rev. Fac. Nal. Agr. Medellín 65(2): 6585-6591. [ Links ]
Sánchez, C.; Alvarado, Y.; Acosta, M.; Cruz, M.; Leiva, M.; Roque, B. 2010. Relación entre caracteres fenotípicos de plantas de ‘Grande Naine’ y ‘Calcutta 4’ cultivadas in vitro y su respuesta a la inoculación con Mycosphaerella fijiensis en casa de cultivo. Biotecnología Vegetal 10(1): 21 – 30.
Sánchez, E.; Hidalgo, L.; Pacheco, R.; Chávez, T., Navarrete, O.; Santos, E. 2016. Identification of differentially-expressed genes in response to Mycosphaerella fijiensis in the resistant Musa accession ‘Calcutta-4’ using suppression subtractive hybridization. PLoS ONE 11(8): 1 – 17.
Sagratzki, P.; Eiji, R.; Gasparotto, L.; Albuquerque, R.; Teodoro de Souza, J. 2015. Biological control of banana black Sigatoka disease with Trichoderma. Ciência Rural 45(6): 951 – 957. [ Links ]
Silveira, L.; Bibiano, L.; Ferreira, G.; Eiji, R.; Mizubuti, E. 2014. Baseline sensitivity of Brazilian Mycosphaerella fijiensis isolates to protectant and systemic fungicides. Tropical Plant Pathology 39(2): 172 – 177. [ Links ]
Torres, J.; Rodríguez, H.; Rodríguez, E.; Arango, R. 2009. Aspectos bioquímicos de la resistencia del banano (Musa acuminata) al ataque del hongo Mycosphaerella fijiensis Morelet. Tumbaga 4: 85 – 96. [ Links ]
Tuo Seydou.; Amari, G.; Chérif, M.; Ouédraogo, L.; Kassi, F.; Kouamé, G.; Camara, B.; Koné, D. 2017. Agronomic Performance of Plantain Cultivars (Musa spp.) in Efficient Mixing Situation for the Control of Black Sigatoka in Southern Côte d’Ivoire. Asian. J. Plant. Pathol. 11: 1 – 9.
Valerio, R.; Lindorf, H.; de García, E. 2002. Anatomía foliar comparada de ocho cultivares de banano con relación a la resistencia o susceptibilidad a la Sigatoka (amarilla y negra). Agronomía Tropical 52(4): 507 –521. [ Links ]
Vera, D. 2003. Componentes epidemiológicos e progresso da Sigatoka negra em bananeria e bananeria-da-terra. Tese MS. Universidade Federal de Viçosa. 49 p. [ Links ]
Zhu, Y.; Chen, H.; Fan, J.; Wang, Y.; Li, Y.; Chen, J.; Fan, J.; Yang, S.; Hu, L.; Leung, H.; Mew, T.; Teng, P.; Wang, Z.; Mundt, C. 2000. Genetic diversity and disease control in rice. Nature 406: 718 – 722. [ Links ]
Corresponding author
E-mail: alex.musaespam@gmail.com (G. Cedeño)
Received October 17, 2016.
Accepted March 06, 2017.