Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.8 no.1 Trujillo 2017
http://dx.doi.org/10.17268/sci.agropecu.2017.01.04
ARTÍCULOS ORIGINALES
Efecto de la intensidad de diodos electroluminosos y fotoperiodo en la optimización de la producción de biomasa de Spirulina (Arthrospira)
Effect of the light emitting diodes intensity and photoperiod in the optimization of the Spirulina (Arthrospira) biomass production
Vásquez-Villalobos, V.*; Vergaray, D.; Méndez, J; Barrios, I.; Baquedano, R.; Caldas, C.; Cruz, J.; Gamboa, J.; Rivera, I.
Universidad Privada Antenor Orrego Escuela de Ingeniería en Industrias Alimentarias. Av. América Sur 3145 Monserrate. Trujillo, Perú.
Resumen
Se optimizó la producción de biomasa (ф) de cultivos batch de Spirulina sp. en fotobiorreactores a escala de laboratorio (FBL) de 0,2 L, por efecto de X1: intensidad de diodos electroluminosos (LED’s) entre 1,25 a 41,7 klux y X2: fotoperiodo de12/12 a 24/0, h de luz/h de oscuridad (L/O) utilizando un diseño compuesto central rotacional (DCCR) y metodología de superficie de respuesta (MSR). Asimismo, se evaluaron las características hidráulicas y el valor ф de un cultivo batch de Spirulina en un fotobiorreactor de canal bucle cerrado abierto a la atmósfera (FB-BCAA) por efecto de la iluminación LED de 8,3±1,9 klux y fotoperiodos de 12/12 y 24/0 h L/O. En los FBL se encontró dos zonas óptimas de ф, ambas con una intensidad LED de 21,5 klux y fotoperiodos 12/12 y 24/0 h L/O, siendo los valores ф de 1,65 y 1,62 respectivamente. El modelo matemático que indicó estas zonas fue de segundo orden (p = 0,000396 < 0,05) con una consistencia de predicción de R² = 0,92. En el FB-BCAA, el cultivo de Spirulina sp. con fotoperiodo de 12/12 h L/O, mostró un valor ф de 0,72, una adaptación más rápida de λ = 4,62 h, una mayor velocidad específica de crecimiento de μmax= 0,033 h-1 y menor tiempo de consumo de energía de 74,05 h; comparado con el cultivo desarrollado con fotoperiodo 24/0 h L/O. Los parámetros hidráulicos del FB-BCAA fueron: volumen de operación 2,5 L, velocidad de flujo 0,26 m/s, números de Reynolds (Re) 15488, Froude (Fr) 0,60 y Vedernikov (Ved) 0,90.
Palabras clave: Spirulina; fotobiorreactor; air-lift; hold-up; LED; optimización; fotoperiodo.
Abstract
Biomass (ф) production from Spirulina sp. batch cultures was optimized in laboratory scale photobioreactors (LPB) of 0.2 L, by the effect of X1: intensity of light emitting diodes (LEDs) and X2: photoperiod, between 1.25-41.7 klux and 12/12-24/0 hours of light/dark (L/D) respectively using a central composite rotational design (CCRD) and response surface methodology (RSM). The hydraulic characteristics and ф value from Spirulina batch cultures were also evaluated in a closed-loop channel photobioreactor open to the atmosphere (PB-CLOA) by the effect of the lighting LED of 8.3±1.9 klux and photoperiod of 12/12 and 24/0 h L/D. Two optimal zones of ф in LPB were identified, both with a 21.5 klux LED intensity and photoperiod relationship of 12/2 and 24/0 h L/D, with values of 1.65 and 1.62 ф respectively. The mathematical model which indicated the optimal zones was of 2nd order, which had a high significance (p = 0.000396 < 0.05) achieving a predictive value of R2 = 0.92. In the PB-CLOA, the cultivation of Spirulina sp. with photoperiod of 12/12 h L/D, showed a ф value of 0.72, a more rapid adaptation of λ = 4.62 h, a higher specific growth rate of μmax=0.033 h-1 and reduced time energy consumption of 74.05 h; compared to culture developed with photoperiod 24/0 h L/D. The PB-CLOA hydraulic parameters were: operation volume 2.5 L, flow velocity 0.26 m/s, numbers of Reynolds (Re) 15488, Froude (Fr) 0.60 and Vedernikov (Ved) 0.90.
Keywords: Spirulina; photobioreactor; air-lift; hold-up; LED; optimization; photoperiod.
1. Introducción
La Spirulina es una microalga filamentosa (Cianobacteria) en forma de espiral que crece en aguas azul verdosas. Las especies consideradas seguras para su consumo son S. platensis, S. maxima y S. fusiformis (Serbana et al., 2016). Pueden ser fácilmente separadas de su medio, poseen alta digestibilidad y llegar a contener hasta 70% de proteína de excelente calidad (Yean-Chang, 2011). Investigaciones han demostrado su potencial aplicación en el área de alimentos funcionales, con capacidad de desarrollo en segmentos industriales como alimentos saludables y terapéuticos (Wen-Qing et al., 2016; Raposo y de Morais, 2015). Por lo que es considerada de alto valor económico, conveniente para cultivos a gran escala (Benelhadj et al., 2016). Un elevado rendimiento de biomasa de Spirulina puede obtenerse ajustando ciertos parámetros, como son la intensidad de luz, modo de operación y configuración del fotobiorreactor (FBR).
Los cultivos por lote (batch), son los más ampliamente aplicados debido a su simplicidad y flexibilidad (da Silva et al., 2016). Los FBR’s pueden aumentar la superficie expuesta a la luz con una elevada relación superficie/volumen (S/V), lo que permite incrementar la concentración celular. En FBR’s tubulares cerrados, la luz es eficientemente capturada por las células, pero sus costos de instalación son elevados (Singh y Sharma, 2012) en comparación con las piletas convencionales abiertas a la atmósfera (Rodrigues et al., 2010) que en forma de canal de bucle cerrado con recirculación, constituye la configuración más ampliamente utilizada para la producción comercial de Spirulina (Brennan y Owende, 2010; da Silva et al., 2016), siendo el método más barato, debido a que requieren baja potencia y son fáciles de mantener y limpiar. Pero presentan desventajas en la disponibilidad de luz, agitación, pH, temperatura, evaporación, pérdida de CO2 cuando utilizan este tipo de fuente carbono, acumulación de oxígeno fotosintético (O2), requerimiento de terreno elevado y susceptibilidad a la contaminación (RamírezMérida et al., 2015a,b), por lo que sus rendimientos son bajos (Brennan y Owende, 2010).
El agua evaporada puede ser restituida periódicamente (Handler et al., 2012). Su mezclado debe ser adecuado para mantener las células en suspensión, evitando la estratificación térmica, optimizando la distribución de nutrientes, el intercambio del gas, reduciendo el efecto sombra y la fotoinhibición. En los cultivos en canales, velocidades de 5 cm/s son suficientes y en FBR’s tubulares son usados sistemas de elevación por aire (air-lift) (Ugwu et al., 2008). La intensidad de luz y la longitud de onda juegan un rol crítico en la actividad fotosintética, lo cual es consecuentemente reflejada en su crecimiento, debido a que los fotosistemas catalizan la reacción de conversión de energía lumínica, capturada por las moléculas excitadas de la clorofila en forma de energía utilizable (Cheirsilp y Torpee, 2012). En este sentido, varios estudios se han desarrollado para mejorar la eficiencia de utilización de la luz y reducir los costos de sistemas de iluminación artificial. Cultivos de laboratorio utilizan tubos fluorescentes, los que consumen alta energía comparada con los diodos emisores de luz LED’s (Light Emitting Diodes), cuyo tiempo de vida e intensidad (W/m2) son 941% y 500% más respectivamente (Carvalho et al., 2011).
Muchos cultivos utilizan solamente energía solar como fuente de luz. Sin embargo, el rendimiento de los sistemas al aire libre, es más bajo que los realizados en recintos cerrados (Chen et al., 2011). La irradiación de luz en los sistemas con luz artificial debe proporcionarse con cuidado, ya que el exceso de esta provoca un fenómeno llamado fotooxidación o fotoinhibición donde se produce daños del aparato fotosintético de la célula (Pedrosa-Bezerra et al., 2012). Kebede y Ahlgren (1996) han reportado en Spirulina estudios con intensidades de luz entre 1,67 a 41,7 klux.
Habiendo logrado condiciones óptimas a 27,5 klux. Existen reportes de tolerancias de flujo en cultivos de Spirulina platensis hasta 5000 μmol fotón/m2s (417 klux) cuando se utilizan fuente de LED’s con flujo de luz discontinuo (Gordon y Polle, 2007). Carvalho et al. (2011) sostienen que los LED’s poseen una intensidad lumínica de 14,7 a 55,5 W/m2, con emisión de energía en la región de 400 a 500 nm de 0,04 a 0,08% y, que en la región de 600 a 700 nm la emisión de energía es de 87,6 a 98,3%. Una longitud de onda de 600 a 700 nm es más eficiente para la fotosíntesis e irradiancias entre 400 y 500 nm pueden incrementar la tasa de crecimiento. Igualmente sostienen que diferentes especies de microalgas requieren distintos espectros de luz, dependiendo de los principales pigmentos presentes en ella, lo que aunado a la intensidad lumínica constituyen parámetros importantes para el crecimiento y metabolismo.
El fotoperiodo es otro factor importante, el cual está constituido por el tiempo de exposición a la luz y oscuridad, lo que tiene efecto sobre los ciclos de vida y actividades metabólicas de las microalgas. Rodríguez y Triana (2006) han sostenido que la Spirulina no puede soportar una exposición prolongada de iluminación, ya que podría ser destruido por fotólisis, recomendando la necesidad de mantener la iluminación controlada en fotoperiodos regulados de tiempo 12/12 horas (día/noche). Aunque Habib et al. (2008) han reportado que para S. platensis, se ha encontrado que el fotoperiodo óptimo es 16 horas/día, basado en la evaluación de la densidad óptica y contenido de clorofila.
En este sentido en la presente investigación se trata de dilucidar los rangos de intensidad lumínica de LED’s blanco y fotoperiodo (L/O) en la producción de biomasa de Spirulina y la determinación los parámetros hidráulicos de importancia en un fotobiorreactor de canal bucle cerrado abierto a la atmósfera (FB-BCAA), evaluándose su producción de biomasa en un cultivo batch.
2. Materiales y métodos
Materiales y equipos
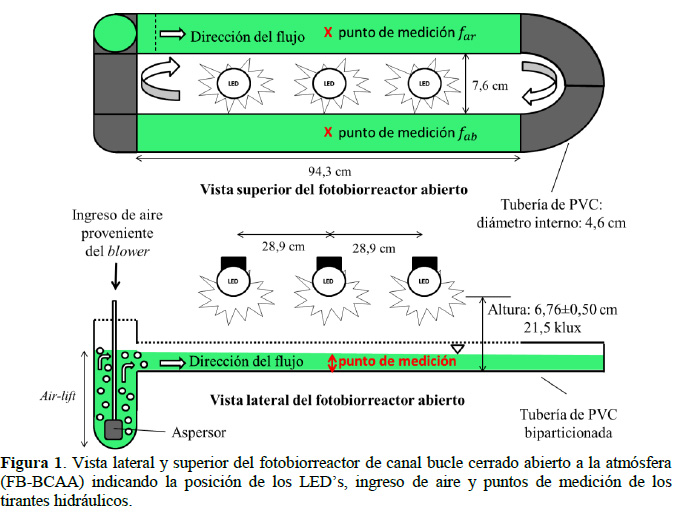
Se contó con cultivos stock de Spirulina sp. (Laboratorio de Biotecnología Alimentaria de la Universidad Privada Antenor Orrego de Trujillo UPAO Perú) mante- nida en medio estándar Zarrouk con una iluminación de 5,0 klux. Como medio para los cultivos experimentales se utilizó (g/L): 0,07 K2HPO4, 0,005 FeSO4, 0,1 NaNO3, 0,1 KNO3, 1,6 NaHCO3, 330 mL/L de agua de mar filtrada para obtener 1,2% de salinidad (Vásquez-Villalobos et al., 2014). Fotobiorreactores de laboratorio (FBL) de vidrio de 0,2 L de capacidad, fotobiorreactor de canal bucle cerrado abierto a la atmósfera (FB-BCAA) de PVC (policlururo de vinilo) de 2,5 L de capacidad máxima con un área de iluminación de 867,6 cm2 (construido de tubería PVC de 2" de diámetro comercial) (Figura 1). La iluminación de los cultivos se realizó con LED’s de color blanco ECORANGE 6500 k, 12W, 220 V. Para el control del fotoperiodo (L/O) por iluminación de los LED se utilizó un timer ALION AHC 15A. La intensidad de luz fue determinada con un medidor de lux AEMC (mod CA813), se utilizó un microscopio óptico 40X Leica (mod CME) para realizar el recuento de células con una cámara Neubauer (1/10 mm deep, brigth line-Boeco, Germany), el pH se determinó con pHmetro Mettler Toledo con electrodo inlab 43, para la inyección de aire al FBBCAA se utilizó un soplador de aire (blower) de 0,24 kW, 0,32 HP, 3330 min-1.
Metodología experimental
Optimización de la producción de biomasa (ф) de cultivos batch de Spirulina en fotobiorreactores a escala de laboratorio (FBL)
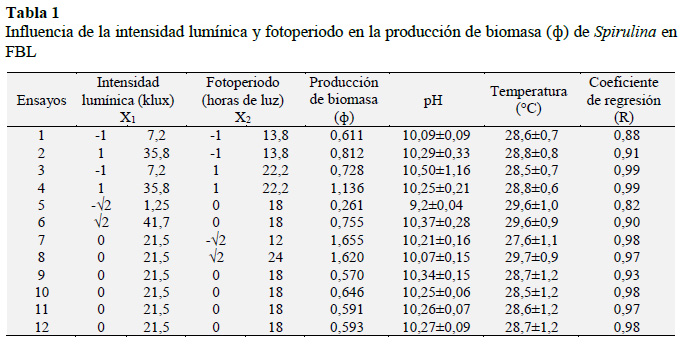
La producción de biomasa de Spirulina (ф) fue determinada en términos de log (N/N0), (N: número de células/N0: número de células iniciales). En los FBL, ф fue evaluada en función a la intensidad lumínica (X1) en rangos de 1,25 a 41,7 klux producida por iluminación LED blanco y, fotoperiodo (X2) en rangos de 12/12 a 24/0 h de luz/h de oscuridad respectivamente (L/O); de acuerdo al planteamiento factorial: 2n+2*n+4 puntos centrales. La amplitud y los puntos centrales de las variables X1 y X2 se determinaron a través de un diseño compuesto central rotacional (DCCR) con un valor α = ±√2, lo que posibilitó una matriz experimental con ocho (08) tratamientos y cuatro (04) repeticiones en el punto central, totalizando doce (12) ensayos (Tabla 1). El recuento celular (N) obtenido en cada ensayo permitió, utilizando la ecuación de Gompertz (Vásquez-Villalobos et al., 2013) [YA = ф•exp(-exp(b c*TA)] donde YA = log (N/N0) donde ф: producción de biomasa, TA: tiempo (h), b, c: constantes; verificar la optimización de ф en función de X1 y X2 utilizando metodología de superficie de respuesta (MSR), obteniéndose un modelo matemático de segundo orden, el cual fue analizado estadísticamente a través del coeficiente de determinación (R2) y probabilidad estadística p < 0,05. Lo que posibilitó visualizar la región óptima en un gráfico tridimensional y una superficie bidimensional. Los rangos de la intensidad lumínica de 1,25 y 41,7 klux fueron tomados de valores reportados por Godoy et al. (2011); Kebede y Ahlgren (1996) respectivamente. Los FBL, fueron agitados con aire proveniente de un blower (0,02 L/s) a los que se les iluminó con luz LED blanco en los rangos indicados en la Tabla 1, aspecto que se obtuvo colocando las luminarias a la distancia apropiada para obtener los lux correspondientes y lo cual fue controlado con un medidor de lux. Asimismo, se controló el pH, la temperatura y N utilizando una cámara Neubauer.
Pruebas hidráulicas con agua corriente en fotobiorreactor de canal bucle cerrado abierto a la atmósfera (FBBCAA)
Para determinar los parámetros aplicables al cultivo de Spirulina, previamente se hicieron pruebas hidráulicas en el FB- BCAA identificando los siguientes parámetros: volumen de operación, caudal de aire suministrado al cultivo, Hold-up (ε), Radio hidráulico (RH), Numero de Reynolds (Re) y Número de Froude (Fr).
ε = (far – fab) / far (1)
Donde far: tirante hidráulico aguas arriba; fab: tirante hidráulico aguas abajo. Los tirantes hidráulicos fueron determinados en el punto de medición central del canal (Figura 1), con ayuda de un Vernier por el desplazamiento de la mandíbula móvil.
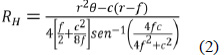
Donde r: radio de la tubería de PVC (m); f: tirante hidráulico (m); c: cuerda = √ [4r2 – 4(r – f)2]; θ: ángulo formado entre dos radios (r) y la cuerda (c) = 2∙sen-1[4fc/(4f2+c2)].
Re = 4RHV/v (3)
Donde V: velocidad del agua (m/s) (fue deter- >minada por inyección de azul de metileno en un punto fijo aguas arriba y medición del recorrido a la aparición del marcador en una longitud fija aguas abajo); ν: viscosidad cinemática del agua a la temperatura del experimento (m2/s).
Fr = V / √ (g[c(r-f)/2]/c) (4)
Donde g: aceleración de la gravedad (9,8 m/s2).
Producción de biomasa (ф) en cultivo batch de Spirulina en fotobiorreactor de canal bucle cerrado abierto a la atmósfera (FB-BCAA)
La producción de biomasa de Spirulina en FB-BCAA se realizó en dos fotoperiodos 12/12 y 24/0 h L/O, para lo cual se instalaron tres focos LED’s separados entre sí 28,9 cm y a una distancia del fondo en la línea longitudinal central de 6,76 ± 0,50 cm, que permitió obtener una iluminación de 21,5 klux y a ambos costados en el fondo del canal de bucle cerrado del FB- BCAA, una iluminación de 8,3±1,9 klux. El volumen del cultivo de microalgas fue de 2,5 L, el cual fue mezclado y agitado en el canal de bucle cerrado por movimiento generado por elevación de aire (air-lift), producido por la aspersión de burbujas (Fig. 1). La producción máxima de biomasa de Spirulina (ф) fue determinada en términos de log (N/N0), donde N (células/mL) fue determinada utilizando cámara Neubauer. Asimismo, se controló el pH, la temperatura y nivel de evaporación.
3. Resultados y discusión
Optimización de la producción máxima de biomasa (ф) de cultivos batch de Spirulina en fotobiorreactores a escala de laboratorio (FBL)
En la Tabla 1 se observa el efecto de la intensidad lumínica de los LED’s y del fotoperiodo en la producción máxima de biomasa de Spirulina (ф), denotándose la acción limitante de la intensidad lumínica por encima de 21,5 klux, conjuntamente con un efecto de alta eficiencia de producción de biomasa en dos valores contrapuestos de fotoperiodo 12/12 y 24/0 h L/O, con similares resultados de ф de 1,655 y 1,620 respectivamente.
Una excesiva intensidad de iluminación de 41,7 klux puede conducir a la fotooxidación, mientras que bajos niveles como 1,25 klux son limitadores de crecimiento de las microalgas. Esto es concordante con lo sostenido por Carvalho et al. (2011) y Pedrosa-Bezerra et al. (2012) quienes además sostienen, que el requerimiento de luz es uno de los parámetros más importantes para el desarrollo de los cultivos de microalgas, por lo que la luz debe ser proveída a una intensidad, duración y longitud de onda adecuadas. La existencia de los valores contrapuestos de fotoperiodo 12/12 y 24/0 h L/O, con similares resultados de ф, podría estar ligado a la naturaleza de la fuente de iluminación y a la fotoaclimatación, ya que ambos cultivos recibieron iluminación LED blanco de 21,5 klux. Al respecto Dubinsky et al. (1995) han sostenido que debido a los cambios relativamente rápidos y amplios en la luz del ambiente al que están sometidas, las microalgas tienen una capacidad notable de fotoaclimatación, la cual está ligada a una serie de cambios interrelacionados físicos, biofísicos, bioquímicos y fisiológicos que ayudan a las células a optimizar el uso de la luz disponible. Por lo que los daños por exceso de luz dependen en cierta medida del estado de fotoaclimatación de las células. Células aclimatadas a luz relativamente baja (adaptada a la sombra), previas a la exposición a radiación de alta intensidad pueden ser dañadas, debido a la baja dosis de irradiación que aquellas células que han sido aclimatadas a alta iluminación. En cultivos batch cultivados al aire libre, es recomendable aclimatar previamente el inóculo a altos valores de luz. Por otro lado, cuando el inóculo celular es pequeño, la irradiación inicial también debe ser baja, de lo contrario daño fotolumínico puede causar colapso del cultivo (Carvalho et al., 2011).
Por otro lado, el pH y la temperatura son aspectos igualmente importantes. Habib et al. (2008) han reportado que Spirulina platensis cultivada en medio Zarrouk normal, con un pH de 10,5 a 11,0 y a una temperatura superior a 35 ºC, produce una disminución del crecimiento y del contenido de β-caroteno. Este aspecto está ligado a la intensidad de la luz, un incremento en la intensidad hasta 10 klux da lugar a un contenido mayor β-caroteno. Cuando se cultivan con iluminación de luz roja, el contenido de β-caroteno es más alto, y más bajo con luz azul y blanca. Wen-Qing et al. (2016) reportan un pH y temperatura óptimos para el crecimiento de Spirulina de 9,5-10,0 y 30 ºC respectivamente, con medio de cultivo específico y con mayores concentraciones (g/L) de: 0,6 KH2PO4, 2,0 NaNO3, 1,2 K2SO4, 10,0 NaHCO3, 0,2 MgSO4·7H2O, en comparación con el medio de cultivo utilizado en la presente investigación y sin presencia de agua de mar. Los valores de pH y temperatura en los FBL en la presente investigación fluctuaron entre 9,82-10,50 y 27,6-29,7 °C respectivamente (Tabla 1), habiendo superado ligeramente los valores óptimos de pH y con una temperatura menor a lo recomendado por Wen-Qing et al. (2016), aspecto que puede influenciar en el crecimiento de la microalga.
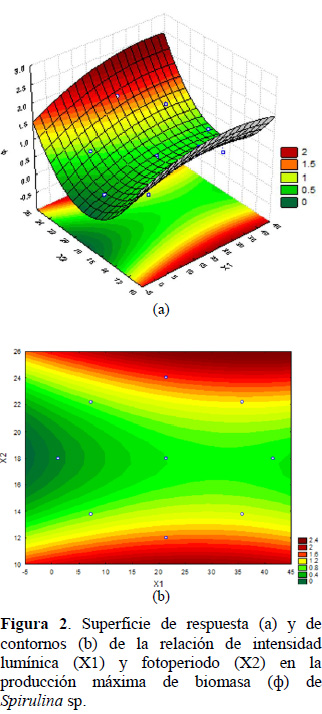
La optimización de la producción de biomasa utilizando MSR permitió obtener un modelo de segundo orden, el cual tuvo una consistencia de R2 = 0,92, p = 0,000396 < 0,05 y error absoluto medio de 12,5% entre los valores experimentales y predichos:
Ф = 8,518776 + 0,018157∙X1 – 0,000519∙X12 –
0,926863∙X2 + 0,02550∙X22 + 0,000865∙X1∙X2
En este sentido la representación de la superficie de respuesta y de contornos (Figura 2), permite ubicar dos regiones óptimas en los intervalos 12/12 y 24/0 h L/O respectivamente, iluminadas con luz LED blanco.
Los resultados observados en la Figura 2 resaltan el alcance del empleo de la luz LED, que en la presente investigación fue de color blanco, la cual de acuerdo a Rengifo y Vargas (2012) posee un rango de emisión de longitudes de onda amplio entre 400 a 700 nm con dos picos de emisión azul y verde (462,5 y 545,7 nm).
Carvalho et al. (2011) sostienen que una longitud de onda de 600 a 700 nm, es más eficiente para la fotosíntesis e irradiancias entre 400 y 500 nm pueden incrementar la tasa de crecimiento. En este sentido, la luz LED empleada en la presente investigación cubre este espectro de longitudes de onda. Con la peculiaridad sostenida por Carvalho et al. (2011), quienes sostienen, que cada tipo de microalga se caracteriza por una curva específica, que relaciona su tasa de crecimiento con la intensidad de luz incidente a una temperatura y, que cerca de la mitad del espectro completo de la luz entre 400 a 700 nm, es fotosintéticamente útil; el cual es normalmente utilizado para el crecimiento de microalgas.
Si bien es cierto que, en la presente investigación, se demuestra la capacidad de la Spirulina a crecer en dos fotoperiodos de 12/12 y 24/0 h L/O respectivamente, iluminadas con luz LED blanco, otros investigadores como WenQing et al. (2016) han utilizado luz LED rojo (longitud de onda, 620-630 nm) con una irradiación diaria de 18 a 22 h con 6000 lux de intensidad, habiendo obtenido la mayor producción de materia seca con un tiempo de exposición de 8 h diarias. Asimismo, combinaron luces LED azulrojo, habiendo obtenido aún mayor producción de biomasa que con luz LED rojo, por lo que los resultados de los referidos investigadores deben ser tomados en cuenta para investigaciones futuras en modelos escalables.
Pruebas hidráulicas con agua corriente en fotobiorreactor de canal bucle cerrado abierto a la atmósfera (FBBCAA)
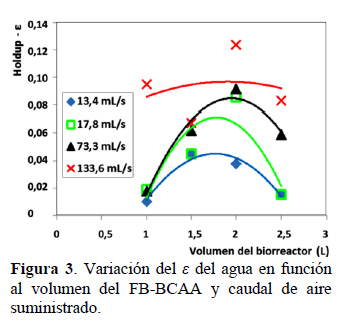
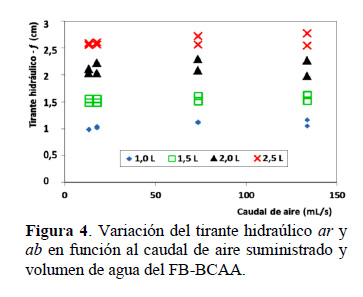
En la Figura 1 se observa los esquemas de las vistas lateral y superior del FB-BCAA. En la vista de superior se denota la dirección de flujo de recirculación en el canal de bucle cerrado y en la vista lateral, se observa la tubería de interconexión entre los canales aguas arriba y abajo (ar, ab), así como el posicionamiento del aspersor en el lado ar, que por el ingreso del aire posibilita la elevación del líquido (air-lift) creando un diferencial en el tirante hidráulico o hold-up (ε). La formación del ε en el FB-BCAA, aumenta con el volumen de operación y caudal de aire (Figura 3). Esta tendencia llega a su máximo a los 2,0 L de volumen, donde se obtiene el mayor valor de ε con el caudal máximo de aire suministrado de 133,6 mL/s. La formación del ε produce una variación de los tirantes hidráulicos ar y ab, donde ar > ab (Figura 4), generando una pendiente en la superficie con el subsecuente movimiento y generación de velocidad, lo que influye en el caso del cultivo de Spirulina en los niveles de turbulencia y aprovechamiento de la energía lumínica.
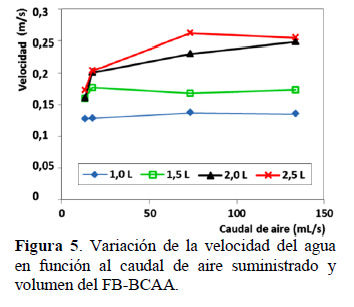
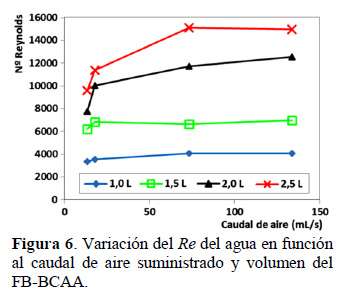
Conforme se observa en la Figura 5, la velocidad del líquido está influenciada por el volumen de operación del BF-BCAA, con un volumen máximo de operación de 2,5 L, se alcanza la mayor velocidad en el agua de 26 cm/s con un caudal de aire promedio suministrado de 73,3 mL/s. Con un mayor caudal del aire suministrado la velocidad no se incrementa. Jiménez et al. (2003) trabajaron en cultivos de Spirulina con piletas semi industriales de PVC de 1350 L, 13500 L y una 135000 L (450 m2), con una profundidad de la suspensión de 30 cm, recirculadas mediante rueda de paletas a una velocidad de 30 cm/s, mayor que la utilizada en la presente investigación. En la literatura, la intensidad de mezcla se define generalmente por el número de Reynolds (Re) (Richmond y Hu, 2013): Re alto está asociado con alto nivel de la mezcla y viceversa. Re es proporcional a la velocidad de flujo, un Re alto significará en consecuencia, una alta velocidad del cultivo en el FB-BCAA. La turbulencia también se utiliza como sinónimo de Re, en muchos trabajos sobre mezclado de algas, un Re alto corresponde a flujo turbulento, mientras que un Re bajo corresponde a flujos laminares. En estructura laminar la viscosidad amortigua las inestabilidades de un flujo vortex, los que tienden a ser suprimidos rápidamente (Prussi et al., 2014). Por lo que el nivel de turbulencia, va influir en el mezclado de la suspensión de microalgas, necesaria para estar en continuo contacto con el sustrato, eliminar oxígeno y aprovechar la energía lumínica para un adecuado desarrollo. En la Figura 6 se observa un Re superior a 14000, con un valor específico de 15127, el cual se logra con un caudal de aire suministrado de 73,3 mL/s y con el mayor volumen de líquido de 2,5 L en el FBBCAA.
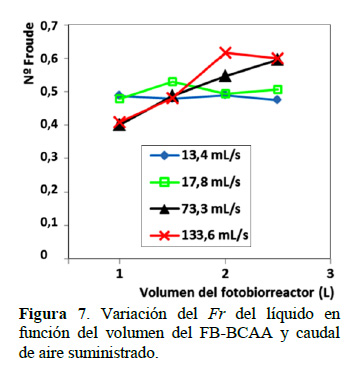
Gudin y Chaumont (1991) definieron para un biorreactor tubular, que un flujo de cultivo es laminar con un Re < 3500 y turbulento Re > 3500, sostenían que el Re = Vdρ/μ depende mayormente de la velocidad (V) y la viscosidad (μ), y que un mezclado significativo del líquido por una alta velocidad puede producir daño celular. Óptimas condiciones de exposición a la luz, por el diseño y funcionamiento del FBR, requieren elevada velocidad del líquido el que genera daño celular y por lo tanto limita la productividad de la biomasa del sistema de cultivo. Según sostiene del Álamo (2005) el movimiento de un fluido en el canal es turbulento para Re mayores que Reb≈Re≈2000, habiendo utilizado para caracterizar el flujo la relación Re = Vch/ν (Re basado en la velocidad de la corriente libre y en el espesor del flujo) y Reb = Vbh/ν (Re basado en la velocidad media y el espesor de flujo), donde Vc es la velocidad en el centro del canal y Vb es la velocidad media, h es la semialtura en canales, ν es la viscosidad cinemática. Por otro lado, Zucarelli y Morresi (2015) sostienen que los números tradicionalmente empleados para el flujo en canales abiertos son Re y el número de Froude (Fr), con un Re > 3000 el flujo es turbulento (Re = Vbd/ν, donde d es la profundidad de flujo. El número de Froude (Fr) se utiliza para caracterizar el flujo subcrítico o supercrítico. Si Fr < 1,0 el flujo es subcrítico, aspecto que caracteriza al FB-BCAA conforme se observa en la Figura 7. Cuyo valor aumenta a mayores volúmenes de trabajo y a mayores valores de caudal de aire suministrado (73,3 y 133,6 mL/s). Un flujo es estable o inestable dependiendo de la tendencia de la perturbación (onda) a atenuarse o amplificarse en el tiempo. Para indicar la condición de flujo de acuerdo a la estabilidad de la superficie libre, se utiliza el número de Vedernikov (Ved = Fr/Frs), donde Frs es el número de Fr para la condición de flujo neutralmente estable. Chen (1995) propuso expresiones de Frs para diferentes números de flujo, que obedecen a diferentes distribuciones de velocidad. Considerando para el presente experimento un flujo hidráulicamente turbulento con superficie lisa, Fs = 2/(1+3m), donde m = 1/6. Los valores de Fr en las condiciones de desarrollo experimental en el FB-BCAA, fueron del >orden de 0,39 a 0,60, mostrando un Ved de 0,59 a 0,90 (Ved < 1), es decir la celeridad de la onda cinemática es menor que la celeridad de la onda dinámica, por lo que el flujo se puede considerar estable, donde la celeridad de la onda dinámica está influenciada por las fuerzas de presión e inercia.
Los aspectos de agitación y mezclado en el FB-BCAA es de relevante importancia, por su utilización en cultivo de microalgas. En relación a este aspecto, se reporta que microalgas dinoflageladas son muy sensibles a las tensiones de cizalla y fuerzas hidrodinámicas, generadas por la turbulencia en los FBR’s (García-Camacho et al., 2011; López-Rosales et al., 2015). Gallardo-Rodríguez et al. (2009) observaron influencia de la turbulencia a pequeña escala, asociadas con la agitación y aireación en los bioprocesos, que en el caso de la presencia de células de Spirulina, si esta es excesiva podría acarrear algunos inconvenientes. Por otro lado, Mitsuhashi, et al. (1994) estudiaron en un experimento de corta duración, la naturaleza de la tasa fotosintética de una suspensión de Spirulina, sometida a un flujo hidrodinámico cortante o de cizalla con luz fluorescente, encontrando que un flujo cortante incrementa la fotosíntesis, pero simultáneamente produce destrucción celular. En un experimento que los referidos autores denominan de larga duración (100h), encontraron que tanto la tasa de crecimiento como la morfología de la Spirulina, son sensibles a los estímulos mecánicos del fluido y, que una aplicación de 100h de tensión mecánica sobre la Spirulina, puede llevar a la adaptación de la función fotosintética y de su morfología; que la tasa de crecimiento depende del esfuerzo cortante, el cual proporciona a las microalgas un estímulo físico. Asimismo, Ravelonandro et al. (2011) encontraron que las células de Spirulina son frágiles y, en una columna de burbujas sin mezclado adicional existe un mejor crecimiento, confirmando su sensibilidad al esfuerzo cortante. En este sentido en la presente investigación, la alta turbulencia podría haber estimulado a una adaptación de la fotosíntesis, adicionalmente a los efectos lumínicos observados en los fotoperiodos de 12/12 y 24/0 h L/O. Ravelonandro et al. (2011) sostienen que la columna de burbujas, parece ser el sistema más adecuado para el estudio del crecimiento de Spirulina en escala de laboratorio, así como a gran escala. En este sentido en la presente investigación, el flujo del cultivo estuvo basado en un sistema de columna de burbujas, que produjo un ε entre ar y ab generando turbulencia por el movimiento del cultivo en el FB-BCAA.
Producción de biomasa (ф) en cultivo batch de Spirulina en fotobiorreactor de canal bucle cerrado abierto a la atmósfera (FB-BCAA)
En la Figura 8 se observa el cultivo de biomasa de Spirulina en FB-BCAA iluminado con luz LED, con un valor de 8,3±1,9 klux en el canal de bucle cerrado, cuyo valor ф fue evaluado en dos fotoperiodos de 12/12 y 24/0 h L/O respectivamente.
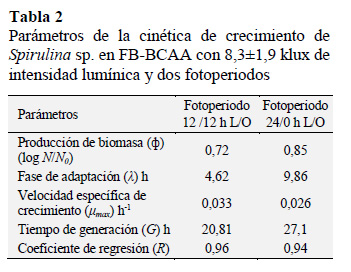
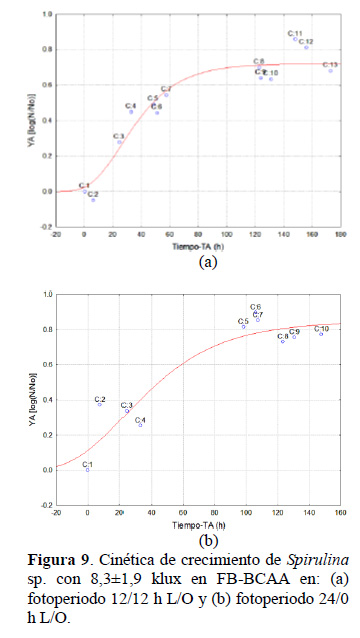
En la Tabla 2 se muestra los parámetros de la cinética de crecimiento para ambos fotoperiodos, modelados con la ecuación de Gompertz (Figura 9 a y b).
Debido a la evaporación, se tuvo que restituir dos veces agua a los cultivos a efectos de mantener las condiciones hidráulicas del FB-BCAA. Se observa que una producción de biomasa (ф) de 0,72 (362’746.323 células netas en una S/V de 0,040 m2/L) y 0,85 (358’916.667 células netas en una S/V de 0,048 m2/L) (Tabla 2), no representan la proporcionalidad de las células netas como biomasa producida. Al respecto se observa una menor producción de células netas en el cultivo realizado, utilizando un fotoperiodo de 24/0 h L/O.
Asimismo, en los dos fotoperiodos se tuvo una baja relación S/V, aspecto que limita el incremento de la concentración celular (Singh y Sharma, 2012). Por otro lado, el cultivo realizado con un fotoperiodo de 12/12 h L/O mostró una adaptación (λ) más rápida, una mayor velocidad específica de crecimiento (µmax) (Figura 9a), con mayor pendiente en la fase de crecimiento logarítmico. Variaciones en el desarrollo de la Spirulina, estuvo influenciado por el fenómeno de formación de biopelículas (fouling) de las células en las paredes del FB-BCAA, por lo que diariamente la biomasa fue desprendida por acción de un cepillado. De acuerdo a Fang et al. (2014), las biopelículas fototróficas son matrices cerradas de comunidades microbianas propias de los quimiotrófos y fotótrofos (cianobacterias y microalgas), inducidas por la energía lumínica. Generalmente las fotótrofas oxigénicas, tales como las cianobacterias, algas verdes y diatomeas, típicamente habitan en la superficie de las biopelículas fototróficas, las que, utilizando energía lumínica y reducción de dióxido de carbono, generan oxígeno y sustratos orgánicos, los que soportan el crecimiento de los heterótrofos. Estas comunidades juegan un papel ecológico importante en el ciclo del carbono y nutrientes. El desarrollo de biopelículas fototróficas es promovida por la excreción de sustancias poliméricas extracelulares, las cuales sirven como un agente autoadhesivo, permitiendo la formación de una matriz de biopelícula con incrustación celular.
Los valores de pH de los cultivos fueron de 9,72±0,15 y 9,7±0,2 a temperaturas de 27,9±0,9 y 27,3±0,6, mostrando valores óptimos de pH (9,5-10,0) y menor temperatura (30 ºC) (Wen-Qing et al., 2016). La iluminación promedio en los cultivos en el canal de bucle cerrado fue de 8,3±1,9 klux, pero como se observa en la Figura 8 esta no fue uniforme, ya que como sostienen Rengifo y Vargas (2012), los LED’s blanco poseen un pico de intensidad máxima, en un ángulo de emisión θ = 0º con una espectro lumínico difuso, debido a la dispersión de la luz, produciendo un rango de emisión de aproximadamente 30º con una mayor intensidad sobre el centro, aunadas a que en los dos extremos del canal de bucle cerrado, se producen zonas oscuras durante el movimiento del cultivo y asimismo, por el movimiento las células de microalgas en la zona expuesta a la atmosfera, estas alternan entre la superficie y el fondo, entre zonas de luz y oscuridad con una determinada frecuencia, lo cual puede influenciar en el crecimiento de las microalgas mejor, que la luz dosificada en forma continua (Amini-Khoeyi et al., 2012; Li et al., 2014). Por otro lado, la intensidad lumínica decrece con el aumento de la densidad celular durante el desarrollo del cultivo (Contreras-Flores et al ., 2003; Markou y Georgakakis, 2011). Al respecto Chen et al. (2016) sostienen que solo una adecuada intensidad, duración y longitud de onda lumínica es apropiada para el cultivo de microalgas. Conforme se observa en la Figura 9 los cultivos de Spirulina en el FB-BCAA, lograron alcanzar la mayor producción de biomasa a las 148,1 y 105,9 horas, con los fotoperiodos de 12/12 y 24/0 h L/O respectivamente. En el primer caso con fotoperiodo 12/12 h L/O se tiene menor tiempo de 74,05 h de consumo de energía; comparado con fotoperiodo 24/0 h L/O con un tiempo de 105,9 h de consumo de energía. Lo que indica la ventaja del uso de fotoperiodos de 12/12 h L/O, máxime que las horas de luz puede ser obtenido de fuente de iluminación natural.
4. Conclusiones
Se determinó en fotobiorreactor de laboratorio (FBL) dos zonas óptimas de producción de biomasa de Spirulina sp. (ф) de 1,65 y 1,62, ambas con una intensidad de diodos electroluminosos (LED’s) de 21,5 klux y fotoperiodo 12/12 y 24/0 h de luz/oscuridad (L/O) respectivamente. El modelo matemático que indica las zonas óptimas fue de segundo orden, el cual tuvo alta significancia (p = 0,000396 < 0,05), logrando un valor de predicción R² = 0,92, entre los valores experimentales de ф y los predichos.
Los parámetros hidráulicos determinados con agua corriente en fotobiorreactor de canal bucle cerrado abierto a la atmósfera (FB-BCAA) fueron: velocidad de 0,26 m/s, la cual se logró con un volumen del FB-BCAA de 2,5 L y con un flujo de aire suministrado de 73,3 mL/s para producir el air-lift. El número de Reynolds (Re) fue de 15127 de naturaleza turbulenta. Asimismo, los números de Froude (Fr) y Vedernikov (Ved) mostraron un valor < 1, lo que indicó su naturaleza subcrítica y estable del fluido.
El cultivo de Spirulina desarrollado en FBBCAA con iluminación LED de 8,3±1,9 klux y fotoperiodo de 12/12 h L/O, mostró una producción de biomasa de 0,72, una adaptación más rápida (λ) de 4,62 h, una mayor velocidad específica de crecimiento (μmax) (0,033 h-1) y menor tiempo de consumo de energía de 74,05 h; comparado con el cultivo de Spirulina desarrollado con fotoperiodo 24/0 h L/O. Lo que indica la ventaja del uso de fotoperiodos de 12/12 h L/O.
Referencias bibliográficas
Amini-Khoeyi, Z.; Seyfabadi, J.; Ramezanpour, Z. 2012. Effect of light intensity and photoperiod on biomass and fatty acid composition of the microalgae Chlorella vulgaris. Aquaculture International 20(1):41-49. [ Links ]
Benelhadj, S.; Gharsallaoui, A.; Degraeve, P.; Attia, H.; Ghorbel, D. 2016. Effect of pH on the functional properties of Arthrospira (Spirulina) platensis protein isolate. Food Chemistry. 194: 1056-1063. [ Links ]
Brennan, L.; Owende, P. 2010. Biofuels from microalgae: a review of technologies for production, processing, and extractions of biofuels and co-products. Renewable and Sustainable Energy Reviews 14: 557-577. [ Links ]
Carvalho, A.; Silva, S.; Baptista, J.; Malcata, F. 2011. Light requirements in microalgae photobioreactors: an overview of biophotonic aspects. Appl Microbiol Biotechnol 89: 1275-1288. [ Links ]
Cheirsilp, B., Torpee, S., 2012. Enhanced growth and lipid production of microalgae under mixotrophic culture condition: effect of light intensity, glucose concentration and fed-batch cultivation. Bioresource Technology 110: 510–516. [ Links ]
Chen, C. 1995. Free-Surface Stability Criterion as Affected by Velocity Distribution. Journal of Hydraulic Engineering 121: 736-743. [ Links ]
Chen, C.; Yeh, K.; Aisyah, R.; Lee, D.; Chang, J. 2011. Cultivation, photobioreactor design and harvesting of microalgae for biodiesel production: A critical review. Bioresource Technology 102: 71-81. [ Links ]
Chen, Z.; Zhang, X.; Jiang, Z.; Chen, X.; He, H.; Zhang, X. 2016. Light/dark cycle of microalgae cells in raceway ponds: Effects of paddlewheel rotational speeds and baffles Installation, Bioresource. Technology 219: 387-391. [ Links ]
Contreras-Flores, C.; Peña-Castro, J.; Flores-Cotera, L.; Cañizares-Villanueva, R. 2003. Avances en el diseño conceptual de fotobiorreactores para el cultivo de microalgas. Interciencia 28(8): 450-456. [ Links ]
da Silva, M.; Casazza, A.; Ferrari, P.; Perego, P.; Bezerra, R.; Converti, A.; Porto, A. 2016. A new bioenergetic and thermodynamic approach to batch photoautotrophic growth of Arthrospira (Spirulina) platensis in different photobioreactors and under different light conditions. Bioresource Technology 207: 220-228. [ Links ]
del Álamo, J. 2005. La organización a gran escala de canales turbulentos. Tesis Escuela Técnica Superior de Ingenieros Aeronáuticos. Universidad Politécnica de Madrid. Pp. 120. [ Links ]
Dubinsky, Z.; Matsukawa, R.; Karube, I. 1995. Photobiological aspects of algal mass culture. Journal of Marine Biotechnology 2:61-65. [ Links ]
Fang, F.; Lu, W.; Shan, Q.; Cao, J. 2014. Characteristics of extracellular polymeric substances of phototrophic biofilms at different aquatic habitats. Carbohidrate Polymers 106: 1-6. [ Links ]
Gallardo-Rodríguez, J..; Sánchez-Mirón, A.; GarcíaCamacho, F.; Cerón-García, M.; Belarbi, E.; Chisti, Y.; Molina-Grima, E. 2009. Causes of shear sensitivity of the toxic dinoflagellate Protoceratium reticulatum. Biotechnology Progress 25(3): 792-800. [ Links ]
García-Camacho, F.; Gallardo-Rodríguez, J.; SánchezMirón, A.; Belarbi, E.; Chisti, Y.; Molina-Grima, E. 2011. Photobioreactor scale-up for a shear-sensitive dinoflagellate microalga. Process Biochemistry 46: 936-944. [ Links ]
Godoy, E.; Rangel-Yagui, C.; Sato, S.; Monteiro de Carvalho, J. 2011. Growth and content of Spirulina platensis biomass chlorophyll cultivated at different values of light intensity and temperature using different nitrogen sources. Brazilian Journal of Microbiology 42(1): 362-373. [ Links ]
Gordon, J.; Polle, J. 2007. Ultrahigh bioproductivity from algae. Applied Microbiology and Biotechnology 76(5): 969-975. [ Links ]
Gudin, C.; Chaumont, D. 1991. Cell-Fragility – The Key Problem of Microalgae Mass Production in Closed Photobioreactors. Bioresource Technology 38(2-3):145-151. [ Links ]
Handler, R.; Canter, C.; Kalnes, T.; Lupton, F.; Kholiqov, O.; Shonnard, D.; Blowers, P. 2012. Evaluation of environmental impacts from microalgae cultivation in open air raceways ponds: Analysis of the prior literature and investigation of wide variance in predicted impacts. Algal Research 1(1): 83-92. [ Links ]
Habib, M.; Parvin, M.; Huntington, T.; Hasan, M. 2008. A review on culture, production and use of Spirulina as food for humans and feeds for domestic animals and fish. FAO Fisheries and Aquaculture Circular No. 1034. Rome FAO. 33p. [ Links ]
Jiménez, C.; Cossío, B.; Niell, F. 2003. Relationship between physicochemical variables and productivity in open ponds for the production of Spirulina: a predictive model of algal yield. Aquaculture 221: 331-345. [ Links ]
Kebede, E.; Ahlgren, G. 1996. Optimum growth conditions and light utilization efficiency of Spirulina platensis (= Arthrospira fusiformis) (Cyanophyta) from Lake Chitu, Ethiopia. Hydrobiologia 332(2): 99-109. [ Links ]
Li, M.; Hu, D.; Liu H. 2014. Photobioreactor with ideal light-dark cycle designed and built from mathematical modeling and CFD simulation. Ecological Engineering 73: 162-167. [ Links ]
López-Rosales, L.; García-Camacho, F.; Sánchez-Mirón, A.; Contreras-Gómez, A.; Molina-Grima, E. 2015. An optimisation approach for culturing shear-sensitive dinoflagellate microalgae in bench-scale bubble column photobioreactors. Bioresource Technology 197: 375-382. [ Links ]
Markou, G; Georgakakis, D. 2011. Cultivation of filamentous cyanobacteria (blue-green algae) in agroindustrial wastes and wastewaters: A review. Applied Energy 88: 3389-3401. [ Links ]
Mitsuhashi, S.; Fujimoto, M.; Muramatsu, H.; Tanlshita, K. 1994. Effect of simple shear flow on photosynthesis rate and morphology of micro algae. Acta Astronautica 33: 179-187. [ Links ]
Pedrosa-Bezerra, R.; Chuei-Matsudo, M.; Sato, S.; Perego, P.; Converti, A.; Monteiro de Carvalho, J. 2012. Effects of photobioreactor configuration, nitrogen source and light intensity on the fed-batch cultivation of Arthrospira (Spirulina) platensis. Bioenergetic aspects. Biomass and Bioenergy. 37: 309-317. [ Links ]
Prussi, M.; Buffi, M.; Casini, D.; Chiaramonti, D.; Martelli, F.; Carnevale, M.; Tredici, M.; Rodolfi, L. 2014. Experimental and numerical investigations of mixing in raceway ponds for algae cultivation. Biomass and bioenergy 67: 390-400. [ Links ]
Ramírez-Mérida, L.; Zepka, Q.; Jacob-Lopes, E. 2015a. Current Status, Future Developments and Recent Patents on Photobioreactor Technology. Recent Patents on Engineering 9 (2): 80-90. [ Links ]
Ramírez-Mérida, L.; Zepka, Q.; Jacob-Lopes, E. 2015b. Why does the Photobioreactors Fail? Journal of Bioprocessing & Biotechniques 5:7. [ Links ]
Raposo, M.; de Morais, A. 2015. Microalgae for the prevention of cardiovascular disease and stroke. Life Sciences 125: 32-41. [ Links ]
Ravelonandro, P.; Ratianarivo, D.; Joannis-Cassand, C.; Isambertc, A.; Raherimandimby, M. 2011. Improvement of the growth of Arthrospira (Spirulina) platensis from Toliara (Madagascar): Effect of agitation, salinity and CO2 addition. Food and bioproducts Processing 89: 209-216. [ Links ]
Rengifo. M.A.; Vargas, C. 2012. Caracterización óptica de Diodos emisores de Luz mediante sus espectros de emisión y patrones de radiación. Scientia et Technica. Universidad Tecnológica de Pereira. 51: 66-70. [ Links ]
Richmond, A.; Hu, Q. 2013. Handbook of Microalgal Culture: Applied phycology and biotechnology. Wiley Blackwell. Pp 736. [ Links ]
Rodrigues, M.; Ferreira, L.; Converti, A.; Sato, S.; Carvalho, J. 2010. Fed-batch cultivation of Arthrospira (Spirulina) platensis: Potassium nitrate and ammonium chloride as simultaneous nitrogen sources. Bioresource Technology 101:4491-4498. [ Links ]
Rodríguez, A.; Triana, F. 2006. Evaluación del pH en el cultivo de Spirulina spp. (=Arthrospira) bajo condiciones de laboratorio. Tesis Microbiólogo Industrial. Pontificia Universidad Javeriana. Bogotá [ Links ].
Serbana, M.C.; Sahebkarb, A.; Dragan, S.; StoichescuHogea, G.; Ursoniu, S.; Andrica, F.; Banach, M. 2016. A systematic review and meta-analysis of the impact of Spirulina supplementation on plasma lipid concentrations. Clinical Nutrition. 35 (4): 842-851. [ Links ]
Singh, R.M.; Sharma, S. 2012. Development of suitable photobioreactor for algae production – A review. Renewable and Sustainable Energy Reviews 16:2347-2353. [ Links ]
Ugwu, C.; Aoyagi, H.; Uchiyama, H. 2008. Photo- bioreactors for mass cultivation of algae. Bioresource Technology 99(10): 4021-4028. [ Links ]
Vásquez-Villalobos, V.; Arteaga, P.; Chanamé, K.; Esquivel, A. 2013. Modelamiento matemático y por redes neuronales artificiales del crecimiento de Spirulina sp. en fotobiorreactor con fuente de luz fluorescente e iluminación en estado sólido. Scientia Agropecuaria 4: 199-209. [ Links ]
Vásquez-Villalobos, V.; Vergaray, D.; Suarez, S.; Valladares, J.; Zamora, A.; Gaspar, K.; Escurra, X. 2014. Influencia de la proporción de agua de mar y bicarbonato en la producción de biomasa de Spirulina sp. con iluminación de diodo emisor de luz. Scientia Agropecuaria 5: 199-209. [ Links ]
Wen-Qing, S; Si-Dong, L.; Gao-Rong, L.; Wen-Hua, W.; Qing-Xiang, Ch.; Yong-Qiang, L.; Xu-Wei, L. 2016. Investigation of main factors affecting the growth rate of Spirulina. Optik – International Journal for Light and Electron Optics 127(16): 6688-6694. [ Links ]
Yean-Chang, Ch. 2011. The effect of shifts in medium types on the growth and morphology of Spirulina platensis (Arthrospira platensis). Journal of Marine Science and Technology 19(5): 565-570. [ Links ]
Zucarelli, G.V.; Morresi, M. del V. 2015. Flujo en canales abiertos: caracterización en cursos de la provincia de Santa Fé, República Argentina. Dpto. Hidrología. Universidad Nacional de Litoral. Disponible en: http://www.fceia.unr.edu.ar/curiham/Secciones/Cuader nos/Pdf-991/zucarelli-morresi.pdf [ Links ]
Corresponding author
E-mail: vvasquezv@upao.edu.pe (V. Vásquez-Villalobos)
Received September 15, 2015.
Accepted March 11, 2017.