Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.8 no.1 Trujillo 2017
http://dx.doi.org/10.17268/sci.agropecu.2017.01.05
ARTÍCULOS ORIGINALES
Composición proximal y propiedades funcionales del surimi liofilizado de Dosidicus gigas "calamar gigante"
Proximal composition and functional properties of lyophilizated surimi of Dosidicus gigas "jumbo squid"
Armando Solari-Godiño1; Javier S. Córdova-Ramos2, *; Silvia Pilco-Quesada3; Luz M. Cerrón-Mallqui2; Miguel Albrecht-Ruiz1; Jorge Sánchez Hernández4
1 Dirección General de Investigaciones Tecnológicas para la Transformación Pesquera. Instituto Tecnológico de la Producción - ITP. Carretera a Ventanilla Km. 5.2, Callao, Perú.
2 Escuela de Ciencia de los Alimentos. Universidad Nacional Mayor de San Marcos. Av. Universitaria /Calle Germán Amézaga 375, Lima, Perú.
3 Facultad de Ingeniería y Arquitectura, Universidad Peruana Unión, Carretera Central Km. 19 Ñaña, Lima 15, Perú
4 CITE Pesquero-Callao. Instituto Tecnológico de la Producción - ITP. Carretera a Ventanilla Km. 5.2, Callao, Perú.
Resumen
El propósito de la investigación fue determinar la composición proximal y propiedades funcionales del surimi liofilizado de calamar gigante (Dosidicus gigas). Se elaboró surimi a partir de calamar gigante y fue liofilizado hasta obtener surimi en polvo para evaluar sus características y propiedades funcionales. El contenido de proteínas fue 58,7% y carbohidratos 30,5%. La solubilidad proteica en agua y sal (3%) fueron 21,1% y 40,6% respectivamente, siendo estos valores superiores a surimi en polvo de especies comerciales. La capacidad de gelificación fue 2,4% y la capacidad emulsificante fue 79,9% a una concentración del 1,0%. El color en la escala de Hunter fue L*: 91,5; a*: 0,5; b*:7,0. El surimi en polvo de calamar gigante fue considerado como un polvo proteico funcional debido a su contenido porcentual proteico, y tuvieron buenas características tecnológicas y de gran potencial en la industria alimentaria.
Palabras clave: surimi; calamari gigante; Dosidicus gigas; propiedades funcionales proteicas.
Abstract
The purpose of the research was to determinate proximal composition and functional properties of the giant squid freeze-dried surimi (Dosidicus gigas). Surimi elaborated from giant squid and it lyophilized until obtaining surimi powder to evaluate its characteristics and functional properties. The protein content was 58.7% and carbohydrate 30.5%. Protein solubility in water and salt (3%) were 21.1% and 40.6% respectively, these values being higher than surimi powder of commercial species. The gelling capacity was 2.4% and the emulsifying capacity was 79.9% at a concentration of 1.0%. The color on the Hunter scale was L*: 91.5; a*: 0.5; b*: 7.0. Giant squid powder surimi considered as a functional protein powder due to its percentage protein content, and had good technological characteristics and great potential in the food industry.
Keywords: surimi; jumbo squid; Dosidicus gigas; protein functional properties.
1. Introducción
Generalmente, el surimi es elaborado en base a lavados sucesivos de carne picada de pescado con fines de eliminar el sabor, olor, color y concentrar proteínas miofibrilares (Moreno et al., 2016). Mayormente se utiliza como materia prima para la elaboración de diversos productos alimenticios, como por ejemplo, análogos marinos, patas de cangrejo, camarones, análogos cárnicos y productos variados tales como hamburguesas, salchichas y tortillas (Ramírez et al., 2011). Esta diversidad de productos marinos está estrechamente ligada a las propiedades funcionales de las proteínas que tiene el surimi, tales como: gelificación, poder emulsificante, capacidad de retención de agua (CRA), entre otras que amplía su espectro de usos y potencialidades en la industria alimentaria (Moreno et al., 2016). En el Perú, se viene desarrollando la elaboración de surimi a partir de calamar gigante (Dosidicus gigas) a nivel semi-industrial. La pota o calamar gigante, es un recurso hidrobiológico abundante en nuestro país y debido al color blanco de su músculo es muy requerido en la industria alimentaria. Para dicha manufactura es imprescindible contar con equipos de congelación adecuados, para garantizar la calidad del producto durante el proceso, almacenamiento y transporte, evitando las fluctuaciones térmicas que causen deterioro de las proteínas y por ende afecten su funcionalidad de estas (Galla et al., 2012). Noruega, Japón y China vienen utilizando tecnologías que permiten tener alimentos funcionales pulverizados, de fácil almacenamiento y con valores bajos de actividad de agua, con fines de evitar pérdidas económicas por deterioro. Este producto es de fácil almacenamiento y económico frente a los productos congelados (Wahl et al., 2016; Huda et al.,
2001).
En este sentido, la técnica de liofilización presenta la ventaja de no afectar severamente la funcionalidad de las proteínas como otras técnicas de deshidratación lo hacen, por tanto, se utilizarían para mezclas secas rehidratables (Wahl et al., 2016). Este tipo de tecnología es muy poco utilizado en nuestro país, de modo que realizar este proceso es aún costoso; no obstante, muchos países vienen trabajando a fin de lograr el costo-beneficio a partir del cual consideramos que en un futuro cercano ésta tecnología será accesible para la industria alimentaria.
El objetivo del trabajo fue determinar la composición químico proximal y las propiedades funcionales del surimi liofilizado de calamar gigante con la finalidad de conocer su potencial y aplicaciones que puede desde ya repercutir en la industria pesquera y alimentaria.
2. Materiales y métodos
2.1 Preparación de muestra
Tres kilogramos de filete procedentes de manto fresco de calamar gigante (Dosidicus gigas), fueron sumergidos en solución ácida-salina fría (2 °C) (NaCl grado reactivo 1% / ácido cítrico grado reactivo 0,5%) en una proporción 1:3; se enjuagaron con agua fría ajustándose el contenido de humedad hasta 75% aproximadamente, se trituraron los filetes en un cortador-mezclador añadiéndose agentes crioprotectores (azúcar 6% y polifosfato de sodio 0,3%), luego se congeló a -30 °C hasta su uso. El surimi congelado fue liofilizado en un equipo Labconco® a una presión de vacío 0,08 mbar, temperatura de colector de -85 °C por 15 horas aproximadamente obteniéndose un producto deshidratado que fue pulverizado denominándosele surimi en polvo de calamar gigante (SP). El producto fue empacado, sellado al vacío y conservado en refrigeración (4 – 6 °C) hasta su uso.
2.2 Análisis Proximal
Para la realización de los análisis químicos se utilizaron 500 g de muestra. El análisis proximal de las muestras surimi en polvo (SP) y surimi congelado (SC) se efectuó según la metodología propuesta por la AOAC (2000). Respecto a la determinación de la actividad de agua, se efectuó directamente en un analizador Aqualab Pre (Decagon Devices Inc, SN: PRE000199, USA).
2.3 Solubilidad en agua destilada y solución salina
Un gramo de SP con 40 mL solución salina al 3%, se agitaron por 2 minutos en vórtex (WISD, VM-10) la mezcla fue centrifugada (EPPENDOR, 5804R, ALEMAN) a 6280 g (6280 veces la gravedad) por 2 minutos. Se colectó el sobrenadante para la determinación de proteínas por el método de Kjeldahl (con factor proteico de 6,25).
Para el caso de la solubilidad en agua se realizó el mismo procedimiento, pero sin la adición de sal de acuerdo a lo descrito por Ghribi et al. (2015) con algunas modificaciones.
2.4 Capacidad de retención de agua (CRA)
Se agitaron en un tubo de centrífuga de 50 mL un gramo de SP con 40mL de agua destilada por 5 minutos, esta mezcla fue luego centrifugada a temperatura ambiente a 7500 g (7500 veces la gravedad) por 5 minutos. El sobrenadante fue vertido en una probeta de 50 mL. El cálculo de la CRA fue estimado en base a la diferencia entre el volumen inicial y el sobrenadante obtenido luego de la centrifugación. El resultado fue reportado en base a mililitros de agua retenida por gramo de proteína
(Miller y Groninger, 1976).
2.5 Capacidad de Gelificación
Concentraciones de SP entre 1 y 10% en 10 mL de agua destilada fueron agitadas en tubos por 5 minutos. Los tubos fueron calentados en baño maría a 90 °C por 30 minutos y luego colocados en agua fría (4-6 °C) por 30 minutos. La capacidad de gelificación fue calculada tomando la mínima concentración añadida en la cual la solución proteica contenida en los tubos no drenó ni cayó cuando se invirtieron en su posición de acuerdo a lo reportado por Berhout et al. (2015) con algunas
modificaciones.
2.6 Capacidad emulsificante y estabilidad de la emulsión
Se utilizaron diferentes concentraciones en el rango de 0 a 2% de SP de acuerdo a lo recomendado por Taheri et al. (2013) con algunas modificaciones. Se añadió primero 25 mL de agua a temperatura ambiente y luego SP, luego se vertió cuidadosamente 25 mL de aceite vegetal de maíz a la licuadora a 10000 rpm por 1 minuto. Posteriormente, la emulsión fue centrifugada a 7500 g por 5 minutos. El cálculo de la capacidad emulsificante se realizó dividiendo el volumen de la emulsión después de centrifugar entre el volumen inicial de la emulsión multiplicada por 100. Para la evaluación de la estabilidad de la emulsión, se realizó el mismo procedimiento, pero antes de centrifugar la muestra, se calentó a 90 °C durante 30 minutos y posteriormente se dispuso en un baño de agua fría (4 °C) por 10 minutos.
2.7 Capacidad espumante
Se vertió 100 mL de agua destilada a una licuadora con 1 gramo de SP y se agitó a 10 000 rpm durante 1 minuto. La mezcla fue vertida en probetas graduadas de 250 mL. La capacidad espumante fue calculada como el volumen de la mezcla luego del licuado comparado con el volumen original de acuerdo a lo reportado por Shahidi et al. (1995) con algunas modificaciones.
2.8. Determinación de color
Se utilizó un colorímetro (NIPON DENSHOKU, modelo ZE-2000, Japón) y la escala propuesta por Hunter siendo L*, a* y b* los valores considerados para el cálculo de blancura (Binsi et al., 2017).
3. Resultados y discusión
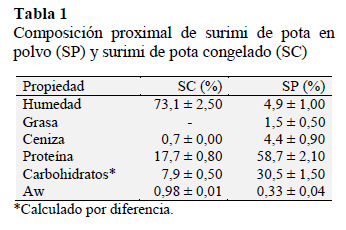
3.1 Composición proximal y actividad de agua (Aw)
La Tabla 1 muestra las composiciones proximales de SC y SP. En SP las proteínas y carbohidratos representaron 58,7% y 30,5% respectivamente. El contenido de carbohidratos proviene de la adición de los crioprotectores (8%), que en el proceso de liofilización se ve incrementado al disminuir el agua. Montejano et al. (1994) reportaron resultados similares en carbohidratos para trucha y tilapia con 30,7% y 33,5% respectivamente, por la adición de sacarosa al 8%. El efecto crioprotector sirve también en el proceso de liofilización; muchos autores reportan los efectos benéficos de los crioprotectores durante la sublimación del agua congelada que podría ser perjudicial para la estructura proteica en una fase denominada cristalización (Wahl et al., 2016).
La marcada reducción del contenido de humedad de SP (4,9%) comparado con SC (73,1%) favorecería una disminución considerable del volumen (Jeyakumari et al., 2014). El valor de actividad de agua (Aw) del SP fue 0,33; este valor disminuye de manera considerable las reacciones enzimáticas que pudieran ocurrir en SC (Aw 0,98), siendo por tanto menor el riesgo de contaminación por microorganismos (Intarasirisawat et al., 2015). Ambas acciones incrementarían el tiempo de vida útil del SP (Jiménez-Martín et al., 2015).
3.2 Solubilidad proteica
En el surimi, la solubilidad de las proteínas miofibrilares es una propiedad funcional que contribuye a la formación y estructuración de geles proteicos que sirven para la elaboración de embutidos y productos reestructurados cárnicos (Leyva-Mayorga et al., 2002, Moreno et al., 2016). Los cambios en la solubilidad se deben a la desnaturalización durante el almacenamiento en congelación, e involucran interacciones intermoleculares que disminuyen la fracción miofibrilar (de la Fuente-Betancourt et al., 2008).
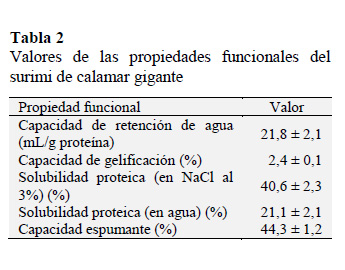
Los resultados obtenidos para la solubilidad proteica del SP realizados en agua y en solución salina al 3% fueron 21,1% y 40,6% respectivamente. Estos resultados sugieren que las proteínas miofibrilares del SP mantienen sus propiedades intrínsecas, al incrementar notablemente su solubilidad en la solución salina. En cambio, en el surimi de pescado en polvo presentó solubilidades de 9,8% y 10,3% en agua y solución salina respectivamente; estos bajos valores son atribuidos a la desnaturalización de proteínas miofibrilares por efecto de la sublimación durante el liofilizado o al uso insuficiente e inadecuado de los agentes crioprotectores (Zhou et al., 2006), como consecuencia existió una disminución en la solubilidad proteica debido a la aparición de puentes intermoleculares del tipo hidrofóbico e hidrógeno así como puentes bisulfuro e interacciones iónicas entre moléculas proteicas, Campo-Deaño et al., 2010; Wahl et al., 2016).
3.3 Capacidad de retención de agua (CRA)
En este estudio la CRA fue 21,8 mL/g de proteína, ligeramente mayor a lo reportado en especies de pescado Nemipterus japonicus y Priacanthus tayenus siendo sus valores 19,5 y 19,7 mL/g de proteína respectivamente (Campo-Deaño et al., 2009). La capacidad de las proteínas para inmovilizar agua es una propiedad funcional muy aplicada en la industria alimentaria y de ella depende la interacción proteína-proteína y agua-proteína en sistemas alimentarios tales como dispersiones coloidales y geles (Sánchez-Alonso et al., 2007; Moreno et al., 2016). Estas interacciones son importantes aun cuando se trata de productos deshidratados pulverizados ya que la molécula proteica debe conservar de manera activa los sitios de enlace con el agua, para rehidratarse y ligar el agua.
3.4 Gelificación
La formación de un gel proteico involucra generación de redes tridimensionales de polímeros entrelazados que atrapan una gran cantidad de agua, dándole a toda la estructura características parecidas a un sólido (Berghout et al., 2015; Yang et al., 2012). Esta propiedad es muy importante en emulsiones alimentarias por su capacidad de generar geles a partir de fases acuosas (Konno et al., 2003). La capacidad de gelificación en SP fue 2,4% siendo este valor promedio para el SP de diferentes especies marinas tal como reporta Campo-Deaño et al. (2010), no obstante, en ladeterminación de proteínas de dicho estudio refieren un valor promedio de 73% mientras que en este estudio el valor fue 58,7%, lo que significa que hay un menor contenido proteico para la misma capacidad de gelificación.
3.5 Capacidad emulsificante y estabilidad de la emulsión
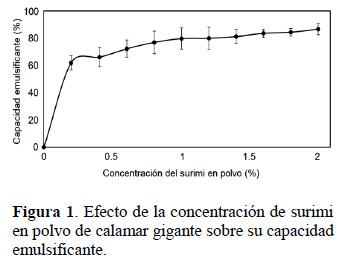
La Figura 1 muestra la capacidad emulsificante del SP en concentraciones entre 0 y 2% (p/p). Se observa un rápido incremento de la capacidad emulsificante en relación a la concentración, mostrando un 80% de capacidad emulsificante a una concentración del 1%. Estos resultados son parecidos a los reportados por Campo-Deaño et al. (2010) siendo los valores de 85% y 87% para las especies Nemipterus japonicus y Priacanthus tayenus respectivamente. Sin embargo, para el surimi liofilizado de Saurida tumbil reportaron valores inferiores capacidad emulsificante (25% a una concentración proteica de 1%), atribuyéndole esta característica a la baja estabilidad de la proteína miofibrilar durante la etapa de congelación. Es necesario resaltar que el SP de calamar gigante presenta mejores propiedades en su capacidad y estabilidad emulsionante debido a las características particulares de solubilidad de la proteína en soluciones acuosas de baja fuerza iónica que permitirían que una menor cantidad de proteínas interactúe con el aceite y por ende mejore las propiedades de emulsificación (Li et al., 2015).
3.6 Capacidad espumante
En la Tabla 2 se muestra los resultados de las propiedades funcionales. La capacidad espumante fue 44,3%, valor superior a lo reportado por Campo-Deaño et al. (2010) para Saurida tumbil, Nemipterus japonicus y Priacanthus tayenus obteniéndose el valor más elevado (34,6%) para Nemipterus japonicus. Esto sugiere que el SP de calamar gigante presenta ventajas en sus propiedades espumantes que podrían utilizarse en la industria alimentaria. De la Fuente-Betancourt et al. (2008) demostró que la estabilidad de la espuma de las proteínas de calamares es tres o cuatro veces mayor que la albúmina.
3.7 El color
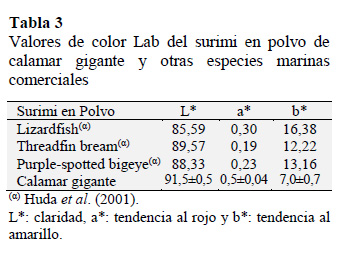
Finalmente, el color del surimi en polvo del calamar gigante mostró ser más claro y con menores valores de tendencia al color amarillo (Tabla 3) comparado con el de otras especies Saurida tumbil, Nemipterus japonicus y Priacanthus tayenus (Campo-Deaño et al., 2010) debido principalmente a las características de la materia prima que es de color blanco.
Esta característica sensorial facilitaría la adición de este concentrado proteico funcional a muchos alimentos ayudando a mejorar su apariencia siendo este factor uno de los criterios más importantes que los consumidores utilizan para juzgar la conveniencia, calidad y seguridad de los alimentos (Konno et al., 2003).
4. Conclusiones
Las propiedades funcionales más sobresalientes en el surimi en polvo de calamar gigante fueron: capacidad gelificante (2,4±0,1%), capacidad de formación de espuma (44,3±1,2%) y solubilidad proteica en NaCl (40,6±2,3%); teniendo un gran potencial en la industria alimentaria como un sucedáneo marino de gran valor nutricional.
Referencias bibliográficas
AOAC. 2000. Official methods of analysis of the association of official analytical chemists (17th ed.). DC: Washington. EEUU. [ Links ]
Berghout, J.; Boom, R.; Van der Goot, A. 2015. Understanding the differences in gelling properties between lupin proteins isolate and soy protein isolate. Food Hydrocolloids 43: 465-472. [ Links ]
Binsi, P.; Nayak, N.; Sarkar, P.; Jeyakumari, A.; Muhamed Ashraf, P.; Ninan, G.; Ravishankar, C. 2017. Structural and oxidative stabilization of spray dried fish oil microencapsulates with gum arabic and sage polyphenols: Characterization and release kinetics. Food Chemistry 219: 158–168. [ Links ]
Campo-Deaño, L.; Tovar, C.; Pombo, M.; Solas, M.; Borderías, A. 2009. Rheological study of giant squid surimi (Dosidicus gigas) made by two methods with different cryoprotectants added. Journal of Food Engineering 94(1): 26–33.
Campo-Deaño, L.; Tovar, C.; Borderías, J. 2010. Effect of several cryoprotectants on the physicochemical and rheological properties of suwari gels from frozen squid surimi made by two methods. Journal of Food Engineering 97(4): 457–464. [ Links ]
de la Fuente-Betancourt, G.; García-Carreño, F.; Navarrete del Toro, M.; Pacheco-Aguilar, R.; Córdova-Murueta, J. 2008. Effect of storage at 0 °C on mantle proteins and functional properties of jumbo squid. International Journal Food Science and Technology 43: 1263-1270. [ Links ]
Galla, N.; Pamidighantam, P.; Akula, S.; Karakala, B. 2012. Functional properties and in vitro antioxidant activity of roe protein hydrolysates of Channa striatus and Labeo rohita. Food Chemistry 135(3): 1479–1484. [ Links ]
Ghribi, A.; Gafsi, I.; Blecker, C.; Danthine, S.; Attia, H.; Besbes, S. 2015. Effect of drying methods on physico-chemical and functional properties of chickpea protein concentrates. Journal of Food Engineering 165: 179–188. [ Links ]
Huda, N.; Abdullah, A.; Salam, A. 2001. Functional properties of surimi powder from three marine fish. Journal of Food Science and Technology 36: 401-406. [ Links ]
Intarasirisawat, R.; Benjakul, S.; Vissessanguan, W.; Maqsood, S.; Osako, K. 2015. Skipjack roe protein hydrolysate combined with tannic acid increases the stability of fish oil upon microencapsulation. European Journal of Lipid Science and Technology 117(5): 646–656. [ Links ]
Jeyakumari, A.; Kothari, D.; Venkateshwarlu, G. 2014. Microencapsulation of fish oil-milk based emulsion by spray drying: Impact on Oxidative Stability. Fishery Technology 51(1): 31–37. [ Links ]
Jiménez-Martín, E.; Gharsallaoui, A.; Pérez-Palacios, T.; Carrascal, J.; Rojas, T. 2015. Volatile compounds and physicochemical characteristics during storage of microcapsules from different fish oil emulsions. Food and Bioproducts Processing 96: 52–64. [ Links ]
Konno, K.; Young-ie, C.; Yoshioka, T.; Shinho, P.; Seki, N. 2003. Thermal denaturation and autolysis profile of myofibrillar proteins of mantle muscle of jumbo squid Dosidicus gigas. Fisheries Science 69: 204–209. [ Links ]
Leyva-Mayorga, M.; Ramírez, J.; Martín-Polo, M.; Hernández, H.; Vázquez, M. 2002. Empleo de su surimi liofilizado en emulsiones cárnicas con bajo contenido de grasa. Ciencia Tecnológica Alimentaria 3(5): 288-294. [ Links ]
Li, J.; Xiong, S.; Wang, F.; Regenstein, J.; Liu, R. 2015. Optimization of microencapsulation of fish oil with gum arabic/casein/beta-cyclodextrin mixtures by spray drying. Journal of Food Science 80(7): 1445–1452. [ Links ]
Miller, R.; Groninger, H. 1976. Functional properties of enzyme modified acylated fish protein derivates. Journal of Food Science 41: 268-272. [ Links ]
Montejano, J.; Morales, O.; Díaz, S. 1994. Rheology of gels of freeze-dried surimi of trout (Cyanoscion nothus) and tilapia (Oreochromis niloticus). Revista Española de Ciencia y Tecnología de Alimentos. 34: 165-167. [ Links ]
Moreno, H.; Herranz, B.; Pérez-Mateos, M.; Sánchez-Alonso, I.; Borderías, J. 2016. New Alternatives in Seafood Restructured Products. Critical Reviews in Food Science and Nutrition 56(2): 237-248. [ Links ]
Ramírez, J. A.; Uresti, R. M.; Velázquez, G.; Vázquez, M. 2011. Food hydrocolloids as additives to improve the mechanical and functional properties of fish products: A Review. Food Hydrocolloids 25: 1842–1852. [ Links ]
Sánchez-Alonso, I.; Careche, M.; Borderías, A. J. 2007. Method for producing a functional protein concentrate from giant squid (Dosidicus gigas) muscle. Food Chemistry 100: 48–54. [ Links ]
Shahidi, F.; Xiao-Qing, H.; Synowiecki, J. 1995. Production and characteristics of protein hydrolysates from capelin (Mallotus villosus). Food Chemistry 53:285–293. [ Links ]
Taheri, A.; Anvar, S.; Ahari, H.; Fogliano, V. 2013. Comparison the functional properties of protein hydrolysates from poultry byproducts and rainbow trout (Oncorhynchus mykiss) viscera. Iranian Journal of Fisheries Sciences 12(1): 154-169. [ Links ]
Wahl, V.; Khinast, J.; Paudel, A. 2016. Lyophilized Protein Powders: A Review of Analytical Tools for Root Cause Analysis of Lot-to-Lot Variability. Trends in Analytical Chemistry 82: 468–491. [ Links ]
Yang, Y.; Anvari, M.; Pan, C.; Chung, D. 2012. Characterisation of interactions between fish gelatin and gum arabic in aqueous solutions. Food Chemistry 135(2): 555–561. [ Links ]
Zhou, A.; Benjakul, S.; Pan, K.; Gong, J.; Liu, X. 2006. Cryoprotective effects of trehalose and sodium lactate on tilapia (Sarotherodon nilotica) surimi during frozen storage. Food Chemistry 96: 96–103. [ Links ]
* Corresponding author
E-mail: jcordovar1@unmsm.edu.pe (J.S. Córdova-Ramos)
Received November 13, 2016.
Accepted March 19, 2017.