Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.8 no.2 Trujillo abr./jun. 2017
http://dx.doi.org/10.17268/sci.agropecu.2017.02.03
ARTÍCULOS ORIGINALES
Producción de polihidroxialcanoatos por bacterias halófilas nativas utilizando almidón de cáscaras de Solanum tuberosum L.
Production of polyhydroxyalkanoates by native halophilic bacteria using Solanum tuberosum L. shell starch
César Guzmán1; Alberto Hurtado2, *; Carmen Carreño1; Indira Casos1
1 Fac. de Ciencias Biológicas, Universidad Nacional Pedro Ruiz Gallo, Av. Juan XXIII 391, Lambayeque, Peru.
2 Fac. de Ingeniería Agraria, Universidad Católica Sedes Sapientiae, Esq. Jr. Cuzco y Jr. Lima S/N, Chulucanas, Peru.
Resumen
El objetivo del presente estudio fue determinar la concentración de almidón de cáscaras de Solanum tuberosum L. "papa" para la producción de polihidroxialcanoatos, PHA, por bacterias halófilas nativas, como una alternativa para disminuir los costos de producción de estos biopolímeros, posibles reemplazantes de los plásticos provenientes del petróleo. Las bacterias fueron aisladas de muestras de agua de ocho salinas y fueron enriquecidas en caldo HM1 a 30 °C, con 5, 10, 15, 20, 25 y 30 g 100 mL-1 de NaCl. A continuación, se realizaron diluciones, se tomaron alícuotas y se sembraron en agar HM1, obteniéndose 203 aislados de bacterias halófilas que fueron cultivados en caldo HM2 con 10 g.L-1 de glucosa como fuente de carbono y entre las que el 38,92% presentó gránulos de PHA teñidos por Sudan Negro B. Los 20 aislados con gránulos de PHA en el 65 95 % de las células nuevamente fueron llevadas a fermentación, alcanzando 0,174 0,889 g.g-1 de rendimiento Y (p/x). Se seleccionaron tres aislados con los mayores valores entre los que Halomonas sp. M4C1 desarrolló y sintetizó PHA en caldo HM2 con 5, 10, 15 y 20 g.L-1 de almidón como fuente de carbono, alcanzando 0,019; 0,016; 0,007 y 0,006 g.L-1 de PHA, con 0,177; 0,111; 0,056 y 0,066 g.L-1 de biomasa, después de 20, 40, 24 y 16 horas respectivamente. El mayor rendimiento de 0,144 g.g-1 le correspondió a 10 g.L-1 de almidón demostrándose que con esta concentración es factible la producción de PHA por las bacterias halófilas nativas.
Palabras clave: Bacterias halófilas; PHA; bioplásticos; biopolímeros; almidón.
Abstract
The aim of this study was to determine the concentration of starch Solanum tuberosum L. "potato" peels for the production of polyhydroxyalkanoates, PHA, from native halophilic bacteria as an alternative to reduce production costs of these biopolymers, possible replacements for petrochemical plastics. The bacteria were isolated of water samples of eight saline Lambayeque region and were enriched in HM1 broth at 30 °C with 5, 10, 15, 20, 25 and 30 g 100 mL-1 NaCl. Dilutions were performed subsequently, aliquots were taken and plated on HM1 agar, 203 isolates of halophilic bacteria were obtained, they were grown in HM2 broth with 10 g.L-1 glucose as carbon source and the 38.92% of the isolates showed PHA granules stained by Sudan Black B. Twenty bacteria with PHA granules in 65 – 75% over carried to fermentation, reaching between 0.174 to 0.889 g.g-1 of yield Y (p / x). Three isolates were selected with the highest values among which Halomonas sp M4C1 grew and synthesized PHA in HM2 broth with 5, 10, 15 and 20 g.L-1 of starch as carbon source, reaching 0.019; 0.016; 0.007 y 0.006 g.L-1 of PHA, with 0.177; 0.111; 0.056 and 0.066 g.L-1 of biomass after 20, 40, 24 and 16 hours respectively. The highest yield of 0.144 g.g-1 corresponded to 10 g.L-1 of starch demonstrating that this concentration is feasible PHA production by native halophilic bacteria.
Keywords: Halophilic bacteria; PHA; bioplastics; biopolymers; starch.
1. Introducción
Los plásticos derivados del petróleo son esenciales en la vida diaria debido a sus múltiples aplicaciones, son de fácil moldeamiento y alta resistencia química (Lemos y Mina, 2015); sin embargo, además de los beneficios de su uso, han traído consigo serios problemas de contaminación. Se estima que 30 % de los millones de toneladas de residuos sólidos generados en el mundo son plásticos y debido a que no son degradados, se acumulan en los suelos, ríos y mares, afectando negativamente el ecosistema (López, 2012; Becerra, 2013). Asimismo, el uso del petróleo como materia prima para la producción de plásticos no es sostenible, porque es un recurso no renovable y además contamina el medio ambiente con la emisión de gases de invernadero como metano, gases conteniendo flúor, cloro y dióxido de carbono (Gonzáles et al., 2013).
Los poli – B – hidroxialcanoatos (PHA) se presentan como los candidatos ideales para reemplazar los plásticos de origen petroquímico. Bajo este título, se conocen más de 90 polímeros biodegradables o poliésteres de ácidos alcanoicos insolubles en agua y sintetizados como material de reserva por algunos microorganismos cuando el medio de cultivo se encuentra desbalanceado con limitación de nitrógeno, fósforo, azufre, magnesio u oxígeno y con exceso de fuente de carbono (Franco et al., 2009; Sánchez et al., 2012; Cardona et al., 2013). El PHA más estudiado es el homopoliéster poli – 3 – hidroxibutirato, (P3HB) que puede constituir hasta el 90 % del peso seco de la célula (Khanna y Srivastaba, 2005). Las propiedades físicas del PHA son similares a las del polipropileno en términos de punto de fusión, densidad y resistencia a la tracción (Fernández, 2012; Becerra, 2013) y copolímeros como el poli (3 – hidroxibutirato – co – 3 – hidroxivalerato): P (3HB – co – 3HV) presentan menor punto de fusión y mayor elasticidad resultando más interesantes (López, 2012; Gómez, 2013; Gonzáles et al., 2013). Una variedad de PHA que contienen 3-hidroxibutirato (3HB) y un segundo monómero, tal como 3 hidroxipropionato (3HP), 4 – hidroxibutirato (4HB), 5 hidroxivalerato (5HV) y 3 – hidroxihexanoato (3HH), se han producido para mejorar las propiedades del material (Insomphun, 2016); sin embargo, el proceso de elaboración de los PHA es muy costoso. En el 2010 el costo de P3HB fue estimado en 2,13 – 6,25 dólares kg-1, muy superior al petroplástico correspondiente a 1,45 dólares kg-1 (Gómez, 2013). Los costos de producción dependen del medio de cultivo, proceso fermentativo y extracción del PHA, habiéndose determinado que el costo del sustrato constituye cerca del 50 % del total de producción de PHA (Chen et al., 2006).
El problema económico puede ser disminuido mediante el mejoramiento del proceso fermentativo y separación del producto (Bello et al., 2008; Mora, 2010), búsqueda de microorganismos más eficientes (Franco et al., 2009; Baca et al., 2010; Razzaq et al., 2010) y el uso de fuentes de carbono más baratas como el glicerol (Beckers et al., 2016) y residuos agrícolas como las cáscaras de Solanum tuberosum L. "papa" (Ramírez et al., 2004; Huang et al., 2006; Rivera y Nevárez, 2009; Cardona et al., 2013), entre otros. Investigaciones realizadas (Díaz, 2007; Oliart et al., 2016; Quillahuaman et al., 2008) demostraron que las bacterias halófilas son heterótrofos capaces de utilizar diversos carbohidratos como fuente de carbono y acumular PHA. Asimismo, las condiciones extremadamente salinas en las que pueden desarrollarse disminuyen los requerimientos de condiciones estériles y la contaminación durante el proceso fermentativo y por ende los costos de producción (Díaz, 2007; Castro et al., 2011). El aislamiento de bacterias halófilas resistentes a condiciones ambientales extremas y por lo tanto poseedoras de sistemas enzimáticos eficientes permitirá seleccionar bacterias productoras de PHA en subproductos industriales como las cáscaras de papa.
Por lo expuesto, se planteó aislar bacterias halófilas productoras de PHA en salinas ubicadas en los distritos de San José y Santa Rosa en la región Lambayeque, seleccionar las bacterias halófilas con mayor rendimiento Y (p/x) en glucosa y almidón de cáscaras de papa como fuente de carbono para la producción de PHA.
2. Materiales y métodos
El trabajo de investigación se ejecutó en dos fases. En la primera, se realizó el aislamiento, detección y selección de bacterias halófilas nativas productoras de PHA, utilizando un diseño no experimental transeccional (Hernández et al., 2010). En la segunda fase se determinó la concentración de almidón para la producción de PHA por una bacteria halófila nativa seleccionada, utilizando un diseño completamente aleatorio, DCA, con cuatro tratamientos y tres repeticiones, totalizando 12 unidades experimentales. Los tratamientos correspondieron a la concentración de almidón con cuatro niveles 5, 10, 15 y 20 gL-1. También se consideró un testigo con glucosa (10 gL-1).
Muestreo
Para aislar bacterias halófilas productoras de PHA se recolectaron aleatoriamente 35 muestras de agua en ocho salinas de los distritos de San José y Santa Rosa, región Lambayeque. Las salinas de San José están ubicadas a 6°46’8.26’’ latitud sur y 79°56’56.78’’ longitud oeste (Fuentes et al, 2013) y las salinas de Santa Rosa están a 6°53’34.87’’ latitud sur y 79°54’33.08’’ longitud oeste (Fuentes et al., 2013). Las muestras de agua en cantidad de 200 mL fueron recolectadas en frascos de vidrio de boca ancha previamente esterilizados e identificados. Inmediatamente después, se midió la concentración de NaCl de las muestras y se transportaron para su procesamiento al Laboratorio de Microbiología y Parasitología de la Facultad de Ciencias Biológicas de la Universidad Nacional Pedro Ruiz Gallo.
Aislamiento de bacterias halófilas productoras de PHA
La población de bacterias halófilas de las muestras de agua fue enriquecida (Guzmán y Guz, 2008) depositando 1 mL de cada muestra en 10 mL de medio HM1 con glucosa (1 gL-1) como fuente de carbono y diferentes concentraciones de NaCl (5, 10, 15, 20, 25 y 30g 100 mL-1) e incubando a 30°C por tiempo suficiente para observar crecimiento bacteriano denotado por una turbidez. El aislamiento de las bacterias halófilas se realizó en las muestras enriquecidas y diluidas (10-3) en solución salina 10 % p/v, tomando alícuotas (10-3) y sembrándolas en agar HM1 con una concentración de NaCl similar al medio de enriquecimiento (Quillahuaman et al., 2008). Después de la incubación a 30 °C, en aerobiosis, hasta observar el crecimiento de las colonias (1 a 15 días), éstas fueron caracterizadas y agrupadas según su color, forma, tamaño y aspecto, seleccionando una colonia representativa de cada grupo, que a su vez se cultivó en agar HM1 y se incubó a 30 °C, en aerobiosis, por tiempo suficiente para observar crecimiento, constituyendo los aislados bacterianos que fueron guardados en refrigeración a 4 °C.
Detección y selección de bacterias productoras de PHA
Para la detección de PHA cada aislado de bacteria halófila se sembró en 5 mL de caldo HM2 con glucosa (10 g.L-1) como fuente de carbono (Guzmán y Guz, 2008) y se incubó en estufa (marca Blue Pard, modelo DHG) a 30 °C, en agitación constante (125 rpm) hasta observar crecimiento. Posteriormente, se realizaron tinciones con Sudan Negro B según lo mencionado por Martínez (2004); y la presencia de gránulos negros o grisáceos en el interior de las células vegetativas rosadas se consideró como positivo para la detección de PHA. Este polímero fue estimado cuantificando el número de células de bacterias con gránulos en cinco campos microscópicos y se seleccionaron los 20 cultivos bacterianos que presentaron el mayor número de células con gránulos por campo.
Rendimiento de PHA en glucosa
Las bacterias halófilas seleccionadas se cultivaron en 6 mL de caldo HM2 con glucosa como fuente de carbono (Guzmán y Guz, 2008), a 30 °C por tiempo suficiente hasta alcanzar 107 cel mL-1 (tubo 3 del nefelómetro de McFarland). Después, 5 mL del cultivo (10 %, v/v) se inocularon en 45 mL de caldo HM2 y se incubaron a 30 °C, en agitación constante a 125 rpm hasta alcanzar 109 cel mL-1 (tubo 9 del nefelómetro de McFarland), momento en que los cultivos se centrifugaron en centrífuga (marca Gemmy, modelo PLC)– 03 a 3000 rpm durante 15 minutos. El sedimento o biomasa celular se lavó dos veces con agua destilada y se deshidrató en estufa (marca Blue Pard, modelo DHG) a 45 °C, hasta alcanzar peso constante (Baca et al., 2010). Para cuantificar el PHA (Cholula, 2005), en el tubo que contenía la biomasa deshidratada se agregó 1 mL de hipoclorito de sodio al 5 % para debilitar la membrana celular y facilitar el proceso de extracción y después de 2 horas se agregó 1 mL de cloroformo para separar la biomasa del polímero. Transcurridos 20 minutos, los tubos se centrifugaron a 3500 rpm durante 5 minutos y se obtuvieron dos fases, una superior conteniendo hipoclorito de sodio con restos celulares y una inferior correspondiente al cloroformo con el PHA. Inmediatamente después, con una pipeta Pasteur se extrajo el cloroformo con el polímero, se depositó en un tubo y se llevó a estufa a 40 °C, por 24 horas para acelerar la evaporación del cloroformo. El polímero obtenido fue depositado en un papel metálico para determinar el peso (g) y verificar su naturaleza, para lo cual el polímero fue digerido con H2SO4 concentrado, durante 30 minutos, a 90 °C (baño María), se dejó enfriar a temperatura ambiente (25 °C) y se realizó un "barrido" en espectrofotómetro (marca UNICO, modelo SQ 2800, 190 – 1 100 nm), con luz UV en un rango de 220 a 250 nm. El polímero fue identificado como PHA cuando se observó un pico máximo de absorbancia a 235 nm. Con las concentraciones de la biomasa celular (x) y PHA (p) se calculó el Y (p/x): coeficiente de rendimiento del producto con relación a la biomasa (Dorán, 1995) o cantidad de PHA obtenido por cantidad de biomasa formada (g.g-1):
Rendimiento de PHA en almidón
Los tres aislados bacterianos que alcanzaron los mayores Y (p/x) se seleccionaron para la producción de PHA en almidón contenido en cáscaras de papa como fuente de carbono. Para la preparación del caldo de fermentación las cáscaras de papa se lavaron con agua potable, se enjuagaron con agua destilada, se deshidrataron a temperatura ambiente (27 °C – 30 °C) por 72 horas y el material obtenido fue molido hasta fracciones de 0,5 a 2 mm. A continuación, se determinó la concentración de almidón mediante el método espectrofotométrico por reacción colorimétrica con yodo, según Lumbre y Potozen (2001). Se observó una coloración azul y se leyó la absorbancia en espectro-fotómetro a 600 nm. Los valores obtenidos se analizaron mediante regresión lineal utilizando el programa Microsoft Excel 2007 y se obtuvo una ecuación de la recta equivalente (y = 1,604•x + 0,068), producto de tres repeticiones con un valor de r2 = 0,999. Considerando que un valor de r2> 0,9 muestra una dispersión homogénea de valores sobre la recta (Mantilla, 2007) se aceptó la ecuación como un patrón de referencia para el cálculo de la concentración de almidón en cáscaras de papa, determinándose que 1 gramo de cáscaras de papa contiene 0,39 gramos de almidón. Con este valor se calculó la cantidad de cáscaras de papa requerida para alcanzar las diferentes concentraciones almidón en el caldo de fermentación, teniendo como base el caldo HM2 en donde se reemplazó la glucosa por cuatro concentraciones de almidón (5, 10, 15, 20 g.L-1).
Para la detección de PHA, según Cholula (2005) las bacterias se cultivaron en 5 mL de caldo HM2 con 5, 10, 15 y 20 g.L-1 de almidón, se incubaron a 30 °C a 125 rpm, durante 48 horas, determinándose el crecimiento por la turbidez en el medio de cultivo y el PHA por la presencia de gránulos en coloraciones con Sudan Negro B. El aislado bacteriano con mayor turbidez y gránulos de PHA fue identificado y seleccionado para el proceso fermentativo. Éste fue cultivado en cuatro tubos con 5 mL de caldo de fermentación con 5, 10, 15 y 20 g.L-1 de almidón y en un tubo con glucosa (10 g.L-1) a 30 °C y 125 rpm, hasta alcanzar 107 celmL-1. Después, se tomaron 2,5 mL (10 % v/v), se inocularon en 22,5 mL de caldo de fermentación con su respectiva concentración de almidón y glucosa y se incubaron a 30 °C, 125 rpm hasta alcanzar 107 cel.mL-1. Para el proceso fermentativo en 15 biorreactores tipo tanque con sistema discontinuo y flujo de aire descendente (1 vvm), conteniendo 225 mL de caldo de fermentación con cuatro concentraciones de almidón y un control con glucosa se depositaron 25 mL (10 %, v/v) de cada uno de los inóculos bacterianos y se incubaron a 30 °C, durante 52 horas. A partir de la inoculación (hora 0) y cada 4 horas se tomaron muestras de 10 mL para cuantificar la biomasa y el PHA.
Análisis estadístico
El análisis de varianza del rendimiento Y (p/x) se realizó para determinar la superioridad entre los tratamientos y mediante la prueba múltiple de Tukey se determinó la significancia, α = 0,05, (Hernández et al., 2010). Se utilizó el software estadístico SPSS versión 15,0 así como los programas Word y Excel para Windows versión 2007.
3. Resultados y discusión
En las muestras de agua de las salinas, la concentración de NaCl alcanzó hasta 25 g/100 mL, coincidiendo con López (2010) y Fuentes et al. (2013), quienes determinaron que estos ambientes son considerados hipersalinos debido a que presentan una elevada concentración de sal. El 100 % de estas muestras fue positivo para el enriquecimiento y aislamiento de bacterias en un tiempo que osciló entre 1 día (5 g/100 mL NaCl) hasta 18 días (30 g/100 mL NaCl). Las salinas son buenos hábitats para los procariotas halófilos (Fuentes et al., 2013). Anteriormente, se asumía que las arqueobacterias dominaban los ambientes extremos, mientras que las bacterias estaban restringidas a los ambientes moderados. Con técnicas moleculares se ha demostrado que ambas se encuentran en ambientes extremos como las salinas (Díaz, 2007).
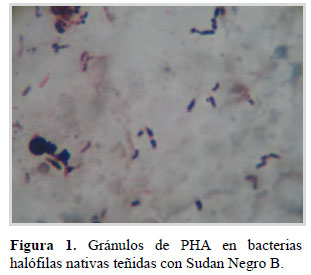
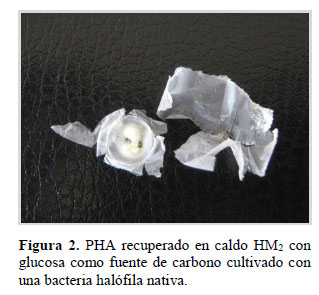
Se obtuvieron 203 aislados de bacterias halófilas y en el 38,92 % de las bacterias halófilas se detectaron gránulos de PHA (Figura 1), en caldo con glucosa como fuente de carbono. Los PHA son poliésteres sintetizados y acumulados en forma de gránulos en el citoplasma por una variedad de procariotas y constituyen una estrategia para incrementar su supervivencia (Pettinari et al., 2004; Dantas, 2005; López, 2010). Entre las bacterias con PHA se seleccionaron 20, debido a que el 65– 95% de las células por campo presentaron gránulos de PHA teñidos con Sudan Negro B. La naturaleza del polímero recuperado (Figura 2) después de cultivar estas bacterias en caldo HM2 con glucosa como fuente de carbono fue verificada en una corrida espectral, observando un pico máximo de absorbancia a 235 nm, coincidiendo con Cholula (2005), Baca et al. (2010) y Legat et al. (2010).
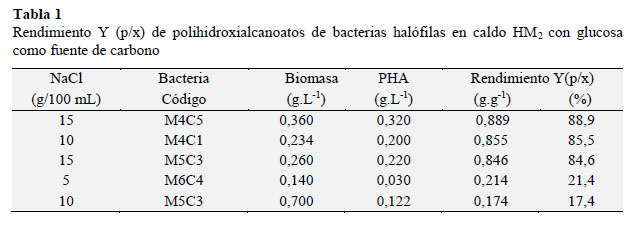
La concentración máxima de PHA fue de 0,320 g.L-1 con un rendimiento Y (p/x) de 0,889 g.g-1 (Tabla 1). Según Fernandez et al. (2005), bacterias con más de 0,3 gL-1 de PHA se consideran con potencial para la producción industrial de este bioplástico.
En porcentaje este valor (88,9 %) es superior al rango 38,7 72,8 % reportado por Dong et al. (2006), Huang et al. (2006) y Koller et al. (2007) para Haloferax mediterranei cultivada en hidrolizado de almidón de maíz, mezcla de paja de arrozalmidón de maíz y suero de leche, respectivamente. Por su parte, 15 aislados presentaron una concentración de PHA menor a 0,0001 g, que no pudo ser cuantificada en las condiciones de la presente investigación.
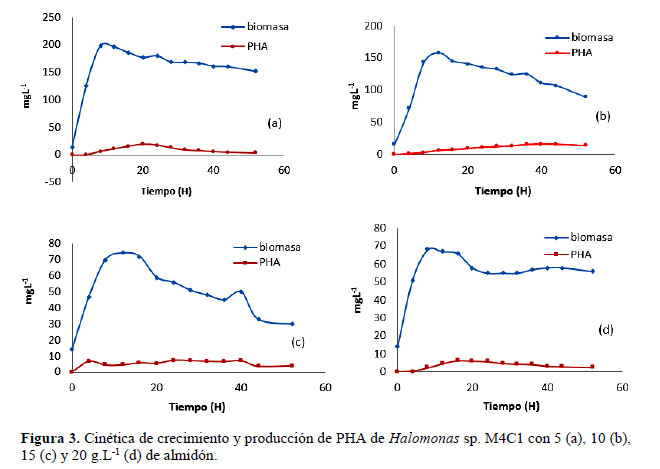
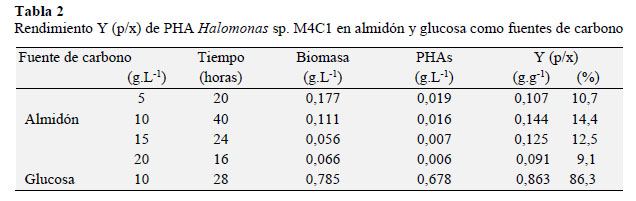
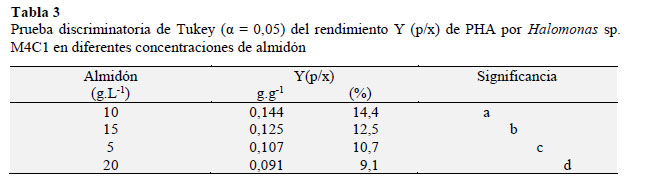
Debido a que presentaron los mayores valores en el rendimiento se seleccionaron M4C5, M4C1 y M5C3, entre las que M4C, identificada como Halomonas sp. (Cardinali et al., 2016) desarrolló y formó gránulos de PHA en las cuatro concentraciones de almidón por lo que fue elegida para cuantificar la biomasa y el PHA, así como también, el rendimiento Y (p/x). Al observar la cinética (Figura 3) de esta bacteria en 5, 10, 15 y 20 g.L-1 de almidón, se aprecia que la biomasa y el PHA se incrementaron hasta alcanzar un valor máximo y luego disminuyeron gradualmente debido al agotamiento de la fuente de carbono externa y al uso de PHA acumulado como fuente de energía. El rendimiento Y (p/x) o gramos de PHA por gramo de fuente de carbono (Tabla 2) fue de 0,107; 0,144; 0,125 y 0,091 g.g -1 equivalentes a 10,7; 14,4; 12,5 y 9,1 % y según la prueba múltiple de Tukey (α = 0,05) el mayor valor se obtuvo con 10 g.L-1 diferenciándose significativamente de 15, 5 y 20 g.L-1 (Tabla 3).
Se enfatiza la importancia de Halomonas sp. M4C1 por tratarse de una bacteria nativa que creció y sintetizó PHA, utilizando como fuente de carbono cáscaras de papa, que industrialmente son considerados como residuos. Coincidiendo con lo expuesto, Dong et al. (2006) manifestaron que se han utilizado muchas bacterias para producir PHA incluyendo Cupriavidus necator, Alcaligenes latus, Azotobacter vinelandii, Pseudomonas spp., Escherichia coli recombinante; sin embargo, las bacterias halófilas tienen la ventaja de requerimientos mínimos de esterilidad, debido a la extrema salinidad del medio de cultivo donde pueden crecer y sintetizar el polímero.
Aun cuando las ventajas ecológicas de los PHA son notables, los costos de producción muy elevados limitan su adopción plena como sustitutos de los poliésteres derivados del petróleo. Para reducir los costos se deben obtener bacterias con mayor rendimiento y buscar sustratos económicos y de fácil accesibilidad para la producción de PHA, así como optimizar los procesos de extracción y purificación del producto (Rivera y Nevárez, 2009; Higuchi et al., 2016). Las cáscaras de papa contienen almidón que constituye una fuente de carbono económica y son residuos que por sí mismos ofrecen poco valor. Coincidiendo al respecto, Grados et al. (2008) y Rivera y Nevárez (2009) demostraron que se pueden utilizar residuos de los procesos industriales como efluentes de las instalaciones donde se crían cerdos, aceites comestibles post utilizados y residuos agrícolas hidrolizados para la producción de PHA por Azotobacter vinelandii ATCC 53799 y Pseudomonas spp. DR2, respectivamente. Asimismo, residuos de aceites de soya también fueron utlizados para la producción de PHA por Pseudomonas aeruginosa (Abid et al., 2016).
Halomonas sp. M4C1 cultivada con almidón como fuente de carbono alcanzó un rendimiento de PHA muy bajo (14,3 %), comparado con el obtenido al utilizar glucosa como fuente de carbono, sugiriendo la necesidad de hidrolizar el almidón o suplementarlo, coincidiendo con Chen et al. (2006), Huang et al. (2006), Koller et al. (2007) quienes cultivaron H. mediterranei en hidrolizados de almidón de maíz, paja de arroz con almidón de maíz, así como suero lácteo obteniendo 20; 77,8 y 12 g.L-1 de PHA correspondientes a 50,8; 55,6 y 72,8 % de acumulación en peso seco, respectivamente. Asimimo, Rivera et al. (2015) cultivaron Halomonas boliviensis en hidrolizado de almidón obteniendo un 41% de PHA después de 24 horas de cultivo. Estos investigadores propusieron la hidrólisis química de los residuos agrícolas, lo que representa un costo extra en la producción. También es posible que otros factores como la aireación puedan explicar el bajo rendimiento. Ésta favorece la producción de PHA; no obstante, Lasala et al. (2004) concluyeron que una oxigenación elevada desvía el metabolismo hacia mayores cuotas de respiración, mayor oxidación del sustrato y por lo tanto menos disponibilidad de Acetil – CoA para la síntesis del polímero. Por el contrario, con bajos niveles de oxigenación y exceso de fuente de carbono, el metabolismo energético genera elevadas concentraciones de NADH y Acetil – CoA, el cual es convertido en formas osmóticamente neutras como el PHA. Asimismo, Martínez (2004) informó que cuando Azospirillum brasilense sp. 7 fue cultivada con alta presión parcial de oxígeno y con cloruro de amonio como fuente de nitrógeno, el contenido de PHA fue menor a 1 %. Por el contrario, en ausencia de cloruro de amonio y en microaerofilia esta bacteria acumuló cerca del 75 % de peso en PHB.
4. Conclusiones
La producción de PHA por Halomonas sp. M4C1 se demostró en cuatro concentraciones de almidón de cáscaras de papa, alcanzando un Y (p/x) de 0,143 g.g-1. La disponibilidad y bajo costo de las cáscaras de papa posibilitan la producción de PHA por Halomonas sp M4C1; no obstante, se sugiere un tratamiento previo al sustrato para incrementar el Y (p/x) a 0,863 g.g-1 obtenido con glucosa como fuente de carbono.
Referencias bibliográficas
Abid, S.; Ali-Raza, Z.; Hussain, T. 2016. Production kinetics of polyhydroxyalkanoates by using Pseudomonas aeruginosa gamma ray mutant strain EBN-8 cultured on soybean oil. Biotech 6:142. [ Links ]
Baca, K.; Sánchez, M.; Carreño, C.; Mendoza, G. 2010. Polihidroxialcanoatos de cepas de Azospirillum spp. aisladas de raíces de Lycoperson esculentum Mill, "tomate" y Oryza sativa L. "arroz" en Lambayeque. Scientia Agropecuaria 1: 213 – 224. [ Links ]
Becerra, M. 2013. Producción de un polímero tipo polihidroxialcanoato (PHA) empleando residuos de la producción de biodiesel. Tesis de Maestría, Colombia, Universidad Nacional de Colombia. [ Links ]
Beckers, V.; Poblete, I.; Tomasch, J.; Wittmann, C. 2016. Integrated analysis of gene expression and metabolic fluxes in PHA‑producing Pseudomonas putida grown on glicerol. Microbial Cell Factories 15:73. [ Links ]
Bello, D.; Zinn, M.; Brandl, H.; Otero, M. 2008. Aislamiento y caracterización de Poli-B-hidroxibutirato obtenido por vía fermentativa a partir de Bacillus megaterium. ICIDCA. Sobre los Derivados de la Caña de Azúcar XLII (1-3): 101-105. [ Links ]
Cardinali, J.; Pereira, R.; Guzmán, C.; Carreño, C.; Ferreira, L.; Keico, M.; Cabrera, J. 2016. Draft Genoma sequence of Halomonas sp. HG01 a polyhydroxyalcanoates acumulating strain isolated. Genome Announc 4(1): e01598-15. [ Links ]
Cardona, A.; Mora, A.; Marín, M. 2013. Identificación molecular de bacterias productoras de Polihidroxialcanoatos en subproductos de lácteos y caña de azúcar. Revista Facultad Nacional de Agronomía Medellín 66(2): 7129-7140. [ Links ]
Castro, L.; Flores, A.; Rodríguez, A.; Aguilar, M.; Aguilar, C.; Rodríguez, R. 2011. Aislamiento y caracterización de microorganismos halófilos de suelos salinos de cuatro Ciénegas Coahuila, México. Revista Científica de la Universidad Autónoma de Coahuila 3: 5-8. [ Links ]
Chen, C.; Dong, T.; Yeng, H. 2006. Enzymatic extruded starch as a carbon source for the production of poly (3 – hydroxybutyrate – co – 3 – hydroxyvalerate) by Haloferax mediterranei. Process Biochemistry 41:2289 – 2296. [ Links ]
Cholula, L. 2005. Estudio de la producción de poli – β – hidroxibutirato (PHB) en Azospirillum brasilense Sp7. Tesis de Maestría, Mexico. Instituto Politécnico Nacional. [ Links ]
Dantas, A. 2005. Estudo produção de polihidroxibutirato por Cupriavidus necator em fermentação no estado solido. Tesis de Maestría, Brasil. Universidad Federal de Rio de Janeiro. [ Links ]
Diaz, S. 2007. NAD – glutamato deshidrogenasa de Haloferax mediterranei: clonaje, secuenciación y expresión. Purificación y propiedades de la enzima nativa y recombinante. Tesis de Doctorado, España, Universidad de Alicante. [ Links ]
Dong, C.; Chen, T.; Chang, T. 2006. Preparation and characterization of poly (hydroxyalkanoates) from the fermentation of Haloferax mediterranei. Journal of Biomaterials Science Polymer Edition 12: 1425–1438. [ Links ]
Dorán, P. 1995. Principios de Ingeniería de los Bio-procesos. España, Editorial Acribia. [ Links ]
Fernández, P.; Ortiz, F.; Edmundo J., 2005. Caracterización de poli – (hidroxibutirato – co – hidroxivalerato) sintetizado por una cepa silvestre de Bacillus mycoides, FCB2. Revista Centro de Estudios en Salud 1(6): 5–12. [ Links ]
Fernández, I. 2012. Estudio del metabolismo de polihidroxialcanoatos en Pseudomonas putida: implicaciones fisiológicas y aplicaciones en el desarrollo de bioplásticos funcionlizados. Tesis de Doctorado, España, Universidad Complutense de Madrid. [ Links ]
Fuentes, A.; Carreño C.; Llanos C. 2013. Rendimiento de expolisacáridos emulgentes producidos por bacterias halófilas nativas en tres concentraciones de melaza de Saccharum officinarum L "caña de azúcar". Scientia Agropecuaria 4: 111 120 [ Links ]
Franco, M.; Gómez, D.; Castro, N.; Rendón, M. 2009. Polihidroxialcanoatos en actinomicetos nativos de suelos colombianos. Revista Peruana de Biología 16(1): 115 – 118. [ Links ]
Grados, R.; Álvarez, M.; Giménez, A.; Mattiasson, B. 2008. Degradación anaeróbica de desechos agrícolaspor consorcios microbianos para la producción de polihidroxialcanoatos. Biofarbo 1: 28 – 35. [ Links ]
Gonzáles, Y.; Meza, J.; Gonzáles, O.; Córdova J. 2013. Síntesis y biodegradación de polihidroxialcanoatos: Plásticos de origen microbiano. Revista Internacional Contaminación Ambiental 29(1): 77 – 115. [ Links ]
Gómez, J. 2013. Producción y caracterización de polihidroxialcanoatos, sintetizadas por microorganismos nativos a partir de residuos grasos. Tesis de Maestría, Colombia, Universidad Nacional de Colombia. [ Links ]
Guzmán, M.; Guz, H. 2008. Producción de plásticos biodegradables obtenidos de bacterias halófilas aisladas de la laguna Blanca-Potosí Biotecnológicos. Bolivia, Universidad Mayor de San Simón. [ Links ]
Hernández, R.; Fernández, C.; Baptista, P. 2010. Metodología de la Investigación. México, Mc Graw. Hill Interamericana Editores S.A. [ Links ]
Higuchi, M.; Morisaki1, K.; Toyooka, K.; Numata, K. 2016. Synthesis of High-Molecular-Weight Polyhydroxyalkanoates by Marine Photosynthetic Purple Bacteria. Plos one 11(8): e0160981
Huang, T.; Duan, K.; Huang, S. 2006. Production of polyhydroxyalkanoates from inexpensive extruded rice bran and starch by Haloferax mediterranei, Microbiology Biotechnology 33: 701–706. [ Links ]
Insomphun, C.; Kobayashi, S.; Fujiki, T.; Numata, K. 2016. Biosynthesis of polyhydroxyalkanoates containning hydroxyl group from glycolate in Escherichia coli. AMB Expres 6:29. [ Links ]
Khanma, S.; Srivastaba, A. 2005. Recent advances in microbial polyhydroxyalcanoates.m Process Biochemistry. Indian Institute Technology 40: 607-619. [ Links ]
Koller, M.; Hesse, P.; Bona, R.; Kutschera, C.; Atlíc, A.; Braunegg, G. 2007. Biosynthesis of high quality polyhydroxyalkanoate co – and terpolyesters for potential medical application by the archaeon Haloferax mediterranei. Macromolecular Symposia 253: 33 – 39. [ Links ]
Lasala, F.; Martínez, J.; Núñez, R.; Rozsa, Ch.; Carballo, M.; Solano, R. 2004. Producción de polihidroxialcanoatos (PHA) por bacterias diazótrofas II. Estudio de la síntesis a escala de Zaranda con Mesorhizobium plurifarium (4033). Revista Biológica 2: 136 – 146. [ Links ]
Legat, A.; Grusber, C.; Zangger, K.; Wanner, G.; Stan, H. 2010. Identification of polyhydroxyalkanoates in Halococcus and other Haloarchaeal species. Applied Microbial and Cell Physiology 87:1119-1127. [ Links ]
Lemos, A.; Mina, A. 2015. Polihidroxialcanoatos (PHA) producidos por bacterias y su posible aplicación a nivel industrial. Informador Técnico 79(1): 93 – 101. [ Links ]
López, A. 2010. Bioprospección de bacterias marinas productoras de poli – hidroxialcanoatos en tapetes microbianos contaminados, XIII Congreso Nacional de Biotecnología y Bioingeniería, México. [ Links ]
López, I. 2012. Development of biorefineries using renewable raw materials for the production of biodegradable polymers. Tesis de Doctorado, España, Universidad de Córdoba. [ Links ]
Lumbre, L.; Potozen, J. 2001. Obtención de tiamina a partir de polvillo de arroz y maíz. Tesis de grado, Perú, Universidad Nacional Pedro Ruiz Gallo. [ Links ]
Mantilla, M. 2007. Evaluación de la acción de un bioinoculante sobre un cultivo de Cristanteno (Chrysanthemun morifolium var. yoko ono) en período de enraizamiento. Tesis de grado, Colombia, Pontificia Universidad Javeriana. [ Links ]
Martínez, J. 2004. Producción de polihidroxialcanoatos en bacterias diazótrofas I. Influencia de la aireación en la síntesis de poli β hidroxibutirato en Azospirillum brasilense cepa 7. Revista Biológica 1: 87 95. [ Links ]
Mora, W. 2010. Contribuciòn a la bioprospecciòn de un biopolímero proveniente de la biodiversidad colombiana y desarrollado por el Instituto de Biotecnología de la Universidad Nacional de Colombia: Caso PHAs en la Plasticultura. Tesis de Maestría, Colombia. Universidad Nacional de Colombia. [ Links ]
Pettinari, J.; De Almeida, A.; López, N. 2004. Bioplásticos: una alternativa ecológica. Revista Química Viva 3: 122 – 133. [ Links ]
Oliart, R.; Manresa, A.; Sánchez, M. 2016. Utilización de microorganismos de ambientes extremos y sus productos en el desarrollo biotecnológico. Biotecnología y Ciencias Agropecuarias II(I): 79 – 90. [ Links ]
Quillahuaman, J.; Doan – Van, T.; Guzman, H.; Martín, J.; Everest, A. 2008. Poly(3-hydroxybutyrate) production by Halomonas boliviensis in fed-batch culture. Applied Microbiology Biotechnology 78: 227–232. [ Links ]
Ramírez, N.; Sandoval, A.; Serrano, J. 2004. Las bacterias halófilas y sus aplicaciones biotecnológicas. Revista de la Sociedad Venezolana de Microbiología 24: 1-21. [ Links ]
Razzaq, A.; Jamil, N.; Naheed, N.; Hasnain, S. 2010. Bacteria from contaminated urban and hilly areas as a source of polyhydroxyalkanoates production. African Journal of Biotechnology 9(13): 1919-1925. [ Links ]
Rivera, L.; Nevárez, G. 2009. Fuentes de carbono económico para la producción de bioplásticos bacterianos. Tecnociencia 3(2): 58 – 63. [ Links ]
Rivera, P.; Tito, E.; Torrico, S.; Caraballo, S.; Van, D.; Quillahuamán, J. 2015. Production of poly(3-hydro-xybutyrate) by Halomonas boliviensis in an air-lift reactor. Journal of Biological Research 22(1):8. [ Links ]
Sánchez, S.; Marin, M.; Mora, A.; Yepes, M. 2012. Identificación de bacterias productoras de polihidroxialcanoatos (PHAs) en suelos contaminados con desechos de Fique. Revista Colombiana de Biotecnología XIV (2): 89-100. [ Links ]
Received January 13, 2017.
Accepted June 16, 2017.
* Corresponding author
E-mail: a_hurtado22@yahoo.es (A. Hurtado).