Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.1 Trujillo jan./mar. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.01.10
ARTÍCULOS ORIGINALES
Hidrólisis de las proteínas de anchoveta (Engraulis ringens) entera por acción de la enzima ProtamexTM
Hydrolysis of proteins from anchovy (Engraulis ringens) whole by action of the ProtamexTM enzyme
Gabriel Sifuentes-Penagos; Susan León-Vásquez; Augusto Castillo*
Escuela Académica de Ingeniería Agroindustrial, Universidad Nacional del Santa, Av. Universitaria s/n Urb. Bellamar. Chimbote – Peru.
Resumen
Hoy en día, es de gran relevancia el desarrollo de la obtención de hidrolizados proteicos a partir de carne de pescado por acción enzimática. El objetivo de la presente investigación fue evaluar el efecto de los factores de la reacción catalítica tales como, relación enzima sustrato (E/S), factor de dilución (D) y tiempo de reacción (t); con respecto al grado de hidrólisis (GH) de proteínas de anchoveta entera por acción de la enzima comercial Protamex™, la recuperación de proteínas (RP) y la distribución aparente del peso molecular (PM) del hidrolizado proteico. La hidrólisis se llevó a cabo en un reactor con un volumen de trabajo de 750 mL, a 55 ºC, a pH 7,5 y una velocidad de agitación de 100 rpm. Se encontró un comportamiento lineal positivo entre el GH y la relación enzima sustrato, mientras que para el factor de dilución fue un comportamiento lineal negativo, sin embargo, con el tiempo de reacción presentó un comportamiento no lineal. Los mismos resultados se hallaron para la RP. Por la metodología de superficie de respuesta se determinaron los valores de la relación enzima sustrato de 60 UA × kg-1 proteína cruda, un factor de dilución de 0,7 kg pescado × kg-1 agua y un tiempo de reacción de 60 min, que correspondieron a obtener los valores óptimos de GH de 16,90% y RP de 68,72% y el menor PM de los péptidos de 10,10 kDa. Se concluyó que el preparado enzimático comercial Protamex™, mostró una buena eficiencia en la extracción e hidrolisis de la proteína presente en la anchoveta entera.
Palabras clave: anchoveta entera; grado de hidrólisis; péptidos; Protamex™
Abstract
Nowadays, the development of obtaining protein hydrolysates from fish meat by enzymatic action is of great importance. The purpose of this investigation was to evaluate the effect of the catalytic reaction factors such as, substrate-enzyme ratio (E/S), dilution factor (D) and reaction time (t); with respect to the degree of hydrolysis (DH) of whole anchovy proteins by the action of the commercial enzyme Protamex™, protein recovery (PR) and the apparent molecular weight distribution (MW) of the protein hydrolysate. The hydrolysis was carried out in a reactor with a working volume of 750 mL, at 55 °C, at pH 7.5 and a stirring speed of 100 rpm. The existence of a positive linear behavior was found between the GH and the substrate-enzyme ratio, while for the dilution factor it was a negative linear behavior, however, with the reaction time, it exhibited a non-linear behavior. The same results were found for the RP. By means of the response surface methodology, the values of the enzyme substrate ratio of 60 UA×kg-1 crude protein, a dilution factor of 0.7 kg fish × kg-1 water and a reaction time of 60 min, were determined to obtain the optimal values of DH of 16.90% and PR of 68.72% and the lowest MW of the peptides of 10.10 kDa. It was concluded that the commercial enzyme preparation Protamex ™ showed good efficiency in the hydrolysis and extraction of the protein present in the whole anchovy.
Keywords: wholy anchovy; hydrolysis degree; peptides; Protamex™
1. Introducción
La anchoveta (Engraulis ringens) tiene una alta demanda en la industria peruana (FAOSTAT, 2015) debido a su utilización en la elaboración de harina de pescado, destinada para consumo humano indirecto; y en la producción de conservas de pescado, la cual genera sub productos de bajo valor que se utilizan como piensos.
En un proceso enzimático con pescado, la materia prima se convierte en ingredientes alimentarios de valor, tales como, concentrados proteicos de pescado del tipo A y B para consumo humano directo, hay que tener en consideración que el aceite que se obtiene en la hidrólisis presenta un alto contenido de ácido grasos poliinsaturados (Morales-Medina et al., 2018), como aceite rico en EPA (Ácido eicosapentaenoico) y DHA (Ácido docosahexaenoico), y también se obtiene una fracción de hueso limpio, adecuado para la obtención de colágeno.
Existen investigaciones para la producción de hidrolizados de proteínas utilizando va-rias especies de pescados como, Thunnus albacares (De Oliveira et al., 2016), Sardine pilchardus (García-Moreno et al., 2016), Capros aper (Shikha et al., 2016), Arctoscopus japonicus (Jang et al., 2016), Engraulis japonicus (Tang et al., 2015), Oreochromis niloticus (Jumardi et al., 2014), entre otros.
La hidrólisis enzimática de la anchoveta entera es un proceso que no genera residuos al usar todo el pescado (Villamil et al., 2016). Existen reportes donde estos productos se han obtenido a partir de la piel (Aleman et al., 2011), vísceras (Jai-Ganesh et al., 2011), hígado (Ahn et al., 2010), huesos (Hou et al., 2011), gónadas (Chalamaiah et al., 2011) y músculo.
Es esencial llevar a cabo un control del proceso de hidrólisis, ya que una hidrólisis incontrolada o larga, conducirá a la formación de péptidos muy pequeños altamente solubles con características nutricionales útiles, pero generalmente desprovistos de las características funcionales asociadas con la proteína nativa (Pagán et al., 2013). Al controlar los parámetros del proceso, tales como el pH, el tiempo y la relación enzima sustrato, es posible producir un hidrolizado con la composición y las propiedades deseadas. Los péptidos obtenidos de esta manera pueden tener una variedad de usos como concentrados proteicos. Estos se elaboran con el fin de contribuir a la formulación de alimentos de consumo humano directo, debido a sus propiedades tecno-funcionales, con beneficios para la salud, por esta razón, están utilizando en diferentes partes del mundo como regulador de funciones intestinales, para la nutrición deportiva, así como para estabilización de glucosa en sangre, suplemento dietético y control de peso (Chalamaiah et al., 2012). Actualmente, se pueden encontrar algunos ejemplos de hidrólisis enzimática en condiciones de reacción controladas para obtener péptidos con actividad biológica. Varios de estos estudios han intentado seleccionar la mejor enzima, en la mayoría de ellas son preparaciones comerciales de proteasas de origen bacteriano, como alcalasas, neutrasas, proteasa N (Amano Enzyme Inc.) y Protamex (Novozymes), y algunas proteasas vegetales como la papaína y la bromelina, también se han utilizado con buenos resultados (Villamil et al., 2017; Halim et al., 2016; Chalamaiaha et al., 2012).
Este trabajo resume los resultados de un estudio en el que se evaluó la capacidad del preparado enzimático Protamex™ para la hidrólisis de las proteínas de la anchoveta entera. Las características evaluadas de interés fueron: el grado de hidrólisis (GH), la recuperación de proteína (RP) y la distribución aparente del peso molecular (PM) de los péptidos producidos, ya que estos influyen en las propiedades funcionales de estos péptidos resultantes.
2. Materiales y métodos
Sustrato: Anchoveta entera (Engraulis ringens)
Se utilizó un lote de 10 kg de anchoveta proporcionados por la empresa de procesamiento de pescado PescArt (Chimbote, Perú). Para asegurar la frescura de la materia prima, el pescado entero, se lavó con abundante agua potable, y se congeló (LG Electronics LT41SGP, Corea del Sur) a -18 ± 1°C en bolsas plásticas de polietileno lineal de baja densidad (0,92 g/cm3), con sello hermético en porciones de 0,5 kg para su conservación durante el periodo de la investigación.
Enzima
En el proceso de hidrólisis proteica de an-choveta entera, se utilizó la proteasa comercial ProtamexTM (CE 3.4.21.62/3.4.24.28), que es una mezcla de serina y metalo endopeptidasas de la empresa Novozymes producidas por las bacterias Bacillus licheniformis y Bacillus amyloliquefaciens con una actividad enzimática declarada de 1,7 UA∙g-1, densidad de 1100 kg∙m-3. Las condiciones de trabajo óptimas para la Protamex™ reportadas por Novozymes son pH 5,50 - 7,50, una temperatura 35 - 60 °C; su temperatura de inactivación es de 85 °C durante 10 minutos (Novozymes A/S, 1998).
Hidrólisis enzimática
Las reacciones de hidrólisis se realizaron en un bioreactor de 2 L (Biostat A-plus, Sarto-rius, Alemania) con un volumen de trabajo de 750 mL, donde las condiciones ambientales establecidas para la reacción fueron, de 55 °C, pH de 7,5 controlado con la adición automática de una solución de NaOH al 0,1 N y una velocidad de agitación constante de 100 rpm. Estas condiciones ambientales están en función de los parámetros óptimos de la enzima comercial, las cuales fueron tomados de otras investigaciones (Fernández et al., 2016; Xi-Qun et al., 2015).
La anchoveta entera se descongeló con 10 horas de anticipación al proceso de hidrolisis en un refrigerador (LG Electronics LT41SGP, Corea del Sur) a 4 ± 1 °C; luego, se cortó en medallones de 0,5 cm de espesor; se mezcló con agua destilada a un determinado factor de dilución tal como se detalla en la Tabla 1; seguidamente, se inactivaron las enzimas endógenas a 85 °C por 10 minutos, para investigar el efecto de la enzima comercial. Finalmente, la mezcla se enfrió hasta 55 °C para adicionar la enzima Protamex™ y dar inicio a la hidrólisis proteolítica. Culminado el tiempo de reacción, se inactivó la enzima exógena a 85 °C durante 10 minutos.
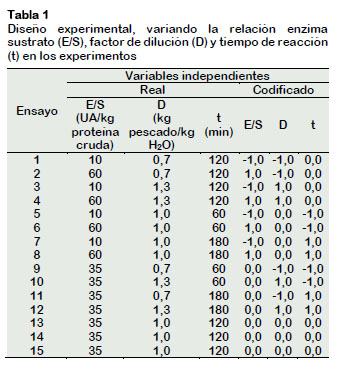
Las pruebas experimentales se realizaron de acuerdo con el diseño de superficie de respuesta Box-Behnken el cual se muestra en la Tabla 1. Los efectos de las variables independientes sobre el grado de hidrólisis (GH), recuperación de proteínas (RP) y distribución aparente del peso molecular (PM) se ajustaron a modelos polinómicos de segundo orden. El análisis estadístico fue generado a partir del software STATISTICA.
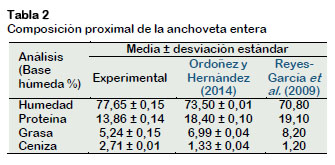
Composición química proximal de anchoveta entera
La composición proximal se obtuvo a través de análisis de humedad (Método AOAC 952.08 - 2005), ceniza (Método AOAC 938.08 - 2005), proteína cruda (Método AOAC 940.25 - 2005) y grasa cruda (Método AOAC 948.15 - 2005), realizados por triplicado.
Determinación del rango de linealidad y la actividad enzimática
El rango de linealidad y la actividad enzimá-tica se determinaron según el método descrito por Cupp-Enyard (2008). En el caso del rango de linealidad se incubó 1 mL de cada dilución enzimática (1:2000, 1:3000 y 1:4000) con 5 mL de caseína (0,65 g/100 mL) a 37 ºC y pH 7,5 durante 30 min. Se añadieron 5 mL de ácido tricloroacético 0,11 mol/L para terminar la reacción en el minuto 0, 5, 10, 15, 20, 25 y 30. Se incubó 2 mL del filtrado obtenido con 5 mL de solución de carbonato de sodio 0,5 mol/L y 1 mL de reactivo de fenol según Folin-Ciocalteu a 37 ºC durante 30 minutos. Finalmente se midió la absorbancia a 660 nm en el espectrofotómetro UV/visible (SQ-2800, Unico SpectroQuest) y se determinó la formación de tirosina.
Para determinar la actividad enzimática se realizaron los ensayos por triplicado incubando 1 mL de la solución de enzima (1:3000).
Determinación de los parámetros cinéticos
Se usó caseína en el intervalo de concentración 8,00 – 18,50 g/L, para determinar los parámetros cinéticos de la enzima a una temperatura de 55 °C, un pH de 7,5 y una solución enzimática de 1:2000 de Protamex™. La constante de Michaelis-Menten (Km) y la velocidad máxima (Vmáx) se determinaron de acuerdo a la metodología descrita por Lineweaver y Burk (1934).
Determinación del grado de hidrólisis (GH)
El GH se determinó mediante el método pH-Stat, basado en el volumen básico con-sumido para mantener el pH de la reacción constante, usando la siguiente ecuación (Adler-Nissen, 1986):
GH (%) = (B∙N∙100)/(α∙Mp∙htot)
Dónde B: consumo básico en mL (o ácido en caso de proteasas ácidas); N: normalidad de la base (o ácido); α: grado medio de disociación de los grupos -NH o –COOH [α = (10pH – pK) / (1+ 10pH – pK), donde pK = 7,8 + (298 – T) / (298∙T)∙2400 (T: temperatura en Kelvin)]; MP: masa de proteína en gramos (%N x 6,25); y htot: número total de enlaces peptídicos en el sustrato.
Determinación de la recuperación de proteína (RP)
La recuperación de proteína se usó como un índice de solubilización de proteína para describir la producción de la hidrólisis. Des-pués de la hidrólisis enzimática, se realizó un prefiltrado del líquido hidrolizado en mallas tipo Johnson de acero inoxidable de alta resistencia y con apertura de 0,5 mm para la separación de las espinas de la fracción soluble, luego se separó la fracción insoluble mediante centrifugación (P-selec-ta 209, Sigma, Alemania) a 5000 rpm, 40 °C y 20 minutos. El nitrógeno total se determinó por el método de Kjeldahl (AOAC, 2005). La RP se calculó de acuerdo con Benkajul y Morrissey (1997):
RP (%) = % N total en sobrenadante /% N en la fracción hidrolizada ∙ 100
Distribución aparente del peso molecular (PM)
La distribución aparente del peso molecular de los péptidos obtenidos se usó con la finalidad de lograr el máximo rendimiento del producto final en el proceso de concentrados proteicos de pescado, el cual consta de péptidos de peso molecular entre 10 a 1 kDa. Debido a que, en este rango, se pueden aprovechar mejor las propiedades nutricio-nales y tecnológicas de las proteínas, las cuales tienen una influencia directa en sus aplicaciones como alimentos funcionales (Zheng et al., 2006).
Se determinó mediante el perfil electro-forético, el cual fue realizado en minigeles de poliacrilamida de 8x7x0,05 cm a la concentración de 15% del gel separador y 3% del gel concentrador; de acuerdo con Schagger y Jagow (1987), para péptidos con masa molecular menor de 30 kDa. El análisis fue realizado a 220 V por 45 minutos, usando el equipo Mini Protean Tetra Cell, Biorad y la fuente de poder Power Pac 300 Biorad. La masa molecular media de las bandas se estimó mediante el uso de un marcador de proteína perfecta (número de catálogo 69079-3 Novagen - Merck, Alemania), el cual contiene en una mezcla de 9 proteínas recombinantes de tamaño preciso de 10, 15, 25, 35, 75, 100, 150 y 225 kDa.
3. Resultados y discusión
Composición química proximal de la anchoveta entera
La composición proximal de la anchoveta entera se detalla en la siguiente tabla y se compara con otros autores.
Puede notarse en la Tabla 2 que la composición proximal obtenida en este trabajo presenta una variación con respecto a los resultados presentados por los otros auto-res. Esto se debe a que la composición proximal del pescado es influenciada por la edad, sexo, época de año y madurez de las gónadas.
Determinación del rango de linealidad y la actividad enzimática
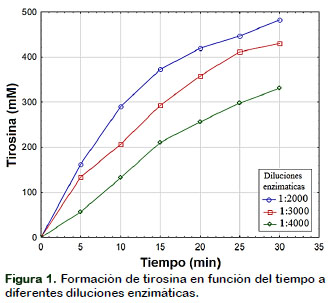
En la Figura 1 se muestra la curva típica de formación de producto (tirosina) en función del tiempo para una reacción catalizada a tres concentraciones diferente de enzima Protamex™ con la finalidad de determinar el rango de linealidad para cada dilución enzimática. Se observa que la linealidad de la velocidad de reacción se pierde en un cierto tiempo, hecho que podría deberse a las siguientes causas: algunos de los productos pueden inhibir la enzima; el transcurso de la reacción produce una disminución significativa de la concentración de sustrato (S) dejando de ejercer su condición saturante (Valencia et al., 2014).
Se determinó que el rango de linealidad para las diluciones enzimáticas de 1:2000, 1:3000 y 1:4000 son de 10, 15 y 20 minutos, respectivamente. De esta manera las diferentes causas que producen la disminución de la actividad con el tiempo son eliminadas.
La enzima comercial Protamex™ presentó un valor de actividad de 369,44 ± 19,11 U/mg, siendo U como la cantidad de enzima que cataliza la conversión de 1 umol de tirosina liberados de la caseína por cada minuto a pH 7,5 y 37,0 °C. En otras investigaciones se han reportado una actividad de la Protamex™ de 2100 U/mg (Zhang et al., 2016), 31,40 U/mg (Song et al., 2016) y 125 U/mg (Kolpakova et al., 2014). Se puede notar que la actividad enzimática obtenida en esta investigación presenta diferencia a los valores reportados por los autores mencionados, pero en dichas investigaciones no se precisa el tipo de sustrato utilizado, ni las condiciones ambientales (pH y temperatura) con la que se llevan a cabo la metodología experimental.
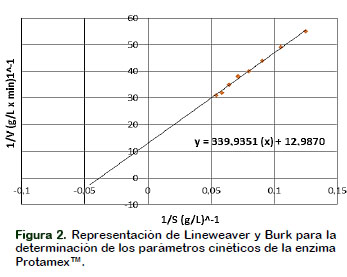
Determinación de los parámetros cinéticos enzimáticos Km y Vmax
En la Figura 2 se muestra la representación de Lineweaver y Burk para los parámetros cinéticos de la enzima Protamex™. Los valores de los parámetros cinéticos obtenidos fueron: la constante de Michaelis-Menten (Km) de 26,175 g×L-1 y velocidad máxima (Vmax) de 0,077 g×(L×min)-1. En un experimento independiente de hidrólisis enzimática a las mismas condiciones ambientales, utilizando la anchoveta como sustrato los parámetros cinéticos son Km de 7,949 g×L-1 y Vmax de 0,192 g×(L×min)-1 (resultados no mostrados).
Se demuestra que: La velocidad de reacción es mayor cuando toda la enzima se encuentra unida a la anchoveta en vez de la caseína, debido a que la caseína es un sustrato puro, en cambio la anchoveta es un sustrato complejo ya que presenta mayor diversidad de enlaces peptídicos a ser hidrolizados durante la reacción como los residuos aromáticos (Phe, Trp, Tyr), ácidos (Glu), azufre (Met), alifáticos (Leu, Ala), hidroxilo (Ser) y básicos (Lys). La afinidad que tiene la Protamex con la anchoveta entera es mayor que con caseína. Por lo tanto, se puede comprobar que esta enzima está diseñada para hidrolizar sustratos complejos como en este caso, la anchoveta entera.
Evaluación del grado de hidrólisis, recuperación de proteína y distribución aparente del peso molecular de los péptidos obtenidos
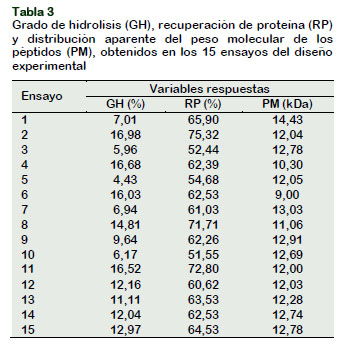
En la Tabla 3, se muestra en detalle los valores del grado de hidrólisis, recuperación de proteínas y distribución aparente del peso molecular de los péptidos obtenidos de las 15 experiencias del diseño experimental utilizado en esta investigación. Para las condiciones utilizadas en el proceso, los valores del grado de hidrólisis variaron de 4,43 a 16,98%, para la recuperación de proteína de 51,55 a 75,32% y para la distribución aparente del peso molecular de los péptidos obtenidos de 9,00 a 14,43 kDa. Los puntos centrales para las respuestas presentaron una variación menor a 7,72% para grado de hidrolisis, 1,57% para recuperación de proteínas y 2,20% para la distribución aparente del peso molecular de los péptidos obtenidos; indicando buena reproducibilidad del proceso.
Los resultados obtenidos en el diseño experimental Box-Behnken se usaron para construir los modelos cuadráticos reducidos que expresan el grado de hidrólisis, GH (%), la recuperación de proteína, RP (%) y la distribución aparente del peso molecular de los péptidos obtenidos, como funciones de las variables independientes. El buen ajuste de los datos experimentales fue verificado por el coeficiente de determinación R2, lo que permite el uso de dichos modelos. Para procesos biotecnológicos, estos coeficientes de determinación son aceptables debido a la alta variabilidad en el bioproceso (Missau et al., 2014).
GH (%) = 1,14271 + 0,2008∙E/S − 3,825∙D + 0,0951∙t − 2,73∙10−4×t2
(R2: 89,37%)
RP (%) = 62,2887 + 0,1895∙E/S − 20,5333∙D + 0,1838∙t − 0,0005∙t2
(R2: 98,53%)
PM (kDa) = 13,5476 + 0,2619∙E/S − 11,1475∙D + 0,068∙t − 0,0045∙E/S2 + 5,0556∙D2 − 0,0002∙t2 − 0,0003∙E/S2D − 0,002∙E/S∙t + 0,00003∙E/S2∙t
(R2: 99,23%)
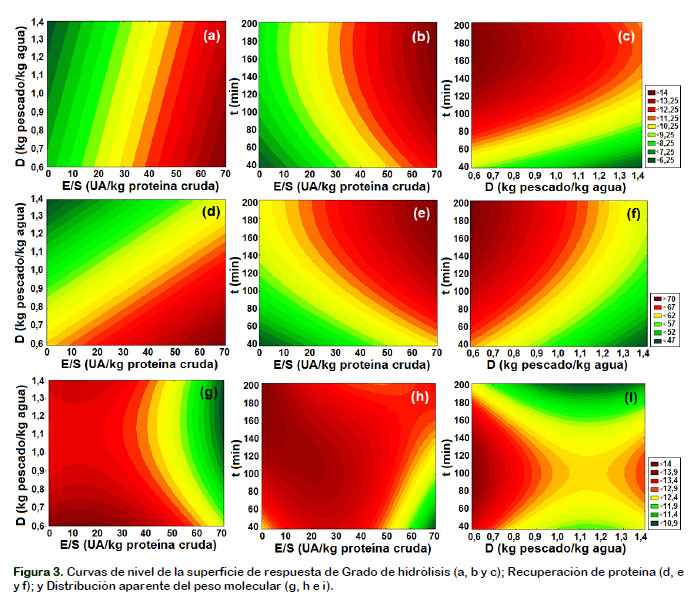
Adicionalmente por el análisis de la desviación media absoluta entre las respuestas experimentales y las respuestas predichas por el modelo Baş y Boyaci (2007), resultó un valor aceptable de 10,23%, 0,97% y 1,98%, respectivamente para cada modelo, que junto con el R2 definen el comportamiento verdadero del sistema y puede usarse para la interpolación en el dominio experimental. La Figura 3 ilustra las superficies de contorno de las variables independientes sobre las variables de respuesta GH, RP y PM, respectivamente.
Efecto de la relación enzima sustrato (E/S) en el GH y RP
Se determina que la variable relación enzima sustrato (E/S) es altamente significativa (p < 0,05) tanto para el grado de hidrólisis (GH), como para la recuperación de proteína (RP). Esto es debido a que con mayo-res relaciones de enzima sustrato, hay mayor concentración de enzima en la mezcla a hidrolizar y, por ende, hay más sitios activos disponibles para que la masa proteica de la anchoveta pueda ser hidrolizada. Los más altos valores de GH (16,98%) y RP (75,32%) se alcanzaron con la relación enzima sustrato de 60 UA/kg, factor de dilución 0,7 kg pes-cado/kg agua y un tiempo de reacción de 120 min. No se encontraron reportes en la literatura de la enzima Protamex™ actuando sobre la anchoveta entera como para poder comparar los valores obtenidos. Otros estudios han informado la misma tendencia entre la relación enzima sustrato y el grado de hidrólisis; Pagán et al. (2013) para hidrólisis proteica de huesos de chancho y Benkajul y Morrissey (1997) para hidrólisis proteica de bacaladilla del Pacífico, quienes trabajaron con la enzima Neutrase®.
De igual manera, Diniz y Martin (1998) han informado la misma tendencia entre la relación enzima sustrato y la recuperación de proteína.
Efecto del factor de dilución (D) en el GH y RP
Del análisis de varianza determina que la variable factor de dilución (D) es altamente significativo (p < 0,05) para la recuperación de proteína (RP), mientras que para el grado de hidrólisis (GH) no lo es. Esto se debe a que con mayor factor de dilución (mayor concentración de sustrato) se incrementa la constante de inhibición enzimática por producto. Es decir, la presencia de los productos finales (péptidos entre 10-15 kDa) hace que la reacción sea más lenta, probablemente, estos péptidos ocupan temporalmente el sitio activo de la enzima por poseer una semejanza estructural con el sustrato original, o bien, estos péptidos alteran la conformación espacial de la enzima, impidiendo que un nuevo sustrato sufra hidrólisis, dando como resultado una disminución de la recuperación de proteína. Otros estudios sobre hidrólisis enzimática han informado la misma tendencia entre el factor de dilución y la RP (Valencia et al., 2014; Liaset et al., 2002; Mohr, 1977; Cheftel et al., 1971; Hale, 1969).
Efecto del tiempo de reacción (t) en el GH y RP
Del análisis de varianza se determina que la variable tiempo de reacción (t) es significativo (p < 0,05) tanto para el grado de hidrólisis (GH), como para la recuperación de proteína (RP).
En el caso del GH, se puede observar una inflexión para un tiempo alrededor de 120 min, mostrando gráficas con mayor pendiente antes de 120 min. Después de este tiempo, aunque el GH aumente, el valor de la pendiente es menor y menos importante. Otros estudios han informado la misma tendencia en la hidrólisis de huesos de porcino por la enzima Neutrase (Pagán et al., 2013). Guerard et al. (2001) informó que no se produce ninguna mejora significativa en el GH a tiempos mayores de 5,5 horas en la hidrólisis de atún de aleta amarilla por la enzima Alcalase.
La influencia del tiempo sobre la recuperación de proteínas (RP) cumple un aumento lineal hasta un punto determinado, a partir de cierto tiempo el incremento en la RP irá disminuyendo gradualmente, probablemente se deba, a que los péptidos liberados se van uniendo a la fase oleosa formando emulsiones. Esta capa, también informó Liaset et al. (2003) en la hidrólisis de salmón por acción de la enzima Protamex™; Liu et al. (2014) en la hidrólisis de sub productos del surimi por acción de la enzima Protamex™. Esta suposición también se apoya en los resultados informados por Kristinsson y Rasco (2000); Liaset et al. (2000) y Liaset et al. (2002).
Distribución aparente del peso molecular (PM)
Del análisis de varianza (p < 0,05) se verifica que todas las variables de estudio son significativas (p < 0,05) para la distribución aparente del peso molecular (PM). La Figura 3g muestra que se obtuvo péptidos de menor peso molecular utilizando una alta relación enzima sustrato y un alto factor de dilución, siendo la relación enzima sustrato la que influye más. La Figura 3h, muestra que el menor peso molecular se obtuvo utilizando una alta relación enzima sustrato y un menor tiempo de reacción, siendo la relación enzima sustrato la que influye más. La Figura 3i muestra que se obtuvo péptidos de menor peso molecular utilizando un alto factor de dilución y a tiempos menores de 60 minutos y mayores de 180 minutos.
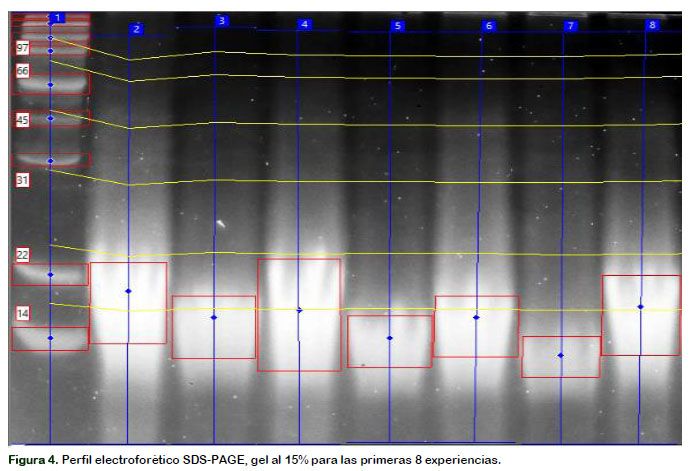
En la Figura 4 se detalla la masa molecular de los péptidos, el cual varió desde 9,00 a 14,43 kDa bajo variaciones sistemáticas de los niveles altos y bajos de la E/S, D y t. Estos valores se encuentran dentro de lo reportado por Fernández y Kelly (2016). Hay que tener en consideración que los péptidos mas pequeños (PM < 9 kDa) tienden a perderse durante el proceso de fijación y destinción en la metodologia de electroforesis SDS-PAGE, por lo que los resultados mostrados en la Tabla 3 podrían variar con la utilización de otra técnica de análisis (Schagger y Von Jagow, 1987). Liu et al. (2014) estudió el hidrolizado obtenido por Protamex con un grado de hidrólisis al 10%, determinando una proporción de moléculas grandes con peso molecular de 150 kDa, y otra con péptidos con peso molecular de 2,5 kDa en menor proporción. Klompong et al. (2009) comparó los pesos moleculares de dos hidrolizados con el mismo grado de hidrólisis por acción de las enzimas Alcalase y Protamex, determinando que la enzima Protamex obtiene péptidos de mayor tamaño molecular, lo que podría estar asociado por presentar una menor actividad enzimática. García-Moreno et al. (2016) determinaron que al aumentar el GH se incrementó la concentración de péptidos entre 0,3 – 9,3 kDa; sin embargo, el contenido de péptidos de bajo peso molecular y aminoácidos (<0,3 kDa) aumentó para hidrolizados con menor GH.
Probablemente, la enzima subtilisina tiene una baja preferencia por cualquier resto de aminoácido como sitio de escisión, por lo que hidroliza a péptidos más cortos antes de degradar una proteína más intacta.
Optimización del proceso de hidrólisis enzimática
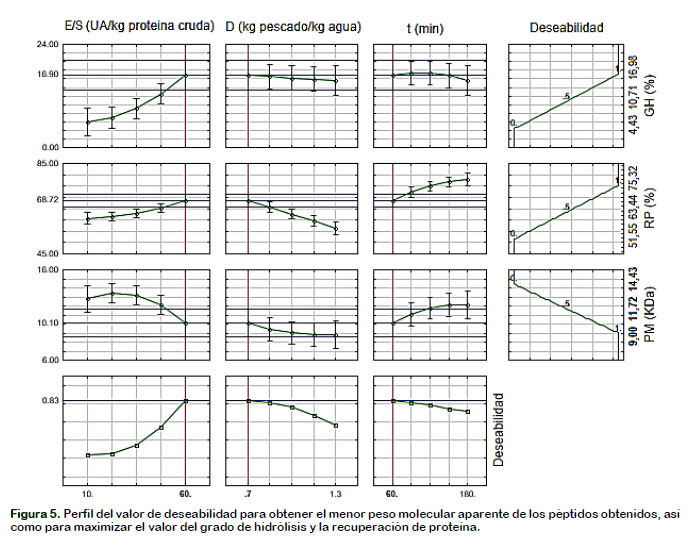
Los modelos validados se utilizaron para optimizar el proceso utilizando la función de deseabilidad que se muestra en la Figura 5.
En la Figura 5 se observa que el menor valor del peso molecular de los péptidos obtenidos (10,104 kDa), así como los mayores valores de grado de hidrólisis (16,896%) y de recuperación de proteína (68,723%), coinciden para una relación enzima sustrato (E/S) de 60 UA/kg proteína cruda, un factor de dilución (D) de 0,7 kg pescado/kg de agua y un tiempo de reacción (t) de 60 minutos. Resultados semejantes fueron obtenidos por Pagán et al. (2013), que estudiaron la hidrólisis enzimática de huesos de cerdo por la enzima Neutrase, donde los péptidos obtenidos presentaron un peso molecular menor de 10 kDa y los mayores valores de grado de hidrólisis (11%) y recuperación de proteína (79%) fueron obtenidos a 55 °C, pH de 7, tiempo de reacción de 60 minutos y una relación enzima sustrato de 1,5 g por cada 100 g de sustrato. Hou et al. (2011) también reportaron péptidos hidrolizados de abadajeo de Alaska por acción de una mezcla de enzimas proteolíticas (Alcalase, Flavourzyme, Protamex, Proteasa ácida, Protease Alcalina, Protease Neutra, Bromelina y Papaína) con un peso molecular de 1,35 kDa y los mayores valores de grado de hidrólisis (18%) y recuperación de proteína (76,89%) fueron obtenidos a 45 °C, pH inicial de 8, tiempo de reacción de 300 minutos, una relación enzima sustrato de 1,2 g por cada 100 g de sustrato y un factor de dilución 0,17 kg pescado por cada kg de agua. Del mismo modo Guerard et al. (2001) optimizaron la hidrólisis de atún de aleta amarilla por acción de la enzima comercial Alcalase, donde los péptidos obtenidos alcanzaron un peso molecular inferior de 6,5 kDa y el mayor valor de grado de hidrólisis (14,64%) fueron obtenidos a 50 °C, pH de 8, tiempo de reacción de 48 minutos y una relación enzima sustrato de 100 UA/kg de proteína cruda. Nilsang et al. (2005) optimizaron la hidrólisis enzimática de un con-centrado de pescado soluble por dos enzimas comerciales. Para Flavourzyme la máxima recuperación de proteínas (60%) se obtuvo a 45 °C, tiempo de reacción de 6 horas, una relación enzima sustrato de 50 LAPU/kg proteína cruda y un factor de dilución 0,2 kg pescado por cada kg de agua. En el caso de Kojizyme la máxima recuperación de proteínas (66,5%) se obtuvo a 50 °C, tiempo de reacción de 6 horas, una relación enzima sustrato de 40 LAPU/kg proteína cruda y un factor de dilución 0,2 kg pescado por cada kg de agua.
4. Conclusión
La actividad de la enzima comercial Protamex™ fue de 369,435 ± 19,107 U∙mg-1, los valores de sus parámetros cinéticos Km y Vmax fueron de 26,175 g∙L-1 y 0,077 g∙L1∙min-1, respectivamente. La hidrólisis de proteínas de anchoveta por la enzima Protamex a diferentes tratamientos produjeron perfiles de péptidos ampliamente similares, entre 9 y 14 kDa, utilizando la técnica de electroforesis SDS-PAGE. Las condiciones óptimas halladas para el proceso de hidró-lisis enzimática, utilizando la metodología de superficie de respuesta fue: relación enzima sustrato de 60 Unidades Anson por cada kg de proteína cruda, factor de dilución de 0,7 kg pescado por cada kg de agua, tiempo de reacción de 60 minutos, en condiciones ambientales constantes de 55 °C, pH de 7,5 y 100 rpm. Se concluye que el preparado enzimático comercial Protamex™ tiene buena eficiencia en la extracción e hidrolisis de la proteína presente en la anchoveta entera.
Referencias Bibliográficas
Adler-Nissen, J. 1986. Enzymic hydrolysis of food proteins. Elsevier Applied Science Publishers, New York. 427 pp. [ Links ]
Ahn, C.; Lee, K.; Je, J. 2010. Enzymatic production of bioactive protein hydrolysates from tuna liver: Effects of enzymes and molecular weight on bioactivity. International Journal of Food Science and Technology 45: 562–568. [ Links ]
Aleman, A.; Gimenez, B.; Montero, P.; Gomez-Guillen, M.C. 2011. Antioxidant activity of several marine skin gelatins. LWT-Food Science and Technology 44: 407–413. [ Links ]
AOAC. 2005. Official methods of Analysis of A.O.A.C. International: Food Composition, Additives, Natural Contaminants. Gaithersburg, Maryland. EE.UU. [ Links ]
Baş, D.; Boyaci, I.H. 2005. Modeling and optimization I: Usability of response surface methodology. Journal of Food Engineering 78: 836-845. [ Links ]
Benkajul, S.; Morrissey, M.T.; 1997. Protein hydrolysates from Pacific whiting solid wastes. Journal of Agricultural and Food Chemistry 45: 3423–3430. [ Links ]
Chalamaiah, M.; Dinesh-Kumar B.; Hemalatha, R.; Jyothirmayi, T. 2011. Fish protein hydrolysates: Proximate composition, amino acid composition, antioxidant activities and applications: A review. Food Chemistry 135: 3020–3038. [ Links ]
Chalamaiaha, M.; Dinesh kumara, B.; Hemalathab, R.; Jyothirmayic, T. 2012. Fish protein hydrolysates: Proximate composition, amino acid composition, antioxidant activities and applications: A review. Food Chemistry 135(4): 3020 – 3038. [ Links ]
Cheftel, C.; Ahern, M.; Wang, D.I.C.; Tannenbaum, S.R. 1971. Enzymatic solubilisation of fish protein concentrate: Batch-studies applicable to continous enzyme recycling process. Journal of Agricultural and Food Chemistry 19: 155–161. [ Links ]
Cupp-Enyard, C. 2008. Sigma's Non-specific Protease Activity Assay - Casein as a Substrate. J. Vis. Exp. (19), e899. [ Links ]
De Oliveira, D.; Minozzoa, G.; Licodiedoffb, S.; Waszczynskyjc, N. 2016. Physicochemical and sensory characterization of refined and deodorized tuna (Thunnus albacares) by-product oil obtained by enzymatic hydrolysis. Food Chemistry 207: 187–194. [ Links ]
Diniz, F.M.; Marin, A.M. 1998. Influence of process variables on the hydrolysis of shark muscle protein. Food Science and Technology International 4:91-98. [ Links ]
FAOSTAT. 2015. Consumo de pescado y productos pesqueros http://www.fao.org/faostat/en/#data/CL [ Links ]
Fernández, A.; Kelly, P. 2016. pH-stat vs. free-fall pH techniques in the enzymatic hydrolysis of whey proteins. Food Chemistry 199: 409 – 415. [ Links ]
García-Moreno, P.G.; Guadix, A.; Guadix, E.M.; Charlotte, J. 2016. Physical and Oxidative Stability of Fish Oil-In-Water Emulsions Stabilized with Fish Protein Hydrolysates. Food Chemistry 203:124–135. [ Links ]
Guerard, F.; Dufosse, L.; De La Broise, D.; Binet, A. 2001. Enzymatic hydrolysis of proteins from yellowfin tuna (Thunnus albacares) wastes using Alcalase. Journal of Molecular Catalysis B: Enzymatic 11: 1051–1059. [ Links ]
Hale, M.B. 1969. Relative activities of commercial-available enzymes in the hydrolysis of fish protein. Food Technology 23: 107–110. [ Links ]
Halim, N.R.A.; Yusof, H.M.; Sarbon, N.M. 2016. Functional and bioactive properties of fish protein hydolysates and peptides: a comprehensive review. Trends in Food Science & Technology 51: 24-33. [ Links ]
Hou, H.; Li, B.; Zhao, X.; Zhang, Z.; Li, P. 2011b. Optimization of enzymatic hydrolysis of Alaska pollock frame for preparing protein hydrolysates with lowbitterness. LWT–Food Science and Technology 44: 421–428. [ Links ]
Jai-Ganesh, R.; Nazeer, R.A.; Sampath-kumar, N.S. 2011. Purification and identification of antioxidant peptide from Black Pomfret, Parastromateus niger (Bloch, 1975) viscera protein hydrolysate. Food Science and Biotechnology 20: 1087–1094. [ Links ]
Jang, H.L.; Liceaga, A.M.; Yoon, K.Y. 2016. Purification, characterisation and stability of an antioxidant peptide derived from sandfish (Arctoscopus japonicus) protein hydrolysates. Journal of Functional Foods 20: 433–442. [ Links ]
Jumardi, R.; Khairul Faezah Md, Y.; Norhafizah, A.; Siti Mazlina, M. 2014. Characterization of Fish Protein Hydrolysate from Tilapia (Oreochromis niloticus) by-Product. Agriculture and Agricultural Science Procedia 2: 312 – 319. [ Links ]
Klompong, V.; Benjakul, S.; Yachai, M.; Visessanguan, W.; Shahidi, F.; Hayes, K.D. 2009. Amino acid composition and antioxidative peptides from protein hydrolysates of yellow stripe trevally (Selaroides leptolepis). Journal of Food Science 74: C126–C133. [ Links ]
Kolpakova, V.V.; Chumikina, L.V.; Vasil'ev, A.V.; Arabova, I.I.; Topunov, A.F. 2014. Wheat gluten proteolysis by enzyme preparations of directional action. International Journal of Agronomy and Agricultural Research 5: 72 – 86. [ Links ]
Kristinsson, H.G.; Rasco, B.A. 2000. Biochemical and functional properties of Atlantic salmon (Salmo salar) muscle proteins hydrolyzed with various alkaline proteases. Journal of Agricultural and Food Chemistry 48: 657–666. [ Links ]
Liaset, B.; Julshamm, K.; Espe, M. 2003. Chemical composition and theoretical nutritional evaluation of the produced fractions from enzymic hydrolysis of salmon frames with Protamex™. Process Biochemistry 38: 1747 – 1759. [ Links ]
Liaset, B.; Nortvedt, R.; Lied, E.; Espe, M. 2002. Studies on the nitrogen recovery in enzymic hydrolysis of Atlantic salmon (Salmo salar L.) frames by Protamex™ protease. Process Biochemistry 37: 1263–1269. [ Links ]
Liaset, B.; Lied, E.; Espe, M. 2000. Enzymatic hydrolysis of by-products from the fish-filleting industry; chemical characterization and nutritional evalua-tion. Journal of the Science of Food and Agriculture 80: 581–589. [ Links ]
Lineweaver, H.; Burk, D. 1934. The Determination of Enzyme Dissociation Constants. Journal of American Chemical Society 56: 658. [ Links ]
Liu, C.; Morioka, K.; Itoh, Y.; Obatake, A. 2014. Contri-bution of lipid oxidation to bitterness and loss of free amino acids in the autolytic extract from fish wastes: Effective utilization of fish wastes. Fisheries Science 66: 343–348. [ Links ]
Missau, L.; Scheid, A.J.; Foletto, E.L.; Jahn, S.L.; Mazutti M.A.; Kuhn, R.C. 2014. Immobilization of commercial inulinase on alginate–chitosan beads. Sustainable Chemical Processes 2: 13. [ Links ]
Mohr, V. 1977. Fish protein concentrate production by enzymic hydrolysis. Biochemical aspects of New Protein Food 44: 53–62. [ Links ]
Morales-Medina, R.; Munio, M.; Guadix, E.M.; Camacho, F. 2018. A lumped model of the lipase catalyzed hydrolysis of sardine oil to maximize polyunsaturated fatty acids content in acylglucerols. Food Chemestry 240: 286 – 294. [ Links ]
Nilsang, S.; Lertisiri, S.; Suphantharika, M.; Assavanig, A. 2005. Optimization of enzymatic hydrolysis of fish soluble concentrate by commercial proteases. Journal of Food Engineering 70: 571-578. [ Links ]
Novozymes A/S. Protamex™ Product Sheet. 1998, B716d-GB, 1:2. [ Links ]
Ordoñez, L.R.; Hernández, E.M. 2014. Efecto del Proceso de Elaboración de la Conserva "Desmenuzado de Anchoveta" (Engraulis ringens) sobre los Ácidos Grasos Poliinsaturados Omega 3. Ciencia e Investigación 17: 27-32. [ Links ]
Pagán, J.; Ibarz, A.; Falguera, V.; Benítez, R. 2013. Enzymatic hydrolysis kinetics and nitrogen recovery in the protein hydrolysate production from pig bones. Journal of Food Engineering 119: 655–659. [ Links ]
Reyes-García, M.; Gómez-Sánchez, I.; Espinoza-Barrien-tos, C.; Bravo-Rebatta, F.; Ganoza-Morón, L. 2009. Tabla Peruana de Composición de Alimentos. 8.ª ed. Lima: Ministerio de Salud, Instituto Nacional de Salud. [ Links ]
Schagger, H.; Jagow, G.V. 1987. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry 166: 368-379. [ Links ]
Shikha, O.; Alvarez, C.; Kumar, P.; O'Donnell, C.; Tiwari, B. 2016. Effect of enzymatic hydrolysis on the production of free amino acids from boarfish (Capros aper) using second order polynomial regression models. Food Science and Technology 68: 470-476. [ Links ]
Song, S.; Li, S.; Fan, L.; Hayat, K.; Xiao, Z.; Chen, L.; Tang, Q. 2016. A novel method for beef bone protein extraction by lipase-pretreatment and its application in the Maillard reaction. Food Chemistry 208: 81–88. [ Links ]
Tang, W., Zhanga, H., Wanga, L., Qiana, H., Qia, X. (2015). Targeted separation of antibacterial peptide from protein hydrolysate of anchovy cooking wastewater by equilibrium dialysis. Food Chemistry 168: 115-123. [ Links ]
Valencia, P.; Pinto, M.; Almonacid, S. 2014. Identification of the key mechanisms involved in the hydrolysis of fish protein by Alcalase. Process Biochemistry 49: 258–264. [ Links ]
Villamil, O.; Váquiro, H.; Solanilla, J.F. 2017. Fish viscera protein hydrolysates: Production, potential applications and functional and bioactive properties. Food Chemistry 224(1): 160-171. [ Links ]
Xi-Qun, Z.; Jun-Tong, W.; Xiao-Lan, L.; Ying, S.; Yong-Jie, Z.; Xiao-Jie, W.; Yue, L. 2015. Effect of hydrolysis time on the physicochemical and functional proper-ties of corn glutelin by Protamex hydrolysis. Food Chemistry 172: 407–415. [ Links ]
Zhang, W.; Li, Y.; Zhang, J.; Huang, G. 2016. Optimization of Hydrolysis Conditions for the Production of Iron-Binding Peptides from Scad (Decapterus maruadsi) Processing Byproducts. American Journal of Biochemistry and Biotechnology 12: 220 – 229. [ Links ]
Zheng, X.-Q.; Liu, X.-L.; Wang, X.-J.; Lin, J.; Li, D. 2006. Production of hydrolysate with antioxidative activity by enzymatic hydrolysis of extruded corn gluten. Applied Microbiology and Biotechnology 73: 763–770. [ Links ]
* Corresponding author
E-mail: acascal2002@yahoo.es (A. Castillo).
Received September 12, 2017.
Accepted February 11, 2018.