Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.1 Trujillo ene./mar. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.01.13
ARTÍCULOS ORIGINALES
Polifenoles totales y capacidad antioxidante en cáscara y hojas de doce cítricos
Total polyphenols and antioxidant capacity of peel and leaves in twelve citrus
Ordoñez-Gómez E.S.1.*; Reátegui-Díaz, D.1; Villanueva-Tiburcio, J.E.2
1 Universidad Nacional Agraria de la Selva, Facultad de Ingeniería en Industrias Alimentarias, Av. Universitaria km. 1,5. Tingo María – Peru.
2 Universidad Nacional Hermilio Valdizan, Escuela Profesional de Ingeniería Agroindustrial, Av. Universitaria N° 601-607 Cayhuayna - Pillcomarca. Huánuco, Peru,
Resumen
Los cítricos son importantes por su aporte en vitamina C; asimismo, los polifenoles muestran interés por sus efectos benéficos hacia la salud. El objetivo de la investigación fue cuantificar polifenoles totales y evaluar la capacidad antioxidante en cáscaras y hojas de 12 variedades de cítricos. Las muestras se obtuvieron de diferentes zonas de la provincia de Leoncio Prado en la Región Huánuco, y se evaluó el contenido de polifenoles y la actividad antioxidante frente al radical DPPH y ABTS+. El mayor contenido de polifenoles en cáscara fue para la Mandarina común y Toronja con 3,22 ± 0,05 y 3,08 ± 0,03 mg AGE/100 g muestra y en hojas fue para mandarina común y mandarina Cleopatra con 2,86 ± 0,04 y 2,92 ± 0,04 mg AGE/100 g muestra. En cáscara, la mayor capacidad para secuestrar radicales DPPH fue mandarina común, Cleopatra y río oro, frente a ABTS+ fueron limón Tahiti, mandarina cleopatra, naranja valencia, tangelo y toronja; en hojas fue el tangelo y mandarina Cleopatra. La cáscara y hojas de diversos cítricos investigados son fuente importante de antioxidantes naturales, los cuales podrían ser utilizados y explotados por la industria para ser incluidos en el desarrollo de alimentos funcionales.
Palabras clave: Cáscara; Cítricos; polifenoles; antioxidantes naturales; Huánuco.
Abstract
Citrus are important because of their contribution in vitamin C; likewise, polyphenols show interest by their beneficial effects in health. The objective of the research was to quantify polyphenols and to evaluate the antioxidant capacity in peels and leaves of 12 citrus varieties. The samples were obtained from different areas of the province of Leoncio Prado in Region Huánuco, the content of polyphenols and the antioxidant activity against the radical DPPH and ABTS+ were evaluated. The highest content of polyphenols in peel was by Common mandarin and Grapefruit with 3.22 ± 0.05 and 3.08 ± 0.03 mg AGE/100 g sample, in leaves it was for Common mandarin and mandarin Cleopatra with 2.86 ± 0.04 and 2.92 ± 0.04 mg AGE/100 g sample. In leaves, the bigger antioxidant capacity front to DPPH radicals were common mandarin, Cleopatra and rio oro, respect to ABTS+ were Tahiti Lemon, mandarin Cleopatra, Orange Valencia, Tangelo and Grapefruit; on leaves was the Tangelo and mandarin Cleopatra. The peel and leaves of citrus investigated are important source of natural antioxidants, could be used and exploited by the industry to be included in the development of functional foods.
Keywords: Peel; citrus; polyphenols; natural antioxidants; Huanuco.
1. Introducción
El cultivo de cítricos, es uno de los más comerciales e importantes en el mundo (Rekha y Bhaskar, 2013; Yoo et al., 2009); incluye naranjas, mandarinas, limones, limas y pomelos los cuales recibieron interés en su cultivo en las últimas décadas (Castro-Vazquez et al., 2016), con una producción estimada entre 80 a 115 millones de toneladas métricas por año (Li et al., 2006; Castro-Vazquez et al., 2016; Lagha-Benamrouche et al., 2013).
Las plantas del género Citrus (Rutaceae) están recibiendo mucha atención por sus propiedades nutritivas y biológicas (Tundis et al., 2012). Otra importancia de los cítricos, es debido a que son una fuente de compuestos bioactivos tales como vitami-nas, carotenoides, fibra y compuestos fenólicos (Castro-vazquez et al., 2016), flavanonas, antocianinas y ácido hidrocinamico (Rekha y Bhaskar, 2013), los cuales están distribuidos en las plantas que ofrecen propiedades funcionales y son responsables del color, flavor y sabor de muchas plantas (Li et al., 2006; Irkin et al., 2015).
El proceso de industrialización de cítricos genera subproductos como cáscara y semilla que son considerados como des-perdicios (Juhaimi, 2014), por ejemplo, el rendimiento de zumo de cítricos (naranja y pomelo) es menos de la mitad del peso de fruta, produciendo cantidades muy grandes de desechos (Li et al., 2006; Lagha-Benamrouche et al., 2013; Tenorio-Domínguez, 2016). La cáscara es descartada como desecho que contiene una amplia variedad de productos secundarios con actividad antioxidante (Rafiq et al., 2016), esta representa una rica fuente de polifenoles (Anagnostopoulou et al., 2006; Ghasemi et al., 2009; Li et al., 2006; Lagha-Benamrouche et al., 2013; Ma et al., 2008). El uso de residuos como fuente de polifenoles y antioxidantes puede tener considerable beneficio económico para los procesadores de alimentos (Singh y Immanuel, 2014; Suja et al., 2017). Bhuiyan et al. (2009) menciona que, en Bangladesh, la India, Indonesia, la cáscara de citrus medica L. se consume crudo con arroz, por su contenido de citroflavonoides, que son una mezcla de hesperidosidos (ramnoglucoside de hesperetol), naringoside y ecryodietyoside (flavanones).
Diversas publicaciones, hacen referencia a los efectos benéficos de los polifenoles obtenidos de plantas y frutas, por sus efectos anticancerígenos, cardioprotector, antidiabético, neuroprotector (Pandey y Rizvi, 2009; Bhullar y Rupasinghe, 2013), efectos antiperoxidación lipídica (Ghasemi et al., 2009), antialérgico, antiaterogénico, antiinflamatorio, antimicrobiano, anticance-rígena, antitrombótica, y efectos vasodila-tadores, así como la capacidad para neutralizar las especies reactivas de oxígeno (ROS) y especies reactivas de nitrógeno (RNS) (Castro-Vázquez et al., 2016). La combinación de la acción de diversos poli-fenoles, actúan como antioxidantes protegiendo a la salud del humano (Parinandi et al., 2015; Grosso et al., 2013), por ejemplo, Kitada y Koya (2013), hacen referencia al efecto protector del sistema renal por parte del resveratrol. Las frutas y hortalizas se caracterizan por el alto contenido de compuestos con capacidad antioxidante; compuestos tales como los fenoles, pigmentos y vitaminas contribuyen a retardar los daños producidos a nivel del sistema nervioso central, como consecuencia del envejecimiento de las células (Ochoa-Velasco et al., 2012). En cuanto al conocimiento sobre el contenido de polifenoles y actividad antioxidante en hojas y cáscara de cítricos producidos en la región Huánuco, existe poca información disponible. El objetivo del presente estudio fue cuantificar los polifenoles totales y evaluar la capacidad antioxidante en cáscara y hojas de doce variedades de cítricos, que se cultivan en la selva de la región Huánuco, Perú.
2. Materiales y métodos
Variedades de cítricos: Los doce cítricos fueron los siguientes: Lima dulce (C. limetta), Naranja valencia (C. sinensis (L.) Osbeck, Mandarina común (C. reticulata), Limón mandarina (Citrus x limonia), Limón tahití (C. latifolia), Limón rugoso (C. jambhiri Lush), Limón sutil (C. aurantifolia Swingle), Tangelo (C. reticulada x C. paradosis), Limón cidra (C. medica L.), Mandarina cleopatra, Mandarina rio de oro (C. reticulata), Toronja (C. paradisi Macf). Estos se reco-lectaron de diferentes áreas en la provincia de Leoncio Prado, departamento de Huánuco, Perú.
Obtención y preparación de muestras: Las hojas y 30 frutos maduros de cada variedad, sin daño físico, fueron cosechados entre 6 a 7 a.m. y transportados en cajas normales hasta el laboratorio, luego se lavaron con agua destilada y se secaron con papel absorbente. La obtención de la cáscara se realizó de forma manual utilizando un cuchillo. Las cáscaras fueron cortadas entre 0,5 x 0,5 cm; luego las cáscaras y hojas se secaron a 60 °C (estufa-Tomos, USA) hasta peso constante (Castro-Vazquez et al., 2016), posterior-mente las diferentes muestras fueron molidas y envasadas en bolsas de polietileno recubierto con papel aluminio y se alma-cenaron a temperatura ambiente (25 °C).
Preparación de extractos: Se utilizó el método reportado por Ramful et al. (2010) y Adnan et al. (2014), se pesó 1,5 g de muestra se mezcló en 30 mL de solución metanólica (80:20 metanol:agua), se agitó por 24 h (Homogenizador Barnstead , USA), se filtró (Watman N° 40) y centrifugó (Hettich-Alemania) a 10000 rpm/10 min a 4 °C, el sobrenadante se guardó en tubos de vidrio con tapa a -20 °C hasta el desarrollo de los análisis.
Cuantificación de polifenoles totales: Se realizó mediante el método colorimétrico de Folin-Ciocalteu reportado por Sultana et al. (2009), con algunas modificaciones. 20 µL de muestra fueron mezclados con 1580 µL de agua desionizada y se adicionó 100 µL de solución Fenol de Folin-Ciocalteu 2N (Merck) después de 1 min se mezcló con 300 µL de Na2CO3 (Sigma Aldrich) al 20% y se almacenó por 2 horas a temperatura ambiente. La absorbancia se registró a 700 nm (espectrofotómetro UV/VIS Genesys 10, USA). Se preparó una curva estándar de Ácido Gálico (Sigma-Aldrich) en concentraciones de 50, 100, 200, 400, 600 800 y 1000 ug/mL y un coeficiente de correlación de 0,9992. El contenido de polifenoles de las muestras se reportó en mg de ácido gálico equivalente/100 g de muestra seca.
Radical 1,1-difenil-2-picrilhidrazil (DPPH): Se utilizó la técnica reportada por Sandoval et al. (2002), 100 µL de extractos de las muestras (0,5 - 5 mg/mL) se hizo reaccionar con 900 µL de DPPH (Sigma) a 100 µM en ambiente oscuro y se registró la absor-bancia a 515 nm (Espectrofotómetro UV/VIS Genesys10, USA) después de 6 min en la que se observó valor de absorbancia constante. El porcentaje de inhibición del radical DPPH fue calculado con la ecuación: % Inhibición DPPH = [(Ac – Am)/Ac] x 100, donde Ac: Absorbancia del control; Am: Absorbancia de la muestra en función del tiempo (5 minutos). La actividad antioxidante fue expresada en IC50 que nos indica la concentración de muestra nece-saria para inhibir el 50% del radical DPPH. El IC50 se obtuvo de la ecuación lineal obtenido del ploteo de las concentraciones de la muestra versus porcentaje de inhibición.
El radical libre 2,2-azinobis (3-etilbenzo-tiazoline-6-ácido sulfónico) (ABTS+) se realizó mediante el método reportado por Re et al. (1999), con algunas modificacio-nes. Se hizo reaccionar 9,8 mL de ABTS (Sigma-Aldrich) a 7,4 mM con 0,2 mL de persulfato de potasio (Merck) a 122,5 mM y se incubó en oscuridad por 16 h. Poste-riormente se diluyó 1 mL de solución de ABTS+ con 49 mL de metanol (Merck) hasta obtener una absorbancia entre 0,7 (± 0,02) a 734 nm (Espectrofotómetro UV/VIS Genesys 10, USA). Luego 100 µL de los extractos (50 – 500 ug/mL) se hizo reaccionar con 900 µL de radical ABTS+ por 6 min en un ambiente oscuro. El porcentaje de inhibición del radical fue calculado con la siguiente fórmula: % Inhibición ABTS+ = [(Ac – Am)/Ac] x 100; donde Ac: Absorbancia del control; y Am: Absorbancia de la muestra en función del tiempo (5 minutos). El IC50 se obtuvo de la ecuación lineal obtenido del ploteo de las concentraciones de la muestra versus porcentaje de inhibición.
Análisis estadístico: Los resultados de los análisis se analizaron mediante un ANOVA unifactorial con la prueba de tukey con p < 0,05 (Hernández et al., 2014) y un análisis multivarado con componentes principales (ACP) y un Cluster (dendrograma) (Franco e Hidalgo, 2003). El cálculo se realizó en el InfoStat versión 2017. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argen-tina.
3. Resultados y discusión
Contenido de polifenoles
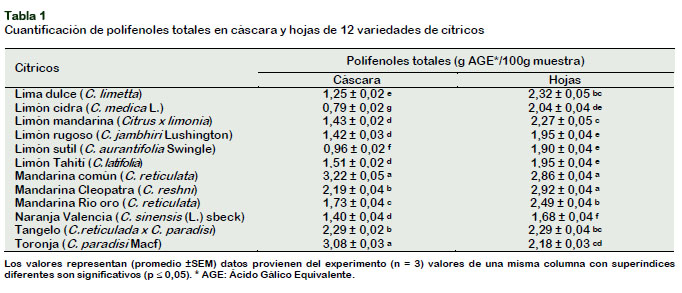
El consumo de polifenoles es importante para la salud, debido a sus múltiples efec-tos benéficos (Bhullar y Rupasinghe, 2013), en la Tabla 1, se muestra el resultado de los análisis en cáscara y hojas en las diferentes variedades de cítricos. El contenido de polifenoles totales entre las diferentes variedades de cítricos en cáscara y hojas mostró diferencias significativas (p < 0,05). Con respecto a las diferentes variedades en cáscara de limón, el contenido de polifenoles mostró diferencias (p < 0,05), siendo los limones tahití, mandarina y rugoso fueron mayores que limón sutil y limón cidra, mientras que, en hojas, el contenido de polifenoles totales fue mayor en limón mandarina, seguido por limón cidra, limón rugoso, limón tahiti y limón sutil; los resultados obtenidos se encuen-tran en el rango obtenido por diferentes investigadores, por ejemplo Sun et al. (2013), reportó 21,17 ± 0,64 mg AGE/ g cáscara en limón Eureka; Irkin et al. (2015), 5,35 ± 5,81 mg AGE/g cáscara seca; Gorinstein et al. (2001) reportó en cáscara de limón, mandarina y pomelo 190 ± 10,6; 179 ± 10,5 y 155 ± 10,3 mg Ac. Clorogénico / 100g cáscara seca. Según Shie y Lay (2013), el contenido de polifenoles varía de acuerdo con el tamaño, por ejemplo, en limón flavedo y albedo, reportó 51,22 - 95,67 y 40,94 - 73,44 µg AGE/mg peso seco en limones pequeño, mediano y grande. Con respecto a la cáscara de mandarina común el resultado obtenido fue mayor a lo reportado por Irkin et al. (2015) con 9,31 mg AGE/g peso seco, pero inferior a los resultados publicados por Ye et al. (2011) en cáscara de mandarina con 47,1 - 78,7 mg AGE/g peso seco.
En lima dulce, el contenido de polifenoles fue mayor en hojas que en cáscara, este resultado no concuerda con lo publicado por Muthiah et al. (2012), que mostró que el contenido de los compuestos fenólicos totales varía entre 7,39 y 33,05 µg Equiv pirocatecol/mg, teniendo el orden siguien-te: C. limetta cáscara > C. aurantium cáscara > C. limon cáscara > C. aurantium hoja > C. limetta hoja > C. limon hoja. En cuanto a las variedades de mandarina, la mandarina común > mandarina cleopatra > mandarina río oro con 3,22 ± 0,05; 2,19 ± 0,04 y 1,73 ± 0,04 g AGE/100 g cáscara respectivamente; Asjad et al. (2013) repor-tó 99,4 mg AGE/g extracto polvo en cáscara de mandarina var. Page (C. reticulate); por su parte. Ma et al. (2008) sometieron cás-cara de mandarina (C. reticulata) a trata-miento con ultrasonido a baja y alta frecuencia obteniendo 10,9 - 15,6 mg AGE/g peso fresco y 22,8 - 28,7 mg AGE/g peso fresco. Respecto a cáscara de mandarina rio oro, se obtuvo 1,73 ± 0,04 g AGE/100g muestra seca, esta mandarina es un hibrido que presentó variación con respecto a las otras variedades de mandarina investigadas, Xu et al. (2008) obtuvo la mayor cantidad de polifenoles mediante extracción metanólica en man-darina Satsuma (C. unshiu Marc.) y Ponkan (C. poonensis Hort. ex Tanaka) obteniendo 55 y 50 mg AGE/g peso seco apro-ximadamente. Sin embargo, en muestras de hojas, las variedades de mandarina común y mandarina cleopatra mostraron diferencias (p < 0,05) con respecto a la cáscara de mandarina río oro.
El contenido de polifenoles en naranja valencia fue mayor en hojas que en cáscara con 1,68 ± 0,04 g AGE/ 100 g muestra y 1,40 ± 0,024 g AGE/ 100 g muestra, cabe indicar que los principales compuestos fenólicos presentes en la naranja incluyen ácidos hidroxicinámicos (HCA) y flavonoides, entre los cuales flavanones son los más fre-cuentes (Park et al., 2014). En cuanto a tangelo no hubo diferencia (p > 0,05) en el contenido de polifenoles en cáscara y hojas con 2,29 g AGE/100 g muestra; con res-pecto al tangelo, Benites et al. (2011) reportaron en cáscaras liofilizadas y extracto acuoso el mayor contenido de polifenoles en Tangelo (C. reticulata x C. paradisi) 1103,8 ± 1,9 mg AGE/100 ml comparado con naranja (C. sinensis) 988,9 ± 32,7 mg AGE/100 ml y limón (C. aurantifolia) 886,5 ± 25,1 mg AGE/100 mL.
En referencia a la toronja, el contenido de polifenoles en cáscara fue mayor que en hojas (3,08 ± 0,03 g AGE/ 100 g muestra seca; 2,18 ± 0,03 g AGE/ 100 g), los valores reportados fueron muy parecidos a lo indicado por Fidrianny et al. (2016) en pomelo (Citrus maxima) el contenido de polifenoles totales en hojas con diferente polaridad de solventes vario entre 2,99 a 5,57 g AGE/100 g y en cáscaras entre 2,62 a 6,88 g AGE/100 g). Sun et al. (2013) obtuvieron en cáscara de huyou (C. paradise Macf. Changshanhuyou) 37,47 ± 0,89 mg AGE/g peso seco; mientras que Rincón et al. (2005) reportaron 51,1 ± 1,22 g AGE/Kg muestra. Ghasemi et al. (2009) menciona que los flavanones, flavones y flavonoles son los tres tipos de flavonoides presentes en frutos cítricos y los más representativos son hespiridina, narirutina, naranginina y eriocitrina.
Capacidad antioxidante
El secuestro de radicales libres por polifenoles es un indicador importante para conocer las bondades antioxidantes de frutas y vegetales (Angeloni et al., 2015; Arteaga y Arteaga, 2016), a ello se suma los diferentes beneficios que ofrecen a la salud (Grosso et al., 2013).
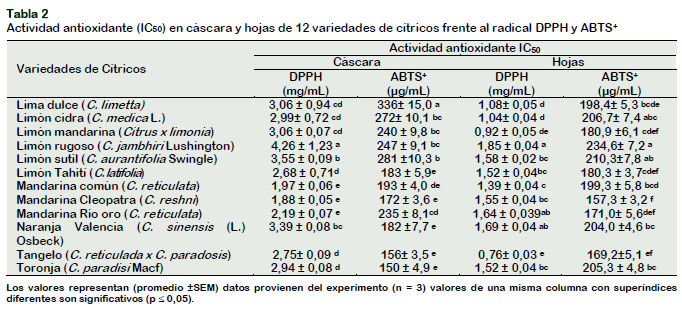
En la Tabla 2 se muestra la capacidad antioxidante en cáscara y hojas de las diferentes variedades de cítricos frente al radical DPPH y ABTS+; de acuerdo con el parámetro IC50, bajos valores reflejan una alta capacidad para inhibir radicales libres (Vinson et al., 1995).
La cáscara de lima dulce presentó mayor capacidad para secuestrar al radical ABTS+ frente al DPPH con IC50 de 336 ± 15,0 ug/mL y 3,06 ± 0,94 mg/mL; en las hojas, la capacidad antioxidante frente al radical ABTS+ fue superior con respecto al DPPH con IC50 de 198,4 ± 5,3 ug/mL y 1,08 ± 0,05 mg/mL.
Entre las variedades de limón, las muestras de cáscara con mayor actividad antioxi-dante frente al radical DPPH fueron el limón cidra, limón mandarina y limón Tahití (p > 0,05), mientras que en el limón rugoso y limón sutil fueron significativos (p < 0,05) con IC50 de 4,26 ± 1,23 mg/mL y 3,55 ± 0,09 mg/mL, con respecto a la actividad anti-radical del ABTS+ la cáscara de limón Tahití presentó mayor eficiencia con 183 ± 5,9 ug/mL, mientras que en las muestras de limón mandarina, limón rugoso, limón cidra y limón sutil no fueron diferentes (p > 0,05); según Singh y Immanuel (2014) la actividad antioxidante fue mayor en la cáscara de limón 75,9% que en las naranja 71,4%, esta actividad de las cáscaras se debe a la presencia de polifenoles y flavonoides. Con respecto a la actividad antioxidante en hojas, los extractos metanólicos de las hojas de limón mandarina y limón cidra (p > 0,05), fueron superiores al limón Tahití, limón sutil y limón rugoso (p < 0,05), mientras que la actividad antioxidante frente al ABTS+ en hojas de limón cidra, limón mandarina y limón Tahiti (p > 0,05) fueron superiores al limón rugoso y limón sutil (p > 0,05), sin embargo, entre limón cidra, limón rugoso y limón sutil no hubo diferencia significativa (p > 0,05).
Los extractos metanólicos de las cáscaras de variedades de mandarina común, mandarina cleopatra y mandarina río oro, no mostraron diferencia significativa (p≤ 0,05) para secuestrar radicales DPPH, mientras que en el secuestro de radical ABTS+ el extracto de mandarina Cleopatra fue superior a la mandarina río oro. Cabe resaltar que la cáscara de mandarina (Citrus reticulata), es una fuente rica de compuestos beneficiosos para la salud, incluida la vitamina C, carotenoides y antioxidantes polifenólicos (Rafiq et al., 2016). El extracto de la hoja de mandarina común fue superior al extracto de mandarina río oro con 1,39 ± 0,04 mg/mL y 1,64 ± 0,04 mg//mL, mientras que entre mandarina Cleopatra y mandarina río oro no hubo diferencia estadística (p > 0,05); de manera similar, la actividad antioxidante contra el ABTS+ de las hojas de mandarina Cleopatra fue superior a la mandarina común con 157,3 ± 3,2 µg/mL y 199,3 ± 5,8 µg/mL (p ˃ 0,05), mientras que entre la mandarina común y mandarina río oro no fue significativo (p > 0,05).
En cáscara de naranja valencia, la actividad antioxidante frente a DPPH fue mayor que en ABTS+ con 3,39 ± 0,08 mg/mL y 182 ±7,7 µg/mL, de manera similar, en hojas, la mayor actividad antioxidante fue 1,69 ± 0,04 mg/mL y 204,0 ± 4,6 µg/mL.
La actividad antioxidante frente al DPPH del extracto metanólico de cáscara de tangelo fue menor frente al extracto de hojas con 2,75 ± 0,09 mg/mL y 0,76 ± 0,03 mg/mL; Tenorio-Dominguez (2016) cuan-tifica naringina en los extractos acuoso y metanólico: 81,1727 mg/g y 49,9399 mg/g respectivamente en la cáscara de naranja tangelo (Citrus reticulata x Citrus paradisi).
Con respecto al ABTS+, el extracto de cáscara fue mayor que el extracto de hojas con 156 ± 3,5 µg/mL y 169,2 ± 5,1 µg/mL, un comportamiento similar, mostro el extracto metanólico de toronja, en la cual la actividad antioxidante frente al DPPH del extracto de hojas, fue mayor al extracto de cáscara con 1,52 ± 0,04 mg/mL y 2,94 ± 0,08 mg/mL, en el secuestro de ABTS+, el extracto metanólico de cáscara fue mayor que el extracto de hojas 150 ± 4,9 µg/mL y 205,3 ± 4,8 µg/mL.
Análisis multivariado de componentes principales
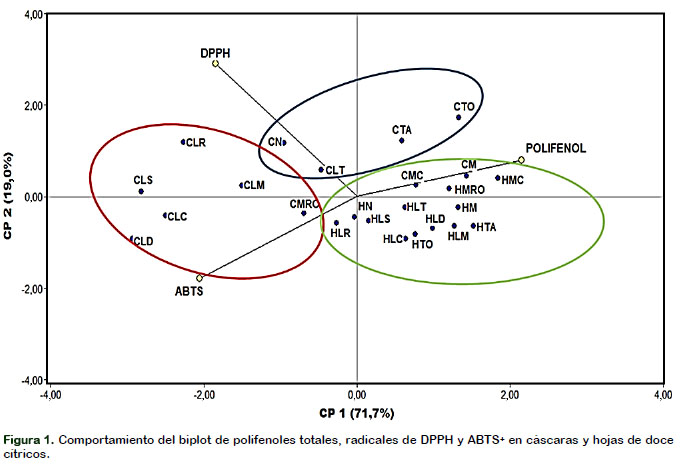
Para evaluar la variabilidad del contenido de polifenoles totales y la actividad antioxidante de radicales DPPH y ABTS+ se realizó el análisis de componentes principales. En la Figura 1 se muestra el biplot de variables del primer componente (CP1) que separa la capacidad de inhibición del radical ABTS+ del resto de variables (polifenoles, DPPH), que representa el 71,7% de la variabilidad total entre los resultados de 24 tratamientos analizados. Asimismo, la capacidad de inhibición al radical DPPH (CP2) representó el 19,0% de la variabilidad y ambos componentes (CP1 y CP2) representaron el 90,7% de la variabilidad total.
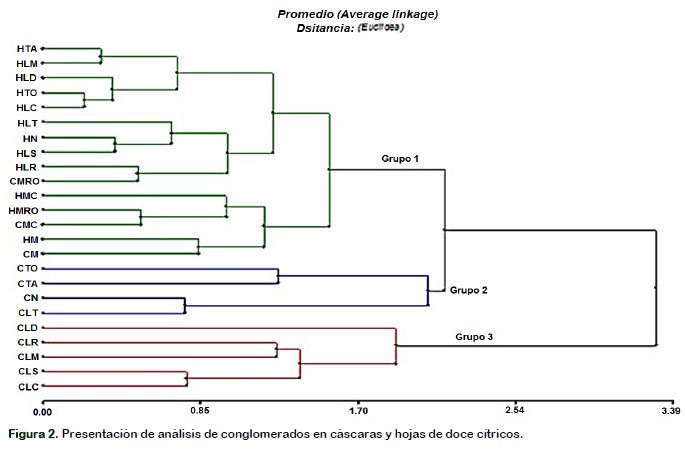
Según el análisis de conglomerados de la Figura 2 referente a cáscaras y hojas se puede diferenciar 3 grupos. El primer grupo representó el 62,5% y estuvo conformado por 12 muestras de hojas y 3 muestras de cáscara mandarina rio oro (CMRO), mandarina cleopatra (CMC) y mandarina común (CM), este grupo mostró mayor asociatividad a los polifenoles totales. Con respecto a las hojas de cítricos podemos indicar que son una fuente importante de compuestos bioactivos incluyendo antioxidantes como ácido ascórbico, flavonoides y compuestos fenólicos (Khettal et al., 2016), Así mismo, las hojas de naranja de las variedades Portugaise, Washington y Bigarade tuvie-ron mayor cantidad de polifenoles totales que las cáscaras, pero la variedad Jaffa tiene mayor contenido de polifenoles tota-les en la cáscara comparado a la hoja (Lagha-Benamrouche y Madani, 2013). Además, Adnan et al. (2014) mencionan que los flavonoides y ácidos fenólicos son especialmente comunes en hojas y flores en las plantas. Por otro lado, en las cáscaras el contenido de polifenoles, en especial los del tipo C6-C3-C6 (Flavonoies, flavonas, isoflavonas), tienen funciones de defensa en la planta, como agente antimicrobiano y protección contra herbívoros (Benites et al., 2011).
El segundo Grupo representó el 16,6% y estuvo conformado por cáscaras de toronja (CTO), Tangelo (CTA), naranja (CN) y limón Tahití (CLT), estas muestras tuvieron capacidad para inhibir al radical DPPH. Lagha-Benamrouche y Madani (2013), re-portaron que los extractos de cáscara de las variedades de naranjas Thomson, Sanguinelli y Jaffa, tuvieron mayor actividad antioxidante frente al radical DPPH; referente al poder reductor las muestras de cáscara de la variedad Bigarade-Thomson> Sanguinelli-Portugaise > Doublefine-Jaffa > Washington.
La actividad antioxidante de polifenoles está relacionado a su propiedad redox; una parte del fenol (grupo hidroxilo en el anillo aromático) actúa como agente reductor, donando hidrógeno y quelando oxígeno sínglete (Adnan et al., 2014). Podría deberse a que los cítricos son fuente importante de muchos compuestos bioactivos, como ácidos fenólicos y glucósidos de flavanona, la naringina y la hesperidina, los llamados flavonoides cítricos, son las dos principales flavanonas glucosídicas (Fejzić y Ćavar, 2014).
El tercer Grupo representó el 20,8% y estuvo conformado por las cáscaras de lima dulce (CLD), limón rugoso (CLR), limón mandarina (CLM), limón sutil (CLS) y limón cidra (CLC), estas muestras tuvieron poca capacidad de inhibir al radical DPPH y ABTS+. La variación con el contenido de metabolitos secundarios se relacionaría con los diferentes tipos de muestras (Venturini et al. 2014). Los subproductos del procesamiento de cítricos son una fuente natural de flavonoides y polifenoles. En investigaciones realizados por Lagha-Benamrouche y Madani (2013), en la cual realizaron extracción alcohólica al 80% (25 °C por una semana), la actividad antioxidante en cáscaras de cítricos fue variables; por ejemplo, en cáscara de naranja agria fue 55,28%; toronja 72,05%; naranja dulce 71,39%; lima 57,71%, mandarina 57,71%; mandarina 54,49%; limón real 48,82% y 95,18% en limón mexicano. En los resultados obtenidos, el extracto de cáscara de toronja presentó una alta actividad antioxidante (72,05 ± 3,44), no se observó una relación con el contenido fenólico y la actividad antioxidante de los extractos, a excepción de la cáscara de toronja.
Sin duda, la cáscara y hojas de cítricos son una fuente importante de antioxidantes naturales; las cáscaras tienen alta actividad antioxidante y pueden resultar ser un mejor sustituto en lugar de los antio-xidantes sintéticos para extender la vida útil de los productos alimenticios al evitar la formación de peróxidos en el producto que contiene grasa y aceite. Además, los antioxidantes naturales son seguros e imparten beneficios de salud al consumidor (Suja et al., 2017).
4. Conclusiones
El contenido de polifenoles totales en cáscaras de 12 cítricos varió entre 3,22 a 0,79 g AGE/100 g. El Coeficiente de inhi-bición IC50 de las cáscaras frente al radical DPPH varió de 1,88 ± 0,45 a 4,26 ± 1,23 mg/mL, frente al radical ABTS+ estuvo en el rango de 150 ± 4,9 a 336 ± 15,0 µg/mL. Como fuentes potenciales en antioxidantes naturales en cáscara tenemos a la man-darina común, toronja, mandarina río oro, mandarina Cleopatra, Tangelo, naranja Valencia, limón Tahití, por presentar el mayor contenido de polifenoles totales y capacidad antioxidante (DPPH y ABTS+).
Estos resultados permitirán direccionar investigaciones para el desarrollo de futuras investigaciones, por ejemplo, estudios de estabilidad antioxidante, capacidad para disminuir enfermedades, incluso desarrollar técnicas de extracción con diferentes tecnologías, así como su posterior aplicación en la industria como aditivos o suplementos alimentarios.
Referencias Bibliográficas
Adnan, M.; Umer, A.; Ahmad, I.; Hayat, K.; Shakeel, S. 2014. In vitro evaluation of biological Activities of Citrus leaf extracts. Sains Malaysiana 43(2): 185-194. [ Links ]
Anagnostopoulou, M.A.; Kefalas, P.; Papageorgiou, V.P.; Assimopoulou, A.N.; Boskou, D. 2006. Radical scavenging activity of various extracts and fractions of sweet orange peel (Citrus sinensis). Food chemistry 94(1):19-25. [ Links ]
Angeloni, C.; Maraldi, T.; Milenkovic, D.; Vauzour, D. 2015. Dietary Polyphenols and Their Effects on Cell Biochemistry and Pathophysiology 2014. Oxidative Medicine and Cellular Longevity 2015: 782424. [ Links ]
Arteaga, A.; Arteaga, H. 2016. Optimización de la capa-cidad antioxidante, contenido de antocianinas y capacidad de rehidratación en polvo de arándano (Vaccinium corymbosum) microencapsulado con mezclas de hidrocoloides. Scientia Agropecuaria 7(3): 191 – 200. [ Links ]
Asjad, H.M.; Akhtar, M.S.; Bashir, S.; Din, B.; Gulzar, F.; Khalid, R.; Asad, M. 2013. Phenol, flavonoid contents and antioxidant activity of six common citrus plants in Pakistan. Journal of Pharmaceutical and Cosmetic Sciences 1(1):1-5. [ Links ]
Benites, V.J.; Rodrigo Díaz, G.R.; López, V.J.; Gajardo, S.S.; Kusch, F.F.; Rojas, A.M. 2011. Actividad antioxidante y antibacteriana de seis cáscaras de frutos del oasis de Pica. BIOFARBO 19(1):1-7. [ Links ]
Bhuiyan, M.N.; Begum, J.; Sardar P. K.; Rahman M. S. 2009. Constituents of peel and leaf essential oils of Citrus medica L. Journal of Scientific Research 1(2): 387-392. [ Links ]
Bhullar, K.S.; Rupasinghe, H.P.V. 2013. Polyphenols: Multipotent Therapeutic Agents in Neurodegene-rative Diseases. Oxidative Medicine and Cellular Longevity 2013: 891748. [ Links ]
Castro-Vazquez, L.; Alañón, M.; Rodríguez-Robledo, V.; Pérez-Coello, M.S.; Hermosín-Gutierrez, I.; Díaz-Maroto, M.C.; Jordán, J.; Galindo, M.; Arroyo-Jiménez, M. 2016. Bioactive flavonoids, antioxidant behaviour and cytoprotective effects of dried grapefruit peels (Citrus paradisi Macf.). Oxidative Medicine and Cellular Longevity 1: 1-12. [ Links ]
Fejzić, A.; Ćavar, S. 2014. Phenolic Compounds and Antioxidant Activity of Some Citruses. Bulletin of the Chemists and Technologists of Bosnia and Herze-govina 42: 1-4. [ Links ]
Fidrianny, I.; Sari, E.; Ruslan, K. 2016. Phytochemical content and antioxidant activities in different organs of pomelo (Citrus maxima [BURM.] merr.) using 2,2-DiphenyL-1- Picrylhydrazyl and phosphomolyb-denum assays. Asian J Pharm Clin Res 9(Suppl. 2): 185-190.
Franco, T.; Hidalgo, R. 2003. Análisis estadístico de datos de caracterización morfológica de recursos fitogenéticos. Instituto Internacional de Recursos Fitogenéticos. Cali (Colombia). Boletín técnico nº 8. 94 pp. [ Links ]
Ghasemi, K.; Ghasemi, Y.; Ebrahimzadeh. M.A. 2009. Antioxidant activity, phenol and flavonoid contents of 13 citrus species peels and tissues. Pakistan Journal of Pharmaceutical Sciences 22(3): 277-28. [ Links ]
Gorinstein, S.; Martin-Belloso, O.; Parkys, Y.S.; Haruenkit, R.; Lojek, A.; Ciz, M.; Capi, A.; Libman, I.; Trakhtenberg, S. 2001. Comparison of some bio-chemical characteristics of different citrus fruits. Food Chemistry 74(3): 309-315 [ Links ]
Grosso, G.; Galvano, F.; Mistretta, A.; Marventano, S.; Nolfo, F.; Calabrese, G.; Buscemi, S.; Drago, F.; Veronesi, U.; Scuderi, A. 2013. Red Orange: Experimental Models and Epidemiological Evidence of Its Benefits on Human Health. Oxidative Medicine and Cellular Longevity 2013: 157240. [ Links ]
Hernández, R.; Fernández, C.; Baptista, P. 2014. Meto-dología de la investigación. 6 Edición. Editorial McGraw-Hill Interamericana. D.F. México. 600 pp. [ Links ]
Irkin, R.; Dogan, S.; Degirmencioglu, N.; Diken, E.M.; Guldas, M. 2015. Phenolic content, antioxidant activities and stimulatory roles of citrus fruits on some lactic acid bacteria. Archives of Biological Sciences 67(4): 1313-1321. [ Links ]
Juhaimi, F.A. 2014. Citrus fruits by-products as sources of bioactive compounds with antioxidant potential. Pakistan Journal of Botany 46(4): 1459-1462. [ Links ]
Khettal, B.; Kadri, N.; Tighilet, K.; Adjebli, A.; Dahmoune, F.; Maiza-Benabdeslam, F. 2017. Pheno-lic compounds from Citrus leaves: antioxidant activity and enzymatic browning inhibition. Journal of Complementary and Integrative Medicine 14(1): 20160030. [ Links ]
Kitada, M.; Koya, D. 2013. Renal Protective Effects of Resveratrol. Oxidative Medicine and Cellular Longevity 2013: 568093. [ Links ]
Lagha-Benamrouche, S.; Madani, K. 2013. Phenolic contents and antioxidant activity of orange varieties (C. sinensis L. and C. aurantium L.) cultivated in Algeria: Peels and leaves. Industrial Crops and Products 50: 723-730. [ Links ]
Li, B.B.; Smith, B.; Hossain, MD.M. 2006. Extraction of phenolics from citrus peels I. Solvent extraction method. Separation and Purification Technology 48: 182-188. [ Links ]
Ma, Y.Q.; Chen, J.C.; Liu, D.H.; Ye, X.Q. 2008. Effect of ultrasonic treatment on the total phenolic and antioxidant activity of extracts from citrus peel. Journal of food science 73(8): T115-T120. [ Links ]
Muthiah, P.L.; Umamaheswari, M.; Asokkumar, K. 2012. In vitro antioxidant activities of leaves, fruits and peel extracts of citrus. International Journal of Phytopharmacy 2(1):13-20. [ Links ]
Ochoa-Velasco, C.E.; García-Vidal V.; Luna-Guevara J. J.; Luna-Guevara M. L.; Hernández-Carranza P.; Guerrero-Beltrán J.Á. 2012. Características antioxi-dantes, fisicoquímicas y microbiológicas de jugo fermentado y sin fermentar de tres variedades de pitahaya (Hylocereus spp). Scientia Agropecuaria 3: 279 – 289. [ Links ]
Pandey, K.B.; Rizvi, S.I. 2009. Plant polyphenols as dietary antioxidants in human health and disease. Oxidative Medicine and Cellular Longevity 2(5): 270-278. [ Links ]
Parinandi, N.L.; Maulik, N.; Thirunavukkarasu, N.; McFadden, D.W. 2015. Antioxidants in Longevity and Medicine 2014. Oxidative Medicine and Cellular Longevity 2015: 739417. [ Links ]
Park, J. H.; Lee, M.; Park, E.2014. Antioxidant activity of orange flesh and peel extracted with various solvents. Prev. Nutr. Food Sci. 19(4):291-298. [ Links ]
Rafiq, S.; Kaul, R.; Sofi, S.A.; Bashir, N.; Nazir, F.; Nayik, G. A. 2016. Citrus peel as a source of functional ingredient: A Review. Journal of the Saudi Society of Agricultural Sciences (In press). [ Links ]
Ramful, D.; Bahorum, T.; Bourdon, E.; Tarnus, E.; Aruoma, O. 2010. Biactive phenolic and antioxidant propensity of flavedo extracs of Mauritian citrus fruit: Potential prophylactic ingredients for func-tional foods application. Toxicology 278(1): 75-87. [ Links ]
Re, R.; Pellegrini, N.; Proteggente, A.; Pannala, A.; Yang, M.; Rice, C. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine 26(9/10): 1231-1237. [ Links ]
Rekha, S.; M. Bhaskar, M. 2013. In vitro screening and identification of antioxidant activities of orange (Citrus sinensis) peel extract in different solvents. International Journal of Pharma and Bio Sciences 4(4): 405-412. [ Links ]
Rincón, A.M.; Vásquez, A.M.; Padilla, F.C. 2005. Composición química y compuestos bioactivos de las harinas de cáscaras de naranja (C. sinensis), mandarina (C. reticulata) y toronja (C. paradisi) cultivadas en Venezuela. Archivos Latinoame-ricanos de Nutrición 55(3): 305-310. [ Links ]
Sandoval, M.; Okuhama, N.; Angeles, F.; Melchor, V.; Condezo, L.; Lao, J.; Miller, M. 2002. Antioxidant activity of the cruciferous vegetable Maca (Lepidium meyenii). Food Chemistry 79(2): 207-213. [ Links ]
Singh, S.; Immanuel, G. 2014. Extraction of antioxidants from fruit peels and its utilization in paneer. J Food Process Technol 5: 349. [ Links ]
Suja, D.; Bupesh, G.; Nivya R.; Mohan, V.; Ramasamy, P.; Muthiah N.S.; Arul A. E.; Meenakumari, K. and Prabu, K. 2017. Phytochemical Screening, Antioxi-dant, Antibacterial Activities of Citrus Limon and Citrus Sinensis Peel Extracts. International Journal of Pharmacognosy and Chinese Medicin 1(2): 1-7. [ Links ]
Sultana, B.; Anwar, F.; Ashraf, M. 2009. Effect of extraction solvent/technique on the antioxidant activity of Selected Medicinal Plant Extracts. Molecules 14(6): 2167-2180. [ Links ]
Sun, Y.; Qiao, L.; Shen, Y.; Jiang, P.; Chen, J.; Ye, X. 2013. Phytochemical profile and antioxidant activity of physiological drop of Citrus fruits. Journal of Food Science 78(1): C37-C42. [ Links ]
Shie, P-H.; Lay, H-L. 2013. Component analysis and antioxidant activity of Citrus limon. Academia Journal of Medicinal Plants 1(3): 49-58. [ Links ]
Tenorio-Dominguez, N. 2016. Flavonoides extraídos de la cascara de naranja tangelo (Citrus reticulata x Citrus paradisi) y su aplicación como antioxidante natural en el aceite vegetal sacha inchi (Plukenetia volubilis). Scientia Agropecuaria 7(4): 419 – 431. [ Links ]
Tundis, R.; Loizzo, M.R.; Bonesi, M.; Menichini, F.; Mastellone, V.; Colica, C. C.; Menichini, F. 2012. Comparative study on the antioxidant capacity and cholinesterase inhibitory activity of Citrus aurantifolia swingle, C. aurantium l., and C. bergamia risso and poit. peel essential oils. Journal of food science 71(1): H40-H46. [ Links ]
Venturini, N.; Barboni, T.; Curk, F.; Costa, J.; Paolini, J. 2014. Volatile and flavonoid composition of the peel of Citrus medica L. var. Corsican fruit for quality assessment of Its liqueur. Food Technology and Biotechnology 52(4): 403–410. [ Links ]
Vinson, J.A.; Hontz, B.A. 1995. Plant flavonoids, especially tea flavonols, are powerful antioxidants using an in vitro oxidation model heart disease. Journal of Agricultural and Food Chemistry 43(11): 2798-2799. [ Links ]
Xu, G.H.; Chen, J.C.; Liu, D.H.; Zhang, Y.H.; Jiang, P.; Ye, X.Q. 2008. Minerals, phenolic compounds, and antioxidant capacity of citrus peel extract by hot water. Journal of Food Science 73(1): C11-C18. [ Links ]
Ye, X.Q.; Chen, J.C.; Liu, D.H.; Jiang, P.; Shi, J.; Xue, S.; Wu, D.; Xu, J.G.; Kakuda, Y. 2011. Identification of bioactive composition and antioxidant activity in Young mandarin fruit. Food Chemistry 124(4): 1561-1566. [ Links ]
Yoo, K.M.; Hwang, I.K.; Park, J.H.; Moon, B. 2009. Major Phytochemical Composition of 3 Native Korean Citrus Varieties and Bioactive Activity on V79-4 Cells Induced by Oxidative Stress. Journal of Food Science 74(6): C463-C468. [ Links ]
* Corresponding author
E-mail: suordonezg@gmail.com (E.S. Ordoñez-Gómez).
Received August 26, 2017.
Accepted March 4, 2018.