Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.1 Trujillo jan./mar. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.01.15
ARTÍCULOS ORIGINALES
Efecto de dietas con lecitina de soya en el crecimiento, muda y supervivencia de machos del camarón de río Cryphiops caementarius (Crustacea: Palaemonidae)
Effect of diets with soy lecithin on the growth, molting and survival of males of the river shrimp Cryphiops caementarius (Crustacea: Palaemonidae)
Amy Acosta Hurtado1; Deyvis Quiñones Ramos1; Walter Reyes Avalos2,*
1 Escuela de Biología en Acuicultura. Facultad de Ciencias. Universidad Nacional del Santa, Av. Universitaria s/n, Urbanización Bellamar, Nuevo Chimbote, Peru.
2 Departamento Académico de Biología, Microbiología y Biotecnología. Facultad de Ciencias. Universidad Nacional del Santa, Av. Universitaria s/n, Urbanización Bellamar, Nuevo Chimbote, Peru.
Resumen
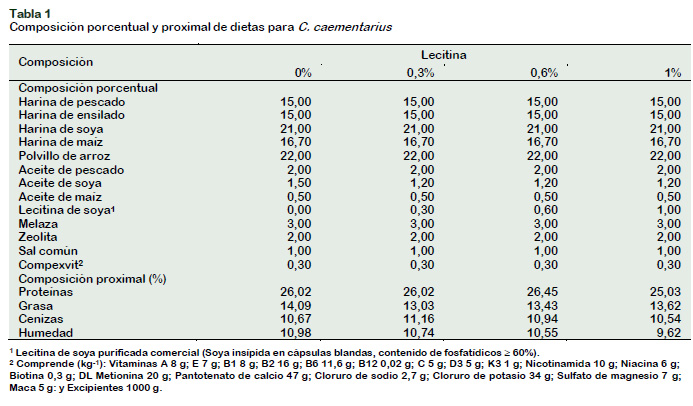
El objetivo fue determinar el efecto de dietas con bajas concentraciones de lecitina de soya sobre el crecimiento, muda y supervivencia de machos del camarón de río Cryphiops caementarius. Se emplearon dos dietas experimentales con 0,3% y 0,6% de lecitina, un control negativo (sin lecitina) y un control positivo (1% de lecitina) con tres repeticiones, respectivamente. Los camarones machos, con 5,15 cm de longitud total y 6,69 g de peso húmedo se sembraron a la densidad de 32 camarones m-2 y se cultivaron individualmente en seis recipientes por acuario, durante 90 días. El mayor crecimiento en peso y longitud se obtuvo con 0,6% y 1% de lecitina, significativamente diferente (p < 0,05) que los demás tratamientos. El período entre muda (26 días) y la frecuencia de mudas (tres mudas) no fueron afectados por la lecitina. La supervivencia fue de 94% con 0,6% y 1% de lecitina, significativamente alta (p < 0,05) en relación con los demás tratamientos que estuvieron entre 77% y 61%. La dieta sin lecitina y con 0,3% de lecitina ocasionaron el síndr ome de muerte por muda y el síndrome de la ecdisis incompleta. Se recomienda emplear un mínimo de 0,6% de lecitina en la dieta de machos de C. caementarius.
Palabras clave: Cryphiops; crecimiento; supervivencia; lecitina de soya; muda.
Abstract
The aim was to determine the effect of diets with low concentrations of soy lecithin on growth, molting and survival of males of the river shrimp Cryphiops caementarius. Two experimental diets with 0.3% and 0.6% lecithin, a negative (without lecithin) control and a positive control (1% lecithin) with three replicates, respectively. Male shrimp, 5.15 cm total length and 6.69 g of 32 wet weight, were stocked with density of 32 shrimp m -2 and were individually cultured in six individual containers per aquarium for 90 days. The highest growth in weight and length was obtained with 0.6% and 1% lecithin, significantly different (p < 0.05) than the other treatments. The period between molting (26 days) and molting frequency (Three molting) were not affected by lecithin. Survival was 94% with 0.6 % and
1.0% lecithin, significantly high (p < 0.05) compared to the other treatments that were
between 77% and 61%. The diet without lecithin and 0.3% lecithin resulted in molt death syndrome and incomplete ecdysis syndrome. It is recommended to use a minimum of 0.6% of lecithin in the diet of C. caementarius males.
Keywords: Cryphiops; growth; survival; soy lecithin: moult.
1. Introducción
La lecitina de soya es una mezcla de fosfolípidos que contiene en mayor cantidad fosfatidilcolina, seguida por fosfatidilserina, fosfatidiletanolamina y fosfatidilinositol; además, proteínas y carbohidratos en pequeñas cantidades (Tamargo-Santos et al., 2011). La lecitina de soya es un producto natural que se utiliza en la industria alimentaria y farmacéutica, así como en la nutrición y salud humana (Torres y Durán, 2015; Cala et al., 2017).
En especies acuáticas, la lecitina de soya actúa como componente lipídico en dietas para peces (Seiedzadeh et al., 2016) y crustáceos tanto para crecimiento (Kanazawa et al., 1985; Teshima et al., 1986; Cruz et al., 1996) como para reproducción (Sui et al., 2009).
El requerimiento de lecitina de soya para crecimiento y para mantener alta supervivencia varía según el organismo acuático. En crustáceos marinos como la langosta Homarus americanus requiere 8% y 15% de lecitina en la dieta (Conklin et al., 1980; D'Abramo, 1981), en Litopenaeus vannamei entre 0,5% y 7% (Parra, 1997; Gong et al., 2001; Re-Araujo y Acosta, 2003; Beiping et al., 2011) y Penaeus monodon entre 1% y 6% (Briggs et al., 1994; Paibulkichakul et al., 1998). Pero en crustáceos de agua dulce como en postlarvas y juveniles de Macrobrachium rosenbergii. La lecitina, en una dieta semi purificada, no es esencial para la supervivencia y el crecimiento (Hilton et al., 1984; Briggs et al., 1988), aunque el requerimiento de fosfolípidos en la especie puede ser dependiente de la edad (D’Abramo, 1998).
La muda es un proceso altamente complejo que requiere coordinación precisa para tener éxito (Chang y Mykles, 2011) y que los crustáceos lo realizan durante toda su vida para desarrollo, crecimiento y reproducción. En Cryphiops caementarius se consideran los estados de postmuda (A y B), intermuda (C), premuda (D) y culmina con la ecdisis (E) que es una etapa muy breve donde el cuerpo sale del exoesqueleto antiguo por la abertura dorsal entre el cefalotórax y el primer segmento abdominal, primero sale la parte anterior conjuntamente con los apéndices y periópodos y después sale el abdomen y telson (Reyes y Luján, 2003). Sin embargo, la ecdisis es una etapa de riesgo para los crustáceos porque una vez iniciada la fase activa ésta debe ser completada o el animal muere (Phlippen et al., 2000).
La deficiencia de lecitina en la dieta ocasiona, en H. americanus, el síndrome de muerte por muda, dificultad para liberarse del antiguo exoesqueleto durante la ecdisis, apéndices cefalotorácicos deformes y otros mueren poco después de la ecdisis (Concklin et al., 1980; Browser y Rosemark, 1981; D’Abramo et al., 1982). En M. rosenbergii, la deficiencia de lecitina en la dieta no causa algún signo del síndrome de muerte por muda o alguna otra anormalidad nutricional relacionado con esta patología (Hilton et al., 1984; Briggs et al., 1988). Sin embargo, en adultos machos del camarón de río C. caementarius se informó que la dieta sin lecitina ocasiona el síndrome de muerte por muda y el síndrome de la ecdisis incompleta, y que con el uso de 1% de lecitina se evitó estas patologías (Reyes, 2016). Estos estudios demuestran que C. caementarius requiere de lecitina en la dieta, pero no se conoce el nivel adecuado de lecitina en la dieta para adultos de la especie.
El camarón C. caementarius se distribuye desde el río Taymi-Mochumi en Lamba yeque al Norte del Perú (Méndez, 1981) hasta el río Maipo al Norte de Chile (Jara, 1997) y es la única especie que soporta extracción comercial, desde hace más de 50 años, en los ríos Ocoña, Majes-Camaná y Tambo en Arequipa, Perú (Zacarías y Yépez, 2008) que en el 2015 alcanzó 1042 t (PRODUCE, 2016) con el cual se abastece al mercado de Lima. Por ello, el interés por cultivar la especie ha conllevado a diversas investigaciones nutricionales como el uso de dietas con diferentes niveles de proteínas que mejoran el crecimiento de juveniles (Ayvar, 1982), el balance energético de dietas (Zúñiga y Ramos, 1987), el uso de ensilado (Rubio, 2010), así como el cultivo de postlarvas en alta densidad (Cano et al., 2014) y de adultos en recipientes individualizados (Reyes, 2016), entre otros.
Por consiguiente, el objetivo fue evaluar el efecto de dietas con bajas concentraciones de lecitina de soya en el crecimiento, muda y supervivencia de machos de C. caementarius.
2. Materiales y métodos
Los camarones machos se recolectaron del río Pativilca cerca del Centro Poblado Huayto (10º39'50'' S, 77º40'02'' O) a 352 msnm (Barranca, Lima). Los camarones se transportaron individualmente en vasos de plástico de 200 mL (los vasos se agujerearon para permitir el flujo de agua) acondicionados dentro de recipientes de plástico de 20 L (3 camarones L-1), con agua del mismo río y aireación continua. El transporte terrestre duró 5 h y no hubo mortalidad. Los camarones de la especie C. caementarius se reconocieron con clave taxonómica (Méndez, 1981), luego los camarones machos se diferenciaron por la presencia de gonóporos en los coxopoditos del quinto par de periópodos. Los camarones se aclimataron durante 10 días en los mismos vasos del sistema de transporte y se alimentaron con balanceado desde el tercer día de aclimatación. El sistema de cultivo consistió de 12 acuarios de vidrio (0,60 m de largo; 0,31 m de ancho y 0,35 m de alto, con área de 0,186 m2 y volumen efectivo de 55 L), cada uno con un filtro biológico percolador (2,5 L) cuyo lecho filtrante de dos capas fue de conchuela triturada y grava, en iguales proporciones, y el flujo de agua fue de 1,5 L min-1. Dentro de cada acuario se instalaron seis recipientes (19 cm de diámetro y 284 cm2) para cultivo individual del camarón, que se dispusieron en dos grupos de tres niveles. En cada recipiente se colocó un tubo PVC de 1,27 cm de diámetro, que sobresalió el nivel del agua y por donde se introdujeron los gránulos de alimento. Se empleó agua potable previamente declorada con aireación vigorosa durante 72 h.
La dieta basal fue la formulada por Reyes (2016) modificada por Terrones (2016) por inclusión de 50% de harina de ensilado biológico de partes blandas de Argopecten purpuratus, y suplementada con 3% de levadura Saccharomyces cerevisiae según Cornejo et al. (2015). Se emplearon dos dietas experimentales (0,3% y 0,6% de lecitina), un control negativo (sin lecitina) y un control positivo (1% de lecitina) con tres repeticiones, respectivamente (Tabla 1). Se empleó lecitina de soya comercial en cápsulas blandas (contenido de fosfatídicos ≥ 60%). El análisis proximal de las dietas (Tabla 1) consistió de proteínas, grasas, cenizas y humedad (AOAC, 2000). La ración diaria (08:00 y 19:00 h) fue del 5% del peso húmedo por camarón, durante seis días a la semana.
Se emplearon 72 camarones machos (4,80 cm de longitud total y 6,5 g de peso húmedo) con apéndices cefalotorácicos completos y sin signos de laceraciones en el cuerpo, seleccionados al azar de un lote de 120 ejemplares. En cada recipiente de cultivo se sembró un camarón y en total se sembraron seis camarones por acuario (32 camarones m-2).
El experimento duró 90 días. El peso húmedo de los camarones se determinó en balanza digital ADAM AQT 600 (± 0,1 g). La longitud total (LT = Escotadura post orbital hasta el extremo posterior del telson) se midió con vernier (± 0,05 mm) con los camarones posicionados ventralmente. Todos los camarones se muestrearon cada 15 días y las variables zootécnicas fueron crecimiento absoluto (CA), ganancia por centual (GP), tasa de crecimiento absoluto (TCA), tasa de crecimiento específica (TCE) (El-Sherif y Ali, 2009), supervivencia (S) y Rendimiento (R) (Reyes, 2016):
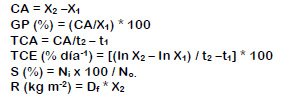
Donde X1 y X2 es el peso húmedo (g) o la longitud total (cm), inicial y final; t1 y t2 es la duración en días; ln X1 y ln X2 el logaritmo natural del peso o la longitud inicial y final; No es el número inicial de camarones; Ni el número final de camarones; Df es la densidad final.
El estado del ciclo de muda de los camarones se evaluó según la descripción de Reyes y Luján (2003), además el período entre mudas y la frecuencia de mudas se determinó por observación directa, a través de los recipientes transparentes, de los exoesqueletos expulsados después de la ecdisis de los camarones.
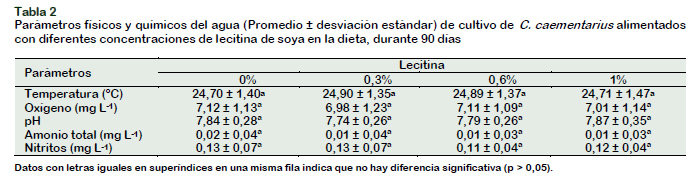
Los desechos sólidos que salieron de los recipientes se extrajeron con sifón una vez por semana. El registro de parámetros físicos y químicos del agua fue realizado cada 15 días y se midió oxígeno disuelto y temperatura con un Oxímetro digital Sension8 (± 0,01 mg L-1; ± 0,01ºC), el pH con un pH-metro digital 110 (± 0,01 unidades), amonio total y nitritos a través del Test colorimétricos Nutrafin (± 0,05 mg L-1). Se empleó el diseño estadístico completamente al azar. La normalidad de los datos se determinó con la prueba de Kolmogorov-Smirnov. Las diferencias entre las medias de los tratamientos se determinaron por análisis de varianza simple y con la prueba de Duncan, en todos los casos con significancia de α = 0,05. El procesamiento estadístico de los datos se realizó con el programa SPSS versión 23 para Windows.
3. Resultados y discusión
El sistema de cultivo individualizado de C. caementarius evitó la interacción física y el canibalismo entre camarones; y además, los parámetros físicos y químicos del agua de cultivo de C. caementarius no mostraron diferencias significativas (p > 0,05) entre tratamientos (Tabla 2), lo cual está de acuerdo a lo registrado para el ambiente natural (Zacarías y Yépez, 2008) y a las condiciones de cultivo en laboratorio (Cornejo et al., 2015; Graciano y Vásquez, 2014; Reyes, 2016), por lo que los resultados se debieron a las concentraciones de lecitina en la dieta.
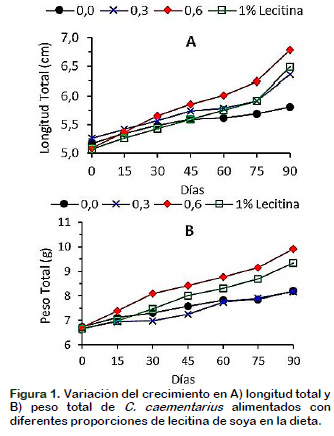
El crecimiento en longitud de C. caementarius fue significativamente (p < 0,05) mayor en los alimentados con diferentes proporciones de lecitina en la dieta, siendo más evidente en aquellos alimentados con 0,6% de lecitina desde los 60 días hasta los 90 días de cultivo (Figura 1A). El crecimiento en peso fue mayor con 0,6% de lecitina después de los primeros 15 días; y a partir de los 75 días fue significativamente similar (p < 0,05) solo con aquellos alimentados con 1,0% de lecitina. Menor crecimiento en peso (p < 0,05) se obtuvo sin lecitina y con 0,3% de lecitina, durante el período de cultivo (Figura 1B). Estos resultados indican que la lecitina favoreció, casi desde un inicio, con el crecimiento en peso del camarón, lo que podría ser consecuencia de la asimilación y transporte de lípidos, como los triglicéridos y el colesterol de la dieta como sucede en P. japonicus (Teshima et al., 1986).
En cambio, en juveniles de M. rosenbergii la lecitina en la dieta (5%) no tuvo efecto en el crecimiento (Briggs et al., 1988), lo que sugiere que el requerimiento de lecitina es especie específica y que los adultos de C. caementarius requieren como mínimo 0,6% de lecitina en la dieta para mejorar el crecimiento en peso, principalmente. Es conveniente investigar los requerimientos de lecitina en los diferentes estados del desarrollo ontogenético de la especie.
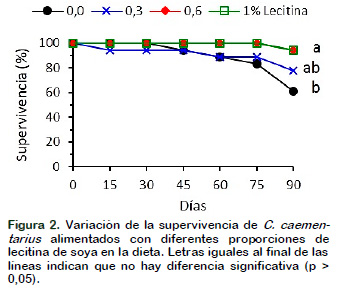
Los parámetros de crecimiento en longitud y peso fueron similares (p > 0,05) en C. caementarius alimentados con 1% y 0,6% de lecitina en la dieta, pero fueron mayores (p < 0,05) a los demás tratamientos. En cambio, los parámetros de crecimiento en peso de los camarones alimentados con 0,6% de lecitina fueron el doble que aquellos con 0% y 0,3% de lecitina (Tabla 3). Estos resultados demuestran que el crecimiento de los camarones adultos incrementa significativamente con el incremento de lecitina en la dieta. El mayor crecimiento de los camarones podría explicarse por el hecho de que las principales fracciones de los fosfolípidos de la lecitina como la fosfatidilcolina y fosfatidilinositol son consideradas como promotoras del crecimiento en crustáceos debido a la mejora de las digestibilidades de los triglicéridos y el colesterol de las dietas (Teshima et al., 1986; Coutteau et al., 1999) donde la fosfatidilcolina ocasiona disminución del contenido total de lípidos, de ácidos grasos libres y de otros fosfolípidos en el hepatopáncreas, mientras que aumenta en el músculo (Gong et al., 2000). En Scylla serrata, el incremento de los niveles de lecitina resulta en el incremento del contenido de lípidos totales y de ácidos grasos esenciales en la dieta, lo que ocasiona rápido desarrollo y crecimiento en peso (Holme et al., 2007). Además, los fosfolípidos de la lecitina interaccionan con diferentes fuentes de proteína de la dieta (D’Abramo, 1998). Todos los camarones C. caementarius alimentados con 1% y 0,6% de lecitina en la dieta supervivieron hasta los 75 días, pero disminuyó hasta 94,44 % a los 90 días de cultivo, porque murió un camarón de una repetición de ambos tratamientos, pero fueron significativamente (p < 0,05) mayores que el control. En cambio, aquellos alimentados sin lecitina y con 0,3% de lecitina en la dieta la supervivencia disminuyó desde los 45 días y 15 días de cultivo, hasta alcanzar los 61,11% y 77,78%, respectivamente (Figura 2).
Los resultados demuestran por primera vez que con 0,6% de lecitina en la dieta se mantiene alta supervivencia al igual que con 1% de lecitina, similar a lo obtenido previamente (>87%) en machos de la misma especie alimentado con 1% de lecitina en la dieta y durante 120 días de cultivo (Reyes, 2016). Sin embargo, la lecitina en la dieta (5%) no tuvo efecto en la supervivencia de juveniles de M. rosenbergii (Briggs et al., 1988). En cambio, en postlarvas de L. vannamei, alta supervivencia (80% y 98%) se obtiene con 1% y hasta con 6,5% de lecitina (Coutteau et al., 1996; Gong et al., 2000; Beiping et al., 2011) y en juveniles se logra moderada supervivencia (>60%) con 0,5% de lecitina (Parra, 1997). En postlarvas de P. monodon, moderada supervivencia (43%) se obtiene con 6% de lecitina (Briggs et al., 1994); en cambio, la supervivencia fue alta (60%) con 1% de lecitina (Paibulkichakul et al., 1998).
Los camarones C. caementarius murieron a causa del síndrome de muerte por muda debido a que no pudieron culminar con la ecdisis debido a que el exoesqueleto antiguo no pudo liberarse por completo del cuerpo, y en otros casos el exoesqueleto se quedó atrapado en los periópodos aun cuando la línea de sutura ecdisial estuvo abierta (Figura 3).
El síndrome de la muerte por muda se presentó en mayor proporción (39% y 23%) en los camarones alimentados sin lecitina y con 0,3% de lecitina, respectivamente, en relación con aquellos alimentados con 0,6% y 1% de lecitina cuyo síndrome se presentó en un camarón de una repetición de cada tratamiento (6%), lo que demuestra que la concentración de 0,3% de lecitina fue insuficiente para evitar la muerte por muda, lo que no sucedió con el uso de 0,6% de lecitina, constituyéndose esta concentración como el mínimo necesario para evitar los problemas con esta forma de muerte de camarones. Reyes (2016) informó que con el uso de 1% de lecitina en la dieta, el síndrome de muerte por muda es mínima (3%) en machos adultos de C. caementarius. Los juveniles de P. japonicus requieren 3% de lecitina para evitar mortalidades (Teshima et al., 1986). En L. vannamei y Panulirus argus el síndrome de muerte por muda es atribuido a deficiencias nutricionales como por deficiencia de colesterol en la hemolinfa (D’Abramo et al., 1981; D’Abramo et al., 1982; Matthews y Maxwell, 2007).
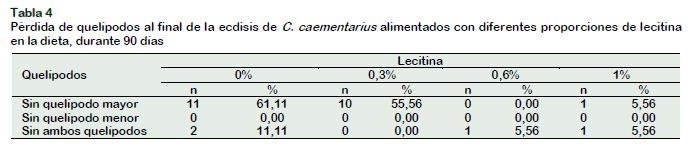
Además, los camarones C. caementarius que no recibieron lecitina en la dieta fueron los que al final del proceso de la ecdisis, el exoesqueleto se quedó atrapado en los quelípodos y en ese estado el camarón, para sobrevivir, realizó autotomía del quelípodo mayor o de ambos quelípodos en mayor proporción (61% y 11%, respectivamente) (Tabla 4). En un estudio previo con machos de la misma especie, la ecdisis con autotomía se presentó hasta en un 22%, cuando la dieta no contiene lecitina (Reyes, 2016). En H. americanus la ausencia de lecitina en la dieta causa fracaso para liberarse del antiguo exoesqueleto (Conklin et al., 1980). Además, elevada proporción (56%) de pérdida del quelípodo mayor por autotomía se presentó en camarones alimentados con 0,3% de lecitina (Tabla 4), lo que demuestra que ésta concentración no fue suficiente para contribuir con el proceso normal de la ecdisis y evitar el atrapamiento de la exuvia y la autotomía de quelípodos. Se conoce que la autotomía de quelípodos afecta el crecimiento en longitud y en peso, como en Cancer productus (Brock y Smith, 1998). En C. caementarius, la pérdida de quelípodos representa entre el 30% y 40% del peso del camarón (Reyes, 2016), que además afecta el crecimiento en peso, porque la regeneración de quelípodos requiere de energía metabólica (Mariappan et al., 2000) y por ello, la regeneración de ambos quelípodos en la especie reduce fuertemente el peso total (-22%) del camarón (Reyes et al., 2017). En cambio, con 0,6% y 1% de lecitina en la dieta, un camarón C. caementarius de una repetición de ambos tratamientos perdieron los quelípodos al final de la ecdisis, que representó el 6% del total de camarones (Tabla 4).
En consecuencia, 0,6% de lecitina en la dieta es el requerimiento mínimo para que la ecdisis de la especie culmine sin inconvenientes y se evite también el síndrome de la ecdisis incompleta. El uso de 1% de lecitina en la dieta también minimiza la aparición del síndrome de la ecdisis incompleta en los camarones machos de la especie (Reyes, 2016), lo que sugiere que la lecitina contribuye con el proceso normal de la ecdisis. Gong et al. (2004) consideraron que los fosfolípidos contribuyen con facilitar el proceso de muda en L. vannamei. De igual manera, Holme et al. (2007) determinaron que la dieta con 4% de lecitina permite que las megalopas de S. serrata muden y mantengan alta supervivencia.
Las diferentes proporciones de lecitina empleadas en la dieta no afectaron significativamente (p > 0,05) el período entre mudas (25,58 ± 1,12 días), ni la frecuencia de mudas (2,97 ± 0,37 mudas) durante 90 días de cultivo de machos adultos de C. caementarius, lo que evidencia que la lecitina en la dieta no tuvo efecto en acelerar el ciclo de muda, pero mejoró el crecimiento, la supervivencia y el proceso de la ecdisis, como se explicó anteriormente. En machos adultos de la misma especie de camarón alimentados con 1% de lecitina, la duración del ciclo de muda fue de 27 días con una frecuencia de tres mudas en 90 días de cultivo (Graciano y Vásquez, 2014) y entre 24 a 32 días (Reyes, 2016).
El rendimiento fue mayor (p < 0,05) en los camarones alimentados con 0,6% (0,304 kg m-2) y 1,0% (0,284 kg m-2) de lecitina, en comparación con los demás tratamientos que presentaron menor rendimiento (<0,200 kg m-2) (Tabla 3). Los mejores rendimientos obtenidos con 0,6% y 1% de lecitina en la dieta se lograron debido a la alta supervivencia y la mínima proporción de pérdida de quelípodos de los camarones, los cuales fueron similares a lo informado previamente en machos de la misma especie al utilizar 1% de lecitina en la dieta cuyos rendimientos fueron de 0,308 kg m-2 (Graciano y Vásquez, 2014) y de 0,374 kg m-2 (Reyes, 2016). Además, es probable que el requerimiento mínimo de lecitina (0,6%) en la dieta contribuirá a disminuir el costo del alimento del camarón. Los resultados de este estudio demostraron que los machos adultos de C. caementarius requieren como mínimo 0,6% de lecitina en la dieta, y que menores concentraciones o la deficiencia de lecitina afectan el crecimiento y ocasionan el síndrome de muerte por muda y el síndrome de la ecdisis incompleta. Diversos estudios sustentan la importancia de la lecitina en la dieta de crustáceos para mejorar la asimilación de lípidos desde el alimento y facilitar el transporte del colesterol desde la hepatopáncreas a la hemolinfa (D’Abramo et al., 1982; Teshima et al., 1986; Baum et al., 1990) donde el colesterol es precursor de la hormona de la muda como la ecdisona (Bonilla-Gómez et al., 2012). Sin embargo, es conveniente investigar el requerimiento de colesterol en la dieta de C. caementarius, porque los juveniles de M. rosenbergii son capaces de realizar la síntesis de colesterol de novo (Teshima et al., 1997), aunque esto no sucede en juveniles de Homarus sp. (D’Abramo et al., 1982), y, además, porque la combinación de fosfolípidos y colesterol mejoran el crecimiento en juveniles de P. monodon (Chen et al., 1993). Postlarvas y juveniles del camarón de agua dulce M. rosenbergii no requieren lecitina en la dieta (Hilton et al., 1984; Briggs et al., 1988); en los camarones marinos el requerimiento de lecitina es mayor, por ejemplo, las postlarvas de P. monodon mejoran su crecimiento con 3% de lecitina y los juveniles con 2% de lecitina (Briggs et al., 1994; Kumaraguru et al., 2005); los juveniles de L. vannamei requieren 1% hasta 5% de lecitina (Gong et al., 2001; Beiping et al., 2011). En el presente estudio, los mejores resultados de crecimiento, muda y supervivencia de machos adultos de C. caementarius se obtuvieron con 1% y 0,6% de lecitina en la dieta. Estos resultados corroboran lo encontrado previamente de 1% de lecitina (Reyes, 2016); además, se demostró por primera vez que los adultos de la especie requieren como mínimo 0,6% de lecitina de soya en la dieta, lo cual es de importancia para disminuir el costo de la dieta para la especie.
4. Conclusiones
El mayor crecimiento en peso y longitud en camarones machos de C. caementarius se obtuvo con 0,6% y 1% de lecitina en la dieta, significativamente diferente (p < 0,05) que los demás tratamientos. El período entre mudas (26 días) y la frecuencia de mudas (tres mudas) no fueron afectados por las concentraciones de lecitina en la dieta. La supervivencia fue de 94% con 0,6% y 1% de lecitina, significativamente alta (p < 0,05) en relación con 0,3% de lecitina y el control (77% y 61%, respectivamente). La dieta sin lecitina y con 0,3% de lecitina ocasionaron el síndrome de muerte por muda y el síndrome de la ecdisis incompleta. Se recomienda emplear un mínimo de 0,6% de lecitina en la dieta de machos de C. caementarius.
Referencias Bibliográficas
AOAC. 2000. Official methods of analyses the association of official analytical chemists. 17th Edition. DC: Washington. EEUU. [ Links ]
Ayvar, F.K. 1982. Pruebas comparativas de raciones balanceadas de diferentes niveles de proteína en la crianza de camarones de río (Cryphiops caementarius) en ambientes cerrados. Tesis de Título. Universidad Nacional Agraria La Molina. Lima, Perú. 56 pp. [ Links ]
Baum, N.; Conklin, D.; Chang, E. 1990. Effect of dietary lecithin in combination with casein or crab protein on cholesterol uptake and transport in the lobster Homarus americanus. Rev. Journal of the World Aquaculture Society 21(4): 277-287. [ Links ]
Beiping, Y.; Kangsen, T.; Qinghui, A.; Zhang, A.; Zheng, S. 2011. Effects of dietary menhaden oil, soybean oil and soybean lecithin oil at different ratios on growth, body composition and blood chemistry of juvenile Litopenaeus vannamei. Aquaculture 19: 460-473. [ Links ]
Bonilla-Gómez, J.L.; Chiappa-Carrara, X.; Galindo, C.; Jerónimo, G.; Cuzon, G.; Gaxiola, G. 2012. Physiological and biochemical changes of wild and cultivated juvenile pink shrimp Farfantepenaeus duorarum (Crustacea: Penaeidae) during molt cycle. Journal of Crustacean Biology 32(4): 597-606. [ Links ]
Briggs, M.R.P.; Jauncey, K.; Brown, J.H. 1988. The cholesterol and lecithin requirements of juvenile prawn (Macrobrachium rosenbergii) fed semipurified diets. Aquaculture 70: 121-129. [ Links ]
Briggs, M.; Brown, J.; Fox, J. 1994. The effect of dietary lipids and lecithin levels on the growth, survival, feed efficiency production and carcass composition of postlarval Penaeus monodon Fabricius. Aquaculture and Fisheries Management 25: 279-294. [ Links ]
Brock, R.E.; Smith, L.D. 1998. Recovery of Claw Size and Function Following Autotomy in Cancer productus (Decapoda: Brachyura). Biological Bulletin 194(1): 53-62. [ Links ]
Browser, P.; Rosemark, R. 1981. Mortalities of cultured lobster, Homarus, associated with a molt death syndrome. Aquaculture 23: 11-18. [ Links ]
Cala, L.; Sánchez, M.E.; García, D.S. 2017. Aspectos farmacológicos de la lecitina de soya y sus posibles aplicaciones médicas. MEDISAN 21(1): 83-95. [ Links ]
Cano, F.; Carrión, S.; Reyes, W. 2014. Efecto de altas densidades de siembra en el crecimiento y supervivencia de postlarvas de Cryphiops caementarius (Crustacea: Palaemonidae) en agua salobre. Revista CITECSA 5(8): 62-78. [ Links ]
Chang, E.S.; Mykles, D.L. 2011. Regulation of crustacean molting: A review and our perspectives. General and Comparative Endocrinology 172: 323–330. [ Links ]
Chen, H.Y. 1993. Requirements of marine shrimp, Penaeus monodon, juveniles for phosphatedylcholine and cholesterol. Aquaculture 109: 165-176. [ Links ]
Conklin, D.; D’Abramo, L.; Bordner, C.; Baum, N. 1980. A successful purified diet for the culture of juvenile lobsters: the effect of lecithin. Aquaculture 21: 243-249.
Cornejo, J.; Pérez, L.; Reyes, W. 2015. Effect of Saccharomyces cerevisiae yeast in the diet of male shrimp Cryphiops caementarius (Crustacea, Palaemonidae) on total and differential hemocytes count. Revista Bio Ciencias 3(3): 173-186. [ Links ]
Coutteau, P.; Camara, M.; Sorgeloos, P. 1996. The effect of different levels and sources of dietary phosphatidylcholine on the growth, survival, stress resistance, and fatty acid composition of postlarval Penaeus vannamei. Aquaculture 147: 261-273. [ Links ]
Coutteau, P.; Geurden, I.; Kontara, E.; Camara, M.R.; Sorgeloos, P. 1999. Revisión de los efectos de fosfolípidodos dietarios en dietas para acuicultura. En: Cruz, L.E.; Ricque, D.; Mendoza, R. (Comp.). Avances en Nutrición Acuícola III. Memorias del Tercer Simposio Internacional de Nutrición y Tecnología de Alimentos. 1999. 11-13 noviembre, 1996. Monterrey, N.L., México. Universidad Autónoma de Nuevo León. Monterrey, N.L. México. Pp. 135-154. [ Links ]
Cruz, L.; Ricque, D.; Dominguez, V. 1996. Utilización de la lecitina de soya en la nutrición acuícola: crustáceos. American Society of Agronomy (ASA). Pp. 34. [ Links ]
D’Abramo, L.R.; Bordner, C.E.; Conklin, D.E.; Baum, N. 1981. Essentiality of dietary phosphatidylcholine for the survival of juvenile lobster. Journal Nutrition 111: 425-431.
D’Abramo, L.R.; Bordner, C.E.; Conklin, D.E. 1982. Relationship between dietary phosphatidylcholine and serum cholesterol in the lobster Homarus sp. Marine Biology 67: 231-235.
D’Abramo, L.R. 1998. Nutritional requirements of the freshwater prawn Macrobrachium rosenbergii: Comparisons with species of penaeid shrimp. Reviews in Fisheries Science 6 (1-2): 153-163.
El-Sherif, M.; Ali, A. 2009. Effect of rearing systems (mono-and poly-culture) on the performance of freshwater prawn (Macrobrachium rosenbergii) juveniles. Journal of Fisheries and Aquatic Science4(3): 117-128. [ Links ]
Graciano, F.; Vásquez, J. 2014. Efecto de diferentes niveles de dureza del agua en la muda, crecimiento y supervivencia de adultos de Cryphiops caementarius, en condiciones de laboratorio. Tesis de Título. Universidad Nacional del Santa. Nuevo Chimbote. Perú. 73 pp. [ Links ]
Gong, H.; Lawrence, A.; Jiang, D.H.; Gatlin, D. 2000. Lipid nutrition of juvenile Litopenaeus vannamei. II. Active components of soybean lecithin. Aquaculture 190: 325–342. [ Links ]
Gong, H.; Jiang, D.H.; Lawrence, A.; Gatlin, A.; Zhang, H. 2001. Comparison of different types and levels of commercial soybean lecithin supplemented in semipurified diets for juvenile Litopenaeus vannamei Boone. Aquaculture Nutrition 7: 1117. [ Links ]
Gong, H.; Jiang, D.H.; Lightner, D.V.; Collins, C.; Brock, D. 2004. A dietary modification approach to improve the osmoregulatory capacity of Litopenaeus vannamei cultured in the Arizona desert. Aquaculture Nutrition 10: 227–236. [ Links ]
Hilton, J.; Harrison, K.; Slinger, S. 1984. A semipurified test diet for Macrobrachium rosenbergii and lack of need supplemental lecithin. Aquaculture 37: 209-215. [ Links ]
Holme, M.H.; Southgate, P.C.; Zeng, C. 2007. Assessment of dietary lecithin and cholesterol requirements of mud crab, Scylla serrata, megalopa using semi-purified microbound diets. Aquaculture Nutrition 13: 413–423. [ Links ]
Jara, C. 1997. Antecedentes sobre el desarrollo de la carcinología en Chile. Investigaciones Marinas 25: 245-254. [ Links ]
Kanazawa, A.; Teshima, S.; Sakamoto, M. 1985. Effects of dietary lipids, fatty acids, and phospholipids on growth and survival of prawn (Penaeus japonicus) larvae. Aquaculture 50: 39–49. [ Links ]
Kumaraguru, K.; Ramesh, S.; Balasubramanian, T. 2005. Dietary value of different vegetable oil in black tiger shrimp Penaeus monodon in the presence and absence of soy lecithin supplementation: Effect on growth, nutrient digestibility and body composition. Aquaculture 250: 317– 327. [ Links ]
Mariappan, P.; Balasundaram, C.; Schmithz, B. 2000. Decapod crustacean chelipeds: an overview. Journal Bioscience 25(3): 301-313. [ Links ]
Matthews, T.R.; Maxwell, K.E. 2007. Growth and mortality of captive caribbean spiny lobsters, Panulirus argus, in Florida, USA. Gulf and Caribbean Fisheries Institute. Pp. 358-366. [ Links ]
Méndez, M. 1981. Claves de identificación y distribución de los langostinos y camarones (Crustacea: Decapoda) del mar y ríos de la costa del Perú. Boletín Instituto del Mar Perú 5: 1-170. [ Links ]
Paibulkichakul, C.; Piyatiratitivorakul, S.; Kittakoop, P.; Viyakarn, V.; Fast, A.; Menasveta, P. 1998. Optimal dietary levels of lecithin and cholesterol for black tiger prawn Penaeus monodon larvae and postlarvae. Aquaculture 167: 273–281. [ Links ]
Parra, E. 1997. Evaluación del efecto de dietas sobre el crecimiento de camarón blanco Penaeus vannamei bajo condiciones controladas de laboratorio. Tesis de Maestría. Universidad de Colima. México. 102 p. [ Links ]
Phlippen, M.; Webster, S.G.; Chung, J.S.; Dircksen, H. 2000. Ecdysis of decapods crustaceans is associated with a dramatic release of crustacean cardioactive peptide into the haemolymph. The Journal Experimental Biology 203: 521-536. [ Links ]
PRODUCE (Ministerio de la producción). 2016. Anuario estadístico pesquero y acuícola 2015. Ministerio de la Producción del Perú. p. 29. [ Links ]
Re-Araujo, A.D.; Acosta, M.J. 2003. Ensayo de diferentes lecitinas en la dieta de juveniles de Penaeus vannamei (Crustacea: Decapoda). Revista Biología Tropical 51(3): 743-748. [ Links ]
Reyes, W.; Lujan, H. 2003. Estados y subestados del ciclo de muda del camarón de río (Cryphiops caementarius Molina, 1872) (Crustacea, Decapoda, Palaemonidae). En: Memorias II Congreso Iberoamericano Virtual de Acuicultura CIVA. 1 sept.-30 nov., 2003. Zaragoza, España. Pp. 808-817. [ Links ]
Reyes, W. 2016. Effect of culture container on the survival and growth of male Cryphiops caementarius in individualized systems. Revista BioCiencias 3(4): 311-325. [ Links ]
Reyes, W.; Terrones, S.; Baltodano, I. 2017. Effects chelipeds regeneration in molting and growth of male Cryphiops caementarius Molina 1782 (Decapod, Palaemonidae). Revista Bio Ciencias 4(4): 1-18. [ Links ]
Rubio, L. 2010. Coeficiente de digestibilidad proteica de dos tipos de ensilado, en juveniles de "camarón de río" Cryphiops caementarius (Molina, 1872) (Crustacea: Decapoda: Palaemonidae), en condiciones de laboratorio. Tesis de Título. Universidad Nacional del Santa, Nuevo Chimbote. Perú. 38 pp. [ Links ]
Seiedzadeh, S.M.; Yavari, V.; Mohammadiazarm, H.; Mousave, M. 2016. Lecithin effects on blood biochemical parameters and resistance to thermal stress in juvenile of Mesopotamichthys sharpeyi (Cyprinidae family). Iranian Journal of Fisheries Sciences 15(4): 14551464. [ Links ]
Sui, L.Y.; Wu, X.G.; Wille, M.; Cheng, Y.X.; Sorgeloos, P. 2009. Effect of dietary soybean lecithin on reproductive performance of Chinese mitten crab Eriocheir sinensis (H. Milne-Edwards) Broodstock. Aquaculture International 17:45–56. [ Links ]
Tamargo-Santos, B.; Herrera-Belen, E.; Bello-Alarcón, A.; Cuellar, A.; González-Rodríguez, H.; SierraGonzález, G.; Morales-González, M.; Ortiz-Zamora, L. 2011. Obtención de fosfolípidos a partir de lecitina de soya (Glicina max L), para usos biomédicos. Revista Cubana de Química 23(3): 5-14. [ Links ]
Terrones, S.I. 2016. Efectos de dietas con harina de ensilado biológico de residuos blandos de Argopecten purpuratus como sustituto parcial de la harina de pescado en el crecimiento de Cryphiops caementarius en cocultivo con Oreochromis niloticus. Tesis de Título. Universidad Nacional del Santa. Nuevo Chimbote. Perú. 36 pp. [ Links ]
Teshima, S.I.; Kanazawa, A.; Kakuta, Y. 1986. Effects of dietary phospholipids on lipid transport in the juvenile prawn. Bull. Jap. Soc. Sc. Fish. 52: 159-163. [ Links ]
Teshima, S.I.; Ishikawa, M.; Koshio, S.; Kanazawa, A. 1997. Necessity of dietary cholesterol of the freshwater prawn. Fisheries Science 63(4): 596-599. [ Links ]
Torres, J.; Durán, S. 2015. Fosfolípidos: propiedades y efectos sobre la salud. Nutrición Hospitalaria 31(1): 76-83. [ Links ]
Zacarías, S.; Yépez, V. 2008. Monitoreo poblacional del camarón de río. Estimación de abundancia de adultos en ríos de la costa centro sur. Informe anual 2007. Instituto del Mar del Perú. 34 pp. [ Links ]
Zúñiga, O.; Ramos, R. 1987. Balance energético en juveniles de Cryphiops caementarius (Crustacea, Palaemonidae). Biota 3: 33-43. [ Links ]
* Corresponding author
E-mail: wreyes_avalos@hotmail.com (W. Reyes).
Received September 1, 2017.
Accepted February 24, 2018.