Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.1 Trujillo ene./mar. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.01.16
SHORT COMMUNICATION
Reporte de una segunda introducción de peces ornamentales transgénicos fluorescentes al territorio peruano: Caso pez Monjita (Gymnocorymbus ternetzi; Boulenger, 1895)
Report of a second introduction of fluorescent transgenic ornamental fish to Peruvian territory: Skirt tetra fish case (Gymnocorymbus ternetzi; Boulenger, 1895)
Carlos Scotto Espinoza
Laboratorio de Mejora Genética y Reproducción Animal. Facultad de Ciencias Naturales y Matemática de la Universidad Nacional Federico Villarreal. Jirón Río Chepén s/n. El Agustino. Lima. Peru.
Resumen
Se reporta la presencia de una línea transgénica de peces Monjita fluorescentes rojos (Gymnocorymbus ternetzi) introducidos al territorio peruano. Donde se identificó su fluorescencia con luz UV y se amplificó por PCR el mismo grupo de primers utilizado para identificar peces Cebra fluorescentes rojos (Danio rerio) junto con controles negativos del pez Cebra sin el transgen RFP y del pez Medaka (Oryzias latipes) transgénico con un transgen GFP que no amplificaron. Sin embargo, tanto el pez Monjita blanco y negro sin el transgen RFP como el pez Monjita transgénico de color rojo fluorescente con RFP no amplificaron ninguna banda. Evidenciándose una nueva variante del gen de la proteína fluorescente roja utilizados para obtener peces Monjitas fluorescentes rojos distinta a la utilizada para generar peces Cebra transgénico fluorescentes.
Palabras clave: Gymnocorymbus ternetzi; fluorescencia; RFP; transgénico.
Abstract
Where their fluorescence was identified with UV light and the same group of primers used to identify red fluorescence zebrafish (Danio rerio) together with negative controls of the zebrafish without the RFP transgene and the transgenic Medaka (Oryzias latipes) fish were amplified by PCR a GFP transgene that they did not amplify. However, both the white and black skirt tetra fish without the RFP transgene and the fluorescent red transgenic skirt tetra fish with RFP did not amplify any bands. A new variant of the red fluorescent protein gene used to obtain red fluorescent skirt tetra fish other than the one used to generate transgenic zebrafish fluorescens.
Keywords: Gymnocorymbus ternetzi; fluorescence; RFP; transgenic.
1. Introducción
El pez Monjita pertenece a la Familia de los Carácidos (Characidae) de la Orden de los Characiformes. Es una especie nativa de la cuenca Amazónica y del Orinoco. Es una especie muy popular en acuariofilia. A medida que se desarrolla y hasta el año que alcanzan la madurez su color negro se va tornando en un gris ahumado con tonos aceitunados y blan-quecinos en el vientre. Llega a medir 5,5 cm. Y vive a temperaturas de 20 a 26 ºC. Es una especie muy prolífera y fácil de reproducir (Aquanovel, 2017).
A principios del año 2 000 se obtuvieron a nivel mundial los primeros peces ornamentales transgénicos con fluorescencia verde o GFP (Green Fluorescent Protein) y con fluorescencia roja o RFP (Red Fluorescent Protein) por la inserción de genes de organismos marinos como medusas y poríferos (Gong et al., 2003; Wan et al., 2002).
Actualmente se generan por microinyección de plásmidos que contienen la construcción sintética con los transgenes GFP o RFP controlados por el promotor mylz2 en embriones de 2 a 4 células (Qing et al., 2012). Así, Pan y colaboradores (2008) obtuvieron por primera vez peces Monjitas fluorescentes rojos (Gymnocorymbus ternetzi).
Actualmente, se han obtenido diversos peces ornamentales cuyos linajes son muy estables y se ha confirmado la herencia mendeliana de éstos transgenes al ser hibridizados entre sí (Ofelio et al., 2012; Mohanta et al., 2014).
En el año 2006, fue reportado por primera vez la introducción al Perú de peces cebras transgénicos fluorescentes (Danio rerio) por Scotto (2016). Y en el año 2013, Scotto y Serna (2013) identificaron molecular-mente la presencia de la proteína fluores-cente roja (RFP) en especímenes de D. rerio fluorescentes de color rojo. Actual-mente y hasta el año 2021 en el Perú se tendrá una Ley de Moratoria que regulará el ingreso de organismos transgénicos a territorio peruano (Ley Nº 29811, 2011).
Actualmente, aún existe una incertidumbre sobre su posible impacto ambiental ante la falta de un análisis de riesgos pertinente por la introducción, reproducción e hibri-dación (flujo génico) descontrolada de este pez con sus parientes nativos. Así, el objetivo de este trabajo fue identificar la fluorescencia roja en peces Monjita orna-mentales transgénicos y hacer una iden-tificación molecular del transgen RFP probado en D. rerio.
2. Materiales y métodos
En el año 2016, se adquirieron peces Monjita con fluorescencia roja y blancos no fluorescentes vivos obtenidos de los acua-rios locales de la ciudad de Lima Metro-politana y fueron llevados al Laboratorio de Mejora Genética y Reproducción Animal de la Facultad de Ciencias Naturales y Mate-mática de la Universidad Nacional Federico Villarreal para su crianza y manutención. Se utilizó un transiluminador UV de 400 nm de longitud de onda a los cuales fueron expuestos los peces Monjita para evidenciar la presencia de fluorescencia corporal o no. Para la extracción de ADN se realizó utilizando el kit DNeasy Blood & Tissue Kit de Qiagen y para lo cual se utilizó parte del musculo dorsal del pez. El tejido muscular colectado fue colocado en un tubo ependorff de 1,5 ml estéril, donde inmediatamente se procesó en el labo-ratorio. Las muestras fueron corridas en un gel de agarosa al 1% para observar la calidad del ADN extraído, luego se cuantificó por espectrofotometría obte-niéndose sus concentraciones y cada muestra fue diluida a una concentración de 20 ng/µl. Se trabajó con una concentración de 40 ng/µl de cada muestra, 1um para los primers, 2µm de MgCl2, 2,5 de dNTPs y 0,05 µ/µl de Taq HotStar de Qiagen. Las condiciones de ciclaje para el PCR fueron las siguientes: Activación inicial de 15 minutos a 95 °C, 35 ciclos de 1 minuto a 94 °C, 1 minuto a 64 °C y minuto a 72 °C seguido por una extensión final de 10 minutos a 72 °C. El producto amplificado fue analizado mediante una electroforesis en geles de agarosa al 1,5%. Se utilizó un marcador de peso molecular de 50 pb. Para determinar la presencia del posible transgen RFP, se sintetizaron cebadores específicos para dicho transgen tomando como referencia la pareja de cebadores reportado por Rehbein y Bogerd (2007) con las siguientes secuencias:
5’-ACAACACCGTGAAGCTGAAGGTGACCAAG-3’ y 5’-GGTGTAGTCCTCGTTG TGGGAGGTGATGTC-3’.
Se utilizaron como muestra de control positivo el ADN de peces Cebra (Danio rerio) rojo fluorescente que dieron positivo (Scotto, 2013). Y como controles negativos muestras de ADN de pez Cebra sin fluorescencia de color gris y del pez Medaka (Oryzias latipes) transgénico con fluorescencia verde. Y como control de calidad de la amplificación por PCR se utilizó la betactina para todas las muestras amplificadas.
3. Resultados y discusión
Los peces Monjitas de color rojo expuestos a luz UV presentaron la fluorescencia roja confirmándose cualitativamente su transgénesis por la presencia del transgen de la RFP. Como control negativo se utilizaron peces cebras silvestres blancos y negros. Los cuales no dieron ninguna fluorescencia o coloración con la luz ultravioleta (Figura 1).
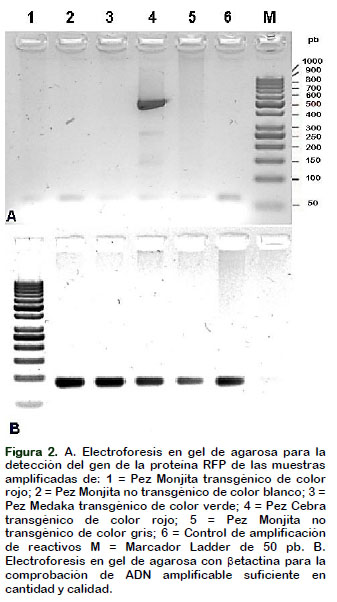
La corrida electroforética solo presentó un producto de amplificación de 505 nucleótidos como banda única el pez Cebra transgénico de color rojo y acorde con los reportes de Rehbein y Bogerd (2007) y Scotto (2013). Los controles negativos del pez Cebra de color gris sin el transgen RFP no evidencio banda alguna. Del mismo modo, el pez Medaka (Oryzias latipes) transgénico con un transgen GFP tampoco amplificó. Asimismo, el pez Monjita blanco sin fluorescencia no presentó ninguna banda amplificada. Sin embargo, tampoco el pez Monjita transgénico de color rojo fluorescente no amplifico ninguna banda (Figura 2).
A medida que se dan los avances biotec-nológicos, se propondrán para la gene-ración de nuevos peces transgénicos a futuro, mejorando la eficiencia y efectividad de los métodos actuales utilizando nuevos vehículos de administración de genes. De hecho, algunos peces transgénicos comestibles y ornamentales ya están disponibles en el mercado actual, lo que valida los esfuerzos continuos para mejorar económicamente especies importantes (Tonelli et al., 2017).
Mundialmente la estrategia consistirá en dar mayor valor agregado a los peces ornamentales mediante el desarrollo de nuevas variantes de colores fluorescentes. usando diferentes genes de color. Actual-mente, existen líneas estables de peces Cebra (D. rerio) transgénicos que expresan varias proteínas de color vivo como son: GFP, RFP, YFP, BFP y CYP. También se ha utilizado con éxito para generar fluores-cencia en el pez Monjita (Gymnocorymbus ternetzi), pez Medaka (Oryzias latipes), Barbo tigre (Puntius tetrazona), Pez ángel o escalar (Pterophyllum scalare), Cíclido convicto (Amatitlania nigrofasciata) y otros (Mohanta et al., 2014; Pan et al., 2008; Scotto, 2016).
Rasal et al. (2016) plantean el uso de peces transgénicos estériles para evitar la conta-minación y el flujo génico. Este pez auto-transgénico debe ser producido siguiendo los principios de los Protocolos de Carta-gena y las reglas de bioseguridad. Donde los riesgos asociados al uso de OVM´s debe analizarse y cuantificarse de forma más sensata y confiable. La acuicultura debería adoptar peces transgénicos estériles para reducir el riesgo de la biodiversidad. Todo esto está desatando discusiones sobre los potenciales problemas ecológicos, éticos y de bioseguridad asociados con su trans-genia en la sociedad, debido a que los principales generadores de peces transgé-nicos fluorescentes de Asia y de USA no comparten su biotecnología por temas comerciales y patentes generando vacíos en la forma que se obtuvieron estos peces; que luego son comercializados a países que no los poseen e incluso donde cuentan con especies acuáticas emparentadas como el caso del Gymnocorymbus ternetzi que es una especie nativa en el Perú y de la cuenca Amazónica.
4. Conclusiones
La secuencia de RFP útil para identificar al pez Cebra transgénico fluorescente rojo con el transgen RFP no es efectiva para identificar molecularmente al pez Monjita transgénico fluorescente rojo con el transgen RFP, pues debe poseer variantes en la secuencia nucleotídica que deberán ser identificados, secuenciados y estandarizadas para generar protocolos adecuados para su identificación molecular a nivel de laboratorio de esta especie hidrobiológica modificada genéticamente. Si bien la tecnología basada en la inserción de proteínas fluorescentes de "Colores" para generar nuevas variedades o líneas de diversos peces ornamentales transgénicos estables está en auge creciente en el acuarismo mundial, las publicaciones cien-tíficas son muy escasas o no están dispo-nibles. Y el tipo de constructor utilizado y el mecanismo de introducción de los transgenes fluorescentes no son de dominio público. Lo cual dificulta el empleo de métodos de detección molecular de los mismos y poder así generar una vigilancia y fiscalización efectiva sobre la liberación accidental o deliberada de estos organismos hidrobiológicos modificados por ingeniería genética. Por lo tanto, se recomienda para esté segundo movimiento transfronterizo de peces fluorescentes como el pez Monjita transgénico a territorio peruano e incluso con otras especies de peces ornamentales y diseñar nuevos tipos de primers específicos para la identificación precisa de ellos; así como obtener sus secuencias nucleotídicas respectivas de los amplificados.
Nota: El presente estudio ha cumplido con las normas éticas internacionales para la investigación de animales aplicando las 3 Rs de Russell y Burch (1959).
Agradecimientos
Un agradecimiento sincero al Dr. Hernán Ortega, Profesor Principal de la Universidad Nacional Mayor de San Marcos y Curador de la Colección Ictiológica del Museo de Historia Natural del Perú. Por su apoyo en la identificación de la especie del pez ornamental Gymnocorymbus ternetzi.
Referencias Bibliográficas
Aquanovel (Revista y comercio online). 2017. En: http://aquanovel.com/index.htm
Gong, Z.; Wan, H.; Leng, Tay.; Wang, H.; Chen, M.; Yan, T. 2003. Development of transgenic fish for orna-mental and bioreactor by strong expression of fluorescent proteins in the skeletal muscle. Biochemical and Biophysical Research Communi-cations 308: 58–63. [ Links ]
Ley Nº 29811. 2011. Moratoria al ingreso y producción de organismos vivos modificados al territorio nacional por un período de 10 años. Diario Oficial El Peruano. 454601.
Mohanta, R.; Jayasankar, P.; Das Mahapatra, K.; Nath Saha, J.; Kumar Barman, H. 2014. Molecular cloning, characterization and functional assess-ment of the myosin light polypeptide chain 2 (mylz2) promoter of farmed carp, Labeo rohita. Transgenic Res 23: 601–607. [ Links ]
Ofelio, C.; Cariani, A.; Trentini, M.; Guarniero, I. 2012. Novel PCR-based assay for rapid identification of Red Fluorescent Proteins in GloFish and GloFish x wildtype zebrafish (Danio rerio) hybrids. Italian Journal of Zoology 79(4): 541-546. [ Links ]
Pan, X.; Zhan, H.; Gong, Z. 2008. Ornamental Expression of Red Fluorescent Protein in Transgenic Founders of White Skirt Tetra (Gymnocorymbus ternetzi). Marine Biotechnology 10: 497–501. [ Links ]
Qing, J., Chen, M., Bai, D., Jiang, P., Fan, J., Ye, X. & Xia, S. 2012. Generation and characterization of a stable red fluorescent transgenic Tanichthys albonubes line. African J. of Biotechnology 11: 7756-7765. [ Links ]
Rasal, K.; Chakrapani1, V.; Patra1, S.; Ninawe, A.; Sundaray, J.; Jayasankar, P.; Barman, H. 2016. Sta-tus of Transgenic Fish Production with Emphasis on Development of Food Fishes and Novel Color Varieties of Ornamental Fish: Implication and Future Perspectives. J. FisheriesSciences.com 10: 52-65. [ Links ]
Rehbein, H.; Bogerd, J. 2007. Identification of Genetically Modified Zebrafish (Danio rerio) by Protein- and DNA-Analysis. J. fur Verbracherschutz und Lebensmittelsicherheit. 2: 122-125. [ Links ]
Russell, W. M. S and Burch, R. L. 1959. The principies of humane experimental technique. Methuen, London. UK. [ Links ]
Scotto, C.; Serna, F. 2013. Primera identificación molecular del transgén de la proteína fluorescente roja (RFP) en peces Cebra (Danio rerio) trans-génicos ornamentales introducidos en el Perú. Scientia Agropecuaria 4: 257–264. [ Links ]
Scotto, C. 2016. Una casuística de peces transgénicos fluorescentes (Danio rerio) liberados en ambientes naturales peruanos con condiciones térmicas similares a su centro de origen. The Biologist 14(1): 129-141. [ Links ]
Tonelli, F.; Lacerda, S.; Tonellia, F.; Costa, G.; Françac, L.; Resende, R. 2017. Progress and biotech-nological prospects in fish transgenesis. Biotechnology Advances 35: 832–844. [ Links ]
Wan, H.; He, J.; Ju, B.; Yan, T.; Lam, T.J.; Gong, Z. 2002. Generation of Two-color Transgenic Zebrafish Using the Green and Red Fluorescent Protein Reporter Genes GFP and RFP. Marine Bio-technology 4: 146-154. [ Links ]
* Corresponding author
E-mail: carlosscottoespinoza@gmail.com (C. Scotto).
Received October 24, 2017.
Accepted March 11, 2018.