Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Scientia Agropecuaria
Print version ISSN 2077-9917
Scientia Agropecuaria vol.9 no.2 Trujillo Apr./Jun. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.02.01
ARTÍCULOS ORIGINALES
Efecto de dietas con ensilado biológico de residuos de molusco en el crecimiento del camarón Cryphiops caementarius y tilapia Oreochromis niloticus en co-cultivo intensivo
Effect of diets with biological silage of mollusk residues on the growth of shrimp Cryphiops caementarius and tilapia Oreochromis niloticus in intensive co-culture
Shirley Terrones España1; Walter Reyes Avalos2,*
1 Escuela de Biología en Acuicultura. Facultad de Ciencias. Universidad Nacional del Santa, Chimbote, Perú.
2 Departamento Académico de Biología, Microbiología y Biotecnología. Facultad de Ciencias. Universidad Nacional del Santa. Avenida Universitaria s/n Urbanización Bellamar, Nuevo Chimbote, Perú.
Resumen
El objetivo fue evaluar el efecto de dietas con ensilado biológico de residuos del molusco bivalvo en el crecimiento del camarón Cryphiops caementarius y tilapia Oreochromis niloticus en co-cultivo intensivo. Se emplearon 72 camarones machos (5,16 ± 0,37 cm de longitud total y 4,78 ± 1,13 g de peso húmedo) y 48 alevines revertidos de tilapia (4,28 ± 0,31 cm de longitud total y 2,86 ± 0,45 g de peso húmedo). Se emplearon tres dietas experimentales (25, 50 y 75% de ensilado) y una dieta control, con tres repeticiones. El ensilado se elaboró de vísceras y mantos del molusco Argopecten purpuratus. El co-cultivo se realizó en 12 acuarios (55 L) implementados con seis recipientes de cultivo individual de camarón (32 camarones m-2), y la tilapia se sembró en el agua restante (22 tilapias m-2). El experimento duró 90 días. El crecimiento del camarón fue similar entre tratamientos. El crecimiento de tilapia fue mayor con 25% y 50% de ensilado. El FCA fue bajo (1,5 a 1,7) en camarón y alto (1,9 a 2,1) en t ilapia, hasta con 50% de ensilado. Dieta con 50% de ensilado es recomendado para machos de camarón, aunque para de tilapia se sugiere ensayar otra dieta.
Palabras clave: Ensilado biológico; cultivo intensivo; crecimiento; camarón; tilapia del Nilo.
Abstract
The aim was to evaluate the effect of diets with biological silage of mollusk residues on the growth of shrimp Cryphiops caementarius and Oreochromis niloticus tilapia in intensive co-culture. Seventy-two male shrimp (5.16 ± 0.37 cm total length and 4.78 ± 1.13 g wet weight) and 48 reversed tilapia fry (4.28 ± 0.31 cm total length and 2.86 ± 0.45 g wet weight). Three experimental diets (25, 50 and 75% of silage) and a control diet were used, with three replicates. The silage was made from viscera and mantles of the mollusk Argopecten purpuratus. The co-culture was carried out in 12 aquariums (55 L) implemented with six individual shrimp culture containers (32 shrimp m-2), and the tilapia was stocked in the remaining water (22 tilapias m-2). The experiment lasted 90 days. Shrimp growth was similar between treatments. The growth of tilapia was greater with 25% and 50% silage. The FCA was low (1.5 to 1.7) in shrimp and high (1.9 to 2.1) in tilapia, up to 50% silage. Diet with 50% silage is recommended for shrimp males, although for tilapia it is suggested to try another diet.
Keywords: Biological silage; intensive culture; growth; shrimp; tilapia of the Nile.
1. Introducción
El cultivo del molusco Argopecten purpuratus (Lamarck, 1819) en Perú, se desarrolla en casi toda la costa, desde la bahía de Sechura en Piura hasta la bahía de Paracas en Ica (Loayza, 2011), cuya producción fue de 23028 t en el 2015 (PRODUCE, 2016). El procesamiento de este molusco produce 15% de residuos húmedos que son fuente de proteínas y de otros nutrientes que se arrojan al ambiente, pero que al ser procesados como ensilados estos rinden el 15% en peso (Encomendero y Uchpa, 2002). Los ensilados de residuos blandos de A. purpuratus son de buena calidad nutricional al poseer entre 43% y 45% de proteína y 6% de lípidos totales (Encomendero y Uchpa, 2002; Alayo y Rojas, 2012; Hurtado, 2017) e incluso son superiores a los ensilados de otros residuos del procesamiento de productos acuáticos (Spanopoulos-Hernández et al., 2010; Bernal-Rodríguez et al., 2013).
Además, en el ensilado biológico, las cepas de bacterias ácido-lácticas transforman la glucosa o melaza de caña en ácido láctico que favorece la proteólisis e inhibe el desarrollo de microorganismos putrefactivos y patógenos (Berenz, 1996) con el cual los nutrientes se encuentran disponibles para asimilación y también hay presencia de bacterias probióticas, respectivamente. En acuicultura, las bacterias de los ensilados son probióticos que modifican la microbiota del tracto gastrointestinal del hospedador y generan compuestos benéficos para el crecimiento y la inmunidad de los organismos que lo consumen (Villamil y Martínez-Silva, 2009).
El camarón Cryphiops caementarius (Molina, 1782) habita en los ríos de la costa peruana (Méndez, 1981) donde la temperatura varía entre 18,1 ºC y 26,5 ºC con un promedio de 20,8 ºC (Llanos, 1980); en cambio en los ríos del norte de Chile la temperatura es menor (Jara, 1997). Sin embargo, las mayores poblaciones de esta especie de camarón se encuentran en los ríos de Arequipa (Perú) desde donde se extrajo 1042 t anuales en el 2015 (Wasiw y Yépez, 2015; PRODUCE, 2016) y por ello la especie tiene importancia económica, comercial y científica. Los estudios nutricionales con la especie se refieren a la digestibilidad aparente de la proteína de la harina de ensilado de pescado (Rubio, 2010), al uso de dietas con lecitina de soya (Acosta y Quiñones, 2016) y levadura (Cornejo et al., 2015). Sin embargo, ningún estudio ha utilizado harina de ensilado de residuos blandos del molusco A. purpuratus en la dieta de la especie de camarón.
La tilapia Oreochromis niloticus (Linnaeus, 1758) es omnívora, cultivada en zonas tropicales y subtropicales de casi todo el mundo, con un rango de 20 ºC a 35 ºC (Alcántar-Vásquez et al., 2014) y acepta diferentes tipos de dietas. Los alevines de la especie logran mayor crecimiento con 50% de ensilado biológico de residuos blandos de A. purpuratus en reemplazo de la harina de pescado (Alayo y Rojas, 2012) cuya digestibilidad fue del 68% (Rodríguez y Minaya, 2013), de igual manera se logra con la adición del 8% de Lactobacillus sp. enriquecido con proteína hidrolizada de vísceras de A. purpuratus (Saldaña, 2011). En cambio, también se utiliza el 30% de ensilado de pescado (Perea et al., 2011).
El cultivo individualizado se utiliza en crustáceos agresivos de los géneros Homarus (Kristiansen et al., 2004), Cherax (Manor et al., 2002) y en C. caementarius (Reyes, 2016), donde se evita el canibalismo. El sistema de co-cultivo del camarón C. caementarius en recipientes individuales dentro de acuarios con tilapia O. niloticus, ya ha sido probado y ambas especies son importantes porque no hay interacción física inter e intraespecífica y se mejora el rendimiento; además, la tilapia utiliza también el alimento que sale de los recipientes del camarón (Reyes, 2012; Mogollón, 2013). De igual manera, sucede en el co-cultivo de O. niloticus en jaulas dentro de estanques con Macrobrachium rosenbergii (Danaher et al., 2007) y en el de O. niloticus en hapas dentro de estanques con Clarias gariepinus (Elegbe et al., 2015). El objetivo fue evaluar el efecto de dietas con diferentes proporciones de harina de ensilado biológico de residuos blandos de A. purpuratus en los parámetros de crecimiento del camarón C. caementarius y tilapia O. niloticus en co-cultivo intensivo.
2. Materiales y métodos
Los camarones C. caementarius se recolectaron del río Pativilca (10º66'85'' S, 77º68'06'' O) cerca del centro poblado Huayto a 352 msnm (Barranca, Lima). Los camarones se transportaron individualmente en vasos de plástico de 200 mL (Reyes, 2016), los que tuvieron agujeros para permitir el flujo de agua, y se acondicionaron dentro de un recipiente plástico de 45 L (3 camarones L-1), con agua del mismo río y aireación constante. El transporte terrestre duró 5 h y no hubo mortalidad de camarones. En el laboratorio, los camarones de la especie C. caementarius se reconocieron con clave taxonómica (Méndez, 1981) y luego se aclimataron por siete días en el mismo sistema de transporte.
Los alevines revertidos de tilapia O. niloticus de 20 días de edad, procedieron de la Estación Pesquera de Ahuashiyacu (6°30ʹ55ʹʹS, 76°19ʹ50ʹʹ O) (Tarapoto, San Martín), se introdujeron en bolsas de polietileno con 10 L de agua (25 alevines L-1) y luego se insufló oxígeno puro. Las bolsas con peces se acondicionaron dentro de baldes de plástico de 20 L. El transporte terrestre duró 24 h y hubo 5% de mortalidad de peces. La aclimatación de las tilapias se realizó en acuarios de 55 L durante cinco días, y un día antes de la siembra se sumergieron en una solución de NaCl al 3% durante 10 min (Vargas et al., 2003). Ambas especies se alimentaron ad libitum con la dieta control.
El ensilado biológico se elaboró según el método de Berenz (1996) con modificaciones (Saldaña, 2011). Las vísceras y mantos de A. purpuratus se recolectaron del mercado de peces "La Sirena" (Chimbote, Perú). Los residuos (5 kg), se lavaron con agua potable, se escurrieron durante 20 min, se sometieron a cocción (100 °C por 20 min) y después de enfriar se molió. La pasta obtenida se mezcló con 10% de melaza y 15% de bacterias lácticas. La melaza de caña de azúcar de 76° Brix se obtuvo de la Empresa Agroindustrial San Jacinto S.A.C (Chimbote). Las bacterias lácticas se obtuvieron de un producto comercial de bacterias liofilizada para yogurt (Vivolar Dri-Set Bioflora ABY 424) que contiene cuatro cepas (Lactobacillus bulgaricus 10%, Streptococcus thermophilus 70%, Lactobacillus acidophilus 10% y Bifidobacterium ssp. 10%), cuya activación se realizó con el método de Berenz (1996). El homogenizado obtenido se introdujo en frascos de 2 L y se incubó a 40 °C por 48 h y el pH final fue de 4,2. Luego, el ensilado se secó al ambiente durante cuatro días, se molió hasta obtener harina y después se tamizó (120 µm).
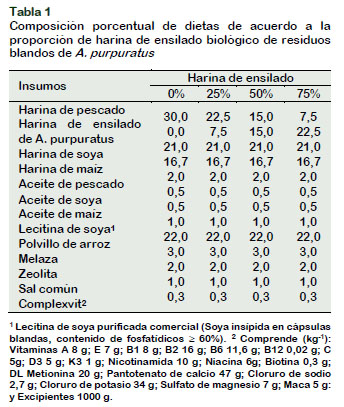
La dieta basal se elaboró según la formulación de Reyes (2012) suplementada con 3% de levadura Saccharomyces cerevisiae (Cornejo et al., 2015). Se emplearon tres dietas experimentales (25%, 50% y 75% de harina de ensilado) y una dieta control (sin harina de ensilado) (Tabla 1), cada uno con tres repeticiones.
La ración diaria (08:00 y 19:00 h) fue del 6% del peso húmedo en camarón y del 5% en tilapia, durante seis días a la semana. El costo de las dietas se estimó de acuerdo a precios de los insumos de mayorista local. Las características organolépticas (color, olor y sabor) de la harina de ensilado y de las dietas se evaluaron según Fernández et al. (2011). El análisis proximal se realizó de una muestra de harina y de cada dieta (por pérdida de muestras durante el análisis) y consistió del análisis de proteínas, lípidos y fibra que se realizaron en el Laboratorio Certificado COLECBI S.A.C., con el método UNE-EN ISO 5983-2 Parte 2 Dic. 2006, donde se empleó el factor 6.25 para el contenido proteico; además se determinó humedad y cenizas (AOAC, 2000). Para los carbohidratos se empleó la fórmula: 100 – (% proteína + % grasas + % fibra + % ceniza).
El sistema de co-cultivo fue el empleado por Reyes (2012) y consistió de 12 acuarios de vidrio (0,186 m2 y 55 L), donde cada acuario tuvo un sistema de recirculación de agua tipo air-water-lift (0,43 L min-1) con filtro biológico percolador (2,5 L) cuyo lecho filtrante de dos capas fue de conchuela triturada y grava, en iguales proporciones. Dentro de cada acuario se instalaron seis recipientes (19 cm de diámetro y 284 cm2) para el cultivo de camarón, que se dispusieron en dos grupos de tres niveles. Los recipientes tuvieron aberturas en los laterales para permitir el flujo de agua; además, se colocó un tubo PVC de 1,27 cm de diámetro que sobresalió el nivel del agua y por donde se introdujeron los gránulos de alimento. Los seis recipientes ocuparon un volumen de agua de 17 L y el volumen restante fue de 38 L. Se empleó agua potable previamente declorada con aireación vigorosa durante 72 h.
El sexo de los camarones machos se verificó por la presencia de gonóporos en los coxopoditos del quinto par de periópodos. Se emplearon 72 camarones (5,16 ± 0,37 cm de longitud total y 4,78 ± 1,13 g de peso húmedo) con apéndices cefalotorácicos completos y sin signos de laceraciones en el cuerpo y apéndices. En cada recipiente para cultivo se sembró al azar un camarón y en total se sembraron seis camarones por acuario (32 camarones m-2).
En cuanto a tilapia, se emplearon 48 alevines revertidos (4,28 ± 0,31 cm de longitud total y 2,86 ± 0,45 g de peso húmedo). En cada acuario, se sembraron al azar cuatro tilapias (22 alevines m-2), según lo recomendado por Mogollón (2013).
El experimento duró 90 días. El peso húmedo de los camarones y tilapias se determinó con balanza digital ADAM AQT600 (± 0,1 g). La longitud de los camarones se midió con vernier digital Trupper (± 0,01 mm) y para medir a las tilapias se empleó un ictiómetro (± 1 mm). En los camarones, la longitud total (Escotadura post orbital hasta el extremo posterior del telson) se midió con los ejemplares posicionados ventralmente. Toda la población de camarones y tilapias se muestrearon mensualmente y las variables zootécnicas fueron crecimiento absoluto (CA), ganancia porcentual (GP), tasa de crecimiento absoluto (TCA), tasa de crecimiento específico (TCE) (El Sherif y Ali, 2009), factor de conversión alimenticia (FCA) y rendimiento (R) (Reyes, 2012):
CA = X2 – X1
GP (%) = (CA/X1) x100 TCA = CA/t2 – t1
TCE (% día-1) = [ln X2 – ln X1) / t2 – t1] x 100
FCA = Alimento entregado (g) / ganancia de peso vivo (g)
R (kg m-2) = Biomasa / área de crianza
Donde X1 (peso y longitud inicial) y X2 (peso y longitud final); t1 (tiempo inicial) y t2 (tiempo final); ln (logaritmo natural).
Los desechos sólidos acumulados en los acuarios se extrajeron tres veces por semana. La calidad del agua se monitoreó cada 15 días y se registró oxígeno y temperatura con Oxímetro digital Hatch LDO (± 0,01 mgL-1, ± 0,01 °C), el pH con pH-metro OAKTON (±0,01 unidades), el amonio total y nitritos con el Test Colorimétrico Nutrafin (± 0,1 mg L-1).
Se empleó el diseño estadístico completamente al azar. La normalidad de los datos se determinó con la prueba de Kolmogorov-Smirnov. Las diferencias entre las medias de los tratamientos se determinaron por análisis de varianza de una vía y con la prueba de rangos múltiples de Duncan, en todos los casos con significancia de α = 0,05. El procesamiento estadístico se realizó con el software SPSS versión 23 para Windows.
3. Resultados y discusión
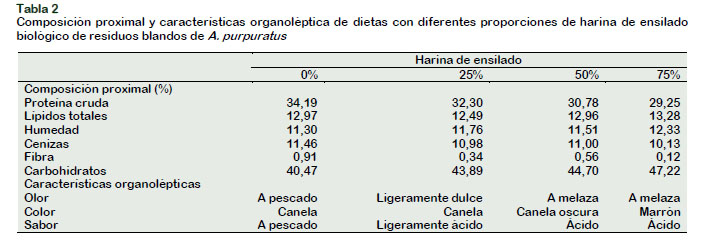
La harina de ensilado biológico producido de residuos del molusco A. purpuratus tuvo un rendimiento de 24,70% y sus características organolépticas fueron de color canela, con olor a melaza, de sabor ácido ligeramente amargo, de consistencia pastosa. Estas características fueron similares a lo informado por Hurtado (2017) para el mismo producto, así como para el de pescados considerados de buena calidad nutricional (Spanopoulos-Hernández et al., 2010). Además, el análisis proximal de la harina producida en el estudio tuvo 42,23% de proteínas, 6,62% de lípidos totales, 1,28% de fibra, 9,97% de cenizas, 39,90% de carbohidratos, 15,78% de humedad. Esta composición química, aunque no hubo repeticiones en el análisis; no obstante, fue similar a lo informado en otros trabajos que utilizaron los residuos del mismo molusco empleado en el estudio, y donde el principal componente que es la proteína fue de entre 43,10% a 45,12% (Encomendero y Uchpa, 2002; Alayo y Rojas, 2012; Hurtado, 2017).
En cambio, el nivel de proteína del ensilado de A. purpuratus fue mayor al del ensilado de desechos de pescados que fue de 38,70% (Bernal-Rodríguez et al., 2013) e incluso los hay de 14,92% y 8,92%, en base húmeda (Spanopoulos-Hernández et al., 2010). El contenido de proteínas del ensilado producido en el presente estudio (42,23%) fue menor que el de la harina de pescado (55 a 60%) que varía también de acuerdo a la calidad de la materia prima procesada (Cabello et al., 2013).
La concentración de proteínas de las dietas disminuyó desde 34% en el control hasta 29% en la dieta con 75% de harina de ensilado, y donde en esta última hubo incremento de lípidos totales y de carbohidratos en relación con las demás dietas (Tabla 2). Similares variaciones de proteínas y de otros nutrientes se producen cuando se sustituyen la harina de pescado con otros insumos en dietas de Litopenaeus vannamei (Ye et al., 2011; Bernal-Rodríguez et al., 2013) y M. inca (Dávila et al., 2013). De ahí que las dietas elaboradas en el presente estudio tuvieron características organolépticas diferentes que el control, es decir, que mientras mayor fue la proporción de ensilado el olor a pescado cambió a olor a melaza, el color se hizo más oscuro y el sabor fue más ácido (Tabla 2). Aunque no se neutralizó el pH del ensilado, no creemos que haya influido en el proceso digestivo de las dietas experimentales, toda vez que, las proteasas son altamente resistentes a pH entre 3 a 6 como en el camarón M. carcinus (Manríquez-Santos et al., 2011) y entre 2 a 4 en el cíclido Cichlasoma beani (Martínez-Cárdenas et al., 2017). En todo caso, las dietas experimentales fueron aceptadas por C. caementarius y O. niloticus, aunque el efecto sobre el crecimiento, como se discutirá más adelante, fue diferente en las especies.
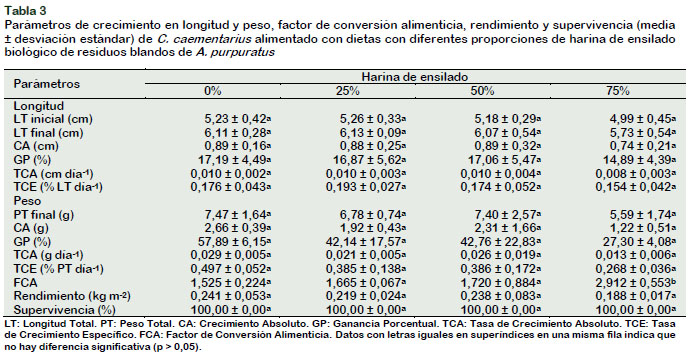
Los parámetros de crecimiento en longitud y en peso de machos de C. caementarius alimentados con diferentes proporciones de harina de ensilado en la dieta no mostraron diferencias significativas (p > 0,05) entre tratamientos; sin embargo, disminuyeron solo cuando fueron alimentados con 75% de harina de ensilado (Tabla 3). Estos resultados constituyen el primer reporte del uso de este tipo de ensilado en la dieta de C. caementarius y sugieren la posibilidad de utilizar dietas hasta con 50% de harina de ensilado en reemplazo de la harina de pescado, sin que afecte el crecimiento de la especie. Las postlarvas de M. inca, aceptan reemplazar completamente la harina de pescado por ensilado de residuos de A. purpuratus, pero mayor crecimiento se logra con 50% de esta harina en la dieta (Dávila et al., 2013). Similar resultado se obtiene en postlarvas de M. rosenbergii pero con ensilado de pescado (Mera y Selis, 2012).
El FCA (1,525 a 1,720) de C. caementarius fue similar (p > 0,05) hasta con 50% de harina de ensilado en la dieta, pero fueron diferentes (p < 0,05) con el de 75% (2,912) (Tabla 3), lo que indicaría que C. caementarius utiliza mejor los nutrientes de las dietas cuando se incluye hasta el 50% de ensilado. En L. vannamei, el FCA entre 1,4 y 1,8 es indicador de que los nutrientes de las dietas son asimilados fácilmente (Hernández et al., 2008), pues generalmente en dicha especie el FCA es de alrededor de 1,27 cuando se incluye 24% de ensilado de pescado en la dieta (BernalRodríguez et al., 2013). En cambio, el alto FCA obtenido en C. caementarius alimentados con 75% de ensilado, indicaría que esta proporción alteraría el balance de nutrientes de la dieta, la palatabilidad y la atractabilidad debido al cambio de las características organolépticas, lo que explicaría el pobre crecimiento obtenido.
En crustáceos carnívoros la palatabilidad de la dieta está influenciada por el contenido de nutrientes del alimento, las necesidades nutricionales del animal y la experiencia pasada del animal con los alimentos; pues, los animales usan todos los sentidos para discriminar entre los alimentos agradables o desagradables asociados con la comida (Tantikitti, 2014). El rendimiento de C. caementarius fue similar (p > 0,05) entre tratamientos (~0,221 kg m-2), donde el menor rendimiento (0,188 kg m-2) se obtuvo en aquellos alimentados con 75% de ensilado en la dieta, aun cuando no hubo mortalidad de camarones durante el período experimental (Tabla 3), lo que es otra evidencia de la dificultad de emplear alta proporción de ensilado en la dieta. Sin embargo, el rendimiento de C. caementarius fue menor en relación a lo obtenido para la misma especie y sistema de cultivo que fue entre 0,374 kg m-2 y 1,049 kg m-2 (Reyes, 2016), ello probablemente se debería al menor tamaño de camarón sembrado. El camarón M. rosenbergii alcanza rendimiento de 2,37 t ha-1 en policultivo con tilapia O. niloticus, pero en estanques de tierra (Danaher et al., 2007).
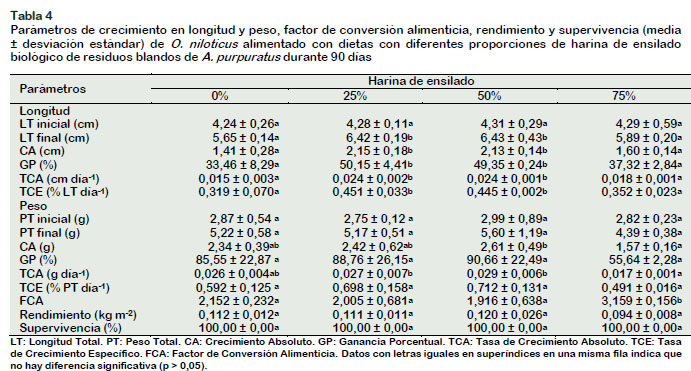
En el caso de O. niloticus, los elevados parámetros de crecimiento en longitud (p<0,05) se obtuvieron con 25% y 50% de harina de ensilado en la dieta, en relación con la dieta control y con la de 75% de harina de ensilado (Tabla 4). En cambio, elevado CA (2,61 g) y TCA (0,029 g día-1), se obtuvieron con tilapias alimentadas hasta con 50% de harina de ensilado en la dieta, en relación con 75% de harina de ensilado (CA=1,57 g y TCA=0,017 g día-1). Estos resultados están de acuerdo con lo informado en el monocultivo de O. niloticus criado en acuarios durante corto período, donde se logra mayor crecimiento hasta con 50% de harina de ensilado de residuos blandos de A. purpuratus en la dieta, en similares condiciones nutricionales y ambientales (Alayo y Rojas, 2012). Sin embargo, aunque la temperatura del agua fue baja para el cultivo de O. niloticus, que debe haber afectado la tasa de crecimiento como en otras investigaciones (Dos Santos et al., 2013; Castillo et al., 2014), en el presente estudio este efecto fue uniforme en todos los tratamientos.
Además, en el presente estudio, el FCA fue similar (p>0,05) en O. niloticus alimentados hasta con 50% de harina de ensilado en la dieta (1,916 a 2,152), pero fueron mayores a lo obtenido para la misma especie que fue de 1,54 pero con 30% de harina de ensilado de pescado (Perea et al., 2011). En cambio, en aquellos peces alimentados con 75% de harina de ensilado en la dieta, el FCA fue significativamente alto (3,159), lo que sugiere que O. niloticus no aprovechó el alimento, probablemente porque la dieta fue formulada para camarón o también podría ser consecuencia del reemplazo de la harina de pescado por harina de ensilado que posee menor contenido de proteínas (Alayo y Rojas, 2012; Rodríguez y Minaya, 2013) lo que deben haber ocasionado disminución de nutrientes esenciales en la dieta y probablemente reducción de la palatabilidad y pérdida de apetito, por exclusión de la harina de pescado en la dieta (Fagbenro et al., 1994). La acidez de la dieta, que no fue neutralizada, no debe haber afectado a los peces alimentados con alta proporción de ensilado, toda vez que en los cíclidos las proteasas actúan mejor a pH entre 2 a 4 (Martínez-Cárdenas et al., 2017). En todo caso, es conveniente ensayar otros insumos alimenticios acorde con los requerimientos nutricionales de O. niloticus, es decir, que en este tipo de cocultivo es mejor emplear alimento para cada especie.
El rendimiento de O. niloticus fue similar (p > 0,05) entre tratamientos, pero elevados rendimientos se obtuvieron hasta con 50% de harina de ensilado (0,120 kg m-2) y el menor rendimiento (0,094 kg m-2) se obtuvo con 75% de harina de ensilado en la dieta, aun cuando no hubo mortalidad durante el período experimental (Tabla 4). Sin embargo, los rendimientos del presente estudio fueron menores a lo obtenido por Danaher et al. (2007) quienes registraron 4 t ha-1 de O. niloticus en policultivo con M. rosenbergii en estanques. Los pobres resultados de rendimiento con O. niloticus del presente estudio, serían también por disminución de nutrientes disponibles en las dietas empleadas con diferentes proporciones de harina de ensilado.
Los elevados parámetros de crecimiento de C. caementarius y O. niloticus en cocultivo, que se obtuvieron hasta con 50% de harina de ensilado biológico de residuos blandos de A. purpuratus en la dieta, aun cuando hubo disminución del nivel de proteína en la dieta (34% a 31%), sugieren que las bacterias ácido-lácticas del ensilado deben haber favorecido el proceso digestivo y la asimilación de nutrientes en ambas especies. Esto se sustenta por el hecho de que las bacterias ácido-lácticas probablemente permanecieron vivas, debido a que durante el procesamiento del ensilado la temperatura empleada (40 ºC) fue cercana a la óptima (44 ºC) para su desarrollo y producción de ácido láctico (Aghababaie et al., 2014). Estas bacterias dentro del tracto digestivo del hospedador mejoran la asimilación del alimento y estimulan la respuesta inmune (Villamil y Martínez-Silva, 2009; Zhouet al., 2009).
Las postlarvas de M. inca crecen mejor con 50% de la harina de ensilado en la dieta (Dávila et al., 2013) y de igual manera sucede en alevines de O. niloticus (Saldaña, 2011; Alayo y Rojas, 2012). En el caso de la dieta con 75% de harina de ensilado que afectó tanto a C. caementarius como a O. niloticus, es probable que las bacterias de la harina de ensilado no encontraron el sustrato adecuado para ayudar con la nutrición de los animales. Similares resultados se obtuvieron con 100% de harina de ensilado de residuos blandos de A. purpuratus en la dieta de alevines de O. niloticus (Alayo y Rojas, 2012) y de postlarvas de M. inca (Dávila et al., 2013). Por tanto, no es aconsejable utilizar alta proporción de este tipo de harina de ensilado en la dieta para las especies del presente estudio, porque su inclusión ocasionaría un desbalance nutricional al disminuir el aporte de nutrientes de la harina de pescado, que posee alto contenido de proteínas, aminoácidos y ácidos grasos esenciales, complejos vitamínicos y minerales (Fenucci, 2007), cuyas consecuencias se evidenciaron por el reducido crecimiento y bajo rendimiento en ambas especies.
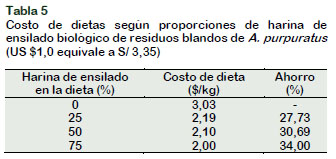
De acuerdo a los resultados del crecimiento de C. caementarius y O. niloticus en co-cultivo, con solo utilizar 50% de harina de ensilado en la dieta de ambas especies se podría ahorrar un 30% del costo del alimento (Tabla 5). En peneidos, el costo de alimento es de ~60% del costo total de producción (Devresse, 2000). En O. niloticus el uso del 50% de harina de ensilado en la dieta representa un ahorro del 52% del costo de producción (Alayo y Rojas, 2012). Sin embargo, el ahorro sería mayor del 30% si la dieta se produce a niveles comerciales y también si O. niloticus se alimenta con harina de ensilado en una dieta cuyos insumos sean de menor costo y acordes con sus requerimientos nutricionales.
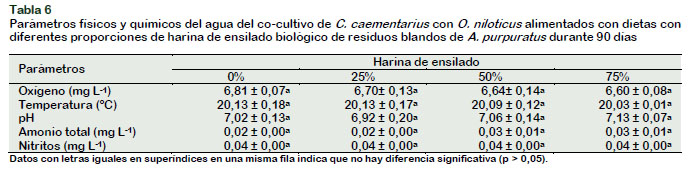
El oxígeno disuelto varió entre 6,60 y 6,81 mg L-1; la temperatura entre 20,09 y 20,13 ºC; el pH entre 6,92 y 7,13 unidades; el amonio total entre 0,02 y 0,03 mg L-1 y los nitritos se mantuvieron en 0,04 mg L-1. Estos parámetros ambientales del agua obtenidos durante los 90 días del co-cultivo C. caementarius con O. niloticus, fueron similares (p > 0,05) entre tratamientos (Tabla 6), y para el caso de camarón estos se mantuvieron cercanos a los parámetros registrados para el ambiente natural y de cultivo (Wasiw y Yépez, 2015; Reyes, 2016). Sin embargo, la temperatura del agua fue baja (20 ºC) para O. niloticus, pues esta especie crece mejor entre 24 ºC y 30 ºC, y que temperaturas de alrededor de 20 ºC afectan el crecimiento (Díaz et al., 2012; Dos Santos et al., 2013; Castillo et al., 2014), pero como se explicó, la temperatura fue uniforme en los tratamientos. Es conveniente emplear temperaturas alrededor de 24 ºC para mejorar el crecimiento de ambas especies en co-cultivo. Además, la calidad del agua indica que el sistema de co-cultivo empleado, soportó la alta densidad generada por la combinación de especies que en total fue de 54 organismos m-2 y más aún, no hubo interacción ni mortalidad de las especies.
En consecuencia, de acuerdo a los resultados del crecimiento de C. caementarius con O. niloticus en sistema de co-cultivo del presente estudio, que fue similar a lo realizado por Mogollón (2013), se estaría en condiciones de establecer el co-cultivo intensivo de ambas especies bien sea en tanques o estanques seminaturales: Además, el uso de 50% de harina de ensilado en la dieta disminuiría la dependencia de la harina de pescado y se reduciría la contaminación del ambiente por los residuos blandos generados en el procesamiento comercial de A. purpuratus que actualmente no están siendo utilizados.
4. Conclusión
Las dietas con harina de ensilado biológico de residuos blandos de A. purpuratus (25%, 50% y 75%) no afectaron (p > 0,05) los parámetros de crecimiento del camarón C. caementarius; mientras que en tilapia O. niloticus solo el crecimiento en longitud fue (p < 0,05) mayor con 25% y 50% de ensilado, y el peso lo fue solo con 50% de ensilado. El FCA fue bajo (1,5 a 1,7) en camarón y alto (1,9 a 2,1) en tilapia, hasta con 50% de ensilado. De acuerdo a los resultados obtenidos, se recomienda utilizar 50% de harina de este tipo de ensilado en dietas para machos de C. caementarius, aunque para alevines revertidos de O. niloticus se recomienda ensayar otra dieta para mejorar el crecimiento.
Referencias Bibliográficas
Aghababaie, M.; Beheshti, M.; Khanahmadi, M. 2014. Effect of temperature and pH on formulating the kinetic growth parameters and lactic acid production of Lactobacillus bulgaricus. Nutrition and Food Sciences Research 1(1): 49-56. [ Links ]
Acosta, A.J.; Quiñones, D.P. 2016. Efecto de bajas concentraciones de lecitina de soya en dietas sobre el crecimiento y supervivencia de machos de Cryphiops caementarius camarón de río, en laboratorio. Tesis de Título. Universidad Nacional del Santa. Nuevo Chimbote. Perú. 36 pp. [ Links ]
Alayo, G.; Rojas, I. 2012. Efecto de diferentes concentraciones de ensilado de ensilado de residuos blandos de Argopecten purpuratus, en reemplazo de harina de pescado en dietas, en el crecimiento y supervivencia de alevines de Oreochromis niloticus "tilapia nilótica", en laboratorio. Tesis de Título. Universidad Nacional del Santa. Nuevo Chimbote. Perú. 45 pp. [ Links ]
Alcántar-Vásquez, J.P.; Santos-Santos, C.; Moreno-de la Torre, R.; Antonio-Estrada, C. 2014. Manual para la producción de supermachos de tilapia del Nilo (Oreochromis niloticus). UNPA-PIFI, Oaxaca. México. 81 pp. [ Links ]
AOAC. 2000. Official methods of analyses the association of official analytical chemists. 17th Edition. DC: Washington. EEUU. [ Links ]
Berenz, Z. 1996. Ensilado de residuos de pescado. En XI Curso Internacional de Procesamiento de Productos Pesqueros. Instituto Tecnológico Pesquero del Perú. Callao, Perú. Pp. 9-31. [ Links ]
Bernal-Rodríguez, C.E.; Spanopoulos-Hernández, M.; Hernández, C.; Barba-Quintero, G.; Ruelas-Inzunza, J.R. 2013. Sustitución parcial de harina de pescado por ensilado biológico en dietas para juveniles de camarón Litopenaeus vannamei (Boone, 1931). El Bohío Boletín Electrónico 3(8): 22-30. [ Links ]
Cabello, A.; García, A.; Figuera, B.; Higuera, Y.; Vallenilla, O. 2013. Calidad físico-química de la harina de pescado venezolana. Saber. Revista Multidisciplinaria del Consejo de Investigación de la Universidad de oriente 25(4): 414-422. [ Links ]
Castillo, W.; Lombardi, C.; Macedo, R.2014. Adaptabilidad de la tilapia, Oreochromis niloticus, sometida a dietas con alta densidad de nutrientes y diferentes temperaturas del agua en la costa de la región La Libertad, Perú. Pueblo Continente 25(1): 137-141. [ Links ]
Cornejo, J.; Pérez, L.; Reyes, W. 2015. Effect of Saccharomyces cerevisiae yeast in the diet of male shrimp Cryphiops caementarius (Crustacea, Palaemonidae) on total and differential hemocytes count. Revista Bio Ciencias 3(3): 173-186. [ Links ]
Danaher, J.; Tidwell, J.; Coyle, S.; Dasgupta, S. 2007. Effects of two densities of caged monosex Nile tilapia, Oreochromis niloticus, on water quality, phytoplankton populations, and production when polyculture with Macrobrachium rosenbergii in temperate pond. Journal of the World Aquaculture Society 38(3): 367-382. [ Links ]
Dávila, E.; Medina, J.; Reyes, W. 2013. Crecimiento y supervivencia de postlarvas de Macrobrachium inca (Holthuis, 1950) (Crustacea, Palaemonidae) alimentadas con ensilado biológico. Revista Intropica 8:79–86. [ Links ]
Devresse, B. 2000. Producción de alimentos para camarón estables en el agua. En Avances en Nutrición Acuícola IV. Memorias del IV Simposium Internacional de Nutrición Acuícola. Noviembre 15-18, 1998. La Paz, B.C.S., México. [ Links ]
Díaz, M.; Alva, R.; Venero, B.; Dávila, F.; Luján, L.A.; Plasencia, W.; Mendoza, F. 2012. Cultivo semi-intensivo de tilapia, Oreochromis niloticus, en estanque de concreto en el caserío Palo Blanco (Cascas, La Libertad-Perú). Rebiol 32(2): 99-107. [ Links ]
Dos Santos, V.B.; Mareco, A.A.; Silva, M.D.P. 2013. Growth curves of Nile tilapia (Oreochromis niloticus) strains cultivated at different temperaturas. Acta Scientiarum. Animal Sciences Maringá 35(3): 235-242. [ Links ]
Elegbe, H.A.; Imorou, I.; Agbohessi, P.; Ble, C.; Banag, A.; Chikou, A.; Eyango, M.; Laleye, P. 2015. Coculture Clarias gariepinus Oreochromis niloticus: what benefits for the improvement of zootechnical and economic performance of fish reared in "whedos" of Delta Ouémé in Benin? International Journal of Biological and Chemical Science 9(4): 1937-1949. [ Links ]
El-Sherif, M.S.; Ali, A.M. 2009. Effect of rearing systems (mono and poly-culture) on the performance of freshwater prawn (M. rosenbergii) juveniles. Journal of Fisheries and Aquatic Science 4(3): 117-128. [ Links ]
Encomendero, E.; Uchpa, F. 2002. Producción de ensilado biológico de subproductos de concha de abanico (Argopecten purpuratus). En Memorias I CongresoIberoamericano Virtual de Acuicultura 2002. Zaragoza, España.1 jun 30 sep. 2002. [ Links ]
Fagbenro, O.; Jauncey, K.; Haylor, G. 1994. Nutritive value of diet containing dried lactic acid fermented fish silage and soybean meal for juvenile Oreochromis niloticus and Clarias gariepinus. Aquatic Living Resource 7: 79-85. [ Links ]
Fenucci, J.L. 2007. Harinas de pescado. En: García, T.; Villarreal, H.; Fenucci, J.L. (Comp.). Manual de ingredientes proteicos y aditivos empleados en la formulación de alimentos balanceados para camarones peneidos. Argentina. Editorial Universitaria de Mar de Plata. Pp. 18-40. [ Links ]
Fernández, A.L.; Tabera, A.; Agüeria, D.; Sanzano, P.; Grosman, F.; Manca, E. 2011. Obtención, caracterización microbiológica y fisicoquímica de ensilado biológico de carpa (Cyprinus carpio). Revista Electrónica Veterinaria 12(8): 1-15. [ Links ]
Hernández, C.; Olvera-Novoa, M.A.; Aguilar-Vejas, K.; González-Rodríguez, B.; Abdo de la Parra, I. 2008. Partial replacement of fishmeal by porcine meat meal in practical diets for Pacific white shrimp (Litopenaeus vannamei). Aquaculture 277: 244–250. [ Links ] Hurtado, B. 2017. Efectos de fuentes de carbono y fuentes fermentables en la composición química proximal de la harina del ensilado biológico de residuos blandos de Argopecten purpuratus. Tesis de Título. Universidad Nacional del Santa. Nuevo Chimbote. Perú. 41 pp. [ Links ]
Jara, C. 1997. Antecedentes sobre el desarrollo de la carcinología en Chile. Investigaciones Marinas 25: 245-254. [ Links ]
Kristiansen, T.S.; Drengstig, A.; Bergheim, A.; Drengstin, T.; Svensen, R.; Kollsgård, I.; et al. 2004. Development of methods for intensive farming of European lobster in recirculated seawater. Results from experiments conducted at Kvitsay lobster hatchery from 2000 to 2004. Fisken og havet 6: 1-62. [ Links ] Llanos, J.A. 1980. Aspectos ambientales de algunos ríos camaroneros del Perú. Tesis de Doctorado. Universidad Nacional de Trujillo, Perú. 34 pp. [ Links ]
Loayza, R.E. 2011. Problemática del biofouling en el cultivo de Argopecten purpuratus en el Perú. Revista AquaTIC 35: 9-19. [ Links ]
Manor, R.; Segev, R.; Pimenta, M.; Aflalo, E.D.; Sagi, A. 2002. Intensification of redclaw crayfish Cherax quadricarinatus culture II. Growout in a separate cell system. Aquaculture Engineering 26: 263-276. [ Links ]
Manríquez-Santos, T.J.; Álvarez-González, C.A.; Arias-Rodríguez, L.; Guerreo-Olazaran, M.; ViaderSalvador, J.M.; Aguilar-Briseño, J.J. 2011. Caracterización de enzimas digestivas, digestibilidad in vitro y síntesis de ADNc del gen de tripsina en adultos de la pigua Macrobrachium carcinus. En: Cruz-Suárez, L.E., Ricque-Marie, D., Tapia-Salazar, M., Nieto-López, M.G., Villarreal-Cavazos, D. A., Gamboa-Delgado, J., Hernández-Hernández, L. (Eds), Avances en Nutrición Acuícola XI Memorias del Décimo Primer Simposio Internacional de Nutrición Acuícola, 23-25 de Noviembre, San Nicolás de los Garza, N. L., México. Universidad Autónoma de Nuevo León, Monterrey, México, pp. 143-171. [ Links ]
Martínez-Cárdenas, L.; Álvarez-González, C.A.; Hernández-Almeida, O.U.; Frías-Quintana, C.A.; Ponce-Palafox, J.T.; Castillo-Vargasmachuca, S. 2017. Partial characterization of digestive proteases in the green cichlid, Cichlasoma beani. Fishes 2(4): 1-11. doi:10.3390/fishes2010004 [ Links ]
Méndez, M. 1981. Claves de identificación y distribución de los langostinos y camarones (Crustacea: Decapoda) del mar y ríos de la costa del Perú. Boletín Instituto del Mar del Perú 5: 1-170. [ Links ]
Mera, A.E.; Selis, L.E. 2012. Sustitución progresiva de la harina de pescado por ensilado biológico de llambina Potamorhina altamazonica, en dietas para crecimiento de post-larvas de camarón gigante de Malasia, Macrobrachium rosenbergii (CrustaceaPalaemonidae), cultivados en corrales. Tesis de Título. Universidad Nacional de la Amazonía Peruana. Iquitos, Perú. 89 pp. [ Links ]
Mogollón, A. 2013. Cocultivo de machos del camarón de río Cryphiops caementarius en recipientes individuales dentro de acuarios con machos de tilapia Oreochromis niloticus a diferentes densidades de siembra y sus efectos en el crecimiento y supervivencia de las especies. Tesis de Título. Universidad Nacional del Santa. Nuevo Chimbote. Perú. 36 pp. [ Links ]
Perea, C.; Garcés, Y.; Hoyos, J. 2011. Evaluación de ensilaje biológico de residuos de pescado en alimentación de tilapia roja (Oreochromis spp.). Biotecnología en el Sector Agropecuario y Agroindustrial 9(1): 60-68. [ Links ]
PRODUCE (Ministerio de Producción). 2016. Anuario estadístico pesquero y acuícola 2015. Ministerio de la Producción. Perú. p. 29. [ Links ]
Reyes, W. 2012. Crecimiento y supervivencia de adultos del camarón de río Cryphiops caementarius criados en sistema de recipientes individuales con recirculación de agua. Tesis de Doctorado. Universidad Nacional de Trujillo. Perú. 89 pp. [ Links ]
Reyes, W. 2016. Effect of culture container on the survival and growth of male Cryphiops caementarius in individualized systems. Revista Bio Ciencias 3(4): 311-325. [ Links ]
Rodríguez, K.D.; Minaya, M.J. 2013. Efecto de dietas con 25, 50 y 75% de ensilado de residuos blandos de Argopecten purpuratus "concha de abanico" como sustituto de la harina de pescado en la digestibilidad aparente en alevines de Oreochromis niloticus "tilapia nilótica" en laboratorio. Tesis de Título. Universidad Nacional del Santa. Nuevo Chimbote. Perú. 46 pp. [ Links ]
Rubio, L. 2010. Coeficiente de digestibilidad proteica de dos tipos de ensilado, en juveniles de "camarón de río" Cryphiops caementarius (Molina, 1872) (Crustacea: Decapoda: Palaemonidae), en condiciones de laboratorio. Tesis de Título. Universidad Nacional del Santa, Nuevo Chimbote. Perú. 38 pp. [ Links ]
Saldaña, G. 2011. Efecto de dietas con diferentes concentraciones de Lactobacillus sp. enriquecido con proteína hidrolizada de vísceras de Argopecten purpuratus, sobre el crecimiento y supervivencia de alevines de Oreochromis niloticus en laboratorio. Tesis de Doctorado. Universidad Nacional de Trujillo. Perú. 72 pp. [ Links ]
Spanopoulos-Hernández, M.; Ponce-Palafox, J.T.; Barba-Quintero, G.; Ruelas-Inzunza, J.R.; Tiznado-Contreras, M.R.; Hernández-González, C.; Shirai, K. 2010. Producción de ensilados biológicos a partir de desechos de pescado, del ahumado de atún aleta amarilla (Thunnus albacares) y del fileteado de tilapia (Oreochromis sp.), para la alimentación de especies acuícolas. Revista Mexicana de Ingeniería Química 9(2):167-178. [ Links ]
Tantikitti, C. 2014. Feed palatability and the alternative protein sources in shrimp feed. Songklanakarin J. Sci. Technol. 36(1): 51-55. [ Links ]
Vargas, L.; Povh, J.; Ribeiro, P.; Moreira, H.; Rocha, L.; Maroneze, M. 2003. Efeito do tratamento com cloreto de sódio e formalina na ocorrência de ectoparasitas em alevinos de tilápia do Nilo (Oreochromis niloticus) revertidos sexualmente. Arquivos Ciências Veterinárias e Zoologia da UNIPAR 6(1): 51-63. [ Links ]
Villamil, L.; Martínez-Silva, M.A. 2009. Probióticos como herramienta biotecnológica en el cultivo de camarón: reseña. Boletín de Investigaciones Marinas y Costeras INVEMAR 38(2): 165-187. [ Links ]
Wasiw, J.; Yépez, V. 2015. Evaluación poblacional del camarón Cryphiops caementarius en ríos de la costa sur del Perú. Revista de Investigaciones Veterinarias del Perú 26(2): 166-181. [ Links ]
Ye, J.D.; Wang, K.; Li, F.D.; Zun, Y.Z.; Liu, X.H. 2011. Incorporation of a mixture of meat and bone meal, poultry by-product meal, blood meal and corn gluten meal as a replacement for fish meal in practical diets of Pacific white shrimp Litopenaeus vannamei at two dietary protein level. Aquaculture Nutrition 17: 337-347. [ Links ]
Zhou, X.; Wong, Y.; Li, W. 2009. Effect of probiotic on larvae shrimp (Penaeus vannamei) based on water quality, survival rate and digestive enzyme activities. Aquaculture 287: 349-353. [ Links ]
* Corresponding author
E-mail: wreyes_avalos@hotmail.com (W. Reyes).
Received December 10, 2017
Accepted April 5, 2018.