Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Scientia Agropecuaria
Print version ISSN 2077-9917
Scientia Agropecuaria vol.9 no.2 Trujillo Apr./Jun. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.02.06
ARTÍCULOS ORIGINALES
El extracto de Caesalpinia spinosa inhibe la infección in vivo de Flavobacterium columnare en tilapia
The extract of Caesalpinia spinosa inhibits the in vivo infection of Flavobacterium columnare in tilapia
Zulita Prieto*; David Salirrosas; Monica Arqueros; Linda Sánchez-Tuesta
Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo. Perú.
Resumen
En la presente investigación se realizó el ensayo in vivo del extracto de C. spinosa como un controlador de F. columnare en individuos de tilapia. Para lo cual, se obtuvo el extracto de frutos secos de C. spinosa y se mezcló con el agua de cultivo para peces a la concentración final de 0.14 mg/ml en acuarios de 280 l. En la primera etapa, los peces de tilapia infectados artificialmente con F. columnare manifestaron los síntomas de la enfermedad. En la segunda etapa, los peces enfermos fueron tratados con el extracto de C. spinosa disuelto en el agua de cultivo y se mantuvieron hasta su recuperación. En el grupo de individuos enfermos que no recibieron C. spinosa, el porcentaje de sobrevivencia fue 53,33. Los peces criados con y sin C. spinosa no mostraron diferencias en el porcentaje de sobrevivencia entre ellos. Se demostró la actividad antibacteriana in vivo de C. spinosa y puede usarse como una alternativa efectiva para el tratamiento de infecciones de otras bacterias y en otras especies acuícolas, a bajo costo y amigable con el medio ambiente.
Palabras clave: tilapia; bactericida; Flavobacterium columnare; Caesalpinia spinosa.
Abstract
In the present investigation, the in vivo test of C. spinosa extract was carried out as a controller of F. columnare in tilapia individuals. For this, the extract of dried fruits of C. spinosa was obtained and was mixed with the culture water for fish at the final concentration of 0.4 mg/ml in aquariums of 280 l. In the first stage, artificially infected tilapia with F. columnare appeared with the disease symptoms. In the second stage, the diseased fish were treated with the extract dissolved in the water and were kept until their recovery. In the group of sick individuals who did not receive C. spinosa, the percentage of survival was 53,33. Survival percentages of healthy fish with and without C. spinosa extract did not show significant differences between them. It showed antibacterial activity in vivo of C spinosa. These results indicate that it could be used as an alternative effective for the treatment of infections bacteria for other species of bacteria and other aquaculture species, at low cost and friendly to the environment.
Keywords: tilapia; bactericide; Flavobacterium columnare; Caesalpinia spinosa.
1. Introducción
Las especies de tilapia del género Oreochromis: O. niloticus, O. aureus y O. mossambicus son las de mayor interés para la piscicultura en el mundo y un factor que puede ocasionar pérdidas significativas es la incidencia de patógenos microbianos, principalmente en los sistemas de cultivo cerrados con alta densidad de peces (Dong et al., 2015). Las enfermedades más comunes de la tilapia son las producidas por Streptococcus agalactiae, S. iniae, Aeromonas veronii, Flexibacter columnaris y Flavobacterium columnare (Huicab-Pech et al., 2017).
De estas bacterias, F. columnare se encuentra de manera natural en el agua dulce (Kunttu et al., 2012) y su presencia en cultivos acuícolas continentales es inevitable. Sin embargo, se debe controlar en cultivos cerrados, ya que puede causar cuantiosa mortalidad (Conroy, 2010). Las lesiones que ocasionan en las branquias de los peces causan necrosis que afectan la captación de oxígeno y la circulación sanguínea, pueden producir alteraciones cardiacas que conducirían a la muerte del individuo, con la presencia de úlceras en cualquier parte del cuerpo, manchas blancas, hendiduras, erosiones en las aletas (Foscarini, 1989).
La detección de F. columnare en los individuos se realiza por la morfología de las lesiones, por cultivo en placas (Kunttu et al., 2012) y por reacción en cadena de la polimerasa (PCR) basada en secuencias de especies específicas de genes ribosomales (Darwish et al., 2004; Panangala et al., 2007; Verma et al., 2013; Faisal et al., 2016). Por la variación morfológica en el tipo de colonias en los subcultivos de F. columnare (Decostere et al., 1999) y en el tipo de ulceraciones podrían confundirse con F. johnsoniae, que es una especie, de baja patogenicidad comparada con F. columnare (Rintamäki-Kinnunen et al., 1997). Por ello, la técnica molecular por PCR se constituye una herramienta que resuelve su detección (Patra et al., 2016).
El control de los agentes infecciosos en la cría de peces se hace a través de la terapia química con medicamentos antimicrobia-nos, como la eritromicina, sulfonamidas, oxitetraciclina, entre otros. Este tratamien-to es discutible por la resistencia que origina en los agentes infecciosos de las especies en cultivo debido al uso excesivo, a lo que se suma la acumulación de antibióticos en los órganos internos de los peces, que pueden afectar al consumidor (Hernández-Serrano, 2005). Una vez detectada la infección en un sistema de crianza, en algunos casos, los productores prefieren eliminar todo el lote por la resistencia que se presenta debido a la aplicación de bactericidas.
Hay que tener en cuenta que el tiempo de eliminación del metabolito 3-amina-2-oxazolidinona (AOZ) después de su aplicación en O. niloticus es de 22 días aproximadamente (Xu et al., 2006). El desin-fectante que suele usarse en la limpieza de acuarios y tanques para la eliminación de parásitos, bacterias y hongos es el per-manganato de potasio, que tiene un alto grado de toxicidad y no se recomienda para peces por alterar la microbioma externa e incrementar la susceptibilidad a enferme-dades bacterianas, como columnaris (Mohammed y Arias, 2015).
Se ensayan estrategias alternativas a fin de sustituir o minimizar la administración de medicamentos químicos a los peces. Una de ellas es la terapia orgánica, que consiste en la adición de probióticos al alimento; la suplementación de Bacillussubtilis, Saccharomyces cerevisiae y Aspergillus oryzae incrementan la resistencia a enfermedades causadas por S. iniae y A. hydrophila en poblaciones juveniles de O. niloticus (Iwashita et al., 2015); y la suplementación de Bacillus amyloliquefaciens en la dieta de O. niloticus para fortalecer el sistema inmune y la consecuente resistencia a enfermedades (Selim y Reda, 2015).
El uso de extractos de origen vegetal es otra estrategia para controlar patógenos microbianos de manera amigable con el ambiente. Al respecto, Arome et al., 2018 reportan la inhibición del crecimiento in vitro de Streptococcus agalactiae con la adición de extractos de ajo (Allium sativum), cebolla (Allium tuberosum y de hojas de betel (Piper betle), y en las pruebas in vivo, reportan la ausencia de mortalidad de individuos de tilapia infecta-dos con S. agalactiae con el tratamiento a través del alimento peletizado incluido el extracto de P. betle a dosis de 0.15mg mL-1. Para el control de la bacteria antes mencionada, S. agalactiae se demuestra su eficacia en tilapia con el uso del extracto etanólico de las hojas de Rhodonyrtus tomentosa (Na-Phatthalung et al., 2017). Control de otras bacterias, Citrobacter freundii y Aeromonas en O. niloticus logran resultados favorables con la aplicación de extractos acuosos de Azadrina indica (Thanigaivel et al., 2015). Así también en el control de Pseudomonas anguilliseptica en tilapia han utilizado extractos de Cassia alata y otras especies de plantas (Phumkhachorn y Rattanachaikunsopon, 2015). En relación a la infección bacteriana en tilapia por Flavobacterium columnare observan su control al ser expuestos a través de una inmersión a diferentes concentraciones del extracto acuoso de Centella asiática (Rattanachaikunsopon y Phumkhachom, 2010).
Otra especie vegetal, que atrae especial atención es Caesalpinia spinosa "tara", ha sido estudiada in vitro y se reporta la inhibición de bacterias gram positivas y gram negativas, como Bacillus subtilis, Enterococcus foescium, Listeria monocytogenes, Staphilococcus aureus, Escherichia coli, Pseudomonas fluorescens, Salmonella enteritidis (Aguilar-Galvez et al., 2014).
No existen reportes sobre uso de C. spinosa para el control de F. columnare y siendo una enfermedad frecuente y de continua reinfección en cultivos de tilapia, es necesario estudios para su erradicación temporal o permanente a fin de evitar muertes masivas y/o constituir un foco de infección de otros patógenos. Esta investigación es la primera sobre el uso del extracto de C. spinosa in vivo en especies
acuáticas. Se tuvo como objetivo inducir la enfermedad producida por F. columnare en tilapia y demostrar la efectividad de la terapia in vivo mediante el uso del extracto acuoso de C. spinosa, así también, evaluar la inocuidad del extracto de C. spinosa en los peces de tilapia durante el tratamiento.
2. Materiales y métodos
Material biológico. En la investigación se emplearon: frutos secos de C. spinosa de un cultivo de Chao, La Libertad, Perú (Latitud 8°36'49.47"S, Longitud 78°43'51.61"O) y una población de individuos sanos de O. niloticus, juveniles y adultos del Centro Experimental de Genética de la Universidad Nacional de Trujillo (Latitud 8° 6'44.66"S, Longitud 79° 2'19.52"O).
Obtención del extracto de C. spinosa. Se pesaron 200 g de vainas secas de C. spinosa (Figura 1), luego se agregó en un recipiente de vidrio conteniendo 1 litro de agua apta para peces. Se calentó en una cocina hasta lograr la ebullición (100 °C), luego de 10 minutos de ebullición se dejó enfriar y se filtró utilizando una gasa limpia. En base al peso del fruto utilizado (200 g) de C. spinosa en un litro de agua, se consideró la concentración inicial del extracto en 0,2 g/ml.
Aislamiento, cultivo e identificación de F. columnare. De dos individuos de O. niloticus con signos de la enfermedad se tomaron muestras del borde de las heridas y se procedió a la siembra en el medio G según las indicaciones de Gao y Gaunt (2016). Se observó el crecimiento de las bacterias a 28 °C. De las colonias iniciales se realizaron las réplicas y se obtuvieron los subcultivos, las que fueron identificadas por PCR. El manejo de muestras de tejidos de peces infectados y los cultivos de F. columnare fue realizado en la cabina de bioseguridad Clase II A2 marca ESCO.
Identificación molecular de F. columnare. De las muestras de sub cultivos de bacterias (F. columnare) se procedió la identificación molecular por PCR. Se utilizaron los cebadores:
FcFd
TGCGGCTGGATCACCTCCTTTCTAGAGACA
y
FcRs
TAATYRCTAAAGATGTTCTTTCTACTTGTTTG
reportados por Panangala et al. (2007) y los cebadores: ColF CAGTGGTGAAATCTGGT y ColR GCTCCTACTTGCGTAGT (Darwish et al., 2004). Para ello, se hizo la extracción del ADN (Prieto et al., 2017), la amplificación del ADN y electroforesis de los productos PCR (Panangala et al., 2007). La concentración y calidad del ADN extraído se determinó en un espectrofotómetro modelo Genesys 10 Bio UV-Visible Thermo Fisher Scientific, la amplificación del ADN en un termociclador Veriti 96 marca Applied Biosystems y la lectura de geles en el documentador de geles ChemiDoc XRS marca Bio-Rad.
Exposición de los peces a la bacteria F. columnare. Los peces de tilapia gris de peso promedio de 55 ± 10 g, sanos y libres de lesiones, fueron distribuidos en 4 tanques de fibra de vidrio de 1000 L de agua, 30 individuos por tanque. Después de 10 días de aclimatación, los peces fueron infectados de dos maneras: una, por vía intramuscular la cantidad de 0,2 ml de la dilución bacteriana en 1 x 107 UFC/ml y otra, infección por inmersión por 24 horas (200 ml de cultivo de 1 x 107 UFC/ml), concentraciones utilizadas en base a las referencias investigaciones previas (Bader et al., 2003; Figueiredo et al., 2005).
Tratamiento de los peces enfermos con el extracto de C. spinosa. Se consideró los siguientes 4 tratamientos:
Peces enfermos criados solo en agua.
Peces enfermos con adición del extracto de C. spinosa.
Peces sanos criados solo en agua
Peces con adición del extracto de C. spinosa.
Los peces enfermos, presentaron úlceras visibles, los que fueron seleccionados teniendo en cuenta la uniformidad en el grado de lesiones y distribuidos de manera aleatoria en dos grupos de 10 peces en cada acuario de capacidad de 280 L, un grupo de peces enfermos criados solo en agua y otro grupo de enfermos criados en agua más el extracto de C. spinosa (concentración final de 0,14 mg/ml). Así
también se consideró la evaluación de peces sanos, distribuidos de manera aleatoria en dos grupos, 10 peces en cada uno, un grupo fue criado solo en agua y el otro grupo de peces sanos fue criado en agua más el extracto de C. spinosa (concentración final de 0,14 mg/ml). Se realizó tres repeticiones en un diseño en bloques al azar.
En todos los casos, se utilizó la misma cantidad de agua de crianza de peces con un sistema de aireación constante, temperatura del agua 26 ± 1 °C, recambios del 30% de agua cada dos días, eliminación de sólidos y alimentación, dos veces al día en una proporción de 2% del peso corporal del individuo.
Toma de datos. En la primera etapa, se obtuvo los peces enfermos, se determinó el porcentaje de individuos enfermos mediante la observación de lesiones en la piel y aletas durante 30 días de cultivo de tilapia, de acuerdo a la forma de infección. En la segunda etapa, tratamiento de los peces enfermos con C. spinosa, se estimó el porcentaje de peces enfermos y porcentaje de sobrevivientes después de 15 días de tratamiento.
Análisis estadístico. La comparación de los valores promedio del porcentaje de enfermos y el porcentaje de sobrevivencia de tilapia se hizo mediante el análisis de varianza y prueba de Tukey con un nivel de significancia de α = 0,05.
3. Resultados y discusión
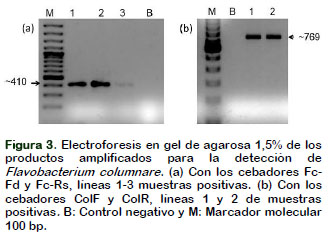
Las ulceraciones en las aletas y cuerpo de las tilapias fueron indicadores de infección bacteriana de F. columnare (Figura 2), las que fueron confirmadas por PCR con dos marcadores alelo específicos. El tamaño del fragmento de PCR para los cebadores Fc-Fd y Fc-Rs fue de 410,07 ± 2,54 bp y con los cebadores ColF y ColR, el tamaño del fragmento PCR fue de 769,40 bp (Figura 3).
La enfermedad producida por F. columnare es conocida por la enfermedad columnaris y constituye la enfermedad no solamente de tilapia. Infecta diferentes especies de peces tanto de aguas cálidas como de aguas frías y en diferentes lugares del mundo. Evenhuis y LaFrentz (2016) reportó F. columnare con diferente grado de virulencia en Oncorhynchus mykiss y recientemente, Faisal et al. (2016) realizaron 305 aislamientos de F. columnare en diferentes especies de peces. La intervención para su control es indispensable por la gravedad en las lesiones en diferentes partes del cuerpo y con bacterias asociadas, que afectan órganos internos, branquias, hígado y riñones, que pueden causar hemorragias y procesos septicémicos en diferentes especies de peces (Eissa et al., 2010).
La identificación de F. columnare fue posible con la prueba reacción en cadena de la polimerasa (PCR) con los cebadores propuestos por Darwish et al. (2004) y Panangala et al. (2007) (Figura 2). Los tamaños de los productos de la PCR fueron concordantes con los resultados de los autores mencionados. Se registraron resultados positivos y negativos de manera coincidente con ambos pares de cebadores evaluados en las mismas muestras. Las secuencias del gen rDNA de F. columnare demuestran su alto grado de conservación, por lo que los distintos cebadores diseñados en base a esas secuencias hacen posible su identificación y demuestran a su vez, diferencias entre distintas razas de F. columnare de diferentes regiones geográficas o dentro de un área geográfica (Rath et al., 2016) y por lo mismo, la variación fenotípica del grado de infección en los peces y la variación fenotípica en los tipos de colonias (Decostere, 1999).
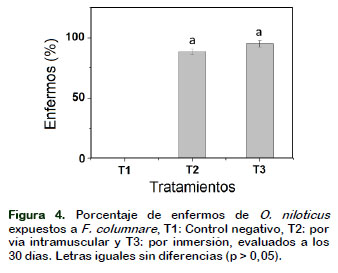
De los peces infectados por vía intramuscular y por inmersión en la bacteria F. columnare, los peces enfermos se presentaron en 95,7% y 88,34% ± 2,36%, respectivamente, presentaron lesiones cutáneas evaluadas después de 7 a 30 días (Figura 4), los peces infectados presentaron úlceras en la piel y/o en las aletas en menor y mayor grado, mientras que los peces control se mantuvieron sanos.
Figura 4. Porcentaje de enfermos de O. niloticus expuestos a F. columnare, T1: Control negativo, T2: por vía intramuscular y T3: por inmersión, evaluados a los 30 días. Letras iguales sin diferencias (p > 0,05).
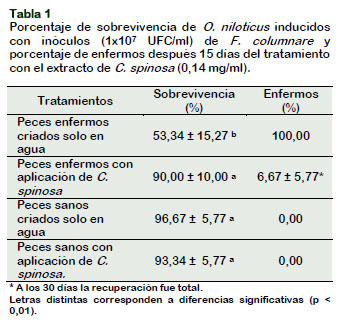
Los resultados del segundo experimento, se muestran en la Tabla 1, la sobrevivencia en los controles, peces sanos criados solo en agua y en agua más el extracto de C. spinosa fue de 96,67% y 93,34% ± 5,77%, respectivamente, y en el grupo de peces enfermos criados solo en agua fue 53,34% ± 15,27% y el 100% estuvieron enfermos, aquellos peces enfermos tratados con C. spinosa la sobrevivencia fue 90,00% ± 10% y la recuperación de la enfermedad fue total a los 30 días.
La variación del porcentaje de mortalidad por la enfermedad F. columnare se reporta entre el 10% al 70% (Dong et al., 2014; Srisapoome y Areechon, 2017). La patogenicidad heterogénea que se presenta en las poblaciones de O. niloticus dependerá de las diferencias genéticas para la resistencia contra el patógeno (Wonmongkol et al., 2017), al grado de virulencia de F. columnare (Kunttu et al., 2012), a la co-infección simultánea con otros patógenos, la severidad de la enfermedad aumenta (Xu et al., 2014), a las condiciones ambientales como la temperatura, presencia de compuestos orgánicos en el agua, y variación en la densidad de los peces (Declercq et al., 2013).
La acción bactericida de C. spinosa fue comprobada in vitro en investigaciones anteriores (Akiyama et al., 2001). Entre los metabolitos con acción antibacteriana presentes en C. spinosa se cita a los galotaninos (Akiyama et al., 2001), con base en los estudios sobre el ácido tánico con actividad inhibitoria del crecimiento de bacterias intestinales (Kyaw et al., 2013) y del ácido tánico como inhibidor del Staphylococcus aureus resistente a la meticilina (Akiyama et al., 2001), entre otras investigaciones.
Sin embargo, otros investigadores sostienen que la actividad bactericida se debería a componentes no tánicos, como los diterpenos de tipo cassane, que fueron aislados de diferentes especies de plantas, entre ellas, Caesalpina sp con efecto antibacteriano contra el crecimiento de Plasmodium falciparum y Candida spp (Maurya et al., 2012). Recientemente, se han descrito seis tipos de diterpenos de tallos y hojas de C. spinosa: isoneocaesalpin H. Caespinosin A, caespinosin B, caespinosin C, caespinosin D, caespinosin E con acciones farmacológicas (He et al., 2015).
Los ensayos con extractos acuoso, etanólico, hidrolizado e hidroalcohólico de C. spinosa no solamente tienen efectos antimicrobianos, sino también buena actividad antioxidante en diferentes ensayos in vitro (DPPH, TEA, radical hidroxilo, radical superóxido) (Valachová et al., 2014).
En esta investigación se ha probado que el extracto acuoso in vivo de C. spinosa en tilapia es efectivo para controlar F. columnare y probablemente, también el control de bacterias asociadas, pues se ha evidenciado la curación de las lesiones epidérmicas y la sobrevivencia de los peces es tan igual que los peces criados solo en agua. En la acuicultura, el uso de extracto de C. spinosa puede constituir un producto orgánico efectivo para controlar distintas bacterias, y evitar los altos costos que implica el uso de antibióticos sintéticos.
4. Conclusión
La investigación ha permitido llegar a las siguientes conclusiones: Se identificó la presencia de F. columnare en las úlceras de O. niloticus y se demostró la efectividad
del control de F. columnare en tilapia con la aplicación de extracto acuoso de Caesalpinia spinosa en el agua de crianza de los peces enfermos. Se demostró la inocuidad del extracto de la tara en los peces y la prevención de enfermedades infecciosas en tanques con alta densidad de peces.
Con una dosificación adecuada del extracto de C. spinosa se puede reemplazar el uso de antibióticos químicos con efectividad en el desarrollo de especies acuáticas, en acuarios y en estanques de crianza de tilapia sin efectos secundarios en los individuos y sin dañar el medio ambiente.
Agradecimientos
Al Dr. Julio León por su asesoría en los protocolos de estandarización de las pruebas moleculares (Reacción de cadena de la polimerasa, PCR) y a la estudiante Nataly Reategui por su colaboración en la crianza de los peces de tilapia.
Referencias Bibliográficas
Aguilar-Galvez, A.; Noratto, G.; Chambia, F.; Debastec, F.; Campos, D. 2014. Potential of tara (Caesalpinia spinosa) gallotannins and hydrolysates as natural antibacterial compounds. Food Chemistry 156: 301-304. [ Links ]
Akiyama, H.; Fujii, K.; Yamasaki, O.; Oono, T.; Iwatsuki, K. 2001 Antibacterial action of several tannins against Staphylococcus aureus. Journal of Antimicrobial Chemotherapy 48(4): 487-491. [ Links ]
Arome A.G.; Thanh D.H.; Rattanarojpong T.; Senapin S.; Rugmini S.K. 2018. Piper betle Leaf Extract Inhibits Multiple Aquatic Bacterial Pathogens and In Vivo Streptococcus agalactiae Infection in Nile Tilapia. Turkish Journal of Fisheries and Aquatic Sciences 18: 671-680. [ Links ]
Bader J. A.; Shoemaker C.A.; Phillip H. Klesius P. H. 2003. Rapid detection of columnaris disease in channel catfish (Ictalurus punctatus) with a new species-specific 16-S rRNA gene-based PCR primer for Flavobacterium columnare. Journal of Microbiological Methods 52: 209– 220. [ Links ]
Balasubramanian, G.; Sarathi, M.; Kumae, S.R.; Hameed, A.S.S. 2007. Screening the antiviral activity of Indian medicinal plants against white spot syndrome virus in shrimp. Aquaculture 263(1-4): 15-19. [ Links ]
Conroy, G. 2010. Importantes enfermedades detectadas en tilapias cultivadas en América Central y del Sur. Jornadas de Acuicultura. Costa Rica. Disponible en: https://es.scribd.com/doc/28949774/Enfermedades-en-Tilapias-Cultivadas-en-Las-Americas. [ Links ]
Darwish, A.M.; Ismaiel, A.A.; Newton, J.C.; Tang, J. 2004. Identification of Flavobacterium columnare by a species-specific polymerase chain reaction and renaming of ATCC43622 strain to Flavobacterium johnsoniae. Molecular and Cellular Probes 18: 421-427. [ Links ]
Declercq A.M.; Haesebrouck F.; Vanc den Broeck W.; Bossier P.; Decostere A. 2013. Columnaris disease in fish: a review with emphasis on bacterium-host interactions. Veterinary Research 44(1): 27. [ Links ]
Decostere, A.; Haesebrouck, F.; Charlier, G.; Ducatelle, R. 1999. The association of Flavobacterium columnare strains of high and low virulence with gill tissue of black mollies (Poecilia sphenops). Veterinary Microbiology 67(4): 287-298. [ Links ]
Dong, H.T.; LaFrents, B.; Pirarat, N.; Rodkhum, C. 2014. Phenotypic characterization and genetic diversity of Flavobacterium columnare isolated from red tilapia, Oreochromis sp., in Thailand. Journal of Fish Diseases 38: 901-913. [ Links ]
Eissa, A.E.; Zaki, M.M.; Aziz, A.A. 2010. Flavobacterium columnare/ Myxobolus tilapia e Concurrent Infection in the Earthen Pond Reared Nile Tilapia (Orechromis niloticus) during the Early Summer. Ibc Interdisciplinary Bio Central 2(5): 1-10. [ Links ]
Evenhuis J.P.; LaFrentz B.R. 2016. Virulencia de Flavobacterium columnare genomovars en trucha arco iris Oncorhynchus mykiss. Diseases of Aquatic Organisms 120(3): 217-24. [ Links ]
Faisal M.; Diamanka A.; Loch T.P.; LaFrentz B.R.; Winters A.D.; Garc-Ia J.C.; Toguebaye B.S. 2016. Isolation and characterization of Flavobacterium columnare strains infecting fishes inhabiting the Laurentian Great Lakes basin. Journal of Fish Diseases 39(6): 649-655. [ Links ]
Figueiredo H.C.P.; Klesius P-H-; Arias C.R.; Evans J.M; Shoemaker C.A.; Pereira Jr. D.J.; Peixoto M.T.D. 2005. Isolation and characterization of strains of Flavobacterium columnare from Brazil. Journal of Dish Diseases 28: 199-204. [ Links ]
Foscarini, R. 1989. Induction and development of bacterial gill disease in the eel (Anguilla japonica) experimentally infected with Flexibacter columnaris: Pathological changes in the gill vascular structure and in cardiac performance. Aquaculture 78(19): 1-20. [ Links ]
Gao, D.X.; Gaunt, P.S. 2016. Development of new G media for culture of Flavobacterium columnare and comparison with other media. Aquaculture 463: 113-122. [ Links ]
He, D.; Li, Y.; Tag, H.; Ma, R.; Li, X.; Wang, L. 2015. Six new cassane diterpenes from the twigs and leaves of tara (Caesalpinia spinose Kuntze). Fitoterapia 105: 273.277. [ Links ]
Hernández-Serrano, P. 2005. Responsible use of antibiotics in aquaculture. FAO Fisheries Technical Paper 469. Disponible en: http://www.fao.org/3/a-a0282e.pdf [ Links ]
Huicab-Pech Z.G.; Castañeda-Chavez M.R.; Lango Reynoso F. 2017. Pathogenic Bacteria in Oreochromis niloticus Var, Stirling Tilapia Culture. Fisheries Aquaculture Journal 8(2): 1-7. [ Links ]
Iwashita, M.K.; Nakandakare, I.B.; Terhune, J.S.; Wood, T.; Ranzani-Paiva, M.J. 2015. Dietary supplementation with Bacillus subtilis, Saccharomyces cerevisiae and Aspergillus oryzae enhance immunity and disease resistance against Aeromonas hydrophila and Streptococcus iniae infection in juvenile tilapia Oreochromis niloticus. Fish and Shelfish Immunology 43(1): 60-66. [ Links ]
Kunttu, H.M.T.; Sundberg, L.R.; Pulkkinen, K.; Tellervo, V.E. 2012. Environment may be the source of Flavobacterium columnare outbreaks at fish farms. Environmental Microbiology Reports 4(4): 398-402. [ Links ]
Kyaw, B.M.; Lim,Ch. S.; Zhou, W. 2013. Tannic acid as phytochemical potentiator for antibiotic resistance adaptation. APCBEE Procedia 7: 175-181. [ Links ]
Maurya, R.; Ravi, M.; Singh, S.; Yadav, P.P. 2012. A review on cassane and nor cassane diterpenes and their pharmacological studies. Fitoterapia 83: 212-280. [ Links ]
Mohammed, H.H.; Arias, C.R. 2015. Potassium permanganate elicits a shift of the external fish microbiome and increases host susceptibility to columnaris disease. Veterinary Research 46: 82. [ Links ]
Na-Phatthalung P.; Chusri S.; Suanyuk N.; Voravuthikunchai D.P. 2017. In vitro and in vivo assessments of Rhdomyrtus tomentosa leaf extract as an alternative anti-strectococcal agent in Nile tilapia (Oreochromis niloticus L.). Journal of Medical Microbiology 66(4): 430-439. [ Links ]
Panangala, V.S.; Shoemaker, C.A.; Van Santen V.L.; Dybvig, K.; Klesius, P.H. 2007. Multiplex-PCR for simultaneous detection of 3 bacterial fish pathogens, Flavobacterium columnare, Edwardsiella ictaluri, and Aeromonas hydrophila. Diseases of Aquatic Organisms 74: 199-208. [ Links ]
Patra A.; Sarker S.; Banerjee S.; Adikesavalu H.; Biswas D.; Jawahar A. T. 2016. Rapid Detection of Flavobacterium columnare Infection in fish by Species Specific Polymerase Chain Reaction. Journal of Aquaculture Research Development 7: 9. [ Links ]
Phumkhachorn P.; Rattanachaikunsopon P. 2015. Use of Cassia alata aqueous extract as a bath treatment to control Pseudomonas anguilliseptica infection in tilapia (Oreochromis niloticus). Archives of Biological Science Belgrade 67(4): 1165-1172. [ Links ]
Prieto Z.; Arqueros M.; Sanchez-Tuesta L.; Salirrosas D. 2017. PCR en tiempo real para el sexaje y análisis citológico de la sinapsis del bivalente más pequeño en espermatocitos en paquiteno de Oreochromis niloticus. Scientia Agropecuaria 8(4): 337-347. [ Links ]
Rath S.S.; Roy P.; Sahoo S.L.; Das B.K. 2016. Molecular Characterization and Phylogenetic Analysis of Seven Flavobacterium columnare Strains Isolated from Freshwater Fishes of Eastern India. Journal of Infection and Molecular Biology 4(2): 16-23. [ Links ]
Rattanachaikunsopon P.; Phumkhachorn P. 2010. Use of asiatic pennywort Centella asiatica aqueous extract as a bath treatment to control columnaris in Nile tilapia. Journal of Aquatic Animal Health 22(1): 14-20. [ Links ]
Rintamäki-Kinnunen P.; Bernardet J-F.; Bloigu A. 1997. Yellow pigmented filamentous bacteria connected with farmed salmonid fish mortality. Aquaculture 149: 1-14. [ Links ]
Selim, K.M.; Reda, R.M. 2015. Improvement of immunity and disease resistance in the Nile tilapia, Oreochromis niloticus, by dietary supplementation with Bacillus amyloliquefaciens. Fish Shellfish Immunol 44(2): 496-503. [ Links ]
Srisapoome P.; Areechon N. 2017. Efficacy of viable Bacillus pumilus isolated from farmed fish on immune responses and increased disease resistance in Nile tilapia (Oreochromis niloticus): laboratory and on-farm trials. Fish and Shellfish Immunology 67: 199-210. [ Links ]
Thanigaivel, S.; Vijayakumar, S.; Gopinath, S.; Mukherjee, A.; Chandrasekaran, N.; Thomas, J. 2015. In vivo and in vitro antimicrobial activity of Azadir achtaindica (Lin) against Citrobacter freundii isolated from naturally infected tilapia (Oreochromis mossambicus). Aquaculture 437: 252-255. [ Links ]
Valachová, K.; Toolská, D.; Nagy, M.; Gaidau, C.; Niculescu, M.; Matyasovký, J.; Jurkovic, P.; Soltés L. 2014 Radical scavenging activity of Caesalpinia spinosa. Neuro Endocrinol Lett 35(2): 197-200. [ Links ]
Verma D.K.; Rathore G. 2013. Molecular characterization of Flavobacterium columnare isolated from a natural outbreak of columnaris disease in farmed fish, Catla catla from India. The Journal of General and Applied Microbiology 59(6): 417-24. [ Links ]
Wonmongkol P.; Sukhavachana S ; Ampolsak K .; Srisapoome P .; Suwanasopee T .; Poompuang S . 2017. Genetic parameters for resistance against Flavobacterium columnare in Nile tilapia Oreochromis niloticus (Linnaeus, 1758). Journal of Dish Diseases 1-8. [ Links ]
Xu, W.; Zhu, X.; Wang, X.; Deng, L.; Zhang, G. 2006. Residues of enrofloxacin, furazolidone and their metabolites in Nile tilapia (Oreochromis niloticus). Aquaculture 254(1-4): 1-8. [ Links ]
Xu D.H.; Shoemaker C.A.; LaFrentz B.R. 2014. Enhanced susceptibility of hybrid tilapia to Flavobacterium columnare after parasitism by Ichthyophthirius multifiliis. Aquaculture 430: 44-49. [ Links ]
* Corresponding author
E-mail: zap199@yahoo.com (Z. Prieto).
Received November 21, 2017.
Accepted May 16, 2018.