Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Scientia Agropecuaria
Print version ISSN 2077-9917
Scientia Agropecuaria vol.9 no.2 Trujillo Apr./Jun. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.02.07
ARTÍCULOS ORIGINALES
Apósito a base de Vaccinium corymbosum L. y quitosano con alta capacidad regenerativa de piel
Dressing based on Vaccinium corymbosum L. and chitosan with high skin regenerative capacity
María E. Luján de Pinedo1; Carmen I. Ayala-Jara2; Ericson F. Castillo Saavedra2; César A. Pinedo-Torres1; Iván González-Puetate1; Claudia S. Durand-Luján1
1 Escuela de Postgrado, Universidad Nacional de Trujillo, Trujillo, Perú.
2 Facultad de Farmacia y Bioquímica, Universidad Nacional de Trujillo, Trujillo, Perú.
Resumen
El estudio estuvo orientado en desarrollar un apósito a base de Vaccinium corymbosum L. y quitosano con alta capacidad regenerativa de piel. Se inició con la obtención del concentrado a partir del fruto de Vaccinium corymbosum L.; luego, se preparó un biofilm de quitosano al 1% p/v, al cual se incorporó el concentrado de Vaccinium corymbosum 10% p/v, para obtener el formulado final. El estudio experimental se basó en la distribución aleatoria de 24 ratas machos cepa albina Lewis en tres grupos de contraste: control, apósito de quitosano, y, apósito del concentrado de Vaccinium corymbosum 10% mas quitosano. Los resultados fueron evaluados en base a la evolución de cicatrización en el área lesionada de 0 a 21 días (nivel macroscópico), y, en el estudio histológico de cicatrización (nivel microscópico). Se concluye que el desarrollo de un apósito de Vaccinium corymbosum L. 10% y quitosano con calidad farmacéutica presentó significativamente mejor capacidad regenerativa al promover la aceleración de la cicatrización de la herida mediante la reducción del área lesionada desde los 7 días de tratamiento, e incrementó la promoción de los procesos de epitelización, neo vascularización, y, proliferación de fibroblastos y colágeno.
Palabras clave: Vaccinium corymbosum L.; apósito; quitosano; regeneración; piel.
Abstract
The study was aimed at developing a dressing based on Vaccinium corymbosum L. and chitosan with high skin regenerative capacity. Started with the obtaining of the concentrate from the fruit of Vaccinium corymbosum L.; then, a 1% w/v chitosan biofilm was prepared, to which the Vaccinium corymbosum 10% w/v concentrate was incorporated, to obtain the final formulation. The experimental study was based on the random distribution of 24 male Lewis albino strain rats in three contrast groups: control, chitosan dressing, and 10% plus chitosan Vaccinium corymbosum concentrate dressing. The results were evaluated based on the evolution of healing in the injured area from 0 to 21 days (macroscopic level), and, in the histological study of scarring (microscopic level). It is concluded that the development of a dressing of Vaccinium corymbosum L. 10% and chitosan with pharmaceutical quality presented significantly better regenerative capacity by promoting the acceleration of wound healing by reducing the injured area from 7 days of treatment, and increased the promotion of the processes of epithelialization, neovascularization, and proliferation of fibroblasts and collagen.
Keywords: Vaccinium corymbosum L.; dressing; chitosan; regeneration; skin.
1. Introducción
La piel es considerada como el órgano más extenso del ser humano, encargado de la regulación de la temperatura corporal, proporciona soporte a los vasos sanguíneos y nervios, participa en la prevención de la deshidratación, procesos de detección sensorial y como barrera externa entre el organismo y el medio ambiente, manteniendo de esta manera, la homeostasis interna, al reducir la fricción de los elementos externos (Meruane y Rojas, 2012; Valencia et al., 2016).
En condiciones normales, la piel tiene la capacidad de la autorregeneración, y este aspecto es importante porque cada año en el mundo, cientos de miles de pacientes requieren hospitalización por quemaduras, siendo el tratamiento más convencional el uso de injertos de piel, los cuales compensarían la pérdida de tejido en múltiples niveles, actuando como apósitos oclusivos contra las heridas (Boucard et al., 2007; Valencia et al., 2016).
En este sentido, una herida representa la perturbación de la estructura anatómica y fisiológica normal de la piel, por lo que, tras una lesión, el tejido cutáneo dañado inicia de forma natural un proceso de reparación, denominado cicatrización (Guarín et al., 2013; Mordon y Trelles, 2011; Pelegrino y Seabra, 2017).
La cicatrización es un proceso de reparación espontánea y dinámica en el tejido lesionado mediado por proteínas solubles (citosinas y factores de crecimiento) y células encargadas de la proliferación celular, que consiste en fases de hemostasia, inflamación, proliferación y remodelación (Guarín et al., 2013; Mordon y Trelles, 2011; Pelegrino y Seabra, 2017; Valencia, 2010; Vargas, 2014).
La cicatrización es un mecanismo que depende de la hemostasis y de un estado inflamatorio inicial, causado por la lesión, y se conoce como fase aguda. Posteriormente entra en una fase proliferativa de células epidermales, endoteliales y de fibroblastos, que generarán un tejido de granulación inicial. Luego sobreviene una fase inflamatoria tardía, caracterizada por neovascularización y dependiente de factores regulatorios como: Factor de Crecimiento Endotelial Vascular (VEGF), diferentes neurotrofinas que estimulan la proliferación, la actividad quimiotáctica y la supervivencia de diferentes poblaciones celulares en piel, encargados de generar una nueva matriz de colágeno. Finalmente se forma una escara y se produce el remodelamiento del tejido de granulación, con la generación de nuevas fibras de colágeno y la diferenciación de los fibroblastos en miofibroblastos, que aumentan la fuerza tensil y permiten la aproximación de los bordes de la lesión (Valencia, 2010).
En la actualidad, diversos estudios sugieren la utilización de apósitos a base de quitosano, que cumplirían la función de absorber los exudados y componentes tóxicos de las heridas superficiales, preservar un alto nivel de humedad en la superficie de la herida, permitir el intercambio gaseoso, proporcionar aislamiento térmico, proteger la herida de la penetración de bacterias, ser no tóxico, promover la regeneración y el crecimiento del tejido nuevo, y, ser eliminado fácilmente (Bakar et al., 2013; Boucard et al., 2007; Fahmy et al., 2018; Gyeung et al., 2018; Lan et al., 2017; Tchemtchoua et al., 2011; Valencia et al., 2016).
El quitosano es un polímero natural derivado de la desacetilación de la quitina, de gran interés en la elaboración de biomateriales en la regeneración de tejidos, y por la presencia de grupos amino e hidroxilo, podría ser utilizado en formulaciones con extractos derivados de especies vegetales, debido a que exhibe excelentes propiedades de ligandos y de formación de películas, andamios y geles, generando una acción sinérgica al crear una matriz muy favorable para el crecimiento celular, imitando de manera eficaz la matriz extracelular de varios tejidos (Haixia et al., 2018; Jang et al., 2018; Naseri y Ziora, 2018; Stephen et al., 2018; Valencia et al., 2016; Yu et al., 2018). Vaccinium corymbosum L. es un arbusto frutal de la familia Ericaceae, originario de América del Norte, crece bien en suelos ácidos (pH≤5,5), y presenta un alto contenido de antocianinas en su composición. En diversos estudios se ha demostrado que las antocianinas tienen la capacidad de neutralizar radicales libres (antioxidante), y considerando que los procesos de lesiones cutáneas presentan procesos oxidativos, un apósito formulado a partir de Vaccinium corymbosum L. y quitosano podría ser utilizado en procesos regenerativos de piel (Abreu et al., 2008; Carrillo et al., 2015; Faria et al., 2005; Figueiredo y Lima, 2015; Guerrero et al., 2010; Loyola et al., 2016; Seong et al., 2018; Song, 2015).
Por lo expuesto, se planteó desarrollar un apósito de Vaccinium corymbosum para regeneración de la piel, a un costo accesible a la población y con productos nativos de nuestro país.
2. Materiales y métodos
Material
Se utilizaron los frutos de Vaccinium corymbosum L. recolectados en el distrito de Virú (82º26’00’’L.S., 78º48’00’’L.O., a 68 m.s.n.m.), provincia de Trujillo, región La Libertad –Perú, que fueron acondicionados a una temperatura de -5 ± 3 °C, después se procedió a hacer la selección del material vegetal, los frutos que no tuvieran daño en la cáscara, con madurez adecuada, buena textura, tamaño uniforme y frescos. Se descartaron los frutos maduros, verdes o con algún daño; esta limpieza permitió desechar totalmente cualquier sustancia extraña. Los frutos seleccionados se procedieron a lavar cuidadosamente bajo chorro de agua potable, luego fueron lavados con agua destilada, y se secó mediante escurrido (Rodríguez y Morales, 2015).
La identificación taxonómica se realizó en el Herbarium Truxillensis de la Universidad Nacional de Trujillo, La Libertad, Perú, donde se le asignó el N° 58861.
Método
La metodología utilizada en el desarrollo de un apósito de Vaccinium corymbosum L. para regeneración de piel se basó en la preparación del concentrado, formulación del apósito y ensayo experimental.
Preparación del concentrado del fruto de Vaccinium corymbosum L.
Se pesó 1 kg del fruto de Vaccinium corymbosum L. y se procedió a licuar en una proporción 1: 3 p/v de una solución etanólica de ácido cítrico al 1%, el licuado obtenido fue trasferido en frascos de vidrio color ámbar previamente esterilizados, luego se realizó la extracción de las antocianinas en bandejas de acero inoxidable con agitación constante a una temperatura de 36 °C durante dos horas, después se procedió a filtrar; posteriormente el extracto obtenido se llevó a concentrar en rotavapor marca HEIDOLPH HB 4003 a una temperatura de 60 °C hasta la obtención de un concentrado de 500 mL (0,5g/mL), se guardaron en frascos color ámbar a -15°C para su posterior uso (Figueiredo y Lima, 2015; Guerrero et al., 2010).
Formulación del apósito de Vaccinium corymbosum L. y quitosano
La formulación del apósito se basó en la metodología realizada por Boucard et al. (2007), Martínez et al. (2014) y modificado por los autores, para lo cual se utilizó Quitosano (Qo), suministrado por SIGMA ALDRICH con un grado de desacetilación de 85 %, luego, se prepararon soluciones de Qo al 1% p/v en solución de ácido láctico al 1% p/v, disolviendo el Qo con agitación constante durante 3 horas.
Las soluciones se dejaron a temperatura ambiente durante la noche y luego se microfiltraron a una presión de 70 psi o 4,8 atm, a través de un filtro de microfibra de borosilicato, nitrato de celulosa de tamaño de poro de 0,45 µm. Se determinó pH y la turbidez de las soluciones filtradas. Las soluciones se dejaron en reposo en un refrigerador a 4 ºC durante 24 horas antes de ser utilizadas con el fin de eliminar las burbujas.
En el biofilm de quitosano se utilizaron 25 mL de solución filtrada de Qo sobre placas petri con medidas de 10x10x0,3 cm3, que fueron colocadas en una estufa a 40 ºC durante 16 horas hasta evaporar el agua, obteniéndose los biofilm de Qo en ácido láctico.
Los biofilm de Qo fueron sumergidos en un recipiente de vidrio PIREX® con medidas de 20x20x5 cm3, durante 5 minutos en 100 mL de una solución de hidróxido de sodio 0,1 M y luego lavados 2 veces y durante 10 minutos cada vez con 100 mL de una solución de agua – etanol (60:40) para eliminar el exceso de álcali. Posteriormente, los biofilm de quitosano fueron cuidadosamente estirados y puestos entre papeles de filtro y se les dejó secar durante 24 horas en un ambiente con humedad y temperatura controladas (50% de humedad relativa, 23 ºC de temperatura).
Finalmente, el biofilm de quitosano se mezcló con el concentrado de Vaccinium corymbosum 10% p/v, para obtener el formulado final.
Ensayo experimental
El estudio se realizó con 24 ratas machos cepa albina Lewis certificadas, con un promedio de peso de 300 g. cada una, para lo cual se consideró condiciones óptimas de alimentación, humedad relativa y temperatura. Después de 7 días, el médico veterinario procedió a realizar un examen de su estado sanitario y fisiológico.
Los protocolos de trabajo aplicados a los especímenes de experimentación, se basaron en estudios relacionados con efecto cicatrizante (Gallardo y Barboza, 2015; Mancebo et al., 2011; Martínez et al., 2014). Los especímenes fueron anestesiados con Ketamina 50 mg/kg vía intraperitoneal, se les realizó tricotomía (2,5 cm) con tijera y bisturí N° 21; el embrocado de la zona fue con gasa estéril embebida con Isodine espuma; a los seis minutos, a través de la técnica de infiltración local con bupivacaina al 0,5% se logró una analgesia del dorso del animal. Se realizó un segundo embrocado con Isodine solución 10 % con gasa estéril procediendo a ejecutar la incisión de 1,6±4 cm, con una pinza porta navaja, posteriormente se procedió a colocar el apósito sobre la herida.
Se realizó un esquema basado en tres grupos de contraste: control, constituido por 8 ratas, no recibieron tratamiento, sólo se limpió con yodo povidona solución 10% el área afectada; patrón, constituido por 8 ratas y se les aplicó apósito de quitosano; problema, constituido por 8 ratas y se le aplicó el apósito a base del concentrado de Vaccinium corymbosum 10% y quitosano. Posteriormente, cada rata lesionada recibió antibiótico (Cefazolina 15 mg/kg vía intramuscular) y analgésico (Meloxican 2 mg/Kg vía intramuscular) por dos días. Luego se colocó en su jaula y se les abrigó con una manta controlando la hipotermia, a la hora paso el efecto de la anestesia y las ratas poco a poco fueron alimentándose y bebiendo su agua.
Durante los 21 días, los especímenes evolucionaron adecuadamente, y se procedió a pesarlas una por una, posteriormente se les administró Ketamina 50 mg/kg seguido de Tiopental sódico 90 mg/kg por vía intraperitoneal. Se realizó la tricotomía de 3,5 cm con tijera y bisturí N° 21, el embrocado de la zona fue con gasa estéril embebida con yodo povidona espuma, luego se procedió a realizar el corte de la piel de 3 cm y se colocó en frascos con formol neutro al 10 % para proceder a su fijación por 25 horas, posteriormente, se realizó el estudio histológico.
Las muestras se cortaron de cuatro a cinco micras de espesor, usando el micrótomo, luego, se realizaron dos tipos de coloración: Hematoxilina – eosina y Tricrómica de Masson. La observación histológica se hizo con el microscopio óptico a cuatro (4X) y cuarenta (40X) aumentos.
Los resultados se analizaron en función a la observación microscópica. La medición en el análisis microscópico arrojó muestras de respuesta cuantitativas (migración epitelial desde el borde de la herida y número de vasos neoformados) y cualitativas (formación de fibras colágenas).
En el análisis de datos se utilizó medidas estadísticas como la media aritmética, análisis de varianza para un diseño completamente al azar y su correspondiente prueba de Duncan, ambas pruebas consideraron un nivel de significancia de 0,05.
3. Resultados y discusión
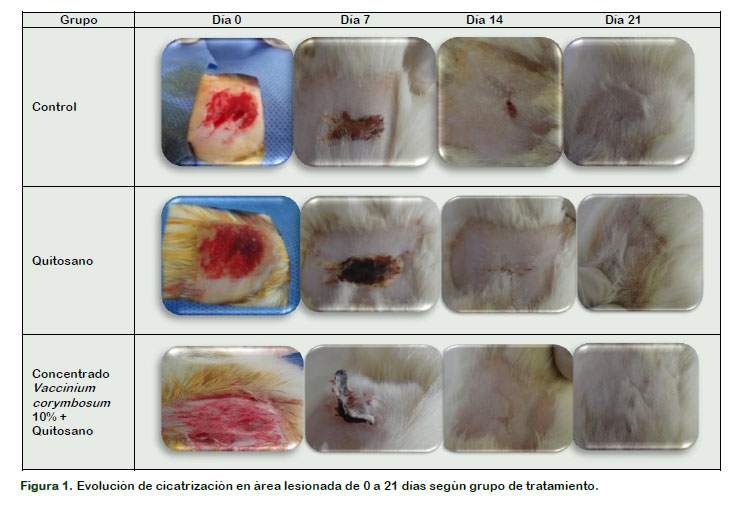
En la Figura 1 se puede observar que en el día 0, predomina la fase inflamatoria, que se caracteriza por una alta celularidad debido a la migración de neutrófilos, macrófagos y linfocitos al lugar de la lesión, promoviendo la hemostasia; por lo que la aplicación del apósito de Vaccinium corymbosum y quitosano proporcionó un ambiente húmedo después de la absorción de los exudados de la herida, además de protegerla de las infecciones secundarias, reducir la necrosis del lecho de la herida, proporcionar el intercambio gaseoso adecuado, regular y/o mediar en la liberación de ciertos factores de crecimiento y citoquinas (Haixia et al., 2018; Jang et al., 2018; Naseri y Ziora, 2018; Pelegrino y Seabra, 2017; Stephen et al., 2018; Valencia et al., 2016).
En el día 7 se observa diferencia estadísticamente significativa en la fase de curación entre el apósito de Vaccinium corymbosum y quitosano y los otros grupos de tratamiento (control y quitosano), y estos resultados evidenciarían una mayor formación de tejido de granulación, caracterizada por la proliferación de fibroblastos en el sitio de la herida y la producción de importantes componentes de la matriz extracelular, como elastina, colágeno y glicosaminoglicanos (Jang et al., 2018; Naseri y Ziora, 2018).
Del mismo modo, desde el día 14 al 21 se observa cambios significativos en la fase de remodelación (o formación de tejido cicatricial), el apósito de Vaccinium corymbosum y quitosano estaría promoviendo la sustitución del colágeno inmaduro de tipo III por colágeno tipo I maduro, el tejido se vuelve menos vascularizado, lo que finalmente conduce a la reparación completa del tejido de la piel. La fase de remodelación es la principal responsable de las diferencias en la calidad de las cicatrices y la formación de queloides. Los queloides y las cicatrices hipertróficas se caracterizan por un crecimiento anormal del tejido debido a la producción extensa de matriz extracelular, especialmente colágeno, que no está confinado al sitio original de la herida e invade los tejidos dérmicos adyacentes. Los componentes celulares principales en el proceso queloide son los fibroblastos, los queratinocitos, los melanocitos y los mastocitos. Los miofibroblastos son una forma diferente de fibroblastos que parecen estar ausentes, o mínimamente presentes, en las cicatrices queloides, en contraste con la situación en las cicatrices hipertróficas (Pan et al., 2017; Pelegrino y Seabra, 2017).
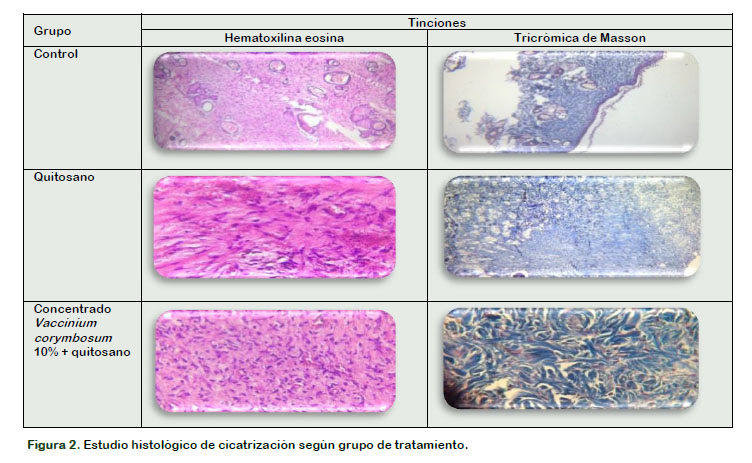
En la Figura 2 se aprecia las tinciones de hematoxilina eosina y tricrómica de Masson para los grupos control, quitosano y el concentrado de Vaccinium corymbosum L. 10% mas quitosano, evidenciando a nivel microscópico cambios signficativos entre los grupos de tratamiento analizados. Vaccinium corymbosum L. presenta antocianinas en su composición química, las cuales cumplen un rol importante en el proceso de cicatrización, ya que presentan una acción secuestrante de radicales libres, que estimulan la contracción de la herida y su cicatrización (Faria et al., 2005; Gallardo y Barboza, 2015; Seong et al., 2018).
En la tinción tricrómico de Masson, el grupo tratado con el apósito de Vaccinium corymbosum L. y quitosano, la dermis en regeneración presentó proliferación de fibras colágenas y neoformación de vasos sanguíneos. La epidermis se regeneró observándose la presencia de lámina basal; mientras que en la tinción hematoxilina eosina, la epidermis se regeneró con presencia de estrato basal, espinoso y esbozo de estrato granular.
Los resultados obtenidos coinciden con lo encontrado por Schencke et al. (2013), donde encontró con la aplicación de un apósito derivado de una especie vegetal una etapa fibroblástica proliferativa inicial observándose aún elementos inflamatorios agudos, y, la dermis presentó un tejido conectivo abundante en fibras colágenas regularmente dispuestas y neoformación de vasos sanguíneos.
En este sentido, las diferencias observadas en las respuestas de cicatrización entre los grupos de tratamiento, podrían deberse porque en la regeneración de tejido dérmico, la fagocitosis estimula un estrés oxidativo caracterizado por la producción de especies reactivas de oxígeno que puede conllevar a problemas en esta etapa inflamatoria como el daño en tejidos y células normales, y en consecuencia demorar o alterar el proceso de cicatrización (Haixia et al., 2018; Jang et al., 2018; Prior y Wu, 2013).
El uso de apósitos para heridas es una de las aplicaciones médicas más prometedoras para el quitosano, debido a su naturaleza adhesiva, su carácter bactericida y antifúngico, y su permeabilidad al oxígeno; pero la incorporación de un concentrado de Vaccinium corymbosum L. 10% potenciaría la actividad cicatrizante por la presencia de compuestos fenólicos y antocinaninas (Faria et al., 2005; Jayakumar et al., 2011; Jiménez, 2008; Pereira et al., 2013; Seong et al., 2018; Valencia et al., 2016).
El apósito de Vaccinium corymbosum L. y quitosano regularía la promoción de factores de crecimiento generados por las células implicadas en el proceso regenerativo como queratinocitos, fibroblastos y células inflamatorias. Asimismo, actuarían en la fase aguda o inflamatoria, donde se destaca el Factor de Crecimiento Transformante beta (TGFβ), Factor de Crecimiento Derivado de las Plaquetas (PDGF), y Factor Estimulante de Colonias de Granulocitos (G-CSF), junto con interleucinas implicadas en la inflamación (Delavary et al., 2011; Valencia, 2010; Yu et al., 2018).
Por tanto, el apósito elaborado a partir de Vaccinium corymbosum L. y quitosano representaría una innovación en los tratamientos regenerativos de piel por la utilización de especies de origen vegetal, porque en la literatura revisada se han encontrado estudios de quitosano con batroxobina con efectos positivos en procesos hemorrágicos (Gyeung et al., 2018); así como de KytoCel, un apósito de fibras no tejidas de quitosano donde se encontró que 19 de 30 participantes regeneraron la piel durante el tratamiento (Stephen et al., 2018). De la misma forma, Haixia et al. (2018) reportaron incremento de fibroblastos y una nueva epitelización mediante el tratamiento con un vendaje compuesto de quitosano, alginato y colágeno. Jang et al. (2018) encontró que las heridas tratadas con polvo dérmico/gelatina se asociaron con un incremento de fibroblastos, que se infiltraron en el lecho de la herida, así como gruesos paquetes de colágeno que se organizaron en matrices dendríticas, asemejándose a la piel normal.
Finalmente, el estudio representaría una alternativa farmacéutica para casos de regeneración de piel, incrementando el efecto sinérgico del quitosano, basado en el alto contenido de compuestos antioxidantes de Vaccinium corymbosum.
4. Conclusión
Se desarrolló un apósito de Vaccinium corymbosum L. 10% y quitosano con calidad farmacéutica que presentó mejor capacidad regenerativa al promover la aceleración de la cicatrización de la herida mediante la reducción del área lesionada a los 7 días y el aumento significativo en la epitelización, neovascularización, proliferación de fibroblastos y colágeno.
Se recomienda realizar ensayos clínicos con el apósito de Vaccinium corymbosum L. 10% y quitosano para evaluar la eficacia y seguridad de esta formulación, y de esta manera potenciar el efecto regenerativo de ambos productos de origen natural y proporcionar una alternativa de solución en la regeneración de la piel y mejorar la calidad de vida de los pacientes.
Referencias bibliográficas
Abreu, O.; Cuéllar, A.; Prieto, S. 2008. Fitoquímica del género Vaccinium (Ericaceae). Revista Cubana de Plantas Medicinales 13: 1-11. [ Links ]
Bakar, A.; Sukari, A.; Hassan, A.; Keong, C.; Noorsal, K; Zainol, I. 2013. In vitro characterization of a chitosan skin regenerating template as a scaffold for cells cultivation. SpringerPlus 2(1): 1-9. [ Links ]
Boucard, N.; Viton, C.; Agay, D.; Mari, E.; Roger, T.; Chancerelle, Y.; Domard, A. 2007. The use of physical hydrogels of chitosan for skin regeneration following third-degree burns. Biomaterials 28(1): 3478–3488. [ Links ]
Carrillo, R.; Guerrero, J.; Rodríguez, M.; Merino, C. 2015. Colonization of blueberry (Vaccinium corymbosum) plantlets by ericoid mycorrhizae under nursery conditions. Ciencia e Investigación Agraria 42(3): 365-374. [ Links ]
Delavary, M.; Van der, W.; Egmond, V.; Niessen, F.; Beelen, R. 2011. Macrophages in skin injury and repair. Immunobiology 216(7): 753–62. [ Links ]
Fahmy, H.; Aly, A.; Abou, A. 2018. A non-woven fabric wound dressing containing layer – by – layer deposited hyaluronic acid and chitosan. International Journal of Biological Macromolecules 114(1): 929-934. [ Links ]
Faria, A.; Oliveira, J.; Neves, P.; Gameiro, P.; Santos, C.; De Freitas, V.; Mateus, N. 2005. Antioxidant properties of prepared blueberry (Vaccinium myrtillus) extracts. Journal of Agricultural and Food Chemistry 53(17): 6896-6902. [ Links ]
Figueiredo, F.; Lima, V. 2015. Antioxidant activity of anthocyanins from quixabeira (Sideroxylon obtusifolium ) fruits. Revista Brasileira de Plantas Medicinais 17(3): 473-479. [ Links ]
Gallardo, G.; Barboza, L. 2015. Efecto cicatrizante del gel elaborado del látex de Croton lechleri "Sangre de Drago". Revista Científica Ciencia Médica 18(1): 10-16. [ Links ]
Guarín, C.; Quiroga, P., Landínez, N. 2013. Proceso de Cicatrización de heridas de piel, campos endógenos y su relación con las heridas crónicas. Revista de la Facultad de Medicina 61(4): 441-448. [ Links ]
Guerrero, J.; Ciampi, L.; Castilla, A.; Medel, F.; Schalchli, S.; Hormazabal, E.; Bensch, E.; Alberdi, M. 2010. Antioxidant capacity, anthocyanins, and total phenols of wild and cultivated berries in Chile. Chilean Journal of Agricultural Research 70(4): 538543. [ Links ]
Gyeung, S.; Mi, L.; Byeong, K.; Min, K.; Min, K.; Young, S.; Jong, K.; Tae, K.; Jong, P. 2018. Recombinant batroxobin-coated nonwoven chitosan as hemostatic dressing for initial hemorrhage control. International Journal of Biological Macromolecules 113(1): 757-763. [ Links ]
Haixia, X.; Xiuli, C.; Xianrong, S.; Ying, H.; Wei, C.; Qun, L.; Weihong, G.; Weihong, Y.; Xue, T.; Dengyon, H.; Dingwen, J.; Qingrong, W.; Yuming, L.; Qiong, L.; Kexian, L. 2018. Preparation of chitosan-collagenalginate composite dressing and its promoting effects on wound healing. International Journal of Biological Macromolecules 107(1): 93-104. [ Links ]
Jang, H.; Kim, Y.; Yoo, B.; Seo, Y. 2018. Wound-healing effects of human dermal components with gelatin dressing. Journal of Biomaterials Applications 32(6): 716-724. [ Links ]
Jayakumar, R.; Prabaharan, P.; Kumar, S.; Nair, S.; Tamura, H. 2011. Biomaterials based on chitin and chitosan in wound dressing applications. Biotechnology Advances 29(1): 322-337. [ Links ]
Jiménez, C. 2008. Curación avanzada de heridas. Revista Colombiana de Cirugía 23(3): 146-155. [ Links ]
Lan, S.; Erickson, A. Chien, F.; Zhang, M. 2017. Chitosan–poly (caprolactone) nanofibers for skin repair. Journal of Materials Chemistry B 5(1): 18221833. [ Links ]
Loyola, N.; Aguirre, F.; Godoy, O.; Arriola, M. 2015. Effect of sucralose and biostimulant on pre-and postharvest of blueberries (Vaccinium corymbosum L. cv. Elliot) under organic and conventional production systems. Acta Agronómica 65(2): 123129. [ Links ]
Mancebo, B.; Sánchez, L.; Díaz, S.; Bulnes, C.; Ivis A.; Escobar, A.; Cordero, E. 2011. Efecto cicatrizante de la pasta de clorofila-caroteno de Pinus caribaea var. caribaea sobre heridas abiertas asépticas. Revista Cubana de Plantas Medicinales 16(1): 2433. [ Links ]
Martínez, H.; Escobedo, A.; Méndez, E.; Vásquez, A.; Sol, M.; Osuna, A. 2014. Evaluación in vivo del efecto cicatrizante de un gel a base de quitosano obtenido de exoesqueleto de camarón blanco Litopenaeus vannamei. Revista Colombiana de Biotecnología 15(1): 45-50. [ Links ]
Meruane, M.; Rojas, M. 2012. Desarrollo de la piel y sus anexos en vertebrados. International Journal Morphology 30(4): 1422-1433. [ Links ]
Mordon, S.; Trelles, M. 2011. Ventajas de la cicatrización cutánea asistida por láser (LASH). Cirugía Plástica Iberolatinoamericana 37(4): 387- 392. [ Links ]
Naseri, M.; Ziora, Z. 2018. Wound dressings from naturally-occurring polymers: A review on homopolysaccharide-based composites. Carbohydrate Polymers 189(1): 379-398. [ Links ]
Pan, H.; Fan, D.; Cao, W.; Zhu, C.; Duan, Z.; Fu, R.; Li, X.; Ma, X. 2017. Preparation and characterization of breathable hemostatic hydrogel dressings and determination of their effects on full-thickness defects. Polymers 9: 727-755. [ Links ]
Peregrino, M.; Seabra, A. 2017. Chitosan-Based Nanomaterials for Skin Regeneration. Medical Science 4(3): 352–81. [ Links ]
Pereira, F.: Barrias, C.; Granja, L.; Bartolo, P. 2013. Advanced biofabrication strategies for skin regeneration and repair. Nanomedicine 8(4): 603– 621. [ Links ]
Prior, R.; Wu, X. 2013. Diet antioxidant capacity: relationships to oxidative stress and health. American Journal of Biomedical Sciences 5(2): 126139. [ Links ]
Rodríguez, M.; Morales, D. 2015. Efecto de mallas sombreadoras sobre la producción y calidad de frutos de arándano (Vaccinium corymbosum L.) cv. Brigitta. Scientia Agropecuaria 6(1): 41–50. [ Links ]
Schencke, C.; Salvo, J.; Vasconcellos, A.; Del Sol, M. 2013. Estudio comparativo de la cicatrización en quemaduras con tratamiento en base a miel de ulmo (Eucryphia cordifolia) y vitamina c oral versus hidrogel en cobayos (Cavia porcellus). International Journal of Morphology 31(3): 839-844. [ Links ]
Seong, J.; Palanivel, V.; Jeong, M.; Byung, O.; Do, J. 2018. Photobiological (LED light)-mediated fermentation of blueberry (Vaccinium corymbosum L.) fruit with probiotic bacteria to yield bioactive compounds. Food Science and Technology 93(1): 158-166. [ Links ]
Song, G. 2015. Blueberry (Vaccinium corymbosum L.). Methods in Molecular Biology 224(1): 121-131. [ Links ]
Stephen, J.; Toner, L.; Jeffrey, S. 2018. Product evaluation of an absorbent, antimicrobial, haemostatic dressing. British Journal of Nursing 27(6): S24-S30. [ Links ]
Valencia, C. 2010. Cicatrización: proceso de reparación tisular. Aproximaciones terapéuticas. Investigaciones Andinas 20(12): 88-98. [ Links ]
Valencia, L.; Martel, S.; Vargas, C.; Rodríguez, C. Olivas, I. 2016. Apósitos de polímeros naturales para regeneración de piel. Revista Mexicana de Ingeniería Biomédica 37(3): 235-249. [ Links ]
Vargas, O. 2014. Regeneración y cicatrización. Revista de Actualización Clínica 43(1): 2256-2260. [ Links ]
Tchemtchoua, V.; Atanasova, G.; Aqil, A.; Filée, P.; Garbacki, N.; Vanhooteghem, O.; Deroanne, C.; Noel, A.; Jérome, A.; Nusgens, B.; Poumay, Y.; Colige, A. 2011. Development of a chitosan nanofibrillar scaffold for skin repair and regeneration. Biomacromolecules 12(1): 3194– 3204. [ Links ]
Yu, X.; Zeng, Y.; Jian, W.; Tong, H.; Qiong, J. 2018. Carboxymethyl konjac glucomannan crosslinked chitosan sponges for wound dressing. International Journal of Biological Macromolecules 112(1): 1225- 1233. [ Links ]
Corresponding author
E-mail: ayalajara27@hotmail.com (C. Ayala-Jara)
Received December 07, 2017.
Accepted May 5, 2018.