Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Scientia Agropecuaria
Print version ISSN 2077-9917
Scientia Agropecuaria vol.9 no.2 Trujillo Apr./Jun. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.02.08
ARTÍCULOS ORIGINALES
Efectos de agentes mutagénicos en la germinación de semillas de aguaymanto
Effect of mutagenic agents on the germination of aguaymanto seeds
Rolando Porta Chupurgo1; Jorge E. Jiménez2,*
1 Escuela Profesional de Agronomía, Facultad de Ciencias Agrarias, Universidad de Huancavelica, Acobamba, Perú.
2 Laboratorio de Biotecnología, Programa de Cereales y Granos Nativos, Universidad Nacional Agraria La Molina, Lima, Perú.
Resumen
El aguaymanto (Physalis peruviana L.), importante por su valor económico y nutritivo, requiere de estudios que apunten a reducir el tamaño de planta, el periodo vegetativo, entre otros. El objetivo de la investigación fue determinar el efecto de dos agentes mutagénicos en la germinación de las semillas de aguaymanto. Se instalaron dos experimentos independientes, los que fueron conducidos tanto en laboratorio como en el vivero. En el primer experimento se aplicó a las semillas la radiación gamma con dosis de 0 Gy, 100 Gy, 150 Gy, 200 Gy, 250 Gy, 300 Gy, 350 Gy y 400 Gy. En el segundo experimento, las semillas fueron remojadas en azida de sodio a dosis de 0,0; 1,0; 1,5; 2,0; 2,5; 3,0 y 3,5 mM.; y además, se incluyó una solución Buffer pH3. Ambos experimentos fueron conducidos en el diseño completamente al azar con cuatro repeticiones por tratamiento. Para la comparación de medias se utilizó la prueba de DUNCAN. Se evaluaron % de germinación radicular, % de germinación cotiledonal, longitud de raíz (mm), % de emergencia y altura de plantas (mm). Los resultados obtenidos sugieren que la dosis de 300 Gy y 2,5 mM produjeron un efecto promedio entre 22,83% y 22,11% comparado con el control, son las recomendables para provocar cambios genéticos deseados.
Palabras clave: Physalis peruviana L.; agentes mutagénicos; dosis de radiación.
Abstract
The aguaymanto (Physalis peruviana L.), important for its economic and nutritional value, requires studies aimed at reducing the size of the plant, the vegetative period, among others. The objective of the research was to determine the effect of two mutagenic agents on the germination of aguaymanto seeds. Two independent experiments were install and conducted both in the laboratory and in the nursery. In the first experiment, the gamma radiation was applying to the seeds with doses of 0 Gy, 100 Gy, 150 Gy, 200 Gy, 250 Gy, 300 Gy, 350 Gy and 400 Gy. In the second experiment, the seeds were soaked in sodium azide at a dose of 0.0; 1.0; 1.5; 2.0; 2.5; 3.0 and 3.5 mM. and in addition, a buffer pH3 solution was include. Both experiments were conduct in the completely randomized design with four repetitions per treatment. For the comparison of means, the DUNCAN test was use. We evaluated root germination percentage, cotyledonal germination percentage, root length (mm), emergence percentage and plant height (mm). The results obtained suggest that the dose of 300 Gy and 2.5 mM produced an average effect between 22.83% and 22.11% compared to the control, are recommended to cause desired genetic changes.
Keywords: Physalis peruviana L.; mutagenic agents; radiation dose.
1. Introducción
Physalis peruviana L. es una especie de importancia por el contenido de minerales y vitaminas presentes en el fruto, elementos indispensables para el desa-rrollo humano. El aguaymanto es una excelente fuente de provitamina A. vitamina C y también del complejo de vitamina B (tiamina, niacina y vitamina B12). Es un alimento energético natural, estupendo para niños, deportistas y estudiantes; sin embargo, no existe en el mercado variedades que se desarrollen en las condiciones ambientales que puedan suplir la demanda nacional. El aguaymanto es muy susceptible a las plagas las mismas que hacen daño a las hortalizas y a la sequía los que constituyen limitantes de la producción. Es indispensable el desarrollo de nuevas variedades a través del mejoramiento genético de plantas con adecuada arquitectura de planta, precoces, alto rendimiento y calidad de fruto. Las hibridaciones entre especies muy relacionadas están limitadas en su capacidad para crear nuevas y diversas variedades de cultivos (Matijevic et al., 2013; Lee et al., 2015), la alternativa es la inducción de mutaciones que provoca cambios que, de manera natural, tardarían demasiado tiempo en aparecer o que, por efectos directamente vinculados al azar, no aparecerían (Salas, 2015; Dayton, 2012). A diferencia de la hibridación y la selección, la mejora de la mutación tiene la ventaja de mejorar un defecto en un cultivar elite, sin perder sus características agronómicas y de calidad (Pathirana, 2011; Monica y Seetharaman, 2016). Se puede cambiar una o pocas características específicas de una variedad en el menor tiempo posible (Datta, 2014), como por ejemplo la resistencia al estrés abiótico, los parámetros físicos del grano, valor nutricional (Ling et al., 2013; Lee et al., 2015), alterar el tamaño de la planta, la época de floración y cosecha, el color de la fruta, la resistencia a plagas y enfermedades entre otros, sin perturbar ninguno de las bondades pre existentes en las variedades (Álvarez et al., 2012; Devi y Mullainathan, 2012; Tshilenge-Lukanda et al., 2013; Aruldoss et al., 2015).
Las mutaciones en cultivos agrícolas son inducidas por mutágenos químicos o físicos (Kayalvizhi et al., 2017; Gnanamurthy et al., 2012) Mutágenos químicos tales como etilmetanosulfonato (EMS), azida de sodio (NaN3), N-nitroso-N-metilurea (NMU) y colchicina han sido utilizados para desarrollar nuevos rasgos en los cultivos. (Kozgar et al., 2011; Jagajanantham et al., 2013; Kashind y More, 2016). La azida sódica, un mutágeno químico se ha convertido en una herramienta importante para mejorar rasgos agronómicos de las plantas de cultivo. Se está utilizando para producir resistencia en varios cultivos susceptibles para mejorar su rendimiento y rasgos de calidad contra patógenos dañinos (Salas, 2015).
Los mutágenos físicos pueden dividirse en dos categorías, en radiaciones no ionizantes e ionizantes (Madigan et al., 2009). Las radiaciones ionizantes más utilizadas en la inducción de cambios de caracteres de los cultivos, incluyen rayos X, rayos gamma γ, rayos β, neutrones y haces de iones de alta energía (Suprasanna et al., 2015; Akshatha et al., 2013), debido a sus características y alto poder de penetración, que pueden provocar cambios en moléculas, como el ácido desoxi-rribonucleico (ADN) (Minisi et al., 2013). Dentro de las radiaciones ionizantes, los rayos gamma son las más utilizadas para generar variabilidad en los cultivos agrícolas (Piri et al., 2011). En este campo, los rayos gamma son considerados un tipo de radiación ionizante usualmente obtenidos por radioisótopos, como el cobalto 60 (Co-60) y el cesio 137 (Ce-137). Entonces, la utilidad de cualquier agente mutagénico depende de su capacidad para inducir una alta frecuencia de cambios deseables en comparación con los indeseables. Por lo tanto, a menudo es necesario evaluar la eficacia y efectividad de los mutágenos para un uso eficiente y efectivo (Usharani y Kumar, 2015). Sin embargo, no basta seleccionar el tipo de radiación a usar; deben tomarse en cuenta otros factores como radiosensibilidad, intervalo de dosis y forma de aplicación, para lograr los objetivos planteados (Udensi et al., 2012). Para determinar el intervalo de dosis que permita inducir los cambios deseados, debe de tomarse en cuenta que cada organismo presenta una particular sensibilidad a la radiación (radiosensibilidad). La dificultad está en que a medida que aumenta la dosis de radiación, se incrementa el deterioro de la planta y disminuye la frecuencia de mutaciones económicamente útiles (Salas, 2015). Caro-Melgarejo et al. (2012) aplicaron dosis de 50, 100, 200 y 300 Gy de rayos gamma en yemas vegetativas de P. peruviana L., y obtuvieron mayor porcentaje de viabilidad, enraizamiento de microtallos, cantidad de hojas por explante, longitud de tallos, porcentaje de endurecimiento y de cromosomas rezagados en la célula con la dosis de 100 y 200 Gy. También, Antúnez et al. (2017) al estudiar el efecto de los rayos gamma 60Co sobre características de germinación de la semilla y vigor de plantas de P. peruviana, reportaron que la radiación no afectó el porcentaje de germinación, ni el número de hojas, pero las plántulas de semillas irradiadas emergieron 8 d antes que el testigo. Las plantas de semillas irradiadas con 125, 150, 200 y 225 Gy presentaron la mayor altura y diámetro de tallo. Las mayores longitudes de la raíz observaron en las plantas testigo. La mayor longitud de entrenudo se tuvo con 125, 150, 175 y 200 Gy.
En esta perspectiva, el objetivo fue evaluar el efecto de la radiación gamma y de la azida de sodio, como agentes mutagénicos, en la germinación de las semillas de aguaymanto.
2. Materiales y métodos
La investigación fue conducida desde el 06 de agosto hasta el 30 de octubre del 2015, en el laboratorio de biotecnología del Programa de Investigación y Proyección Social (PIPS) en Cereales y Granos Nativos de la Facultad de Agronomía, de la Universidad Nacional Agraria La Molina (UNALM), utilizándose semilla botánica de aguaymanto, de la variedad comercial "Colombiano" proveniente de AZ Inge-nieros EIRL. Esta variedad por haber sido desarrollada en condiciones de Colombia, en nuestro país no desarrolla adecua-damente en lugares de baja humedad, por lo que se busca tolerancia a estrés hídrico, precocidad y mejor estructura de planta. Se implementaron dos experimentos inde-pendientes. En el primer experimento, las semillas fueron sometidas a la radiación gamma con fuente de Cobalto (Co60) con las dosis de: 100, 150, 200, 250, 300, 350 y 400 Gy, en el Instituto Peruano de Energía Nuclear (IPEN. El irradiador utilizado fue el tipo I, marca Gammacell 220 Excel Modelo C-198, serie GS-401. En el segundo experimento, las semillas fueron sometidas a la azida de sodio con dosis de 0,5; 1,0; 1,5; 2,0; 2,5; 3,0 y 3,5 mM, siguiéndose el protocolo:
- Preparación de la solución buffer pH3. Se pesó KH2PO4 (0,4 M) y se disolvió en agua destilada. Luego se llevó a pH3 utilizando ácido ortofosfórico.
- Se preparó una alícuota de NaN3, en una solución 1:1 disolviendo la azida de sodio en la solución buffer pH3.
- Las semillas de todos los tratamientos se remojaron en cada una de las dosis de NaN3, durante 1 hora y luego se reali-zaron 3 enjuagues con agua corriente.
- Luego, se sembraron todas las semillas en placas y macetas de acuerdo a las dosis propuestas en el experimento.
En el experimento con azida de sodio se incluyó a la solución buffer como un control adicional.
Los experimentos fueron conducidos en el diseño completamente al azar, con 4 repeticiones por tratamiento. Cada unidad experimental estuvo conformada por 100 semillas. Para la comparación de medias, se utilizó la prueba de DUNCAN.
Los experimentos fueron realizados tanto en el laboratorio (en placas petri) como en el tinglado. En el laboratorio se evaluaron germinación radicular (%), germinación cotiledonal (%) y longitud de raíz (cm); y en el vivero (en macetas), el porcentaje de emergencia y altura de las plántulas. Los efectos de los rayos gamma y la azida de sodio (NaN3) fueron calculados teniendo en cuenta el comportamiento del control en cada uno de los parámetros evaluados.
3. Resultados y discusión
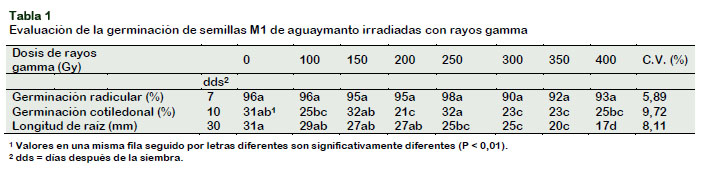
Germinación
La primera expresión de crecimiento en la etapa de germinación corresponde a la aparición de la radícula. Así, en la Tabla 1 se observa que no hubo diferencias significativas entre las diferentes dosis de radiación en el porcentaje de germinación radicular. A pesar de que las diferencias estadísticas no fueron significativas en la germinación radicular y teniendo en cuenta que los cambios que puedan ocasionar los mutagénicos son aleatorios, se aprecia el incremento de la germinación radicular en el rango de 0,75% a 2,00% comparado con el testigo en las dosis de 100 y 250 Gy respectivamente y la reducción de 2,50%, 3,25%, 6,00%, en las dosis superiores a 300 Gy. Al respecto, Akshatha y Chandrashekar (2014) mencionan que la radiación acelera la diferenciación de las células, afecta la síntesis de proteínas, el balance hormonal, el intercambio gaseoso y la actividad enzimática.
El hipocótilo, que corresponde a la parte subterránea del tallo principal, aparece entre uno a dos días después de la radícula y conduce a los cotiledones hacia arriba, hasta posicionarlos por sobre el ápice de la plántula (germinación cotiledonal).
En la Tabla 1 se muestra que las semillas irradiadas con 200, 300 y 350 Gy, fueron afectadas al presentar menores porcen-tajes de germinación cotiledonal; mientras que el control sin irradiar y las dosis de 150 y 250 Gy lograron mayor porcentaje de germinación.
De estos resultados, se desprende que dosis iguales o mayores a 200 Gy, reducen el porcentaje de germinación cotiledonal, hasta en 8% comparado con el testigo. Beyaz et al. (2016) encontraron efectos significativos en la germinación de semillas de Lathyrus chrysanthus, y que las semillas irradiadas a dosis más altas tenían un mayor porcentaje de germinación de semillas. Resultados similares fueron reportados por Salomón et al. (2017) en semilla botánica de papa irradiadas de 10 a 100 Gy, quienes encontraron diferencias significativas entre las proporciones en las diferentes dosis de radiación gamma. Los resultados sugieren que existen dosis particulares e intermedias de radiación que estimulan la germinación de las semillas, lo que podría estar relacionado con la especie y el estado fisiológico de la semilla,
Respecto a la longitud de raíces, se encontró efectos significativos (Tabla 1), registrándose una disminución de hasta 14 mm a la dosis de 400 Gy respecto al testigo sin irradiar. Las semillas expuestas a irradiaciones de 100, 150 y 200 Gy, desarrollaron plántulas con raíces de longitudes similares al testigo; sin embargo, se puede apreciar que radiaciones iguales o superiores a 250 Gy, reducen de manera significativa la longitud de las raíces.
En otras especies de plantas, cuyas semillas fueron irradiadas, los resultados obtenidos para longitud de raíces, han sido variables (Caro et al., 2012; Marcu et al., 2013; Araujo et al., 2016). Por ejemplo, semillas de tomate (Solanum lycopersicum L.) irradiadas con dosis bajas (5 y 20 Gy), respondieron favorablemente, al presentar longitudes de raíces superiores en un 37 % con relación al control (Alvares et al., 2012). Nasab et al. (2010), irradiando semillas de Hordeum vulgare spp. con dosis de 700 y 1200 Gy, no evidenciaron diferencias significativas para longitud de raíces con el control sin irradiar.
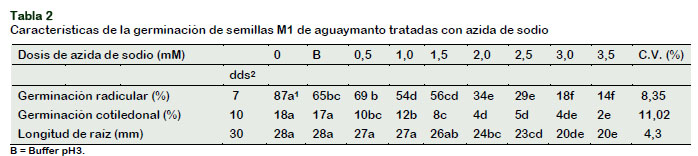
Al analizar el efecto de la azida de sodio (Tabla 2), se observó reducción significativa del porcentaje de germinación radicular conforme se incrementó la dosis; así, al comparar el testigo y el tratamiento con la dosis más alta de azida de sodio (3,5 mM.), se redujo en 73,0% la germinación radicular de las semillas de aguaymanto. Estos resultados coinciden con lo reportado por Huari (2014), quién encontró diferencias significativas en el porcentaje de germinación de semillas de amancay. Por otro lado, Salas (2015), reportó que el efecto letal que ocasiona el uso de azida de sodio en la germinación de las semillas aumenta a medida que se incrementa su dosis en referencia al testigo.
Del mismo modo, el porcentaje de germinación cotiledonal se redujo a medida que se incrementó la dosis de azida de sodio, afectando a la formación de las hojas cotiledonales, hasta en 16,0% con la dosis de 3,5 mM. (Tabla 2). La longitud de la raíz también fue reducida hasta en 30% en las dosis más altas (3,0 y 3,5 mM). Las dosis bajas no afectaron la longitud de las raíces comparado con el testigo.
Al analizar el efecto de semillas tratadas con azida de sodio sobre el crecimiento de las raíces, se observa que hubo reducción significativa en la longitud de las raíces. Y conforme se incrementa la dosis de azida de sodio, se reduce el tamaño de las mismas. Así, al comparar el testigo con el tratamiento de 3,5 mM., se reduce en 28,57% (Tabla 2).
Estos resultados confirman que el incremento de las dosis de azida de sodio produce mayor letalidad; en tanto que dosis reducidas generan menos letalidad (García et al., 2010).
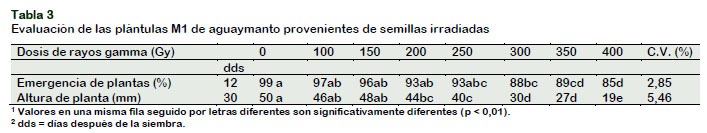
Emergencia y altura de planta
Los resultados obtenidos en el tinglado muestran que la irradiación aplicada influyó significativamente (P < 0,01) en la emergen-cia y la altura de planta. En la Tabla 3, se aprecia que el incremento en la dosis redujo la emergencia y la altura de las plantas. Así, las semillas irradiadas con 400 Gy, fueron afectadas al reducirse el porcentaje de emergencia (14%) y la altura de planta (38%), con respecto al testigo.
Se puede observar que ambas variables fueron afectadas conforme aumentaron las dosis de irradiación. Antúnez et al. (2017) no evidenciaron diferencias significativas (P ≤ 0,05) en semillas de aguaymanto irradiadas con 16 dosis de rayos gamma; sin embargo, influyó de manera signifi-cativa sobre la altura de la planta (p ≤ 0,05), reportando que las mayores alturas se presentaron con las dosis intermedias de 125 (13,57 cm), 150 (13,72 cm), 175 (13,35 cm) y 200 Gy (13,42 cm), superiores en 29 % con respecto al testigo; en tanto que con dosis altas (300 y 350 Gy) la altura fue menor a 6,27 cm.
Coinciden con estos resultados, los reportados por Álvarez et al. (2013) quienes notaron estimulación significativa (P ≤ 0,001) en la altura de plantas de pimiento con relación al control con todas las dosis evaluadas, observándose los mejores valores con la dosis de 30 Gy que incrementó la altura de plantas en un 15%.
Del mismo modo Álvarez et al. (2012) encontraron respuesta estimulante signifi-cativa (p < 0,05) sobre el crecimiento en plántulas de tomate provenientes de semilla irradiada.
Resultados contrarios fueron observados por López et al. (2012) en semillas de "Chile de Agua" Capsicum annum L. irradiadas a dosis de 0 a 120 Gy, quienes no encon-traron efectos radioestimulantes favora-bles en la germinación.
Las diferencias en los porcentajes de emergencia entre los tratamientos, se deben a la inhibición o estímulo de los procesos bioquímicos y fisiológicos de la radiación ionizante, lo cual depende de la dosis, (Figura 1), resultados que es confirmado por Hasbullah (2012).
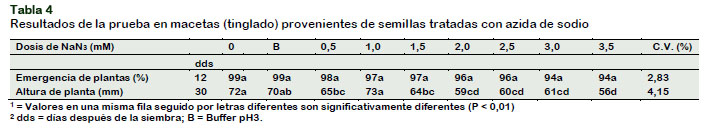
Con respecto a la azida de sodio, para emergencia no se observó diferencias significativas entre los diferentes tratamientos (Tabla 4); sin embargo, se puede apreciar una ligera disminución en el porcentaje de emergencia a medida que se incrementan las concentraciones del mutagénico. Similares resultados fueron reportados por Salas (2015) con la dosis de 3,0 mM. de NaN3 tratando a las semillas de salvia; y por Vargas (2016), a las semillas de tres variedades de café.
En el caso de la altura de planta, los tratamientos con azida de sodio afectaron esta variable disminuyéndola hasta en 33% con respecto al testigo. La reducción mayor se produjo en las plántulas que se desarrollaron a partir de las semillas tratadas con 3,5 mM de azida de sodio, lo que concuerda con lo reportado por Salas (2015) y Vargas (2016) en semillas de Salvia y Café respectivamente.
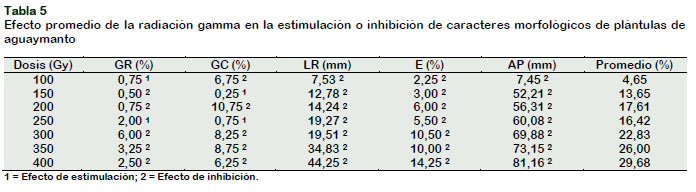
Efecto promedio de los agentes muta-génicos
La Tabla 5 muestra los efectos de estimu-lación e inhibición en los parámetros medi-dos de los tratamientos con irradiación comparados con el testigo. El efecto promedio de modificación de las variables evaluadas comprende desde 4,65% a (100 Gy), hasta 29,68% (400 Gy).
La dosis de 100 Gy de radiación produjo inhibición en la germinación cotiledonal, longitud de raíz, emergencia y altura de plantas en 6,75%, 7,53%, 2,25% y 7,45% respectivamente. Sin embargo, produjo una estimulación en 0,75% en la germinación radicular. El rango de 300 a 400 Gy produjo efecto negativo en todas las variables evaluadas.
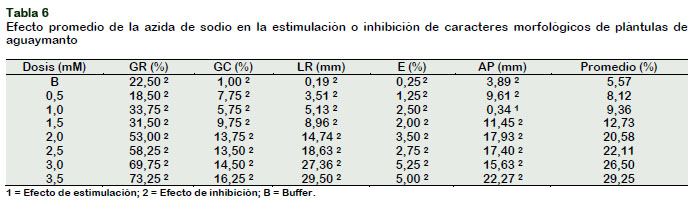
La Tabla 6 muestra los efectos estimulación e inhibición en los parámetros medidos con azida de sodio comparados con el testigo. El menor efecto promedio se obtuvo con el Buffer (5,57%) y el mayor efecto (29,25%) se produjo con 3,5 mM de azida de sodio.
Al comparar los efectos promedios en la germinación radicular de las semillas se puede visualizar que las diferentes dosis de radiación gamma produjeron un menor rango de variación (de 6,00% de inhibición a 0,75% de estimulación), respecto a las dosis de azida (de 18,50% a 73,25% de inhibición). Esta misma tendencia se presentó en la germinación cotiledonal, donde la radiación gamma produjo un rango desde 10,75% de inhibición hasta 0,75% de estimulación; en tanto que la azida de sodio produjo inhibición de 1,00 a 16,25%. El crecimiento de la raíz fue inhibido tanto por las diferentes dosis de radiación gamma (de 7,53% a 44,25%), como por las diferentes dosis de azida de sodio (de 0,19% a 29,50%). El porcentaje de emergencia fue afectada de 2,25% a 14,25% y de 0,25% a 5,25% por efecto de las dosis de radiación gamma y azida de sodio respectivamente. La altura de plántula se redujo en un mayor rango de variación (de 7,45% a 81,16%) por efecto de la radiación gamma, respecto a la azida de sodio que redujo el crecimiento de las plántulas en un rango de 0,34% a 22,27%. En general, se puede inferir que conforme se incrementa la dosis de radiación gamma y azida de sodio en tratamiento a las semillas de aguaymanto, aumenta el porcentaje de inhibición en la germinación radicular, germinación cotiledonal, longitud de raíz, emergencia y altura de planta respectivamente.
Al comparar el efecto promedio mayor causado por ambos agentes mutagénicos, la dosis de 400 Gy y 3,5 mM. de NaN3, tuvieron similares respuestas para los parámetros evaluados en Physalis. De acuerdo a Maluszynski et al. (1995), sugiere que debería recomendarse la dosis cuyo efecto promedio esté lo más cerca del 20%, en este caso se recomendaría las dosis de 300 Gy (22,83%) y 2,0 mM de NaN3 (20,58%).
4. Conclusión
Se concluye que las diferentes dosis de radiaciones gamma redujeron la germi-nación cotiledonal, longitud de raíces, emergencia de plantas y altura de planta, más no la germinación radicular. En tanto que las diferentes dosis de azida de sodio redujeron la germinación radicular, germi-nación cotiledonal, longitud de raíces y altura de planta, mas no la emergencia. Se infiere que las dosis de 300 Gy y 2,0 mM, son los más recomendables para usar, por haber presentado efectos promedios de 22,83% y 20,58%, y encontrarse dentro del rango sugerido para promover mutaciones genéticas favorables.
Agradecimientos
Al personal del Programa de Cereales y Granos Nativos de la Universidad Nacional Agraria La Molina, por el apoyo brindado.
Referencias Bibliográficas
Akshatha, K.; Chandrashekar, R. 2014. Gamma sensitivity of forest plants of Western Ghats. Journal of Environmental Radioactivity 132: 100-107. [ Links ]
Akshatha, K.; Chandrashekar, R.; Somashekarappa, H.; Souframanien, J. 2013. Effect of gamma irradiation on germination, growth, and biochemical parameters of Terminalia arjuna Roxb. Radiation Protection and Environment 36(1): 38-44. [ Links ]
Álvarez, A.; Chávez, L.; Ramírez, R.; Pompa, R.; Estrada, W. 2012. Indicadores fisiológicos en plántulas de Solanum lycopersicum L., procedentes de semillas irradiadas con rayos X. Biotecnología Vegetal 12(3): 173-177. [ Links ]
Álvarez, A.; Chávez, L.; Ramírez, R.; Fernández, R.; Estrada, W.; Estrada, Y.; Maldonado, A. 2013. Efecto del tratamiento de semillas con bajas dosis de rayos X en plantas de pimiento Capsicum annuum L. Nucleus (53): 14-18. [ Links ]
Antúnez, O.; Cruz, C.; Sandoval, M.; Santacruz, A.; Mendoza, L.; De la Cruz, E.; Peña, A. 2017. Variabilidad inducida en caracteres fisiológicos de Physalis peruviana L. mediante rayos gamma 60co aplicados a la semilla. Fitotecnia Mexicana 40(2): 211-218. [ Links ]
Araújo S.; Paparella, S.; Dondi, D.; Bentivoglio, A.; Carbonera, D.; Balestrazzi, A. 2016. Physical methods for seed invigoration: advantages and challenges in seed technology. Frontiers in Plant Science 7: 646. [ Links ]
Aruldoss, T.; Mullainathan, L.; Natarajan, S. 2015. Effect of Induced mutagenesis on quantitative characteristics of Chilli Capsicum annuum (L). var- K1 in M2 generation. Indo- Asian Journal of Multidisciplinary Research 1(3): 265-272. [ Links ]
Beyaz, R.; Kahramanogullari, C.; Yildiz, C.; Selcen, E.; Yildiz, M. 2016. The effect of gamma radiation on seed germination and seedling growth of Lathyrus chrysanthus Boiss. under in vitro conditions. Journal of Environmental Radioactivity 162: 129-133. [ Links ]
Caro, D.; Estupiñán, S.; Rache, L.; Pacheco, J. 2012. Efecto de rayos gamma sobre yemas vegetativas de Physalis peruviana L. Acta Agronómica 61: 305-314. [ Links ]
Datta, S. 2014. Induced mutagenesis: basic knowledge for technological success. In National Botanical Research Institute. India. Pp. 97-140. [ Links ]
Dayton, H.; Yihua, Y.; Jiang, P.; Anjanabha, B. 2012. Targeted mutation breeding of horticultural plants. Emirates Journal of Food and Agriculture 24(1): 31-41. [ Links ]
Devi, S.; Mullainathan, L. 2012. Effect of Gamma Rays and Ethyl Methane Sulphonate (EMS) in M3 generation of Blackgram Vigna mungo L. Hepper. African Journal of Biotechnology 11(15): 3548-3552. [ Links ]
García, A.; Porras, I.; Jiménez, J. Evaluación del efecto de la azida de sodio en la germinación de la semilla de quinua para la inducción de mutaciones. En: Primer Congreso Peruano de Mejoramiento Genético y Biotecnología Agrícola, Perú, 17-19 mayo, 2010. [ Links ]
Gnanamurthy, S.; Mariyammal, S.; Dhanavel, D.; Bharathi, T. 2102. Effect of gamma rays on yield and yield components characters R3 generation in cowpea Vigna unguiculata Walp. International Journal of Research in Plant Science 2(2): 39-42.
Hasbullah, N.; Taha, R.; Saleh, A.; Mahmad, N. 2012. Irradiation effect on in vitro organogenesis, callus growth and plantlet development of Gerbera jamesonii. Horticultura Brasileira (30): 252-257. [ Links ]
Huari, P. 2014. Dosimetría de la azida de sodio para determinar el posible efecto mutagénico en semillas y bulbillos de "amancay" Ismene amancaes Ruiz y Pav. Tesis Ingeniero Agrónomo, Universidad Nacional Agraria La Molina, Lima. Perú. 92 pp. [ Links ]
Iglesias, L.; Sanchez, L.; Tivo, Y.; Luna, M.; Flores, N.; Noa, J.; Ruiz, C.; Moreno, J. 2010. Efecto de radiaciones gamma en Abies religiosa (Kunth) Schld. et. Cham. Revista Chapingo Serie Ciencias Forestales y del Ambiente 16(1): 5-12. [ Links ]
Jagajanantham, N.; Dhanavel, D.; Gnanamurthy, S.; Pavadai, P. 2013. Induced on chemical mutagens in Bhendi Abelmoschus esculentus L. Moench. International Journal of Current Science 5: 133-137. [ Links ]
Kashid, N.; More, S. 2016. A study of effect of induced mutation on flowering of plant in M2 & M3 generations in chickpea Cicer arietinum L. Tropical Plant Research 3(1): 182-185 [ Links ]
Kayalvizhi, K.; Kannan, M.; Ganga, M. 2017. Effect of Physical and Chemical Mutagens on Morphological Characters in M1V2 Generation of Tuberose Polianthes tuberosa L. International Journal of Current Microbiology and Applied Sciences 6(4): 2492-2499. [ Links ]
Kozgar, M.; Goyal, S.; Khan, S. 2011. EMS induced mutational variability in Vigna radiata and Vigna mungo. Research Journal of Botany 6(1): 31-37 [ Links ]
Lee, T.; Oh, T.; Yang, S.; Shin, J.; Hwang, S.; Kim, C.; Kim, H.; Shim, H.; Shim, J.; Ronald, P. 2015. RiceNet v2: an improved network prioritization server for rice genes. Nucleic Acids Research 43: 122-127. [ Links ]
Ling, P.; Ung, Y.; Hussein, S.; Harun, A.; Tanaka, A.; Yoshihiro, H. 2013. Morphological and biochemical responses of Oryza sativa L. cultivar MR219 to ion beam irradiation. Journal of Zheliang University Science 14(12): 1132-1143. [ Links ]
López, H., Carrillo, J.; Chávez, J. 2012. Effects of gamma-irradiated seeds on germination and growth in Capsicum annuum L. plants grown in a greenhouse. Acta Horticulturae 947: 77-81. [ Links ]
Madigan, P.; Bodemann, O.; Brady, C.; Dewar, J.; Keller, J.; Leitges, M.; Philips, R.; Ridley, J.; Der, J.; Cox, D. 2009. Regulation of Rnd3 localization and function by protein kinase C α-mediated phosphor-rylation. Biochemical Journal 424(1): 153-161. [ Links ]
Maluszynski, M., B.S. Ahloowalia & B. Sigurbjörnsson, 1995. Application of in vivo and in vitro mutation techniques for crop improvement. Euphytica 85: 303–315. [ Links ]
Marcu, D.; Cristea, V.; Daraban, L. 2013. Dose dependent effects of gamma radiation on lettuce Lactuca sativa var. capitata seedlings. International Journal of Radiation Biology 89(3): 219-223. [ Links ]
Matijevic, M.; Bado, S.; Lagoda, P.; Foster, B. 2013. Impact of induced mutations in plant breeding. In: Plant Genetics and Breeding Technologies. Editorial Monduzci. Vienna. Austria. Pp. 45 – 47. [ Links ]
Minisi, A.; El-mahrouk, M.; Rida, F.; Nasr, M. 2013. Effects of Gamma Radiation on Germination, Growth Characteristics and Morphological Variations of Moluccella laevis L. American-Eurasian Journal of Agricultural & Environmental Sciences 13(5): 696-704. [ Links ]
Monica, S.; Seetharaman, N. 2016. Effect of gamma irradiation and ethyl methane sulphonate (EMS) in early generation of Garden bean Lablab purpureus L. Sweet var. typicus. International Journal of Advanced Scientific and Technical Research 6(3): 398-410. [ Links ]
Nasab, S.; Sharifi-Sirchi, G.; Torabi-Sirchi, H. 2010. Assessment of dissimilar gamma irradiations on barley Hordeum vulgare spp. Journal of Plant Breeding and Crop Science 2(4): 59-63. [ Links ]
Pathirana, R. 2011. Plant mutation breeding in agricultura. En Perspectives in Agriculture, Vete-rinary Science. Nutrition and Natural Resources 6(32): 1-20. [ Links ]
Piri, I.; Babayan, M.; Tavassoli, A.; Javahen, M. 2011. The use of gamma irradiation in agriculture. African Journal of Microbiology Research 5(32): 5806-5811. [ Links ]
Salas, L. 2015. La azida de sodio aplicada a las semillas de salvia Salvia farinacea Benth. var. Blue Bedder para cambios genéticos. Tesis Ingeniero Agrónomo, Universidad Nacional Agraria La Molina, Lima. Perú. 74 pp. [ Links ]
Salomón, J.; González, M; Castillo, J.; Varela, M. 2015. Efecto de los rayos gamma sobre la germinación de la semilla botánica de papa Solanum tuberosum L. Cultivos Tropicales 38(1): 89-91. [ Links ]
Tshilenge, L.; Kalonji, A.; Nlongolo, K.; Kizungu, R. 2013. Effect of Gamma Irradiation on Morpho- Agronomic Characteristics of Ground nut Arachis hypogea L. American Journal of Plant Sciences 4: 2186-2192. [ Links ]
Suprasanna, P.; Mirajkar, S.; Bhagwat, S. 2015. Induced Mutations and Crop Improvement. In: Bahadur B.; Venkat Rajam M.; Sahijram L.; Krishnamurthy K. (eds) Plant Biology and Biotechnology. India. Pp 593 – 617. [ Links ]
Udensi, O.; Arong, G.; Obu, J.; Ikpeme, E.; Ojobe, T. 2012. Radio-sensitivity of some selected landraces of pulses to gamma irradiation: indices for use as improvement and preservation techniques. American Journal of Experimental Agriculture 2(3): 320-335 [ Links ]
Usharani, K.; Kumar, C. 2015. Mutagenic efficiency and effectiveness of gamma rays and EMS and their combination in inducing chlorophyll mutations in M2 generation of Urdbean Vigna mungo L. Electronic Journal of Plant Breeding 6(1): 210-217 [ Links ]
Vargas, L. 2016. Efecto de la azida sódica (NaN3) en la germinación y morfología post germinación en café Coffea sp. Tesis de Biólogo, Universidad Nacional Agraria La Molina, Lima. Perú. 116 pp. [ Links ]
* Corresponding author
E-mail: jjimenezd@lamolina.edu.pe (J.E. Jiménez).
Received December 26, 2017.
Accepted April 30, 2018.