Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.2 Trujillo abr./jun. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.02.10
ARTÍCULOS ORIGINALES
Efecto del desamargado de la torta de semilla de moringa (Moringa oleífera) sobre su composición proximal y su perfil nutricional y toxicológico
Effect of the debittered of moringa seed cake (Moringa oleifera) on its proximal composition and its nutritional and toxicological profile
Marcial Ibo Silva Jaimes1,*; Fabio Enzo Cibej López3; Bettit Salvá Ruíz2; Américo Guevara Pérez2; Gloria Pascual Chagman2
1 Departamento de Ingeniería de Alimentos y Productos Agropecuarios, Facultad de Industrias Alimentarias de la Universidad Nacional Agraria La Molina. Lima, Perú. Av. La Universidad s/n. La Molina, Lima, Perú.
2 Departamento de Tecnología de Alimentos y Productos Agropecuarios, Facultad de Industrias Alimentarias de la Universidad Nacional Agraria La Molina. Lima, Perú. Av. La Universidad s/n. La Molina, Lima, Perú.
3 Facultad de Medicina San Fernando, Universidad Nacional Mayor de San Marcos, Av. Grau 755 Lima 1, Perú.
Resumen
Con la finalidad de evaluar el desamargado de la torta de semilla de moringa, estas fueron prensadas obteniéndose aceite y torta. La torta fue sometida a un tratamiento en solución salina (Torta SS) y etanol (Torta OH) y sus características fueron comparados con la de una Torta Testigo. Se determinó en cada muestra, por triplicado, el análisis proximal, el Valor Biológico, digestibilidad verdadera, composición de aminoácidos y el Score de Aminoácidos Corregido por Digestibilidad Proteica (PDCAAS), así mismo se determinaron los taninos, las saponinas, fitatos y los cianuros. El contenido de proteína en la Torta Testigo fue de 43,82%, en la Torta SS de 32,57% y en la Torta OH de 63,69%. El Valor Biológico de la Torta Testigo fue de 20,6; de la Torta SS 24,3 y de la Torta OH 56,9, demostrando la ventaja del tratamiento con etanol. Respecto al PDCAAS en la Torta Testigo puntajes de 115,46; 102,46; 142,79; 342,73; 125,71 y 110,00 para Histidina, Leucina, Fenilalanina, Treonina, Triptofano y valina, respectivamente, fueron superiores frente a las muestras desamargadas, sin embargo, las bondades del desamargado, se observaron en la eliminación del 90% de taninos y el 100% de fitatos aunque los cianuros no pudieron ser removidos.
Palabras clave: Moringa oleífera; torta de moringa; Valor Biológico; PDCAAS; perfil toxicológico.
Abstract
With the purpose of evaluating the debittering of the seed cake of Moringa, they were pressed in order to obtain oil and cake. The cake was subjected to a treatment in saline solution (Cake SS) and ethanol (Cake OH) and its characteristics were compared with that of a Witness Cake. In each sample, in triplicate, the proximal analysis, the Biological Value, true digestibility, amino acid composition and the Amino Acid Score Corrected by Protein Digestibility (PDCAAS) were determined, as well as the tannins, saponins, phytates and cyanides. The content of protein in the Control Cake was 43.82%, in the SS Cake was 32.57% and in the OH Cake was 63.69%. The Biological Value of the Test Cake was 20.6; of the SS Cake was 24.3 and for the OH Cake was 56.9, demonstrating the advantage of the treatment with ethanol. Regarding the PDCAAS in the Testigo Cake scores of 115.46, 102.46, 142.79, 342.73, 125.71 and 110.00 for histidine, leucine, phenylalanine, threonine, tryptophan and valine, respectively, were higher compared to the debittered samples, however, the benefits of debittering, were observed in the elimination of 90% of tannins and 100% of phytates although the cyanides could not be removed.
Keywords: Moringa oleifera; moringa cake; Biological Value; PDCAAS; toxicological profile.
1. Introducción
La Moringa oleífera, árbol perteneciente a la familia Moringaceae, nativo de las estribaciones meridionales del Himalaya, en la actualidad se cultiva prácticamente en todas las regiones tropicales, subtro-picales y semiáridas del mundo. Puede crecer en condiciones de escasez de agua, pero su cultivo intensivo con irrigación y fertilización aumenta los rendimientos de biomasa hasta superar las 100 toneladas por hectárea (Foild et al. 2001). Según refieren Hernandez et al. (2017) la moringa es utilizada desde la raíz hasta las hojas, siendo estas las más utilizadas, debido a su mayor valor nutricional y su aporte de una gran variedad de aminoácidos esenciales.
Adewumi y Samson (2018) considera que la M. Oleifera es una planta milagrosa, con enormes potencialidades por explorar en la elaboración de alimentos. Las harinas de la hoja, semilla y flores, si bien se utilizan empíricamente, falta realizar mayores estudios sistemáticos de sus propiedades. De hecho, las principales aplicaciones para consumo humano que han sido estudiadas tienen que ver con las hojas y el aceite. Las hojas pueden ser utilizadas como fortificante de pan, galletas, yogur, queso y en la preparación de sopas (Adewumi y Samson, 2018), incluso se ha ensayado como posible ingrediente para la elaboración de tamales (Hernandez et al., 2017), o la elaboración de un snack tradicional de maíz (Kokoro), un refrigerio local muy popular en el sudoeste de Nigeria (Ewulo et al., 2017).
Las semillas, según refiere Navarro (2015), pueden consumirse tiernas y hervidas en agua (similares a los garbanzos) o secas y tostadas (como los cacahuetes); sin embargo, el mayor valor de la semilla radica en la fracción oleosa, pues de ella se obtiene el aceite en una proporción aproximada del 35 - 40% del peso, cuyas características son muy parecidas al aceite de oliva. Sin embargo, no se ha documentado bien el uso de la torta resultante de la extracción del aceite. Se menciona su uso como fertilizante para los suelos de cultivo, en algunos casos para la alimentación animal, pero hay gran cantidad de información respecto de su uso como floculante natural para reducir la turbidez del agua, habiendo sido catalogado como el mejor coagulante natural para la purificación de aguas turbias (Meza-Leones et al., 2018). Recientemente se ha demostrado que una globulina y una albúmina, dos componentes de la torta de la semilla de moringa, fueron indicados como los agentes de coagulación de aguas superficiales (Baptista et al., 2017)
Según refieren Meza-Leones et al. (2018) las semillas desengrasadas (torta de moringa) tienen 448,16 mg de proteína/g de semilla, donde el 2,05% no es soluble en agua, pero el 97,95% si lo es y se divide en: 44% albúminas solubles en agua, 53% globulinas I y II solubles en sales, 0,56% prolaminas solubles en alcohol y 0,39% glutelina soluble en NaOH. Pese al generoso aporte de compuestos nitrogenados, el aprovechamiento de tortas proteicas en alimentación humana no es una práctica muy difundida en la actualidad. Estos subproductos de la extracción de aceite, como es el caso también de las tortas de soja o de Sacha Inchi, se prefieren incluir en raciones para animales. Su incorporación a la dieta, en países deficitarios de proteínas, no solamente mejoraría la calidad de la alimentación sino permitiría una disminución parcial del consumo de trigo importado, pues estas tortas podrían sustituir parcialmente la harina de trigo en la formulación de panes, galletas, fideos, etc. También ofrecen la posibilidad de enriquecer con proteínas de origen vegetal una serie de alimentos formulados, con beneficios potencialmente notables para los núcleos de población más afectados por un consumo insuficiente de proteínas (Pérez et al., 2000).
Andrew et al. (2018) han informado que el consumo de M. oleífera, en sus diversas formas, estimula los antioxidantes endó-genos y combate la producción excesiva de radicales libres, pero se necesita más investigación para determinar la biodis-ponibilidad de los nutrientes y fitoquímicos una vez consumidos. Su potencial como fuente de fitoquímicos para el desarrollo de nanopartículas para combatir patógenos humanos sigue siendo un área de investigación en rápido desarrollo que los científicos pueden explotar en la medicina humana. En esta área, se necesitan más estudios clínicos e investigaciones más profundas sobre el mecanismo de acción de los compuestos bioactivos. En lo que respecta a las tortas, como residuos de la extracción del aceite, su valor nutricional está dado por su contenido de proteínas, vitaminas, minerales y fitoquímicos nutraceuticos y se reduce por la presencia de antinutrientes y podría generar un efecto adverso a la salud del consumidor si contienen toxinas o alérgenos. Como el mayor interés está dirigido a la alimentación animal, Makkar y Becker
(1997) hicieron la evaluación de las proteínas, antinutrientes y toxinas en hojas, ramas y tallos de moringa, encontrando en las hojas, cantidades insignificantes de taninos (12 g/kg), saponina (80 g/kg) y fitatos (21 g/kg), no detectándose inhibi-dores de tripsina y amilasa, lectinas, glucósidos cianogénicos y glucosinolatos y en ramas y tallos encontraron taninos, saponinas, glucósidos cianogénicos y glucosinolatos, en concentraciones insig-nificantes. No se descarta la posibilidad que estas sustancias se encuentren también en las semillas, inclusive en concentraciones elevadas, luego de la extracción del aceite, razón por la que al masticar la semilla se percibe un sabor amargo, aunque luego se desarrolla más bien un sabor dulce (Paniagua y Chora, 2016). Como recomiendan Andrew et al. (2018) se requiere de una extensa investigación sobre el aspecto toxicológico de las partes utilizables de la M. oleifera antes de recomendar su introducción como parte de la dieta diaria para grandes poblaciones.
Por esta razón, la presente investigación plantea estudiar el desamargado de la torta de moringa, obtenida de la extracción del aceite por prensado, utilizando solución salina y etanol y evaluar su efecto sobre la composición proximal, el perfil nutricional y el perfil toxicológico.
2. Materiales y métodos
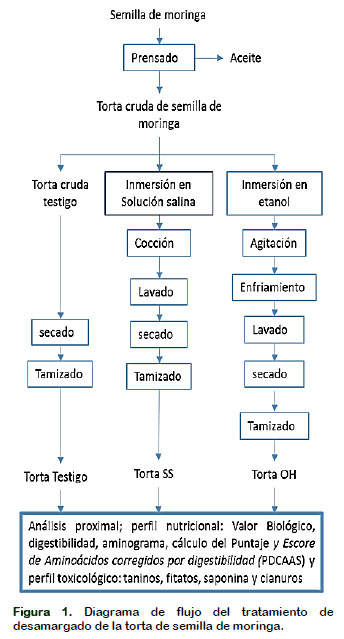
Se empleó semilla de moringa (Moringa Oleifera) en estado fresco proporcionado por la empresa Fundo Escondido S.A.C. Ubicado en el departamento de Ica, la cual fue sometida a la extracción del aceite por prensado. La torta proveniente de esta operación fue utilizada como materia prima para los ensayos presentados en esta investigación, según las operaciones mostradas en la Figura 1.
La semilla fue sometida a una extracción de aceite por prensado, utilizando la prensa Komet (Fabricación Alemana) de 1,5 kilos/hora de capacidad, la torta obtenida se dividió en tres muestras, una sin tratamiento alguno (Testigo), otra muestra fue sometida a desamargado mediante solución salina (SS) y la tercera con etanol (OH). Para el desamargado con tratamiento salino se preparó una solución acuosa conteniendo 2% de cloruro de sodio, 0,75% tripolifosfato de sodio y 0,25% de bicar-bonato de sodio de acuerdo a los trabajos efectuados previamente por Kallasapathy et al. (1985) Luego la muestra se remojó en esta solución, en una proporción de solución salina/materia prima de 3/1, por 24 horas, se coció por 15 minutos a 100 °C se remojó en agua caliente durante una hora, se enfrió y se filtró en papel Whatman No 54 finalmente se secó en estufa hasta una humedad menor al 5%, se molió y tamizó en una malla de 200 micras.
El tratamiento de la torta de semilla moringa con etanol se realizó según el método de Aguilar et al. (2012) para lo cual, la torta de semilla de Moringa fue remojado en etanol al 96% en una proporción etanol/materia prima de 8/1 con agitación continua durante 4 horas a 70 °C, luego se procedió a enfriar durante 1 hora para filtrar, a continuación se procedió a lavar con agua destilada para eliminar los restos de etanol, se filtró con papel Whatman No 54 y finalmente se secó en estufa hasta obtener una humedad menor al 5%, se molió y tamizó en una malla de 200 micras.
En cada una de las muestras se evaluó el efecto de los tratamientos sobre el análisis proximal (AOAC, 2012), el Valor Biológico descrito (Mitchel, 1923), la digestibilidad (método descrito por Pellet, 1978) y el aminograma utilizando HPLC (Hitachi, modelo: Chromaster con detectores AD y FL), con la que se calculó, para cada caso, el Puntaje y Escore de Aminoácidos corregidos por digestibilidad (PDCAAS), de acuerdo al método recomendado por la FAO/WHO (1989):
Para la determinación del Valor Biológico y la digestibilidad verdadera, es decir, la calidad proteica de la harina de semilla de Moringa, se utilizaron tres grupos de seis ratas macho, raza Holtzman, recién destetadas, de 25 días de nacidas, de distintas camadas y con pesos homogéneos (alrededor de 56,3 g). Los animales fueron instalados en jaulas metabólicas individuales de aluminio, con sus respectivos comederos y bebederos, donde se ofreció a un grupo una dieta basada en Torta Testigo, otro grupo fue alimentado con una dieta basada en Torta SS y el tercer grupo fue alimentado con una dieta basada en la Torta OH.
El periodo de adaptación de los animales duró 4 días y consistió en alimentación con la dieta experimental, con el objetivo de eliminar totalmente el contenido intestinal de dietas anteriores, Pasado este periodo se acondicionaron las jaulas metabólicas con sus respectivos embudos colectores de heces y tubos de ensayo para la recolección de la orina, a estos tubos se agregó cuatro gotas de tolueno con el fin de conservar el nitrógeno urinario, así mismo se colocaron hojas debajo de cada jaula, para recolectar los alimentos no consumido, pesar y cuantificar el desperdicio, finalmente se suministró la dieta experimental. El efecto de la dieta se evaluó durante los 6 días siguientes, anotando cuidadosamente el peso de cada rata, el peso de la ración servida, el residuo y el desperdicio, recolectándose y cuantificando también la orina y las heces. Las heces fueron almacenadas con 100 mg de timol (para conservación del nitrógeno) en solución, en tubos de ensayo y refrigeradas para su posterior análisis, El periodo de evaluación duró en total, 10 días. Finalmente se determinó la cantidad de nitrógeno en las heces y orina, mediante los métodos de la AOAC (2012), se hicieron los cálculos respectivos para hallar el Valor Biológico (VB) descrito por Mitchel (1923) y la Digestibilidad verdadera (Dv) según el procedimiento descrito por Pellet (1978):
Todas las determinaciones se hicieron por triplicado y los resultados fueron evaluados estadísticamente mediante un diseño completamente al azar (DCA), utilizando tanto la planilla electrónica Excel como el software SPSS. Cuando se encontraron diferencia en los tratamientos se hicieron pruebas de comparación de promedios de Tukey.
3. Resultados y discusión
Efecto sobre el análisis proximal
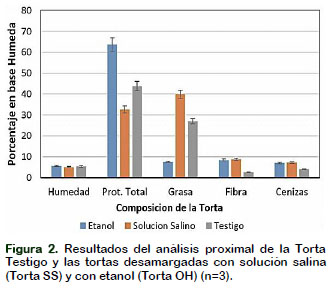
En la Figura 2 se puede ver que el promedio de humedad para la Torta SS fue de 5,59%, para la Torta OH de 5,11 y para la Torta testigo de 5,39%. El análisis de varianza de los datos (α = 5% y 1%) indica que no existe diferencia significativa entre los tratamientos. Es obvio que los tratamientos con una solución salina y con etanol, a la que fueron sometidas las muestras, no afectan al contenido de humedad; sin embargo, existen niveles de humedad (desgrasado) diferentes reportado por investigadores como Bridgemohan y Knights (2009), quienes hallaron 7,31% en la semilla de moringa, Garcia et al. (2009) que encontraron 7,7% en la torta de moringa, valores ligeramente superiores a lo encontrado en esta investigación. El contenido de proteínas para la Torta SS fue de 32,57%, para la Torta OH y la Torta testigo fueron de 63,69% y 43,82%, respectivamente. El contenido de proteínas de la Torta SS fue muy similar al reportado por Bridgemohan y Knights (2009), de 31,57% y el de la torta OH, muy similar al encontrado por García et al. (2009) que fue de 60,3%. EL ANVA (α = 5% y 1%) y la prueba de comparación múltiple de promedios de Tukey (α = 5% y 1%) nos muestra que la proteína de la Torta OH fue mayor, en forma altamente significativa, que el de la Torta SS, debido principalmente a que el tratamiento con SS provoca una precipitación de las proteínas por interacciones hidrofóbicas entre ellos, según lo manifestado por Cohn et al. (2002).
El contenido de grasa en la Torta SS fue de 39,82%, para la Torta OH fue de 7,5% y para la Torta Testigo fue de 26,99%. El ANVA (α = 5% y 1%) y la prueba de Tukey indican que todos los tratamientos difieren entre sí. Se sabe que los lípidos son compuestos insolubles en agua, pero solubles en solventes como el etanol, alcohol, cloroformo etc., moléculas apolares, sin carga eléctrica que no se vio afectada por el tratamiento con solución salina, incrementándose más bien por la pérdida de sólidos solubles, lo que explica su alta concentración. Lo inverso ocurre en la Torta OH, donde el tratamiento con etanol elimina una cantidad importante de lípidos por lo que se detecta apenas un 7,5%. En la Torta Testigo la grasa residual, luego del prensado, fue de 27%, lo que significa que se requeriría un proceso de extracción de mayor rendimiento. En este caso, investigadores como Bridgemohan y Knights (2009) reportaron un contenido de grasa de 25,6% en muestras similares a la Torta Testigo, mientras que García et al. (2009) reportaron 1,03% en muestras de torta de moringa oleífera desgrasada.
La fibra cruda fue de 8,79% para la Torta SS, 8,44% para la Torta OH y 2,54% para la Torta testigo, para las tortas sometidas a proceso de desamargado los valores obtenidos son ligeramente mayores que lo encontrado por Bridgemohan y Knights (2009) quienes reportaron un 6,5%. El análisis estadístico, ANVA (α = 5% y 1%) y comparaciones múltiples Tukey (α = 5% y 1%), demuestra que la cantidad de fibra para la Torta SS y la Torta OH son iguales, mientras que entre la Torta testigo y la Torta OH existen diferencias significativas, lo mismo que entre la Torta testigo y la Torta SS. Estas diferencias se deberían a que las muestras tratadas con solución salina y las muestras tratadas con etanol, comparadas con el testigo, con cualquiera de los métodos de desamargado emp-leados, las tortas experimentan pérdida de solutos, como la pérdida de grasas en la Torta OH y la perdida de proteínas y sales en la Torta SS, lo cual resulta en un incre-mento porcentual de otros componentes.
El contenido de cenizas de 7,11% para la Torta SS y de 6,95% para la Torta OH, estadísticamente son iguales en forma significativa (α = 5% y 1%), pero cada una de ellas son diferentes de la Torta Testigo (3,96%). Bridgemohan y Knights (2009) encontraron un valor ligeramente inferior de cenizas (4,6%) en muestras sometidas a procesos de desamargado. En el caso de los carbohidratos totales se determinó un 6,6% para la Torta SS, de 7,83% para la Torta OH y de 17,3% para la Torta Testigo, los que resultan ligeramente más elevados a lo reportado por Bridgemohan y Knights (2009) que fue de 14,18%.
Efecto sobre el perfil nutricional
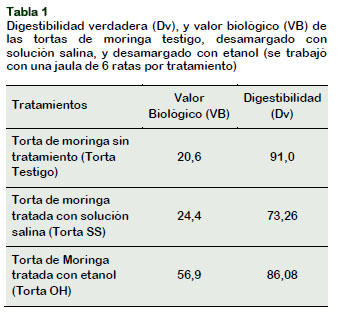
En la Tabla 1 se puede apreciar que en la muestra no sometido a tratamiento (Torta Testigo) el valor biológico fue de 20,6, un valor inferior a lo reportado por Carbajal (2013) que para el caso de la soya encontró un valor de 73 y para el trigo entero 65, mientras que la FAO/WHO (1989) reportó valores de 65 para granos de trigo, 73 para granos de arroz y 73 para granos de soya. A pesar de los dos tratamientos de desamargado (Torta SS y Torta OH) empleados, el valor biológico no alcanza valores semejantes a la de la castaña (65,23), trigo, arroz o soya. La razón para la poca utilización de las proteínas de la torta de moringa se debería a la presencia de antinutrientes. El menor valor observado, en la Torta Testigo, se debería a la presencia de los taninos, que, al unirse a macromoléculas, principalmente proteínas (Robbins et al., 1987), reducirían el valor biológico y la digestibilidad.
En el caso de la Torta SS, a pesar que fue tratada con la solución salina, no mejora la calidad de la proteína, posiblemente debido a la gran afinidad entre las sales y las proteínas, que no solamente implica la eliminación de importantes nutrientes de la torta, sino también porque los aminoácidos forman enlaces con las sales a través de los grupos carboxilo y amino que reducen la absorción de compuestos nitrogenados, a pesar de la eliminación parcial de los compuestos amargos. La torta desamar-gada con etanol genera un valor biológico de 56,9 siendo en esta investigación el más alto valor obtenido, posiblemente por la eliminación parcial de los taninos.
En la Tabla 1 se puede ver también que la Dv para la Torta Testigo fue de 91 lo cual indica que hubo buena utilización proteica a nivel intestinal en este grupo testigo, el de la Torta SS fue de 73,26 y el de la Torta OH 86,08. EL grupo alimentado con Torta OH tiene una Dv que coincide con lo reportado por la Comercializadora Internacional ABBE Ltda. (1996) quienes encontraron en la torta de soya un valor de 89 y en el Arroz un valor de digestibilidad de 85, valor semejante con lo reportado por Torres et al. (2013) quien encontró una Dv de 92 para la torta de soya.
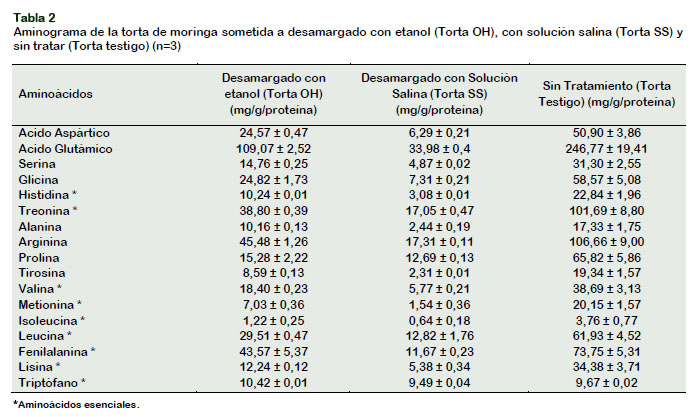
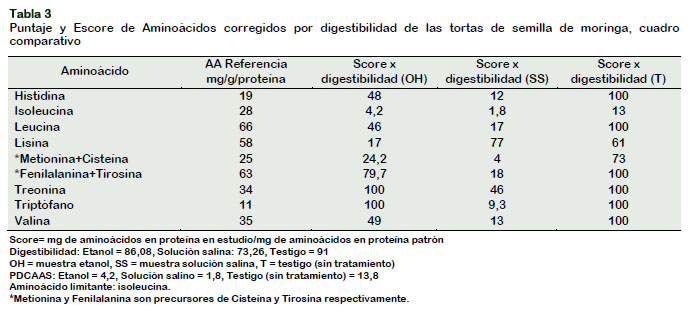
En la Tabla 2 se muestra el aminograma de las tres muestras analizadas (Torta SS, Torta OH y Torta Testigo). El ANVA (α = 5% y 1%) para el caso de la histidina indica que existen diferencias altamente significativas entre las muestras lo cual es confirmada mediante una prueba de comparaciones múltiples de Tukey (α = 5% y 1%). El hecho que la Torta Testigo muestre un mayor contenido tiene que ver con la naturaleza polar de éste aminoácido, lo cual lo hace muy soluble en agua, por lo que, cualquier tratamiento con solventes, como en el caso de la Torta SS o la Torta OH, resultaría en pérdidas significativas de histidina (Fennema, 2010).
Diferencias semejantes se observan tam-bién en el caso de la treonina y lisina (α = 5% y 1%), ya que estos aminoácidos son muy solubles en agua, mostrando también una solubilidad importante en etanol (Badui, 2006; Fennema, 2010).
Los análisis estadísticos (α = 5% y 1%) para los aminoácidos no polares, generalmente hidrófobos, de limitada solubilidad en agua, han sufrido también una disminución importante al ser sometidos a procesos de desamargado utilizando solución salina (Torta SS) y etanol (Torta OH), en compa-ración con la muestra no tratada (Torta Testigo). Se ha observado para el caso de éstos aminoácidos (valina, metionina, isoleucina, leucina, fenilalanina y triptó-fano) que se produce una disminución altamente significativa cuando la torta es tratada con la solución salina y en menor grado al ser tratadas con etanol, esto se debería a la alta afinidad de las proteínas por los taninos (Hagerman y Butler, 1980), unida a su alta solubilidad, lo que sugeriría la existencia de complejos solubles.
Según Bowman y Russell (2003) si bien el score de una proteína se refleja en el contenido en aminoácidos (AA) que posee, en comparación con una proteína ideal, cuando se requiere conocer la utilización de estos AA en el organismo, es necesario realizar la corrección de este escore, según la digestibilidad proteica (PDCAAS).
En la Tabla 3 se muestran los resultados de PDCAAS para los 2 tratamientos y el testigo, resultando el aminoácido limitante la isoleucina para las 3 muestras, con 4,2 en etanol, 1,8 en solución salina y 13 en la muestra testigo (sin tratamiento) Al respecto, Suarez et al. (2006) indica un PDCAAS de 42,94 para la lisina en la almendra, en la harina de arvejas un PDCAAS de 43,34 para el aminoácido histidina, en el caso de la harina de trigo reportó un PDCAAS de 47,81 para la lisina y en las lentejas un PDCAAS de 63,34 para los aminoácidos azufrados (FAO/WHO, 1989).
Efecto sobre el perfil toxicológico
La presencia de saponinas y taninos no solamente ejercen una acción anti-nutricional reduciendo la digestibilidad y el valor biológico de las semillas (McAllister et al., 1994) sino también afectan las características sensoriales. La Torta Testi-go muestra un fuerte sabor astringente y amargo de acuerdo a las pruebas sensoriales desarrolladas (Datos no publicados). En el test de sabor amargo se le indico a las personas identificar la intensidad de la diferencia respecto a la prueba testigo que se le asigno la puntuacion de cero, Los resultados son los siguientes Etanol: -1,875, Solucion salino: -1,775, y soya con menos sabor amargo en promedio con un puntaje de -1,15. A más negativo el puntaje menos amargor y sabor astringente respecto al testigo.
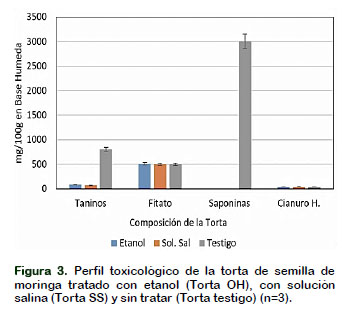
En la Figura 3 se muestra que en la torta tratada con etanol la concentración de taninos es de 82 mg/100 g de muestra, habiendo una disminución del 90% después del tratamiento, en la muestra tratada con solución salino se obtuvo 71,6 mg/100g de taninos y 801,6 mg/100 g en la muestra testigo. Ambos tratamientos tuvieron éxito sobre la extracción de taninos de la torta de moringa, los factores que pueden afectar a la extracción son los siguientes, pH, la adición de un reactivo formador de pares iónicos o la adición de sales neutras a la fase acuosa para reducir la solubilidad del analito (Cela et al., 2002) Técnicas de extracción sólido-líquido y liquido-liquido, basados en la polaridad; son comúnmente usados para remover sustancias de interferencia (azucares, ácidos orgánicos, etc.) o fenólicos no deseados de los fenólicos de interés.
Los taninos cuentan con efectos benéficos para la salud por sus propiedades astrin-gentes, antiinflamatorias, cicatrizantes, antioxidantes y antibacterianas, entre otros. Sin embargo, en altas concen-traciones, puede limitar la absorción y digestibilidad de algunos nutrientes, como es el caso del hierro y las proteínas, en gran parte responsables del sabor astringente de la Torta Testigo, tienen que ser removidos, lo que implica intervenir sobre su composición, especialmente su fracción fenólica (Velasquez-Valderrama, 2004; Bagepallis et al., 1982).
Según Antolovich et al. (2000) la solubilidad de los compuestos fenólicos está determinada por el tipo de solvente (polaridad), grado de polimerización de los fenólicos, así como la interacción de los fenólicos con otros constituyentes del alimento y la formación de complejos insolubles.
El metanol, etanol, acetona, agua, acetato de etilo, entre otros, son los solventes frecuentemente usados para la extracción de estos compuestos; con menos frecuen-cia se usan propanol, dimetilformamida y sus combinaciones, por ello, probable-mente, se produce una remoción impor-tante utilizando el alcohol etílico. En este caso, ambos métodos de desamargado (Torta SS y Torta OH), dieron resultados satisfactorios.
Uno de los compuestos indeseables que más destaca en la Torta Testigo es la saponina, que en la Figura 3 se puede observar alcanza un valor alrededor de 3000 mg/100 g. Esta sustancia, en gran parte, es la responsable del sabor amargo de la torta cruda.
Las saponinas se encuentran en muchos vegetales como el Quillaje saponaria y la Saponaria officinalis, las semillas de quinua y en la moringa (hojas y semillas), la producirían como un mecanismo de resistencias bioquímicas y morfológicas contra herbívoros (Morris y Bogan, 1994).
También es necesario resaltar que es una sustancia tóxica, en seres humanos, pues alteran la permeabilidad de las paredes celulares de eritrocitos y producen hemólisis y afectan el nivel de colesterol en el hígado y sangre (Cheeke, 1991), además son irritantes, estornutatorios y eméticos. Por ello, los niveles de saponina aceptados para consumo humano son tolerados entre 0,06 y 0,12% (Nieto y Soria, 1997). Igualmente, el efecto tóxico de la saponina en peces es muy elevada y la ganancia de peso se hace lento en otros animales. Se puede observar en la Figura 3 que la aplicación de los dos procesos de desamargado (Torta SS y Torta OH) logran el objetivo de remover completamente la saponina.
El contenido de fitatos que se muestra en la Figura 3 es de 0,50% para la Torta Testigo, aunque Ajibola et al. (2004) encontraron valores muy por debajo de lo hallado (10,18 mg/100g) lo cual contrasta mucho con lo encontrado en este trabajo de investigación. El valor de fitatos hallado en la Torta OH fue de 0,49% y en la Torta SS de 0,50%, demostrándose que no existen diferencias significativas entre ellas (α = 5% y 1%). Los dos métodos de desamargado no permitieron la remoción de los fitatos. Se sabe que el ácido fítico es el principal antinutriente presente en los cereales y que se puede encontrar en altas concentraciones en granos de cereales y en legumbres (1% - 2%). El efecto anti-nutricional es significativo ya que puede reducir la biodisponibilidad de proteínas y de minerales mediante la formación de complejos con el hierro, el calcio y el zinc. Normalmente el quelato formado con estos minerales se torna altamente insoluble en solución salina, así como en solventes orgánicos como el etanol (Hurrell et al., 1992). Una de las razones que podría explicar la imposibilidad de remover los fitatos mediante los métodos utilizados es que, esta sustancia se encuentra en las capas externas como aleurona y en el germen, en forma de subestructuras cristalinas en los cuerpos proteínicos, imposibilitando la acción de los solventes utilizados
Son muchos los estudios que han documentado las propiedades de antinutriente del fitato (Manary et al., 2000; Pallauf et al., 1999), basándose en que se trata de una molécula con seis grupos fosfato y, por lo tanto, se halla altamente cargada y presenta gran afinidad por cationes divalentes y trivalentes, con los cuales puede formar especies no solubles dentro del tracto gastrointestinal, evitando así su absorción y reduciendo por lo tanto la biodisponibilidad de estos elementos. Por otra parte, y en contraposición con estos trabajos han aparecido otros estudios donde se pone en duda esta acción antinutriente del fitato (Grases et al., 2001; Sandstrom et al., 2000; Siqueira et al., 2001), señalando más bien sus efectos beneficiosos. Un estudio llevado a cabo con ratas sometidas a diferentes dietas (en presencia y ausencia de fitato) demostró que las concentraciones de minerales en tejidos y fluidos biológicos no difieren estadísticamente en el grupo tratado con un 1% de fitato y en el grupo control (Grases et al., 2001). Estudios de toxicidad aguda del ácido fítico y del fitato sódico, administrados por vía oral, con ratas y ratones determinaron una DL50 situada entre 400 y 2750 mg/kg (Fujitani et al., 1987; Ichikawa et al., 1987), por ello las cantidades halladas en las muestras analizadas no representarían algún tipo de riesgo por el consumo de la torta de moringa.
Se puede observar en la Figura 3 que la cantidad de Cianuro hallado en la Torta Testigo de 40 mg/100g, no fue removido por los dos métodos de desamargado emplea-dos, por lo que los valores de cianuro encontrados en la Torta OH fue de 40mg/100 g, igual que en la Torta SS. La cantidad encontrada puede ser semejante a las encontradas normalmente en otros vegetales. El cianuro en cantidad de trazas, está ampliamente distribuido en las plantas, donde se encuentra princi-palmente en forma de glucósido. Existen algunas plantas que pueden acumular una alta concentración como la almendra amarga (Prunus amigdalus) donde se puede encontrar entre 280 - 2500 mg/kg, en el frijol blanco (2100 mg/kg), en la raíz de la yuca (Manihot esculenta) en una proporción de 138 mg/kg, en albaricoques, frijoles germinados, cerezas, aceitunas, papas, sorgo, soya y nueces, a las que probablemente, brinda protección contra los depredadores (Kuti y Konoru, 2006).
La extracción de éstos glucocidos cianogénicos sería dependiente de su estructura que es un azúcar D-β-glucosa, unido por enlace O-β-glucosido a una aglicona, entre los que se cuenta la amigdalina a la que un segundo azúcar se une al C6 de la glucosa mediante un enlace O-β-glucosidico. Este enlace estabiliza al grupo nitrilo cuando es hidrolizado por β-glucosidasa. El glucósido resultante puede ser α o β, dependiendo de la enzima espe-cifico que catalice la reacción y este mecanismo complejo podría hacer que el efecto de los solventes sea poco efectivo durante la extracción (Belitz y Gross, 1988).
Los glucósidos cianogénicos no son tóxicos por sí mismo, pero sí el CN- liberado por hidrólisis enzimática, el cual actúa a nivel de citocromo oxidasa; como potente inhibidor de la cadena respiratoria. La DL50 del HCN, administrado oralmente a ratones, es 0,5 - 3,5 mg/kg. Para el caso del ser humano la información sobre datos toxicocinéticos es escasa y muy variada. Las dosis letales medias para humano estimadas en base a estudios de reporte de casos son: para exposición por vía inhalatoria la DL50 sería de 524 ppm por 10 minutos, por vía oral la DL50 sería de1,52 mg/kg y por vía dérmica 100 mg/kg, por lo que las cantidades encontradas en la torta de moringa, tanto las tratadas como las no tratadas, no entrañarían mayores proble-mas de orden toxicológico.
4. Conclusión
El contenido de proteína de la torta cruda (Torta Testigo) fue de 43,82%, de la torta tratada con solución salina (Torta SS) de 32,57% y de la tratada con etanol (Torta OH) de 63,69%. El Valor Biológico de la Torta Testigo fue de 20,6, de la Torta SS fue de 24,3, y de la Torta OH de 56,9 demostrando la ventaja del tratamiento con etanol respecto al testigo y a la torta con solución salino. Respecto al Score de Aminoácidos Corregido por Digestibilidad Proteica (PDCAAS) en la Torta Testigo se obtuvo un puntaje de 115,46, 102,46, 142,79, 342,73, 125,71 y 110 para Histidina, Leucina, Fenilalanina, Treonina, Triptofano y valina, respectivamente, demostrando superioridad frente a las Tortas SS y Torta OH. Los tratamientos de desamargado con etanol y solución salina, removieron los taninos en 90% mientras que las saponinas fueron removidas en un 100% los fitatos y cianuro no fueron removidos. Es necesario que las investigaciones sobre la torta de moringa persistan en el proceso de desamargado y la aplicación en la elabo-ración de diversos alimentos, deben estu-diarse las propiedades de digestibilidad in vivo e in vitro de productos fortificados, la biodisponibilidad de nutrientes y los conte-nidos fitoquímicos, así como la evaluación de la estabilidad en almacenamiento de las muestras fortificadas, sin dejar de lado el aspecto toxicológico, incluyendo la posible presencia de alérgenos y mutágenos.
Agradecimientos
Financiado por el Programa Nacional de Innovación para la Competitividad y Productividad (Innóvate Perú), de acuerdo al contrato 226-FINCyT- IA-2013.
Referencias Bibliográficas
Adewumi, T.O.; Samson, A.O. 2018. Review article: Moringa oleifera as a food fortificant: Recent trends and prospects. J. Saudi Soc. Agr. Sci. 17: 127-136. [ Links ]
Ajibola, V.; Anhwange, B.; Onige, S. 2004. Chemical Studies of the Sceds of Moringa Oleifera (Lam) and Detarium microcarpum (Guill and Sperr). Journal of Biological Sciences 4(6): 711-715. [ Links ]
Andrew, B.F.; Felicitas, E.M.; Emrobowansan, M. I.; José, M.L.; Anthony, J.A.; Voster, M. 2018. Multi-functional application of Moringa oleífera Lam. in nutrition and animal food products: a review. Food Research International 106: 317–334. [ Links ]
Antolovich, M.; Prenzler, P.; Robards, K.; Ryan, D. 2000.Sample preparation in the determination of phenolic compounds in fruits. The Analyst 1(25): 989 - 1009. [ Links ]
AOAC (Association of oficial Analytical Chemistry). 2012. Official Methods of Analysis of the Association of official analytical Chemistry. 19 th Edition AOAC, Washington DC. [ Links ]
Badui, S. 2006. Química de los alimentos. 4a ed. México, Editorial Pearson S.A. de C.V. 717 pp. [ Links ]
Bagepallis, S.; Narasinga, R.; Tatineni, P. 1982. Tannin contents of foods commonly consumed in India and its influence on ionisable iron. J. Sci. Food Agric. 33(1): 89-96. [ Links ]
Baptista, A.T.A.; Silva, M O.; Gomes, R.G.; Bergamasco, R.; Vieira, M.F.; Vieira, A.M.S. 2017. Protein fractionation of seeds of Moringa oleifera lam and its application in superficial water treatment. Sep. Purif. Technol. 180: 114–124. [ Links ]
Belitz, D.; Gros, W. 1988. Química de los alimentos. Editorial Acribia, Zaragiza (España) 173-179. [ Links ]
Bowman, B.A.; Russell; R.M. 2003. Conocimientos actuales sobre nutrición. Publicación Científica y Técnica No. 592. Organización Panamericana de la Salud / Oficina Sanitaria Panamericana, Oficina Regional de la Organización Mundial de la Salud. Washington, D.C. 871 pp. [ Links ]
Bridgemohan, M.; Knights, M. 2009. Nutritive Value of Moringa Oleífera and its potential as a high protein supplement for animals. Centre for Bioscience, Agriculture and Food Technology, University of Trinidad and Tobago. 3 pp. [ Links ]
Carbajal, A. 2013. Manual de nutrición y Dietética. Universidad Complutense de Madrid. Consultado el 26 de noviembre de 2017. Disponible en https://www.ucm.es/data/cont/docs/458-2013-07-24-cap-5-proteinas.pdf. [ Links ]
Cela, R.; Lorenzo, R.; Del-Carmen, M. 2002. Técnicas de Separación en Química analítica. Editorial Síntesis, S.A. [ Links ]
Cheeke, P. 1991. Nutritional and physiological implica-tions of saponins: a review. Canadian J. Animal Sci. 51(3): 631 – 632. [ Links ]
Cohn, E.J.; Henry, J.L.; Prentiss, A.M. 2002. Studies in the physical chemistry of the proteins. V. Molecular weights of the proteins. Journal of Biological Chemistry 63: 721-766. [ Links ]
Comercializadora Internacional ABBE Ltda.1996. Curso práctico de alimentación porcina. 43 pp. [ Links ]
Ewulo, T.O.; Oluwalana, I.B.; Ewulo, B.S.; Awolu O.O. 2017. Enrichment of traditional maize snack (Kokoro) with moringa (Moringa oliefera) leaf and soybean. Afr. J. Food Sci. 11(5): 140-145 [ Links ]
FAO/WHO. 1989. Protein quality evaluation. Report of Joint FAO/WHO Expert Consultation. FAO Food and Nutrition Paper 51. 67 pp. [ Links ]
Fennema, O. 2010. Química de los alimentos. 3a ed. Zaragoza, España, Editorial Acribia S.A. 1258 pp. [ Links ]
Foild, N.; Makkar, S.; Becker, K. 2001. The potential of Moringa oleifera for agricultural and industrial use. Disponible en: https://miracletrees.org/moringa-doc/the_potential_of_moringa_oleifera_for_agricultural_and_industrial_uses.pdf. [ Links ]
Fujitani, T.; Yoneyama, M.; Kabashima, J.; Hosokawa, N.; Ichikawa, H. 1987. Acute toxicity of phytic acid and sodium phytate in mice. Kenkyu Nenpo-Tokio-toristu Eisei Kenkyusho 38: 368- 370. [ Links ]
Garcia, A.; Rodriguez, I.; Martinez, R. 2009. Evaluación de los usos potenciales del Teberino (Moringa oleífera) como generador de materia prima para la Industria Química. Tesis para optar el título de ingeniero químico. Universidad de El Salvador. 97 pp. [ Links ]
Grases, F.; Simonet, M.; Prieto, M.; March, G. 2001. Dietary phytate and mineral bioavailability. J. Trace Elem. Med. Biol. 15: 221-228. [ Links ]
Hagerman, E.; Butler, L.G. 1980. Condensed tannin purification and characterization of tannin-associated proteins. Journal of Agricultural and Food Chemistry 28: 947–952. [ Links ]
Hernández, G.N.G.; Hernández, D.C.; Ruiz, G.V. 2017. Elaboración de tamal a base de sorgo blanco (Sorghum bicolor L. moench) y moringa (M. oleífera) como alimento funcional. Jóvenes en la Ciencia 3: 81-84 [ Links ]
Hurrell, R.; Lynch, S.; Trinidad, T. 1992. Iron absorption in humans as influenced by bovine milk proteins. American Journal of Clinical Nutrition 49: 546-552. [ Links ]
Ichikawa, H.; Ohishi, S.; Takahashi, H.; Yuzawa, K.; Hosokawa, N. & Hashimoto, T. 1987. Acute oral toxicities of phytic acid and sodium phytate in rats. Kenkyu Nenpo-Tokio-toristu Eisei Kenkyusho 38: 371-376. [ Links ]
IOM/FNB. 2005. Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Protein and Amino Acids (Macronutrients). Washington: The National Academies Press. 1331 pp. [ Links ]
Kallasapathy, K.; Perera, P.A.J.; Macneil, J.H. 1985. Improved nutritional value in wheat bread by fortification with full-fat winged bean flour (Psophocarpus tetragonolobus L.D.C). Journal of Food Science 50: 1693-1696. [ Links ]
Kuti, J.O.; Konoru, B. 2006. Cyanogenic glycosides content in two edible leaves of tree spinach (Cnidoscolus spp.). J. Food Composition and Analysis 19(5): 56-61. [ Links ]
Makkar, P.S.; Becker, K. 1997. Nutrients and antiquality factors in different morphological parts of the Moringa oleífera tree. Journal of Agricultural Science 128(3): 311-322. [ Links ]
Manary, J.; Hotz, C.; Krebs, F.; Gibson, S.; Westcott, W.; Arnold, T.; Broadhead, L.; Hambidge, M. 2000. Dietary phytate reduction improves zinc absorption in Malawian children recovering from tuberculosis but not in well children. Journal of Nutrition 130: 2959-2964. [ Links ]
McAllister, A.; Bae, H.D.; Jones, G.A.; Cheng, K.J. 1994. Microbial attachment and feed digestion in the rumen. Journal of Animal Science 72(11): 3004-3018 [ Links ]
Meza-Leones, M.; Riaños-Donado, K.; Mercado-Martínez, I.; Olivero-Verbel, R.; Jurado-Eraso, M. 2018. Evaluación del poder coagulante del sulfato de aluminio y las semillas de Moringa oleífera en el proceso de clarificación del agua de la ciénaga de Malambo-Atlántico. Revista UIS Ingenierías 17(2): 95-104 [ Links ]
Mitchell, H.H. 1923. A method of determining the biological value of protein. Journal of Biological Chemistry 58(1): 873-907 [ Links ]
Morris, D, M.; Bogán, M. 1994. Bases bioquímicas y morfológicas de la resistencia. En: Mejoramiento de plantas resistentes a insectos. México: Editorial Musa S.A. 386 pp. [ Links ]
Navarro, G.P. 2015. Moringa oleífera: Un aliado en la lucha contra la desnutrición. Acción Contra el Hambre: ACF International. Madrid. 36 pp. [ Links ]
Nieto, C.; Soria, M. 1997. Procesamiento de quinua en Ecuador. En Proyecto Informe final de labores. Quito, Ecuador: INIAP UTA – CIID. 3: 85-94 [ Links ]
Pallauf, J.; Pippig, S.; Most, E.; Rimbach, G. 1999. Supplemental sodium phytate and microbial phytase influence iron availability in growing rats. J. Trace Elem. Med. Biol. 13: 134-140. [ Links ]
Paniagua, A.; Chora, J. 2016. Elaboración de Aceite de semillas de Moringa Oleífera para diferentes usos. Revista de Ciencias de la Salud 3 (9): 36-46. [ Links ]
Pellet, R.; Millward, J.; Newsholme, A. 1978. Amino acid scoring in health and disease. En: Protein - Energy interactions. Ed. Scrimshaw N. S., Schurch B. Nestlé Foundation. Lausanne. 405-413. [ Links ]
Pérez, W.; Rodriguez, I.; Nunez, A.; Carrasco, M. 2000. Mezcla de harinas para plantas alimenticias. Heladería Panadería Latinoamericana 14(6): 26-31. [ Links ]
Robbins, T.; Hanley, E.; Hagerman, O.; Hjeljord, L.; Baker, C.; Schwartz, C.; Mautz, W. 1987. Role of tannins in defending plants against ruminants: Reduction in protein availability. Ecology 68: 98-107. [ Links ]
Sandstrom, B.; Bugel, S.; MCgaw, A.; Price, J.; Reid, D. 2000. A high oat-bran intake does not impair zinc absorption in humans when added to a low-fiber animal protein-based diet. J. Nutr. 1(30): 594-599. [ Links ]
Siqueira, M.; Arruda, F.; De-Sousa, M.; 2001. Phytate from an alternative dietary supplement has no effect on the calcium, iron and zinc status in undernourished rats. Arch. Latinoam. Nutr. 5(1): 250-257. [ Links ]
Suárez, M.; Kizlansky, A.; López, B. 2006. Evaluación de la calidad de las proteínas en los alimentos calculando el escore de aminoácidos corregido por digestibilidad. Nutrición Hospitalaria 21(1): 47-51 [ Links ]
Torres, V.; Yossa, W.; Espinoza, M.; Gutierrez, M. 2013. Digestibilidad aparente de ingredientes de origen vegetal y animal en la cachama. Pesq, agropec. Bras. 48: 920-927. [ Links ]
Velásquez-Valderrama, M. 2004. Extracción de taninos presentes en el banano verde Revista Lasallista de Investigación 1(2): 17-22. [ Links ]
* Corresponding author
E-mail: misilva@lamolina.edu.pe (M. Silva).
Received December 6, 2017.
Accepted April 30, 2018.