Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.3 Trujillo jul./set. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.03.13
COMUNICACIÓN CORTA
Cruzamiento y flujo génico de los transgenes de las proteínas fluorescentes roja (RFP) y verde (GFP) en el pez cebra transgénico (Danio rerio) introducido al Perú
Crossing and gene flow of the transgens of the red fluorescent proteins (RFP) and green (GFP) in the zebrafish (Danio rerio) transgenic introduced to Peru
Carlos Scotto Espinoza1,2,*; Ricardo Chuan García1
1 Laboratorio de Mejora Genética y Reproducción Animal de la Facultad de Ciencias Naturales y Matemática. Universidad Nacional Federico Villarreal. Jirón Río Chepén s/n. El Agustino. Lima. Perú.
2 Escuela Internacional de Posgrado. Jr. Junín 429 Cercado de Lima Perú. http://www.eiposgrado.edu.pe
Resumen
La introducción de peces Cebra (Danio rerio) fluorescente transgénicos en el Perú data desde mediados de la primera década del siglo XXI. A partir de ese momento, se han introducido OVM´s hidrobiológicos de diversos colores a territorio peruano, lográndose incluso su reproducción en cautiverio e hibridación o cruzamiento. En el presente estudio se realizó un análisis de la bioluminiscencia con luz UV y un análisis molecular que comprobó el flujo génico de los transgenes GFP y RFP de los parentales a la progenie F1 en condiciones confinadas.
Palabras clave: Danio rerio; Bioseguridad; OVM, transgénico; hidrobiológico.
Abstract
The introduction of Zebrafish (Danio rerio) fluorescent transgenic fish in Peru dates back to the midfirst decade of the twenty-first century. From that moment, hydrobiological LMO´s of various colors have been introduced into Peruvian territory, including their reproduction in captivity and hybridization or crossbreeding. In the present study we performed a bioluminescence analysis with UV light and a pertinent molecular analysis that verified the gene flow of the parental to F1 progeny in confined conditions.
Keywords: Danio rerio, Biosafety, LMO, transgenic, hydrobiological.
Introducción
Actualmente en el Perú, posee una Ley de Moratoria que regula el ingreso de los Organismos Vivos Modificados (OVM´s) (Ley Nº 29811, 2011) hasta el año 2021. Así mismo, el Decreto Supremo Nº 011-MINAM (2016) señala que los organismos hidrobiológicos transgénicos son mercancías restringidas de ingresar al Perú. Sin embargo, existe la necesidad de implementar y estándarizar protocolos moleculares para la detección de la presencia y flujo génico de los transgenes de las proteínas de fluorescencia en OVM´s como son los peces Cebra (Danio rerio) transgénicos ornamentales introducidos al país y actualmente existentes en varios acuarios o criaderos comerciales donde son criados y reproducidos libremente en el Perú. Mundialmente, existe una creciente preocupación ante la falta de información generada por una valoración real de los efectos negativos por la introducción, reproducción e hibridación descontrolada (Flujo génico de un organismo transgénico a un organismo no transgénico emparentado) de éstos peces modificados genéticamente en sus colores corporales u otros rasgos por la acción de transgenes de organismos marinos invertebrados (Kusrini et al., 2016; Mohanta et al., 2014; Ofelio et al., 2012; Scotto, 2016).
A principios del año 2000 se desarrollaron los primeros peces ornamentales transgénicos fluorescentes. La técnica para la obtención de estos OVM consistió en la introducción de genes que producen proteínas fluorescentes de colores verde (GFP, Green Fluorescent Protein), rojo (RFP, Red Fluorescent Protein), entre otros. Extraídos primero de la medusa abisal Aequorea victoria y luego de la anémona de mar (Anemonia majano) (Tsien, 1998). Los primeros peces transgénicos producidos fueron el pez Medaka (Oryzias latipes) y el pez Cebra (Danio rerio) (Gong et al., 2003). En el año 2006 se identificó el primer movimiento transfronterizo de peces cebra fluorescentes al territorio peruano (Scotto, 2011). Posteriormente, se logró su reproducción y su hibridación en cautiverio (Scotto, 2012). Y en el 2013, se logró la identificación molecular por PCR de peces Cebra que expresaban la proteína fluorescente roja (RFP) (Scotto, 2013). En el año 2016, se reportó la captura de peces Cebra fluorescentes de color rojo liberados en la cuenca del río Amazonas en el departamento de Loreto (MINAM, 2016).
Por lo mencionado, a la fecha no se ha realizado ningún análisis de riesgos ecológicos pertinente en condiciones acuáticas controladas con los peces cebra transgénicos fluorescentes introducidos por movimientos transfronterizos recurrentes al Perú desde hace más de una década desde que fueron descubiertos. Y tampoco se ha medido sus efectos en condiciones controladas a nivel laboratorial que imiten o simulen microambientes naturales para obtener respuestas concretas y objetivas de si los transgenes de fluorescencia en peces ornamentales afectaran o no a la biodiversidad peruana en el tiempo. El objetivo principal de la presente investigación fue analizar su fluorescencia ante la exposición con luz UV de longitud de onda corta. E identificar molecularmente el flujo génico de los transgenes de la proteína fluorescente roja (RFP) y de la proteína fluorescente verde (GFP) en los peces Cebra (Danio rerio) transgénicos de los parentales hacia la generación (F1). Y que podría servir a futuro para reforzar la bioseguridad peruana con el manejo de éstos OVM´s en condiciones confinadas para realizar análisis de riesgos pertinentes.
2. Materiales y métodos
La presente investigación se desarrolló en el Laboratorio de Mejora Genética y Reproducción Animal de la Facultad de Ciencias Naturales y Matemática de la Universidad Nacional Federico Villarreal.
Reproducción de peces Cebra fluorescentes
Se trabajaron con seis peces Cebra reproductores (Dos hembras y cuatro machos) para cada color (Rojo y verde fluorescentes). Se obtuvo sus crías F1, las cuales fueron mantenidas en peceras de vidrio independientes de 20 litros a condiciones óptimas controladas (25 °C y aireación constante) hasta la edad de tres meses de edad.
Identificación de la fluorescencia corporal por la presencia de los transgenes GFP y RFP
Se analizó la presencia (Transgénico) o ausencia (No transgénico) de fluorescencia corporal mediante la exposición de cada pez Cebra de color rojo (RFP = Red Fluorescent Protein) y del color verde rojo (GFP = Green Fluorescent Protein) ante la luz ultravioleta de un transiluminador (Safe Imager™ 2.0 Blue-Light Transilluminator, Marca Invitrogen™, USA) a 400 nm de longitud de onda por treinta segundos tanto de los animales parentales como de la progenie F1 obtenida de tres meses de edad.
Extracción de ADN de tejido muscular del pez Cebra
La extracción de ADN se realizó utilizando el Kit DNeasy Blood & Tissue Kit (Qiagen, USA) y para lo cual se extrajo parte del músculo dorsal del pez con la ayuda de un escarpelo (Marca Rottman Stainless Steel, No. 3) con una hoja de bisturí (Marca Rottman Stainless Steel), aproximadamente 100 mg a 200 mg de tejido muscular colectado fue colocado en un tubo ependorff de 1,5 ml estéril para ser procesado con el kit de extracción de ADN (Qiagen, USA). Las muestras fueron corridas en un gel de agarosa al 1% para observar la calidad del ADN extraído y luego se cuantificó con un espectrofotómetro UV (NanoPhotometer NP80, Marca Implen, Alemania) para obtener concentraciones de 90 a 170 ng/µl. Cada muestra fue diluida a una concentración de 20ng/ul para las pruebas moleculares de amplificación con PCR en un termociclador punto final (SimpliAmp™ Thermal Cycler, Marca Applied Biosystems™, USA).
Análisis molecular por PCR mediante la amplificación de los primers de GPF y RFP en peces Cebra
Para la amplificación se trabajó con una concentración de 40 ng/µl de cada muestra, 1µm para los primers, 2 µm de MgCl2, 2,5 de dNTPs y 0,05 µ/µl del Kit comercial Taq HotStar (Qiagen, USA). Las condiciones de ciclaje para el PCR punto final fueron: Activación inicial de 15 min a 95 °C, 35 ciclos de 1 min a 94 °C, 1 min a 64 °C y seguido por una extensión final de 10 minutos a 72 °C. El producto amplificado fue analizado en una fuente de poder con cámara electroforética (PowerPac™ Basic Power Supply, Marca Bio-Rad, USA) en geles de agarosa al 1,5%. Se utilizó un marcador comercial de peso molecular de 100 pb (Fermentas, USA).
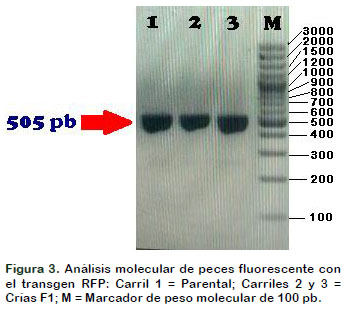
Para determinar la presencia del transgen RFP (505 pb) se sintetizaron cebadores o primers específicos comerciales reportados por la literatura científica de la marca Invitrogen (Thermo Scientifica, USA) y cuyas secuencias fueron (Figura 3):
5’-ACAACACCGTGAAGCTGAAGGTGACCAAG-3’ y 5’-GGTGTAGTCCTCGTTGTGGGAGGTGATGTC-3’.
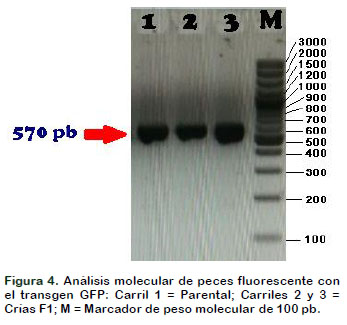
Para determinar la presencia del transgen GFP (570 pb) se sintetizaron primers específicos cuyas secuencias fueron (Figura 4):
5’-TCGAGCTGGACGGCGACGT-3’ y 5’GGTGCTCAGGTAGTGGTTGTC-3’ (Rehbein y Bogerd, 2007; Bielikova et al., 2012).
3. Resultados y discusión
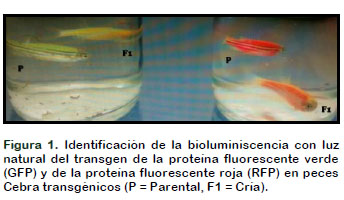
Se logró identificar la fluorescencia corporal por luz ultravioleta tanto en los parentales de los peces Cebra transgénicos como de las crías F1 de la línea roja y verde por la presencia de los transgenes de la proteína fluorescente roja (RFP) y de la proteína fluorescente verde (GFP) demostrándose que la fluorescencia se mantiene a través de la reproducción evidenciándose un flujo génico de los transgenes GFP y RFP (Figuras 1 y 2).
En la Figura 3 se evidenció a nivel molecular por análisis electroforético de los amplificados por PCR de la presencia del transgen de la proteína fluorescente roja (RFP) tanto en el pez Parental como de las dos crías F1 pues amplificaron una banda de aproximadamente 505 pb. En la Figura 4 se evidenció a nivel molecular por análisis electroforético de los amplificados por PCR de la presencia del transgen de la proteína fluorescente verde (GFP) tanto en el pez Parental como de las dos crías F1 pues amplificaron una banda de aproximadamente 570 pb.
Comprobándose de que dichos transgenes fueron pasados a la siguiente generación F1 mediante la reproducción de los parentales. Concordando con los resultados de la identificación de la fluorescencia corporal con el ensayo con luz UV (Figuras 1 y 2). Este análisis preliminar podría dar respuesta a los posibles peligros para el Perú y evaluar los potenciales efectos negativos o no de los transgenes heredados en el tiempo mediante el flujo génico por reproducción de los peces cebras transgénicos rojos y los peces cebra transgénicos verdes previamente identificados por bioluminiscencia y molecularmente. Y de esta manera, tratar de dar respuestas con validez científica. Si en verdad se atentaría negativamente contra la biodiversidad por el potencial riesgo del flujo genético por la liberación no controlada de éstas líneas de peces transgénicos.
Varios investigadores (Grooves y Burdon, 1986; Crossin et al., 2015; Devlin et al., 2013) han tratado de realizar un modelamiento teórico para predecir los efectos negativos del flujo génico de un OVM hidrobiológico en el tiempo. Se sabe, que si un pequeño número de peces modificados genéticamente se escaparan y aparearan con miembros de su especie silvestre emparentado en libertad. El transgen (Gen troyano) aumentará las posibilidades de éxito en el apareamiento, pero se reducirá la viabilidad de la descendencia transgénica. Con el tiempo, las poblaciones silvestres de peces podrían llegar a extinguirse o podrían dispersarse y persistir en el tiempo como una población nueva híbrida. Los animales transgénicos podrían competir por comida o por nichos ecológicos y podrían alterar los equilibrios dentro de la cadena alimenticia (Muir y Howard, 2002; Moreau et al., 2014). Para éste caso, los peces Cebra son introducidos del sudeste asiático y no tienen parientes nativos. Pero otros OVM´s hidrobiológicos como son el pez Monjita (Gymnocorymbus ternetzi) o el Pez Escalar (Pterophyllum scalare) que son peces nativos sudamericanos y poseen actualmente su versión transgénica con diferentes colores y están empezando a ser introducidos al territorio peruano como animal ornamental (Scotto, 2018).
Se recomienda que a nivel de manejo se puede mitigar implementado barreras o sistema de mallas en el sistema de drenaje o desagüe que impidan algún escape accidental de peces pequeño o alevines. Y capacitar al personal que trabaja con ellos y prohibiendo el acceso a personal ajeno no autorizado a las instalaciones donde se cultivan. A nivel físico se puede ubicar el laboratorio fuera o lejos de los ambientes acuáticos cercanos en caso de un posible escape intencional o accidental.
4. Conclusiones
Se identificó la fluorescencia corporal por luz ultravioleta en los peces Cebra adultos reproductores transgénicos y de su progenie F1 de la línea roja y verde en peces Cebra (Danio rerio) introducidos en el territorio peruano. Asimismo, se eviden-ció por análisis molecular la presencia de los transgenes de la proteína fluorescente roja (RFP) y de la proteína fluorescente verde (GFP) en los parentales y sus crías F1 de cada una de las líneas de peces Cebra respectivamente. Comprobándose que existe flujo génico de los transgenes GFP y RFP al evidenciarse su herencia genético molecular hacia los individuos F1 de cada línea de pez Cebra analizada.
Nota
El presente estudio ha cumplido con las normas éticas internacionales para la investigación de animales aplicando las 3 Rs de Russell y Burch (1959).
Referencias Bibliográficas
Bielikova, M.; Bukovska, G.; Vavrova, S.; Timko, J.; Turna, J. 2012. Identification of genetically modified zebrafish (Danio rerio) by PCR methods. Disponible en: http://gmoglobalconference.jrc.ec.europa.eu/2008/Posters/T.2.22%20Bukovska%20-Poster%20Zebrafish%2024062008last.pdf [ Links ]
Crossin, G.; Sundström, F.; Vandersteen, W. Devlin, R. 2015. Early Life-History Consequences of Growth Hormone Transgenesis in Rainbow Trout Reared in Stream Ecosystem Mesocosms. PLoS ONE 10: 1-16. [ Links ]
Decreto Supremo Nº 011-MINAM. 2016. Aprueban el listado de mercancías restringidas sujetas a controlen el marco de la Ley N° 29811 (2016, Julio 24). Diario Oficial El Peruano, pp. 594319-594320.
Devlin, R.; Sakhrani, D.; White, S.; Overturf, K. 2013. Effects of domestication and growth hormone transgenesis on mRNA profiles in rainbow trout (Oncorhynchus mykiss). J Anim Sci. 91: 5247-5258. [ Links ]
Gong, Z.; Wan, H.; Leng, Tay.; Wang, H.; Chen, M.; Yan, T. 2003. Development of transgenic fish for ornamental and bioreactor by strong expression of fluorescent proteins in the skeletal muscle. Biochemical and Biophysical Research Communications 308: 58–63. [ Links ]
Grooves, R.; Burden, J. 1986. Ecology of biological invasions. Proceedings of the Australia Academy of Science 12: 24-30. [ Links ]
Kusrini, E.; Alimuddin, A.; Zairin, M.; Tri Sulistyowati, D. 2016. Gene transfer on Betta imbellis through transfection method with different DNA concentration. Indonesian Aquaculture Journal 11(1): 1-7. [ Links ]
Ley N° 29811. 2011. Ley que establece la moratoria al ingreso y producción de organismos vivos modificados al territorio nacional por un período de 10 años. Diario Oficial El Peruano, pp. 454601.
MINAM. 2016. Servicio de consultoría para la prospección, distribución y análisis socioeconómico de peces ornamentales en las regiones de Loreto y Ucayali. Contrato N° 039-2016-MINAMOGA. pp 97-98. Disponible en: http://genesperu.minam.gob.pe/wp-content/uploads/2016/09/PO2-Prospecci%C3%B3n-distribuci%C3%B3n-y-analisis-socioeconomico-de-peces-O-en-Loreto-y-Ucayali.pdf [ Links ]
Mohanta, R.; Jayasankar, P.; Das Mahapatra, K.; Nath Saha, J.; Kumar Barman, H. 2014. Molecular cloning, characterization and functional assessment of the myosin light polypeptide chain 2 (mylz2) promoter of farmed carp, Labeo rohita. Transgenic Res 23: 601–607. [ Links ]
Moreau, D.; Gamperl, A.; Fletcher, G.; Fleming, I. 2014. Delayed phenotypic expression of growth hormone transgenesis during early ontogeny in Atlantic salmon (Salmo salar). PLoS ONE 9(4): e95853. [ Links ]
Muir, W.; Howard, R. 2002. Assessment of possible ecological risks and hazards of transgenic fish with implications for other sexually reproducing organisms. Transgenic Research 11: 101–114. [ Links ]
Ofelio, C.; Cariani, A.; Trentini, M.; Guarniero, I. 2012. Novel PCR-based assay for rapid identification of Red Fluorescent Proteins in GloFish and GloFish x wildtype zebrafish (Danio rerio) hybrids. Italian Journal of Zoology 79(4): 541-546. [ Links ]
Rehbein, H.; Bogerd, J. 2007. Identification of Genetically Modified Zebrafish (Danio rerio) by Proteinand DNA-Analysis. Journal fur Verbracherschutz und Lebensmittelsicherheit 2: 122-125. [ Links ]
Russell, W.M.S.; Burch, R.L. 1959. The principies of humane experimental technique. Methuen, London. UK. [ Links ]
Scotto, C. 2011. Peces transgénicos fluorescentes en el Perú: Bioseguridad y análisis de riesgos pendientes. The Biologist (Lima) 8: 235-243. [ Links ]
Scotto, C. 2012. Nota Científica: Reproducción e hibridación de peces transgénicos fluorescentes en cautiverio: un alcance prospectivo. Scientia Agropecuaria 3(1): 89-93. [ Links ]
Scotto, C.; Serna, F. 2013. Primera identificación molecular del transgén de la proteína fluorescente roja (RFP) en peces Cebra (Danio rerio) transgénicos ornamentales introducidos en el Perú. Scientia Agropecuaria 4: 257–264. [ Links ]
Scotto, C. 2016. Una casuística de peces transgénicos fluorescentes (Danio rerio) liberados en ambientes naturales peruanos con condiciones térmicas similares a su centro de origen. 2016. The Biologist 14(1): 129-141. [ Links ]
Scotto, Cs. 2018. Reporte de una segunda introducción de peces ornamentales transgénicos fluorescentes al territorio peruano: Caso pez monjita (Gymnocorymbus ternetzi; Boulenger, 1895). Scientia Agropecuaria 9(1): 153-156.
Tsien, Roger. 1998. The green fluorescent protein (Review). Annual Review of Biochemistry 67: 509-544. [ Links ]
* Corresponding author
E-mail: carlosscottoespinoza@gmail.com (S. Scotto).
Received December 14, 2017.
Accepted May 5, 2018.