Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.3 Trujillo jul./set. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.03.14
COMUNICACIÓN CORTA
Detección del virus de la hoja amarilla de la caña de azúcar y virus mosaico de la caña de azúcar en sorgo (Sorghum bicolor (L.) Moench) en el Estado de Morelos, México
Detection of sugarcane yellow leaf virus and sugarcane mosaic virus in sorghum (Sorghum bicolor (L.) Moench) in the state of Morelos, México
Daniel Perales-Rosas1; Ricardo Hernández-Pérez2,*; Dagoberto Guillén-Sánchez3; Víctor López-Martínez4; Irán Alia-Tejacal4; María Andrade-Rodríguez4; Porfirio Juárez-López4; Francisco Perdomo-Roldán3
1 UAEM. Facultad de Ciencias Agropecuarias. Av. Universidad 1001, Colonia Chamilpa. Cuernavaca Morelos. C.P. 62 209.
2 Asesor Científico. Laboratorio de Agrodiagnóstico Fitolab, S.A. de C.V., Colonia el Mirador de Puxtla, Cuautla, Morelos, México. C.P. 62 755.
3 UAEM. Escuela de Estudios Superiores de Xalostoc. Av. Nicolás Bravo s/n, Parque Industrial Cuautla, Xalostoc, Ciudad Ayala, Morelos, México. C.P. 62 740.
4 UAEM. Facultad de Ciencias Agropecuarias. Av. Universidad 1001, Colonia Chamilpa. Cuernavaca Morelos. C.P. 62 209.
Resumen
El presente estudio se realizó en los meses de junio-julio del 2017, con el propósito de determinar la presencia de virus asociados al cultivo del sorgo (Sorghum bicolor (L.) Moench). Se muestrearon 21 localidades, distribuidas en 10 municipios de los 33 que forman el Estado de Morelos. Se utilizaron dos anticuerpos para detectar las enfermedades Virus de la hoja amarilla de la caña de azúcar (SCYLV) y Virus mosaico de la caña de azúcar (SCMV). Se analizaron muestras de follaje colectadas al azar en cinco puntos de cada campo o parcela. El diagnóstico se realizó mediante el test inmunoenzimático tipo DAS-ELISA (doble anticuerpo), con un set de reactivos AGDIA (2017), con conjugado de fosfatasa alcalina para (SCMV) y el segundo set de reactivos de NANO Diagnostic (2017) "AC Diagnostic" con conjugado fosfatasa alcalina para (SCYLV). Los resultados obtenidos evidenciaron presencia de ambas enfermedades virales en el cultivo del sorgo para el estado de Morelos. Con muestras positivas al (SCYLV) y absorbancias altas (1,50 A° y 1,10 A°) en los municipios de Amacuzac y Tequesquitengo respectivamente. Mientras solo dos muestras positivas al (SCMV) fueron detectadas en las localidades de Puente de Ixtla y Yautepec, pero con valores bajos de absorbancia respecto a los controles positivos.
Palabras clave: sorgo; virus; DAS-ELISA.
Abstract
The study was carried out in the months of June-July 2017, with the purpose of studying the current situation of the viruses associated with the cultivation of sorghum (Sorghum bicolor (L.) Moench). Twenty-one commercial sorghum plantation in Morelos state, were analyzed to detected Sugarcane yellow leaf virus (SCYLV) and Sugarcane mosaic virus (SCMV). The diagnosis was made, by means DAS-ELISA (double antibody) an immunoenzymatic test, that used a AGDIA kit (2017) and a reagent set of NANO Diagnostic (2017) "AC Diagnostic" with conjugated alkaline phosphatase, to detection of SCMV and SCYLV respectively. The results obtained evidenced, the presence of both viral diseases in the sorghum cultivation, in ten municipalities of Morelos state whit predominance of SCYLV. Positives samples to this virus with high absorbance (1.50 A° and 1.10 A°) on the municipalities of Amacuzac and Tequesquitengo, respectively were observed. While, only two positive samples of SCMV, in Puente de Ixtla and Yautepec were detected, but with low absorbance values respect to positive controls.
Keywords: sorghum; virus; DAS-ELISA.
1. Introducción
El sorgo (Sorghum bicolor (L.) Moench) es un cereal de origen tropical ampliamente cultivado en todo el mundo. Se utiliza fundamentalmente para la alimentación animal; el grano como fuente energética, es usado en la elaboración de alimentos concentrados y para forraje (Garrido et al., 2011). Es el segundo cultivo más importante en superficie sembrada en México, ocupando el cuarto lugar mundial en producción de grano (Jiménez et al., 2016). Desde la década de los ochenta, el sorgo viene experimentando una extraordinaria expansión por las características antes mencionadas. Sin embargo, los rendimientos y la productividad siguen siendo bajos. Uno de los principales factores que limita la obtención de altos rendimientos en el cultivo es la incidencia de enfermedades, particularmente los de origen viral (Garrido et al, 2000).
Los síntomas que inducen los virus en sorgo son muy variados, pueden causar mosaicos, moteados, diversos grados de amarillamiento y enrojecimiento, necrosis de hojas, tallos y pedúnculos. Otros síntomas son achaparramiento, arrosetamiento, excesivo macollar o rebrotamiento y esterilidad (Toler y Giorda, 1992). Según Xie et al. (2009) la enfermedad del mosaico es ocasionada por un complejo de tres virus: Sugarcane mosaic virus (SCMV), Sorghum mosaic virus (SrMV) y Sugarcane streak mosaic virus (SCSMV).
La presencia de los áfidos vectores Melanaphis sacchari y Rophalosiphum maidis (Figueredo et al., 2004) han favorecido la dispersión del virus SCMV, además de sus características de multiplicación vegetativa (semilla-estaca). El Comité Nacional para el Desarrollo Sustentable de la Caña de Azúcar (CONADESUCA), ha manifestado que no existen reportes sólidos o con validez científica para sostener estos hechos debido a que la información que se tiene sobre la presencia del virus en el país data desde los años 1930-1950, además de que se han basado en la sintomatología típica de la enfermedad (Bermúdez et al., 2016).
El Virus de la hoja amarilla de la caña de azúcar (SCYLV) (genus Polerovirus, family Luteoviridae), fue reportado en semillas de sorgo, en caña de azúcar y ha sido encontrado en más de 35 países del mundo. En 1999 se informó su presencia por primera vez en Cuba, la cual fue favorecida por el vector M. sacchari y la inexistencia de métodos de control eficientes para la erradicación del virus a través del sistema de producción de semilla certificada (Aday et al., 2014).
Se ha considerado eficiente para detectar alguna de estas enfermedades, las pruebas serológicas como el ELISA-DAS, que permite diagnosticar plantas enfermas con síntomas o asintomáticas infectadas con SCYLV, procedentes de meristemos de caña de azúcar regeneradas in vitro, en aclimatación o de campo, lo que lo convierte en la mejor opción de manejo para una indexación adecuada (Suresh y Devi, 2017). Otros resultados con técnicas más sensibles como la RT-PCR, RT-RPA y RTLAMP, demuestran alta especificidad y confiabilidad, pero deben ser consideradas como pruebas de reconfirmación de los diagnósticos positivos a emplear en los programas de propagación (ElSayed et al., 2018).
Con el propósito de estudiar la situación actual de los virus asociados con el cultivo del sorgo (Sorghum bicolor (L.) Moench), se realizaron muestreos en siembras comerciales representativas del estado de Morelos, para detectar la presencia de Virus de la hoja amarilla de la caña de azúcar (SCYLV) y Virus mosaico de la caña de azúcar (SCMV).
2. Materiales y métodos
Ubicación del estudio
El estudio se realizó entre los meses de junio-julio del 2017, en el estado de Morelos, México, ubicado geográficamente a los 22°51′43″ de latitud Norte y 102°36′38″ longitud Oeste y a una altura sobre el nivel del mar de 2309 m. El procesamiento y análisis de las muestras se llevó a cabo en el Laboratorio de Fitopatología de la Escuela de Estudios Superiores de Xalostox/UAEM.
Toma de muestras y localización
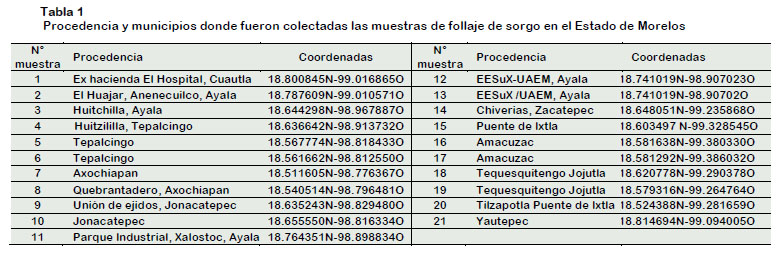
Se analizaron muestras de follaje de sorgo, colectadas en 21 localidades, distribuidas en 10 municipios de los 33 que forman el Estado de Morelos (Tabla 1). Las muestras fueron colectadas al azar en cinco puntos de cada campo o huerta (Noroeste, Noreste, Medio, Suroeste, Sureste), luego fueron colocadas en bolsas plásticas en neveras con geles fríos, para mantenerlas turgentes, hasta su procesamiento.
Análisis serológico
El diagnóstico fue realizado mediante un test inmunoenzimático tipo DAS-ELISA (doble anticuerpo), con un set de reactivos AGDIA (2017) y conjugada fosfatasa alcalina (ref: SRA 18100/0500), para la detección del Virus mosaico de la caña de azúcar (SCMV).
Para el Virus de la hoja amarilla de la caña de azúcar (SCYLV) fue empleado un test inmunoenzimatico tipo DAS-ELISA (doble anticuerpo), conformado por un set de reactivos de NANO Diagnostic (2017) "AC Diagnostic" y conjugado fosfatasa alcalina (ref: V093). La detección se empleó según el protocolo descrito para esta técnica (Clark y Adams, 1977), ajustándose a las indicaciones del fabricante y repitiéndose dos veces para cada virus.
Paso 1. Recubrimiento con 1er anticuerpo
Se empleó una placa de reacción ELISA de 96 pocillos, recubierta con un primer anticuerpo (IgG concentración/1:100), diluido con buffer carbonato o recubrimiento (1X), añadiéndose a cada pocillo (100 μL) de la IgG. Las placas fueron incubadas toda la noche a 4 oC y lava-das posteriormente con buffer (PBST 1X) 2 â 3 veces y secadas antes de ser usadas.
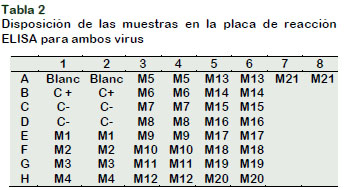
Paso 2. Muestras y Controles (â/+)
Las muestras de hojas previamente preparadas y divididas (5 sub muestras por parcela), formaron muestras individuales (1-21M). De cada muestra, se pesó 1 g de hoja, el cual fue triturado y diluida su savia con un buffer de extracción (GEB 1X) (1:10). Dispensándose 10 µL/ pocillo (dos pocillos por muestra) en la placa sensibilizada con IgG previamente. De igual forma, se añadieron los controles (‒/+) diluidos. Todas las muestras y controles se dispensaron según la posición en el croquis (Tabla 2). Las placas finalmente, fueron incu-badas durante 2 h a temperatura ambiente en cámara húmeda. Transcurrido ese tiempo fue-ron lavadas con buffer (PBST 1X) 3 4 veces.
Paso 3. Adición del Conjugado enzimático (IgGFA)
Después de asegurarse que los pocillos de las placas estaban totalmente limpios de restos vegetales u otros residuos, se adicionó el conjugado, el cual estaba formado por el 2do anticuerpo enlazado a la enzima fosfatasa alcalina concentrada (1:100), misma que fue diluida en buffer (ECI 1X). La mezcla o conjugado fue adicionada (100 µL) por pocillo, en agitación para su homogenización. Posteriormente, las placas fueron incubadas en cámara húmeda durante 2 h a temperatura ambiente y trascurrido ese tiempo, se lavaron de igual forma que en el paso anterior.
Paso 4. Adición del Sustrato colorimétrico
Unos 15 min previos a finalizar la incubación, se preparó el sustrato cromogénico. Se diluyó 1 tableta de PNP (ref: ACC 00404) en 5 mL de buffer sustrato (1X) y se resguardó de la luz hasta su uso. Lista las placas en el paso 3, se añadieron 100 µL del sustrato en cada pocillo y se resguardó de la luz en cámara húmeda durante 30-60 min, verificando con frecuencia hasta visualizar reacción amarilla en los controles positivos. Las placas se leyeron hasta los60 min, usando un Lector de placas Elisa (BioRad) con filtro (405 nm), registrándose los valores o datos de la absorbancia por pocillos.
Análisis estadístico
Los datos obtenidos se sometieron a un análisis estadístico con el programa SAS (Sistema de Análisis Estadístico), por sus siglas en inglés, versión 9.0 (SAS, 1996), realizando la comparación de medias con análisis Tukey (p ≤ 0,05).
3. Resultados y discusión
Absorbancia detectada del Virus de la hoja amarilla de la caña de azúcar (SCYLV) en híbridos de sorgo/localidades
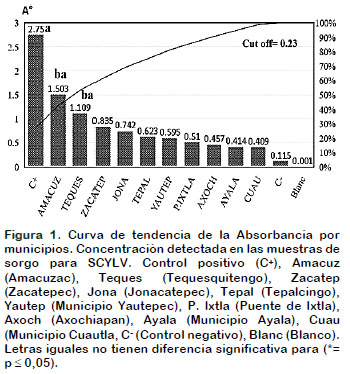
Las pruebas serológicas efectuadas con el kit específico para la detección de SCYLV, Polerovirus, de la family: Luteoviridae, confirman la presencia de este virus en las diferentes localidades que fueron muestreadas en el estado de Morelos, donde se cultiva el sorgo. La curva de tendencia de la absorbancia representada en la Figura 1, compara las muestras analizadas por municipios. Se identificó a la localidad de Amacuzac por encima del 50% de tendencia, reflejando altos valores o concentración detectada en las muestras para el (SCYLV) en sorgo, con 1,50 A°, respecto al C+ 2,75 A°. Le siguió el municipio de Tequesquitengo con un valor de 1,10 A°, sin diferencias estadísticas entre ellos, pero sí con el resto de las localidades donde se detectó el virus.
La detección de este agente patógeno es de suma importancia en México, debido a que la información que se tiene sobre la presencia del virus en el país data desde los años 1930-1950, además de que los informes han sido basados en la síntomatología típica de la enfermedad para describirla en caña de azúcar según CONADESUCA (Bermúdez et al., 2016). Coincidiendo en este ensayo con Aday et al. (2014), los que reportaron que el SCYLV no se encontró asociado a la presencia de síntomas de amarillamiento en caña de azúcar y los resultados de la prueba de Inmunoimpresión de Tejidos (Tissue Blot Immunoassay o TBIA), detectándose el virus en (13,48%) de las muestras asintomáticas, mientras que en el 12,36 % de las muestras con síntomas de la enfermedad resultaron negativas en este análisis. Recientemente Wei et al. (2016), reportaron este virus en semillas de sorgo y lo mencionan como una nueva amenaza para Estados Unidos, por ser transmitido eficientemente por M. sacchari.
La presencia de SCYLV en las muestras analizadas de sorgo, se puede atribuir a la existencia de híbridos susceptibles, a la proximidad de fuentes de inóculo, dinámica del vector (M. sacchari) y una propagación del material vegetal infectado. Siendo este el primer informe de este virus en sorgo.
Absorbancia detectada del Virus mosaico de la caña de azúcar (SCMV) en híbridos de sorgo/localidades
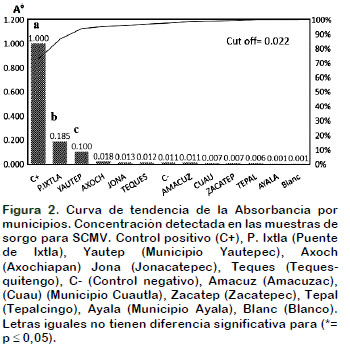
En el caso de los análisis realizados para determinar la presencia del Virus mosaico de la caña de azúcar (SCMV), se obtuvo que el 9,5% de las muestras analizadas resultaron positivas, aunque los valores de absorbancia fueron bajos, lo cual corrobora lo reportado por Giménez et al. (1997), para cereales infectados naturalmente en campo.
La curva de tendencia de la absorbancia representada en la Figura 2, compara las muestras analizadas por municipios, donde fueron detectadas solo dos muestras positivas al (SCMV), en las localidades de Puente de Ixtla y Yautepec, con valores bajos respecto a la tendencia, lo que permite inferir que existe la fuente de inoculo en sorgo de este virus y constituyen una fuente potencial para ser transmitida en forma latente. Según Bermúdez et al. (2016), en los estados de Colima, Jalisco y Nayarit durante el 2013-2014 se detectó en caña de azúcar, la presencia del SCYLV y SCMV, siendo Jalisco donde se detectó la mayor cantidad de infecciones mixtas por ambos virus. En Morelos no se tenían referencias sobre la infección de este virus en el cultivo.
Bermúdez et al. (2017) realizaron uno de los estudios más completos en México, detectando la presencia y distribución del SCMV en caña de azúcar en la zona cañera del Pacífico mexicano, mediante secuencias parciales HC-Pro del aislado de SCMV JalMex-126, lo que permitió identificar dos grupos, el primero que tuvo como hospederos a plantas de maíz y el segundo plantas hospederas de diferentes especies e híbridos de caña de azúcar. Al respecto, algunos autores como Xie et al. (2016) han referido que el sorgo, con frecuencia se siembra cerca de plantaciones de caña de azúcar donde comúnmente se encuentran malas hierbas como Sorghum halepense (L.) Pers., reservorios potenciales del SCMV en campo. Esta información proporciona una base para evaluar las características epidemiológicas de SCMV en el cultivo, con posibilidad de diseñar una gestión sostenible a largo plazo y crear estrategias para evaluar la diversidad molecular y evolución de este virus en México (Moradi et al., 2016).
4. Conclusiones
El test inmunoenzimático DAS-ELISA (doble anticuerpo) permitió detectar la presencia del Virus de la hoja amarilla de la caña de azúcar (SCYLV) y el Virus mosaico de la caña de azúcar (SCMV) en sorgo en el Estado de Morelos. Con mayor concentración se detectó a (SCYLV) en Amacuzac y Tequesquitengo, con valores de absorbancia de 1,50 A° y 1,10 A°, respectivamente. Asimismo, fueron detectadas solo dos localidades con muestras positivas al SCMV en Puente de Ixtla y Yautepec, pero con valores bajos de absorbancia respecto a los controles positivos. La detección de estos agentes como estudio preliminar, se considera una alerta temprana sobre el peligro de dispersión por diferentes vías y recomienda profundizar en el diagnóstico de estos patógenos y su interacción con los híbridos de sorgo cultivados en Morelos.
Referencias Bibliográficas
Aday, O.; La O, M.L.; Zardón, M.A.; Lema, E.; Mesa, J.M.; Puchades, Y.; Delgado, J.; Díaz, F. 2014. Distribución del Virus de la hoja amarilla de la caña de azúcar en Cuba. Revista de Protección Vegetal 29(3): 177-184. [ Links ]
AGDIA. 2017. Reagent set. DAS ELISA, Alkaline phos-phatase label. ELISA Reagent Set for Sugarcane mosaic virus (SCMV). Disponible en: https://orders.agdia.com/agdia-set-scmv-alkphos-sra-18100 . [ Links ]
Bermúdez, M.J; Delgado, F.J.; Cervantes, J.F.; García, J.C.; Farías, V.S. 2017. Detection of Sugarcane mosaic virus (SCMV) in Saccharum spp. in Mexico and phylogenetic origin of one isolate from Jalisco. Revista Mexicana de Fitopatología 36 (1): 16-34. [ Links ]
Bermúdez, M.J.; García, K.P.; Orozco, M.; Guzmán, S.; Velázquez, J.J.; García, J.C.; Cervantes, J.F.; Álvarez, M. 2016. Enfermedades ocasionadas por virus en caña de azúcar en el Occidente de México.
Folleto técnico Núm.13. SAGARPA INIFAP-CIRPAC Campo Experimental Tecomán. Tecomán, Colima, México. 27 pp.
Clark, M.F.; Adams, A.N. 1977. Characteristics of the microplate method of enzyme-linked immunesorbent assay for the detection of plant viruses. Journal of general virology 34(3) 475-483. [ Links ]
ElSayed, A.L.; Boulila, M.; Odero, D.C.; Komor, E. 2018. Phylogenetic and recombination analysis of sorghum isolates of Sugarcane yellow leaf virus. Plant Pathology 67(3): 221-232. [ Links ]
Figueredo, L.; Hernández, L.; Linares, B. 2004. Relación epidemiológica entre áfidos (Homoptera: Aphididae) y enfermedades virales en el cultivo caña de azúcar en los valles de los ríos Turbio y Yaracuy, Venezuela. Caña de azúcar 22: 5-19. [ Links ]
Garrido, M.J.; Freites, J.; González, M. 2011. Reacción de cultivares de sorgo al Potyvirus del mosaico del pasto Johnson. Fitopatología Venezolana 24: 60-61. [ Links ] Garrido, M.J.; Trujillo, G.; Cuello, R. 2000. Ocurrencia del virus del bandeado amarillo del sorgo en Venezuela. Interciencia 25: 321-327. [ Links ]
Giménez, M.P.; Laguna, I.G.; Dagoberto, E.; Truol, G.; Rodríguez, P.E.; Conci, L.R.; Ornaghi, J. 1997. Cebada (Hordeum vulgare L.), un nuevo hospedante natural del virus del mal de Río Cuarto (MRCV) en Argentina. In Actas, VI Congreso Nacional de Maíz. Pergamino, Argentina (Vol. 1). [ Links ]
Jiménez, A.A.; Sánchez, V.; Carranza, J.I.; Padilla, J.M. 2016. Avance en la formación de líneas androestériles y mantenedoras de la esterilidad en sorgo (Sorghum bicolor L. Moench). Revista de Ciencias Naturales y Agropecuarias 3(8): 1-8. [ Links ]
Moradi, Z., Mehrvar, M.; Nazifi, E.; Zakiaghl, M. 2016. The complete genome sequences of two naturally occurring recombinant isolates of Sugarcane mosaic virus from Iran. Virus Genes 52: 270-280. [ Links ]
NANO Diagnostic. 2017. Inc. Product catalog. Sugarcane Yellow Leaf Virus (SCYLV) DAS ELISA. Catalog #: V093. Test used to detect (SCYLV) in infected sugarcane and other cereal crops. Disponible en: http://www.nanodiaincs.com/. [ Links ]
SAS. 1996. Statistical analysis system: user´s guide. SAS Institute, Cary, North Caroline, USA. 956 pp. [ Links ]
Suresh, M.S.; Devi, U.G. 2017.Virus indexing for Sugarcane Yellow Leaf Virus (SCYLV) in field varieties and in vitro regenerated plantlets of sugarcane. Australasian Plant Pathology 46(5): 433–439. [ Links ]
Toler, R.W.; Giorda, L.M. 1992. Detection and identification of viruses and virus diseases of sorghum. Sorghum and millets diseases, a second world review. Ed.: de Milliano, WAJ, Frederiksen, RA and Bengston, GD ICRISAT, Patancheru, Andhra Pradesh, India, 153-159. [ Links ]
Wei, C.; Hincapie, M.; Larsen, N.; Nuessly, G.; Rott, P. 2016. First Report of Sugarcane yellow leaf virus Infecting Grain Sorghum (Sorghum bicolor) in the United States (SCYLV). Disease Notes 100. 8, 1798. [ Links ]
Xie, J.; Wang, M.; Xu, D.; Li, R.; Zhou, G. 2009. Simultaneous detection and identification of four sugarcane viruses byone-step RT-PCR. Journal of virological methods 162: 64-68. [ Links ]
Xie, X.; Chen, W.; Fu, Q.; Zhang, P.; An, T.; Cui, A.; An, D. 2016. Molecular variability and distribution of Sugar cane mosaic virus in Shanxi, China. PLoS one 11(3): e0151549. [ Links ]
* Corresponding author
E-mail: santaclara57@yahoo.es (R. Hernández-Pérez).
Received May 16, 2018.
Accepted June 13, 2018.