Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.4 Trujillo out./dic. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.04.03
ARTÍCULOS ORIGINALES
Biopelículas de Staphylococcus spp. sobre acero inoxidable utilizando leche y brain heart infusion broth como medios de cultivo
Biofilms of Staphylococcus spp. on stainless steel by milk and brain heart infusion broth as culture media
Cruzado-Bravo, M.L.M.1,*; Silva, N.C.C.1,2; Rodrigues, M.X.1; Saldaña E.1; Contreras- Castillo, C.J.1; Sturion, G.L.1
1 Departamento de Agroindustria Alimentos y Nutrición, Escuela Superior de Agricultura "Luiz de Queiroz", Universidad de São Paulo, Piracicaba, São Paulo, 13418-900, Brasil
2 Departamento de Ciencia de Alimentos, Universidad de Campinas, Campinas, São Paulo, 13083-862, Brasil
Resumen
Staphylococcus spp. tiene la capacidad de adherirse y desarrollar biopelículas sobre diferentes superficies de contacto. Así el objetivo de la presente investigación fue comparar la producción de biopelículas de Staphylococcus spp. sobre acero inoxidable empleando dos medios de cultivo, leche Ultra High Temperatura (UHT) y Brain Heart Infusion broth (BHI). Se realizaron recuentos microbiológicos de las células adheridas en dos tiempos (12 y 24 h), en los dos medios de cultivo, incubados a 25 °C. Los recuentos de las células adheridas fueron analizados mediante ANOVA y comparación de medias por el test de Duncan (p < 0,05). Las biopelículas de dos cepas (cepa silvestre y cepa de tipo) cultivadas por 12 h en BHI, fueron observadas empleando microscopia electrónica de barrido (MEB). Se obtuvieron recuentos microbiológicos entre 7 y 8 log UFC/cm2. Fue observada diferencia significativa entre las cepas evaluadas, mientras que, no hubo diferencia significativa en los tiempos y medios de cultivo evaluados. Fue comprobado a través de la MEB que la cepa silvestre S.a2 presentó considerable producción de biopelículas, como era esperado de acuerdo con los resultados encontrados en los recuentos microbiológicos. Esto indicaría que la leche proporciona condiciones adecuadas para la formación de biopelículas de Staphylococcus spp. sobre acero inoxidable.
Palabras clave: Superficies de contacto; medios de cultivo; biopelículas bacterianas; MEB.
Abstract
Staphylococcus spp. can adhere and produce biofilm on different contact surfaces. Thus, the aim of this work was to compare the biofilm production by Staphylococcus spp. on stainless steel using two culture media, milk Ultra High Temperatura (UHT) and Brain Heart Infusion broth (BHI). The bacterial count of adhered cells on steel was performed two times (12 and 24 hours) for both media evaluated with incubation at 25 °C. The bacterial counts of adhered cells were analyzed using ANOVA and Duncan's test for average comparison (p < 0.05). The biofilm formation of two strains (wild type strain and type strain) were observed applying Scanning electron microscopy (SEM). The bacterial counts were between 7 and 8 log CFU/cm2. Significant difference was found among the strains evaluated; however, no significant difference was described in times and culture media tested. It was showed by SEM that the wild type strain (S.a2) had considerable ability to biofilm production, which was expected due its results on bacterial counts. Thus, it can indicate milk offers appropriate conditions to biofilm formation of Staphylococcus spp. on stainless steel.
Keywords: Contact surface; culture media; bacterial biofilm; SEM.
1. Introducción
En la industria láctea, Staphylococcus spp. puede provenir de diferentes fuentes, como leche cruda, equipos de ordeño, equipos de procesamiento, medio ambiente, manipuladores de alimentos, entre otros (André et al., 2008; Acco et al., 2003; Simeão do Carmo et al., 2002; Jørgensen et al., 2005). Gran parte de los casos de contaminación en este sector son ocasionados por los manipuladores de alimentos (Castañeda- Ruelas, 2017; Acco et al., 2003). Se conoce que al rededor del 20 al 30% de la población humana es portadora persistente de Staphylococcus aureus mientras que el 60% son portadores intermitentes, es decir colonizadores transitorios. De hecho, solo el 20% de las personas no serían portadores de S. aureus (Wertheim et al.,2005), siendo las fosas nasales el principal nicho de S. aureus (van Belkum et al., 2009; Vatansever et al., 2016). Adicionalmente, numerosas investigaciones muestran que S. aureus es uno de los principales patógenos asociados a mastitis subclínica en vacas lecheras (Contreras y Rodríguez, 2011; Khoramrooz et al., 2016; Zhang et al., 2016); consecuentemente, esta infección puede contribuir con la contaminación de S. aureus a la leche cruda y debido a posibles deficiencias en los procesos de producción, este patógeno puede ser transferido a los derivados lácteos (Castañeda-Ruelas et al., 2017)
El género Staphylococcus comprende más de 50 especies, una de las más estudiadas es S. aureus que está catalogado como un patógeno oportunista, posee diferentes factores de virulencia, entre ellos la formación de toxinas y adhesinas (Honeyman et al., 2002). Las proteínas de adhesión codificadas por los genes bbp, fib, cna, clfA, clfB, fnbA, fnbB, ebpS, eno son conocidas como microbial surface components recognizing adhesive matrix molecules (MSCRAMM) están presentes en la pared celular, proporcionándole a Staphylococcus la capacidad de colonizar y formar biopelículas (Patti et al., 1994). Adicionalmente, los genes icaA e icaD están ampliamente estudiados por su relación con la formación de biopelículas, básicamente por la producción de la adhesina intercelular polisacárida (PIA) y la polyN-acetylglucosamine (PNAG) que promueven y forman parte de las biopelículas de Staphylococcus (Heilmann, 2011). Las biopelículas bacterianas son comunidades microbianas organizadas sobre una superficie viva o inerte, con características funcionales y estructuras complejas, posen un proceso dinámico de formación que sigue las siguientes etapas: adhesión, proliferación y formación, maduración y finalmente la dispersión de la biopelícula (Le et al., 2014). Está relatado que el 99% de las bacterias viven en forma de biopelículas y solo el 1% de ellas viven en estado plantónico (Sanclement et al., 2005). Este singular comportamiento tiene profundas consecuencias en el modo de analizar la supervivencia de las células procariotas en ambientes naturales e industriales (Liaqat, 2011).
En la producción de lácteos, las biopelículas microbianas se pueden formar sobre todo tipo de superficies, como: mesas de trabajo, utensilios, tubulaciones, pisos, paredes, equipos, afectando negativamente la calidad microbiológica del producto final (Vlková et al., 2008; Dutra et al., 2018). Las biopelículas aportan protección a las células bacterianas, disminuyendo con ello la eficiencia en los procedimientos de limpieza y desinfección (Vázquez-Sánchez et al., 2013). En consecuencia, genera la necesidad de desa- rrollar nuevas estrategias, así como agentes anti-biopelículas que permitan la prevención y control de estas, minimizando el riesgo de contaminación en los alimentos (Ait Ouali et al., 2014; Meesilp y Mesil, 2018). Por lo tanto, es indispensable más investigaciones que permitan evaluar la formación de biopelículas en superficies de materiales comúnmente utilizado en la industria láctea como el acero inoxidable, igualmente evaluar el comportamiento de estos microorganismos utilizando medios de cultivo disponibles en las plantas de procesamiento como la leche el suero, salmueras.
Así, el objetivo de la presente investigación fue comparar la producción de biopelículas formadas por Staphylococcus spp. sobre acero inoxidable empleando dos medios de cultivo leche UHT y BHI. De esta manera se evaluaría la capacidad potencial de Staphylococcus spp. de colonizar super- ficies de acero inoxidable con residuos de leche desarrollando biopelículas. Mostrándose así, como posible reservorio para la transmisión de este patógeno en las plantas de productos lácteos.
2. Materiales y métodos
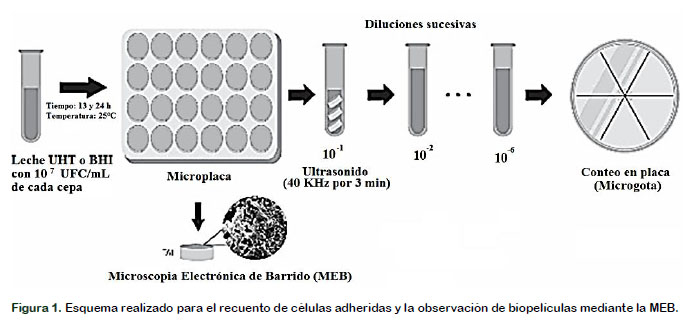
La formación de biopelículas fue realizada de acuerdo con el esquema de la Figura 1. Iniciando con la preparación de inóculo, contaminación de la leche UHT y Brain Heart Infusion broth (BHI, OXOID, CM 0373) posterior incubación en microplaca a 25°C, finalmente el recuento de células viables en agar Baird Parker (BP, OXOID, CM 0275) y la observación por MEB de las biopelículas formadas en BHI como medio de cultivo.
2.1 Origen de las cepas
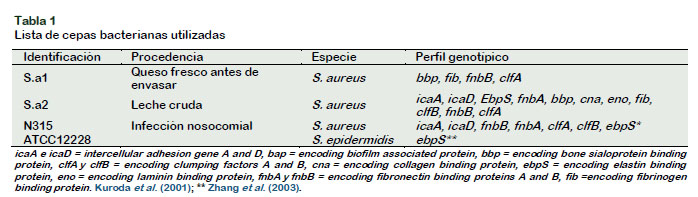
En total fueron utilizadas cuatro cepas: dos cepas tipo (S. aureus N315 y S. Epidermidis ATCC 12228) y dos cepas silvestres (S.a1, S.a2), las cuales pertenecen a la colección de microrganismos del Laboratorio, Higiene y Lacteos (Escuela Superior de Agricultura "Luiz de Queiroz" (ESALQ), Universidad de São Paulo (USP), Brasil). Las cepas S.a1 y S.a2, previamente fueron identificadas por el equipo del mencionado laboratorio, tanto la especie (Rodrigues et al., 2017) como los genes de adhesión y de formación de biopelículas (Cruzado et al., 2015). La procedencia y perfil genotípico de las cepas empleadas se muestran en la Tabla 1.
2.2 Mantenimiento de las cepas y preparación del inóculo inicial
Las cepas mantenidas en Trypticase Soy Agar (TSA, OXOID, CM0131) fueronrepicadas en BHI e incubadas a 37± 1°C por 24 h. A partir del caldo con cultivo, se preparó un inóculo inicial de cada cepa, estandarizado con la escala de 0.5 McFarland (108 UFC/ml) para posterior uso.
2.3 Formación de biopelículas
Las superficies empleadas fueron trozos de acero inoxidable 304 (TAI) de 2,7 cm2, los cuales fueron individualmente higienizados y sanitizados de acuerdo con la método- logía propuesta por Marques et al. (2007). La formación de biopelículas se realizó en microplaca de 24 pocillos, siguiendo la metodología adaptada de Stepanović et al. (2000). Cada pocillo de la microplaca, conteniendo el TAI, fue inoculado con 1 mL de leche UHT o BHI previamente contaminado con 107 UFC/mL de cada cepa, ajustado a partir del inóculo inicial, descrito anteriormente. Las microplacas fueron incubadas durante 12 y 24 h a 25 °C.
2.4 Recuento de células adheridas
Tres TAI del mismo tratamiento (leche UHT o BHI) fueron transferidos a tubos con 4 mL de agua peptona estéril 0,1% (dilución 10-1) y tratados con ultrasonido (UNIQUE, modelo USC-800A, Brasil) a 40 kHz durante 3 min, procedimiento utilizado para des- prender las células adheridas. Placas de BP fueron inoculadas con 0,01 mL (microgota) de las diluciones seriadas correspondientes (10-1 hasta 10-6) e incuba- das durante 48 h a 37 ºC. Se calcularon las UFC/cm2 para cada una de las tres réplicas independientes realizadas, utilizando la fórmula 1 (Martin et al., 2016).

2.5 Microscopia electrónica de barrido (MEB)
Se analizaron TAI con 12 h de incubación en BHI, una cepa silvestre y una cepa tipo, S.a2 y ATCC 12228, respectivamente. Un cupón de cada cepa fue trasferido a una nueva microplaca de 24 pocillos para realizar tres lavados con Phosphate Buffered Saline (PBS, SIGMA, P3813) estéril. Las biopelículas se fijaron con solución de Karnovsky modificado (Paraformaldehído 2%, glutaraldehído 2,5%, CaCb 25 mg/ml) (Sigma Chemical, St. Louis, MO, EUA) por 3 h a 5°C, posteriormente tratados con osmio al 2% (EM Sciences, Philadelphia, PA, EUA) por 24 h a 25°C y secados en silica-gel por 12h. Finalmente los TAI fueron fijados en los soportes, metalizados en baño de oro (Balzers, modelo SCD-050) y observados mediante microscopio electrónico de barrido (LEO 435 VP, Leo Electron Microscopy Ltda., Cambridge, England) en el Departamento de Entomología y Acarologia (ESALQ/USP).
Análisis estadístico
Los datos del recuento microbiológico en log UFC/cm2 fueron analizados con el software XLSTAT 2016 (Microsoft®, WA, USA). Se realizó ANOVA al 5%, teniendo como fuente de variación el tipo cepa y el medio de cultivo y como variable respuesta el recuento de células viables en log UFC/cm2. Fue utilizado el test de Duncan para comparar las medias.
3. Resultados y discusión
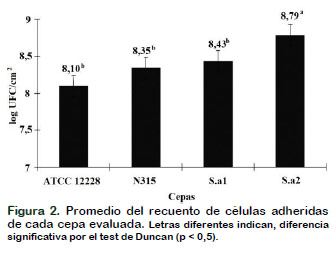
De acuerdo con el ANOVA realizado, se encontró diferencia significativa (p=0,0003) entre las cuatro cepas evaluadas (Figura 2), mientras que no se observó diferencia significativa (p > 0,05) entre los medios de cultivo utilizados (Leche UHT y BHI) ni en los tiempos de evaluación (12 y 24 h). La diferencia significativa entre cepas evaluadas, encontrada en este trabajo, es similar al realizado por Kroning et al. (2016), los autores también encontraron diferencia significativa entre las 14 cepas que evaluaron, compararon biopelículas formadas sobre acero inoxidable a 25 °C.
La cepa silvestre S.a2, que presentaba once genes asociados a adhesinas y formación de biopelículas (Tabla 1), entre ellos los genes icaA e icaD, presentó los recuentos microbiológicos más altos, ob- teniéndose en promedio 8,79 log UFC/cm2, significativamente diferente a las otras tres cepas evaluadas (Figura 2). Como era esperado la cepa ATCC 12228 presentó el menor recuento microbiológicos (8,10 log UFC/cm2). La cepa ATCC 12228 también fue utilizada por otros autores (Hassan et al., 2011; Arciola et al., 2001) como cepa poco formadora de biopelículas, por tener ausencia de los genes icaA e icaD. Posteriormente, en otra investigación realizada por Siljamäki et al. (2014), comparó la formación de adhesinas en tres cepas de S. epidermidis: una cepa comensal (ATCC 12228), una cepa asociada a sepsis (RP62A) y una proveniente de mastitis bovina (PM221), mostró que la producción de adhesinas fue similar, sin embargo, la patogenicidad de la cepa PM221 fue más alta, sugiriendo que la producción de adhesinas no necesariamente está relacionada con la patogenicidad de las cepas. Es indudable que los estafilococos pueden utilizar diferentes mecanismos para formar biopelículas. En varios estudios, la presencia de genes del operón ica ADBC no se correlacionan completamente con la producción in vitro de biopelículas, lo que indica que otros mecanismos están probablemente involucrados (Chokr et al., 2006; Vasudevan et al., 2003; Allignet et al., 2001; Mack et al., 1996). Así, los recuentos microbiológicos de cada cepa, que indicarían la producción de biopelículas, medidos en este ensayo (Figura 2), fue observado que las cepas S.a1 y ATCC 12228 que no poseen lo genes icaA e icaD, estadísticamente son iguales a los recuentos de la cepa N315 que posee los genes icaA e icaD.
Por otro lado, el hecho de no encontrar diferencia significativa entre los medios de cultivo se puede sugerir que es debido a la plasticidad metabólica que presentan las bacterias (Madigan et al., 2016). Staphylo- coccus produce diferentes enzimas, como: lipasas, proteasas, fosfolipasas, catalasas, coagulasas, betalactamasas, oxidasas, entre otras. Enzimas que le permiten adecuarse rápidamente al medio, facilitando la absorción de nutrientes que están presentes. Esta plasticidad metabólica fue observada debido a que se empleó dos medios de cultivo. Por un lado, leche UHT que posee los nutrientes necesarios para el desarrollo microbiano, así como un pH próximo al neutro, condiciones apropiadas que Staphylococcus fácilmente puede aprovechar (Giannuzzi y Parada, 1991). Por otro lado, BHI es una fórmula rica en nutrientes que se emplea en laboratorio como medio de cultivo para una gran variedad de microorganismos. Los principales componentes de este medio de cultura incluyen extractos de diferentes tejidos animales además de peptona, tampón fosfato y glucosa que proporcionan a las bacterias una fuente de energía rápida y de fácil acceso.
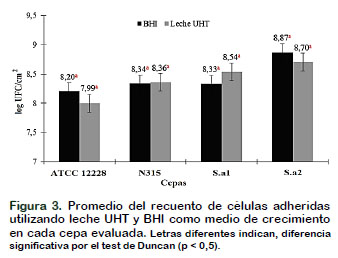
En la Figura 3 se observa dicha versatilidad, ya que el recuento de células viables, estadísticamente fueron las mismas en los dos medios de cultivo evaluados (p = 0,75). Se obtuvieron recuentos entre 7 y 8 log UFC/cm2 tanto en leche UHT como en BHI, lo cual sugiere el potencial que posee Staphylococcus para la formar biopelículas, indiferente al medio de cultivo utilizado. Zottola y Sasahara (1994) y Marques et al. (2007) mencionan que para que ocurra formación de biopelículas el recuento de células adheridas debe estar entre 6 y 7 log UFC/cm2, valores inferiores indicarían apenas un proceso de adherencia. En base a lo antes mencionado, todas las cepas evaluadas presentaron recuentos micro- biológicos superiores a 7 log UFC/cm2, indicando formación de biopelículas sobre acero inoxidable en los dos medios de cultivo evaluados.
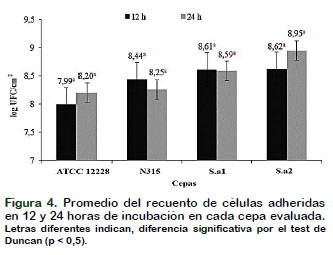
Con relación a los recuentos micro- biológicos en los dos tiempos evaluados (12 y 24 h), mostrados en la figura 4. Se observó resultados similares a los encon- trados por Son et al. (2016), dónde la población bacteriana (UFC/TAI) se mantuvo constante durante las 72 h de evaluación. Este fenómeno puede ser explicado, debido a que, las biopelículas tienen un proceso dinámico, en el caso de biopelículas formadas por Staphylococcus la acción proteínas: Phenol-Soluble-Modulins (PSMs), proteasas y nucleasas, influyen en el des- prendimiento de fracciones de biopelículas, con ello la "pérdida" de células (Le et al., 2014).
También puede ocurrir el agotamiento de nutrientes y la acumulación de metabolitos que dificultan el aumento de la densidad poblacional, de esta forma son observados, recuentos similares a lo largo del tiempo (Karatan y Watnick, 2009).
ATCC 12228 (b) con 12 h de incubación a 25 °C, utilizando BHI como medio de crecimiento. Aumento= 20.000x.
Finalmente, la arquitectura de las biopelí- culas fue observada mediante MEB, permitiendo observar las comunidades bacteria- nas formadas sobre las superficies de los TAI a 12 h de incubación utilizando BHI como medio de cultivo.
La MEB puede ser utilizada como una técnica semicuantitativa. Con las micro- grafías obtenidas (Figura 5), se pretende mostrar lo que posiblemente ocurriría en las superficies de acero inoxidable de las plantas productoras de lácteos.
Se observaron dos cepas: una silvestre (S.a2) que presentó significativamente el recuento de células adheridas más alto y una cepa de tipo (ATCC 12228), considerada como poco formadora de biope- lículas. Mediante esta técnica se observó que la cepa S.a2, presentó considerable formación de biopelículas (Figura 5a), mientras que, la cepa ATCC 12228 produjo visualmente menos cantidad de biopelí- culas (Figura 5b). Un experimento realizado por Di Ciccio et al. (2015) también observó que la cepa ATCC 12228 presentó menor formación de biopelículas comparada con otra cepa altamente formadora de biopelículas (ATCC 35984). El resultado obtenido en la MEB está en concordancia con los recuentos microbiológicos, dónde la cepa S.a2 presentó el más alto número de UFC/cm2, mientras que en la cepa ATCC 12228 ocurrió lo contrario.
4. Conclusiones
Las biopelículas son comunidades microbianas de alta organización estructural, lo que genera problemas latentes de contaminación cruzada en la industria de lácteos. Las adhesinas y genes asociados a producción de biopelículas mejoran la capacidad de adhesión celular, colonizando con mayor facilidad diferentes superficies bióticas y abióticas. En ese sentido, los resultados de este trabajo indican que las cepas de Staphylococcus spp. evaluadas, forman la misma cantidad de biopelículas sobre acero inoxidable, independientemente al medio de cultivo utilizado: leche UHT o BHI. Por lo tanto, muestra la versatilidad de este microorganismo para adaptarse rápidamente al medio y utilizar los nutrientes para producir biopelículas. Es un hecho preocupante, debido que esta bacteria es comúnmente aislada en las plantas de lácteos, los datos mostrados sugieren que Staphylococus spp fácilmente podría aprovechar los residuos de leche presentes en las superficies para formar biopelículas. Sin embargo, es necesario investigar este comportamiento en un número mayor de cepas, en otras superficies, tiempos y temperaturas. Finalmente recalcamos la importancia de una limpieza adecuada y con intervalos de tiempo recomendados, para evitar la formación de biopelículas microbianas sobre las superficies.
Agradecimientos
Los autores agradecen al Programa Nacional de Becas y Crédito Educativo (PRONABEC) y a la Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) por las becas de estudio otorgadas a investigadores que forman parte de este trabajo.
Referencias bibliográficas
Acco, M.; Ferreira, F.S.; Henriques, J.A.P.; Tondo, E.C. 2003. Identification of multiple strains of Staphylococcus aureus colonizing nasal mucosa of food handlers. Food Microbiol 20: 489–493. [ Links ]
Ait Ouali, F.; Al Kassaa, I.; Cudennec, B.; Abdallah, M.; Bendali, F.; Sadoun, D.; Chihib, N.E.; Drider, D. 2014. Identification of lactobacilli with inhibitory effect on biofilm formation by pathogenic bacteria on stainless steel surfaces. Int. J. Food Microbiol. 191: 116–124. [ Links ]
Allignet, J.; Aubert, S.; Dyke, K.G.; El Solh, N. 2001. Staphylococcus caprae strains carry determinants known to be involved in pathogenicity: a gene encoding an autolysin-binding fibronectin and the ica operon involved in biofilm formation. Infect. Immun. 69: 712–718.
André, M.C.D.P.B.; Campos, M.R.H.; Borges, L.J.; Kipnis, A.; Pimenta, F.C.; Serafini, Á.B. 2008. Comparison of Staphylococcus aureus isolates from food handlers, raw bovine milk and Minas Frescal cheese by antibiogram and pulsed-field gel electrophoresis following SmaI digestion. Food Control 19: 200–207.
Arciola, C.R.; Baldassarri, L.; Montanaro, L. 2001. Presence of icaA and icaD genes and slime production in a collection of staphylococcal strains from catheter-associated infections. J. Clin. Microbiol 39: 2151–2156.
van Belkum, A.; Verkaik, N.J.; de Vogel, C.P.; Boelens, H.A.; Verveer, J.; Nouwen, J.L.; Verbrugh, H.A.; Wertheim, H.F.L. 2009. Reclassification of Staphylococcus aureus Nasal Carriage Types. J. Infect. Dis. 199: 1820–1826.
Chokr, A.; Watier, D.; Eleaume, H.; Pangon, B.; Ghnassia, J.-C.; Mack, D.; Jabbouri, S. 2006. Correlation between biofilm formation and production of polysaccharide intercellular adhesion in clinical isolates of coagulase - negative staphy- lococci. Int. J. Med. Microbiol. 296: 381–388.
Di Ciccio, P.; Vergara, A.; Festino, A.R.; Paludi, D.; Zanardi, E.; Ghidini, S.; Ianieri, A. 2015. Biofilm formation by Staphylococcus aureus on food contact surfaces: Relationship with temperature and cell surface hydrophobicity. Food Control 50: 930–936.
Dutra, T.V.; Fernandes, M. da S.; Perdoncini, M.R.F.G.; Anjos, M.M.; Abreu Filho, B.A. 2018. Capacity of Escherichia coli and Staphylococcus aureus to produce biofilm on stainless steel surfaces in the presence of food residues. Journal of Food Processing and Preservation 42(4): e13574.
Castañeda-Ruelas, G.M.; Soto-Beltrán, M.; Chaidez, C. 2017. Detecting Sources of Staphylococcus aureus in One Small-Scale Cheese Plant in Northwestern Mexico. Journal of Food Safety 37(1): e12290. Contreras, G.A.; Rodríguez, J.M. 2011. Mastitis: comparative etiology and epidemiology. J. Mammary Gland Biol. Neoplasia 16: 339–356. [ Links ]
Cruzado, M.L.M.; Silva, N.C.; Rodrigues, M.X.; Trevilin, J.H.; Scarpelin, C.; Sturion, G.L.; Porto, E. 2015. Biofilm formation by Staphylococcus spp on stainless steel and polypropylene. 28° Congresso Brasileiro de Microbiologia. Florianopolis, SC. [ Links ]
Giannuzzi, I.; Parada, J.L. 1991. Crecimiento de Staphylococcus aureus en medios sólidos de actividad acuosa inferior a 0,86. Rev. argent. microbiol. 23: 79–85.
Hassan, A.; Usman, J.; Kaleem, F.; Omair, M.; Khalid, A.; Iqbal, M. 2011. Evaluation of different detection methods of biofilm formation in the clinical isolates. Brazilian J. Infect. Dis. 15: 305–311.
Heilmann, C. 2011. Adhesion Mechanisms of Staphylo- cocci. In Bacterial Adhesion. Dirk Linke and Adrian Goldman, editors. Springer, Dordrecht. 105–123. [ Links ]
Honeyman, A.; Friedman, H.; Bendinelli, M. 2002. Staphylococcus aureus infection and disease. Kluwer Academic. 330 pp. [ Links ]
Jørgensen, H.J.; Mørk, T.; Rørvik, L.M. 2005. The Occurrence of Staphylococcus aureus on a Farm with Small-Scale Production of Raw Milk Cheese. J. Dairy Sci. 88: 3810–3817.
Karatan, E.; Watnick, P. 2009. Signals, regulatory networks, and materials that build and break bacterial biofilms. Microbiol. Mol. Biol. Rev. 73: 310–47.
Khoramrooz, S.S.; Mansouri, F.; Marashifard, M.; Malek Hosseini, S.A.A.; Chenarestane-Olia, F.; Ganavehei, B.; Gharibpour, F.; Shahbazi, A.; Mirzaii, M.; Darban- Sarokhalil, D. 2016. Detection of biofilm related genes, classical enterotoxin genes and agr typing among Staphylococcus aureus isolated from bovine with subclinical mastitis in southwest of Iran. Microb. Pathog. 97: 45–51.
Kroning, I.S.; Iglesias, M.A.; Sehn, C.P.; Valente Gandra, T.K.; Mata, M.M.; da Silva, W.P. 2016. Staphylo- coccus aureus isolated from handmade sweets: Biofilm formation, enterotoxigenicity and antimi- crobial resistance. Food Microbiol. 58: 105–111.
Kuroda, M.; Ohta, T.; Uchiyama, I.; Baba, T.; Yuzawa, H.; Kobayashi, I.; et al. 2001. Whole genome sequen- cing of meticillin-resistant Staphylococcus aureus. Lancet. 357: 1225–1240.
Le, K.Y.; Dastgheyb, S.; Ho, T.V.; Otto, M. 2014. Molecular determinants of staphylococcal biofilm dispersal and structuring. Front. Cell. Infect. Microbiol. 4: 167.
Liaqat, I. 2011. An overview of biofilm formation, properties and control. Int. J. Med. Biol. Front. 17: 1081–3829.
Mack, D.; Haeder, M.; Siemssen, N.; Laufs, R. 1996. Association of biofilm production of coagulase-negative staphylococci with expression of a specific polysaccharide intercellular adhesin. J. Infect. Dis. 174: 881–884.
Madigan, M.T.; Martinko, J.M.; Bender, K.S.; Daniel, D.H.; Buckley, H.; Stahl, D.A. 2016. Brock biology of microorganisms. 14th ed. 1006 pp.
Marques, S.C.; Rezende, J.D.G.O.S.; Alves, L.A.D.F.; Silva, B.C.; Alves, E.; De Abreu, L.R.; Piccoli, R.H. 2007. Formation of biofilms by Staphylococcus aureus on stainless steel and glass surfaces and its resistance to some selected chemical sanitizers. Brazilian J. Microbiol. 38: 538–543.
Martin, J.G.P.; Silva, G.D.O.; da Fonseca, C.R.; Morales, C.B.; Silva, C.S.P.; Miquelluti, D.L.; Porto, E. 2016. Efficiency of a cleaning protocol for the removal of enterotoxigenic Staphylococcus aureus strains in dairy plants. Int. J. Food Microbiol. 238: 295–301. [ Links ]
Meesilp, N.; Mesil, N. 2018. Effect of microbial sanitizers for reducing biofilm formation of Staphylococcus aureus and Pseudomonas aeruginosa on stainless steel by cultivation with UHT milk. Food Science and Biotechnology (In press). [ Links ]
Patti, J.M.; Allen, B.L.; Mcgavin, M.J.; Hook, M. 1994. MSCRAMM -Mediated Adherence of Microorga- nisms to Host Tissues. Annu. Rev. Microbiol. 48:585–617. [ Links ]
Rodrigues, M.X.; Silva, N.C.C.; Trevilin, J.H.; Cruzado-Bravo, M.; Mui, T.S.; Duarte, F.R.S.; Castillo, C.J.C.; Canniatti-Brazaca, S.G.; Porto, E. 2017. Molecular characterization and antibiotic resistance of Staphylococcus spp. isolated from cheese proce- ssing plants. J. Dairy Sci. 100: 5167–5175. [ Links ]
Sanclement, J.; Webster, P.; Thomas, J.; Ramadan, H.H. 2005. Bacterial biofilms in surgical specimens of patients with chronic rhinosinusitis. Laryngoscope. 115: 578–582. [ Links ]
Siljamäki, P.; Varmanen, P.; Kankainen, M.; Sukura, A.; Savijoki, K.; Nyman, T.A. 2014. Comparative Exoprotein Profiling of Different Staphylococcus epidermidis Strains Reveals Potential Link between Nonclassical Protein Export and Virulence. J. Proteome Res. 13: 3249–3261. [ Links ]
Simeão do Carmo, L.; Dias, R.S.; Linardi, V.R.; José de Sena, M.; Aparecida dos Santos, D.; Eduardo de Faria, M.; Pena, E.C.; Jett, M.; Heneine, L.G. 2002. Food poisoning due to enterotoxigenic strains of Staphylococcus present in Minas cheese and raw milk in Brazil. Food Microbiol. 19: 9–14. [ Links ]
Son, H.; Park, S.; Beuchat, L.R.; Kim, H.; Ryu, J.H. 2016. Inhibition of Staphylococcus aureus by antimicrobial biofilms formed by competitive exclusion microorganisms on stainless steel. Int. J. Food Microbiol. 238: 165–171. [ Links ]
Stepanović, S.; Vuković, D.; Dakić, I.; Savić, B.; Švabić- Vlahović, M. 2000. A modified microtiter-plate test for quantification of staphylococcal biofilm formation. J. Methods Microbiol. J. Microbiol. Methods 40: 175–179.
Vasudevan, P.; Nair, M.K.M.; Annamalai, T.; Venkitana-rayanan, K.S. 2003. Phenotypic and genotypic characterization of bovine mastitis isolates of Staphylococcus aureus for biofilm formation. Vet. Microbiol. 92: 179–185. [ Links ]
Vatansever, L.; Sezer, Ç.; Bilge, N.; Collignon, P.; Powers, J.; Chiller, T.; et al. 2016. Carriage rate and methicillin resistance of Staphylococcus aureus in food handlers in Kars City, Turkey. Springerplus. 5: 608.
Vázquez-Sánchez, D.; Habimana, O.; Holck, A. 2013. Impact of Food-Related Environmental Factors on the Adherence and Biofilm Formation of Natural Staphylococcus aureus Isolates. Curr. Microbiol. 66: 110–121. [ Links ]
Vlková, H.; Babák, V.; Seydlová, R.; Pavlík, I.; Schlegelova, J. 2008. Biofilms and hygiene on dairy farms and in the dairy industry: Sanitation chemical products and their effectiveness on biofilms - A review. Czech J. Food Sci. 26: 309–323. [ Links ]
Wertheim, H.F.; Melles, D.C.; Vos, M.C.; van Leeuwen, W.; van Belkum, A.; Verbrugh, H.A.; Nouwen, J.L. 2005. The role of nasal carriage in Staphylococcus aureus infections. Lancet Infect. Dis. 5: 751–762. [ Links ]
Zhang, L.; Li, Y.; Bao, H.; Wei, R.; Zhou, Y.; Zhang, H.; Wang, R. 2016. Population structure and antimi- crobial profile of Staphylococcus aureus strains associated with bovine mastitis in China. Microb. Pathog. 97: 103–109. [ Links ]
Zhang, Y.Q.; Ren, S.X.; Li, H.L.; Wang, Y.X.; Fu, G.; Yang, J.; Qin, Z.Q.; Miao, Y.G.; Wang, W.Y.; Chen, R.S.; Shen, Y.; Chen, Z.; Yuan, Z.H.; Zhao, G.P.; Qu, D.; Danchin, A.; Wen, Y.M. 2003. Genome-based analysis of virulence genes in a non-biofilm-forming Staphylococcus epidermidis strain (ATCC 12228). Mol. Microbiol. 49: 1577–1593. [ Links ]
Zottola, E.A.; Sasahara, K.C. 1994. Microbial biofilms in the food processing industry—Should they be a concern? Int. J. Food Microbiol. 23: 125–148. [ Links ]
* Corresponding author
E-mail: mcruzado@usp.br (M. Cruzado-Bravo)
Received May 18, 2018.
Accepted October 12, 2018.