Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.4 Trujillo oct./dic. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.04.07
ARTÍCULOS ORIGINALES
Sinergismo entre Azotobacter chroococcum y Bradyrhizobium yuanmingense en el crecimiento de Lactuca sativa "lechuga"
Sinergism between Azotobacter chroococcum and Bradyrhizobium yuanmingense in the growth of Lactuca sativa "lettuce"
Tania Cerna-Yamali; Eika Salinas-Aranda; Bertha Soriano-Bernilla*
Laboratorio de Microbiología Ambiental, Dpto. de Microbiología y Parasitología. Facultad de Ciencias Biológicas. Universidad Nacional de Trujillo.
Resumen
Las rizobacterias promotoras de crecimiento vegetal están siendo consideradas como una alternativa para el desarrollo agrícola. Se evaluó el efecto del sinergismo entre las rizobacterias, nativas de la región norte del Perú, como Azotobacter chroococcum y Bradyrhizobium yuanmingense en el crecimiento de Lactuca sativa "lechuga". Se realizó una suspensión de cada bacteria, a una concentración de 109 UFC/mL y con tres tratamientos a semillas germinadas de L. sativa. En un tratamiento se inoculó 5 mL de A. chroococcum, al otro B. yuanmingense y al último, una mezcla de suspensión bacteriana, 2,5 mL de A. chroococcum y 2,5 mL de B. yuanmingense. Además, se consideró un control (sin bacterias). Esta experiencia fue realizada con cuatro repeticiones. Se recolectó información a partir de las variables agronómicas: número de hojas, longitud del tallo y raíz, peso seco de la parte aérea y de la raíz, peso seco total de la planta e índice de efectivi dad de la inoculación (IEI) después de 40 días. Se observó un incremento significativo en cada una de las variables procesadas en condiciones de laboratorio, por lo que la sinergia entre las bacterias nativas utilizadas beneficia el crecimiento de L. sativa.
Palabras clave: A. chroococcum; B. yuanmingense; Lactuca sativa; sinergismo; promotores de crecimiento vegetal.
Abstract
Plant growth promoting rhizobacteria are being considered as an alternative for agricultural development. The effect of synergism between rhizobacteria, native of the northern region of Peru, such as Azotobacter chroococcum and Bradyrhizobium yuanmingense on the growth of Lactuca sativa"lettuce" was evaluated. A suspension of each bacterium was made at a concentration of 109 CFU / mL and with three treatments of germinated seeds of L. sativa. In one treatment, 5 mL of A. chroococcum was inoculated, to the other B. yuanmingense and to the last, a mixture of bacterial suspension, 2.5 mL of A. chroococcum and 2.5 mL of B. yuanmingense. In addition, a control (without bacteria) was considered. This experience made with four repetitions. Information was collected from the agronomic variables: number of leaves, length of stem and root, dry weight of the aeria l part and of the root, total dry weight of the plant and index of effectiveness of the inoculation (IEI) after 40 days. A significant increase was observed in each of the variables processed under laboratory conditions, so the synergy between the native bacteria used benefits the growth of L. sativa.
Keywords: A. chroococcum; B. yuanmingense; Lactuca sativa; synergism; plant growth promoters.
1. Introducción
El uso indiscriminado de fertilizantes químicos ha contribuido al deterioro de las propiedades biológicas, físicas y químicas del suelo, lo que derivó en la pérdida de su capacidad productiva. Por esta razón, la Corporación Colombiana de Investigación Agropecuaria (CORPOICA) ha desarrollado un biofertilizante a base de Azotobacter chroococcum cepa AC1 (Camelo-Rusinque et al., 2017), considerándose como un elemento valioso en la agricultura sostenible para lograr un desarrollo agrícola que permita la producción de un biofertilizante a bajo costo, sin contaminar el ambiente y conservando la fertilidad y biodiversidad del suelo (Thangavel y Sridevi, 2015).
El suelo es un recurso finito y no renovable. No obstante, con las prácticas de manejo agronómico sustentables, se puede mantener su fertilidad. En ese sentido, la salud del suelo, referido a la capacidad funcional como un sistema vivo, los microorganismos adquieren un papel preponderante (Creus, 2017). Por lo que, en los últimos años existe interés creciente en los microorganismos benéficos del suelo por promover el crecimiento de las plantas y en algunos casos evitar la infección del tejido vegetal por patógenos (Ortuño et al., 2018).
Según Santillana et al. (2012), las investigaciones han sido orientadas al estudio de rizobio como promotor del crecimiento de plantas leguminosas y no leguminosas, proceso conocido como capacidad PGPR (Plant Growth Promoting Rhizobacteria) y de acuerdo con Saharan y Nehra (2011), la inoculación con PGPR en estadios tempranos de desarrollo, mejora la producción de biomasa a través de efectos directos en el crecimiento de la raíz y de la plántula (Sánchez et al., 2014). Así mismo, las interacciones sinérgicas microbianas repercuten en un aumento en el crecimiento de las plantas debido a los mecanismos de promoción de crecimiento utilizados por los microorganismos tales como la producción de sustancias reguladoras de crecimiento, supresión de patógenos, fijación de nitrógeno y solubilización de fósforo (Pérez et al., 2015). Molina-Romero et al. (2015) menciona que entre los microorganismos considerados PGPR se tiene a Bacillus, Pseudomonas, Azotobacter, Azospirillum, Burkholderia entre otros. Azotobacter, bacteria Gram negativa, pertenece a la subclase Proteobacteria y comprende siete especies: A.chroococcum, A. vinelandii, A. beijerinckii, A. paspali, A.armeniacus, A.nigricans y A. salinestri. Su importancia agronómica se debe a la capacidad de sintetizar antibióticos, sustancias de promoción del crecimiento de las plantas, vitaminas, exopolisacáridos y producción de pigmentos, además de su efecto antagonista contra patógenos (Jiménez et al., 2011).
Azotobacter ha sido utilizado extensamente en la producción agrícola mundial, ya que aportan a las plantas hasta el 50% de sus necesidades de nitrógeno mediante la fijación asociativa del elemento que llevan a cabo a partir de la atmósfera, además de suministrarles sustancias activas estimula- doras del desarrollo vegetal. Hoy se utilizan extensamente en los biopreparados a base de Azotobacter chroococcum sobre una amplia gama de cultivos que son beneficiados por esta bacteria, que se encuentra en gran parte en los suelos, aunque en poblaciones muy bajas (entre 1000 y 10000 células/g de suelo) (León et al., 2012).
Bradyrhizobium, bacteria Gram negativa, con un flagelo subpolar o polar, vive en el suelo y forma relaciones simbióticas con especies de plantas leguminosas donde fijan nitrógeno a cambio de carbohidratos de la planta, forma nódulos en las raíces de las plantas del género Lupinus, esta leguminosa está ampliamente distribuida en los páramos andinos y las semillas de algunas especies como L. mutabilis tienen un alto contenido proteico. Bradyrhizobium sp. tiene un gran potencial como inoculante por lo que se trató de caracterizar cepas aisladas de nódulos radicales de L. mutabilis y L. meridanus usando como criterios: capacidad de nodulación, incorporación de materia seca, resistencia a antibióticos, formación de pigmentos y presencia de plásmidos de alto peso molecular (Vanlnsberghe et al., 2015).
Ogata-Gutiérrez et al. (2016) reporta que en las últimas décadas, la investigación en microbiología agrícola ha destacado la eficacia de las rizobacterias promotoras del crecimiento de las plantas (PGPR) para inducir la emergencia de plántulas, promoviendo el aumento en la altura de la planta, el peso así como el rendimiento total de los cultivos y, considerando que se tiene bacterias nativas como Azotobacter chroococcum y Bradyrhizobium yuanmingense, utilizarlas como inoculantes para el cultivo de Lactuca sativa "lechuga" planta muy apreciada por su alto contenido en vitaminas y en cierta medida, indispensable en la dieta moderna (Tapia et al., 2010). L. sativa pertenece a la familia Compositae, contiene alto porcentaje de agua (90-95%), como también folatos, provitamina A o beta-caroteno y cantidades apreciables de vitamina C, estas dos últimas con acción antioxidante, relacionadas con la prevención de enfermedades cardiovasculares e incluso de cáncer (Carranza et al., 2010).
El objetivo del presente estudio fue determinar el efecto de la sinergia entre A. chroococcum y B. yuanmingense sobre el crecimiento de L. sativa, evaluando las variables agronómicas: número de hojas, longitud del tallo, longitud de la raíz, peso seco de la parte aérea y peso seco del total de la planta, así mismo se determinó el índice de efectividad de la inoculación en condiciones de laboratorio.
2. Materiales y métodos
2.1 Muestras
Bradyrhizobium yuanmingense aislado e identificado según Valdez et al. (2016).
Azotobacter chroococcum aislado e identificado en el Laboratorio de Microbiología Ambiental, Dpto. de Microbiología y Parasitología, Universidad Nacional de Trujillo.
Semillas certificadas de Lactuca sativa adquiridas en Agropecuaria Chimú S.R.L., Trujillo, La Libertad.
2.2 Procedimiento
Propagación del cultivo de Azotobacter chroococcum
A partir del cultivo puro de A. chroococcum se procedió a la reactivación en placas Petri conteniendo agar base 77, con un tiempo de incubación de 72 horas a 30 °C. La propagación se hizo en dos frascos de superficie plana estériles en agar base 77 estéril y fueron incubados a 30 °C durante 7 días con la finalidad de incrementar la biomasa microbiana para la inoculación (Diestra, 2014).
Propagación del cultivo de Bradyrhizobium yuanmingense
A partir del cultivo puro de B. yuanmingense se procedió a la reactivación en placas Petri conteniendo agar extracto de levadura manitol (ELMA), con un tiempo de incubación de 28 °C por 48 horas.
La propagación se hizo en dos frascos de superficie plana estériles y agar manitol extracto de levadura (ELMA) y fueron incubados a 28 °C durante 7 días con la finalidad de incrementar la biomasa microbiana para la inoculación (Diestra, 2014).
Desinfección de semillas de Lactuca sativa "lechuga"
Las semillas se lavaron dos veces con agua corriente para eliminar las impurezas de los productos agroquímicos de la semilla. Luego se desinfectó por inmersión en etanol al 70% durante tres minutos y poste- riormente se lavó cinco veces consecutivas con agua destilada estéril (Neyra et al., 2013).
Preparación del suelo agrícola para la siembra de las semillas
El suelo que se utilizó para la siembra de las semillas de L. sativa "lechuga" fue de uso agrícola, procedente del Distrito de Moche, Provincia de Trujillo, en un volumen aproximado de 60 Kg (para las cuatro repeticiones realizadas). Se colocó 400g de suelo en cada uno de los recipientes utilizados. Se determinó los parámetros físico-químicos del suelo agrícola como: nitrógeno (0,14%), fósforo (7,32 ppm), potasio (221 ppm), pH (6,04) y materia orgánica (2,26%) en el laboratorio de servicios a la comunidad e investigación (LASACI), Universidad Nacional de Trujillo.
Siembra de las semillas de L. sativa "lechuga" en suelo agrícola
Las semillas ya desinfectadas se sembraron en los recipientes conteniendo suelo agrícola estéril a una profundidad de 3 cm y a una razón de tres semillas (equidistantes) por recipiente y cubiertos con papel filtro hasta la emergencia de plantas y con un riego por goteo (10 a 14 mL de agua destilada estéril) cada tres días.
Preparación de la suspensión bacteriana e inoculación
A partir de las bacterias propagadas, se preparó una suspensión de A. chroococcum en volumen de 100 mL y a una concentración aproximada de 109 UFC/mL de acuerdo con la escala de MacFarland. De igual manera se procedió con B.yuanmingense en un volumen de 100 mL y a una concentración de 109 UFC/mL (Constantino et al., 2011).
La inoculación se realizó de la siguiente manera:
Los ensayos control no se inocularon con microorganismos, pero fueron tratados con 5 mL de agua destilada estéril.
Inoculación simple con A. chroococcum, se inoculó 5mL de la suspensión bacteriana de A. chroococcum a una concentración de 109 UFC/mL.
Inoculación simple con B. yuanmingense se inoculó 5mL de suspensión bacteriana de B. yuanmingense a una concentración de 109 UFC/mL.
Inoculación mixta, se inoculó 2,5 mL de una suspensión de A. chroococcum a una con- centración de 109 UFC/mL y 2,5 mL de una suspensión de B. yuanmingense a 109 mL.
Evaluación del sinergismo entre A. chroococcum y B. yuanmingense en el crecimiento de L. sativa. "lechuga"
Se determinó mediante la evaluación de las variables agronómicas: número de hojas, longitud del tallo, longitud de la raíz, peso seco de la parte aérea, peso seco del total de la planta y la determinación del índice de efectividad de la inoculación (IEI), (Santillana et al., 2012) expresado en porcentaje, calculado mediante la siguiente fórmula:
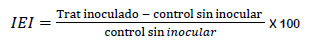
Estas variables se evaluaron para cada ensayo. Se realizó cuatro repeticiones por ensayo, en condiciones de luz artificial por fluorescentes de 36 W a una distancia de 50 cm. La evaluación se realizó después de 45 días de inoculación (Neyra et al., 2013).
2.3. Análisis estadístico
Se llevó a cabo en base a la varianza (ANOVA) y Duncan, para determinar las diferencias de las variables agronómicas en los tratamientos considerados en Lactuca sativa "lechuga".
3. Resultados y discusión
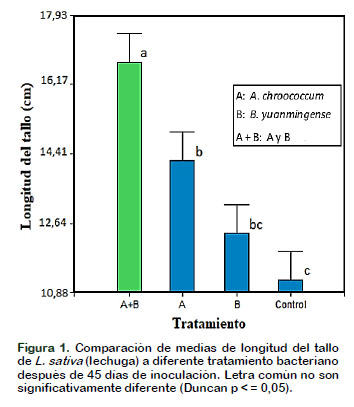
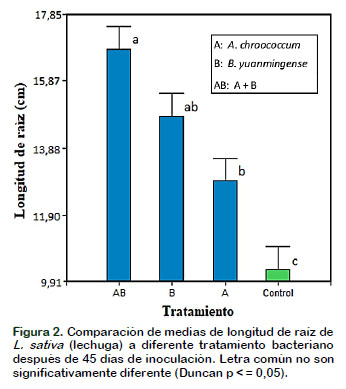
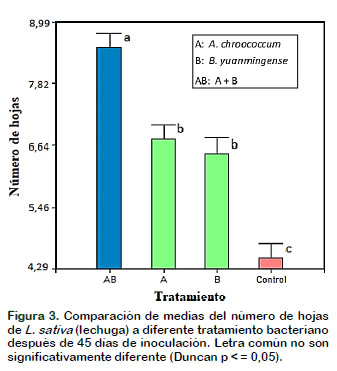
Las plantas de L. sativa (lechuga) coinoculadas con A. chroococcum (A) y B. yuanmingense (B) incrementaron significativamente (p < 0,05) la longitud de tallo y raíz así como el número de hojas en comparación con los controles (Figura 1, 2 y 3 respectivamente) después de 45 días de crecimiento vegetal en condiciones de laboratorio. Los datos encontrados en esta investigación pueden corroborarse con los numerosos estudios que han demostrado el empleo de A. chroococcum y B. yuanmingense como bacterias fijadoras de nitrógeno y promotoras del crecimiento de las plantas no leguminosas. En otros experimentos realizados reportan que los rizobios no solo colonizan las superficies de las raíces, sino también las células lisadas de la corteza de la raíz y en el espacio intracelular del centro de las células cilindro de las raíces; además, se ha demostrado que tanto Rhizobium como Bradyrhizobium sp. pueden colonizar otras plantas no leguminosas (Soriano y González, 2012).
Esto podría deberse a que el sinergismo entre A. chroococcum y B. yuanmingense (A + B) permiten la síntesis de sustancias estimuladoras del crecimiento vegetal, tales como, vitaminas y hormonas vegetales, cuyas principales ventajas son estimular la germinación de semillas, acelerar el crecimiento de las plantas especialmente en sus primeros estadios, inducir la iniciación radicular e incrementar la formación de raíces y producir diferentes modificaciones fisiológicas en las plantas, al intervenir en procesos de fotosíntesis y respiración. Cabe resaltar que A. chroococcum al ser responsable de la fijación asimbiótica de nitrógeno y solubilización de fosfatos (Rico, 2009), permitiría que en esta relación sinérgica con Bradyrhizobium incremente las enzimas responsables de estos procesos fisiológicos, donde se favorece tanto la planta como los microorganismos y, estos datos pueden compararse con los obtenidos por Pérez et al. (2015) con otra especie vegetal pero inoculadas con una mezcla de rizobacterias promotoras de crecimiento vegetal y micorrizas, la cual presentó un mejor establecimiento, desarrollo y vigor vegetal. En relación al número de hojas (Figura 3) fue uno de los parámetros en que se notó mayor claridad el efecto del ensayo, esto también gracias al empleo de una mezcla de bacterias que incrementaron la absorción de nitrógeno en forma amónica especialmente en los estados tempranos de crecimiento, ya que los productos de la fotosíntesis son preferencialmente usados para la síntesis de proteínas, producción de vainas de la hoja y de macollos (Bacilio, 2015).
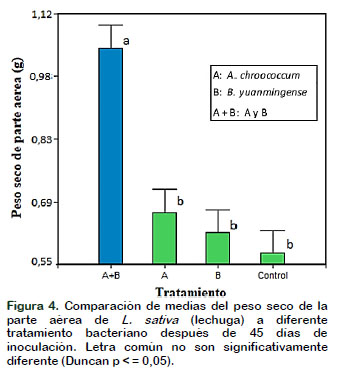
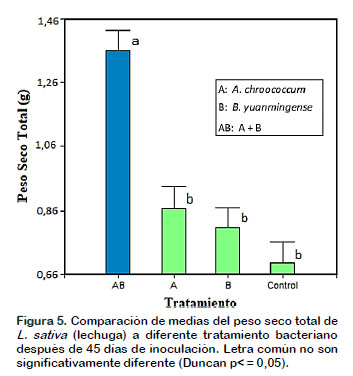
Con respecto a los resultados obtenidos del peso seco de la parte aérea (Figura 4) y del peso seco total de la planta (Figura 5) después de la inoculación con las bacterias A. chroococcum y B. yuanmingense en las plantas de Lactuca sativa "lechuga", promovieron el crecimiento significativamente (p ˂ 0,05) en comparación con el control, esto puede deberse a que Azotobacter y Bradyrhizobium al producir fitohormonas y en sinergia promueven el crecimiento vegetal y, así la planta capta más nutrientes e incrementa materia seca (Borda et al., 2009). También se puede mencionar que B. yuanmingense demuestra capacidad de producir actividad de 1- aminociclopropano-1-ácido carboxílico (ACC) desaminasa, compuesto que reduce el nivel de etileno en las raíces de las plantas, incrementando de esta manera la longitud y el crecimiento de raíces (Glick, 2014; Esquivel et al., 2013; Valdez et al., 2016).
Algunos autores como Santillana et al. (2005) sostienen que las hormonas promotoras del crecimiento como el ácido indolacético, citoquinas y giberelinas producidas por estas dos bacterias presentes en la rizósfera o en los tejidos mejoran la capacidad de absorción de nutrientes de la raíz en beneficio de la planta que no es leguminosa lo que denotará un incremento del peso seco total de la planta. Así mismo, en otros experimentos relacionados con inoculación bacteriana en arroz y caña de azúcar, se detectó un incremento significativo en el peso seco de las plantas, aunque no se observó una diferencia en el contenido de nitrógeno en arroz, pero sí en la caña de azúcar, indicando que la fijación denitrógeno es el mecanismo promotor de crecimiento (Rojas-Rojas et al., 2018).
L. sativa al ser una hortaliza que presenta un alto contenido de agua, 90-95%, en la raíz se encuentra muchos pelos radiculares, los cuales incrementan el área de absorción de agua y nutrientes del medio ambiente circundante, llevando lo absorbido al tallo y este lo distribuye a las hojas de las plantas, luego por medio de la radiación solar se lleva a cabo la foto- síntesis, logrando un máximo desarrollo fisiológico de la parte aérea de la planta donde se acumula (Carranza et al., 2010).
Estos resultados concuerdan con lo descrito por investigadores que reportan incrementos en número de hojas, en la longitud y biomasa seca de la parte aérea de L. sativa "lechuga" a la inoculación de bacterias diazotróficas de los géneros Azotobacter y Bradyrhizobium es decir, los tratamientos inoculados con una mezcla de bacterias tienen una influencia positiva en el crecimiento y nutrición vegetal en comparación con los tratamientos inoculados individualmente (Hernández-Rodríguez et al., 2014).
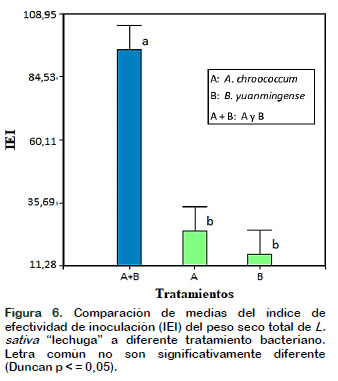
Con respeto al índice de efectividad de inoculación (IEI) del peso seco total de la lechuga después de 45 días de crecimiento vegetal, (Figura 6), se observa que la inoculación mixta de A. chroococcum y B. yuanmingense (A + B) es mayor en comparación con los demás tratamientos, obteniéndose una diferencia significativa según el análisis estadístico aplicado. Esto se debería a las interacciones como la sinergia y simbiosis que existen entre los microorganismos y que pueden ser beneficiosas al mejorar el desarrollo y crecimiento o permitir la supervivencia de estas dos bacterias que interactúan con las plantas estimulando el desarrollo de raíces y tallo de la planta de L. sativa "lechuga" a través de la producción de diferentes sustancias químicas promotoras del crecimiento vegetal (Escobar et al., 2011).
Según Malik y Sindhu (2011), entre las PGPR que realizan un efecto directo se ubican las rizobacterias fitoestimuladoras y éstas serían las que proporcionan nutrientes esenciales como las rizobacterias fijadoras de nitrógeno, entre ellas, Azotobacter, Bradyrhizobium y Rhizobium. Varios microorganismos tienen la capacidad de generar reguladores de crecimiento que aprovechan las plantas, el efecto primario de las fitohormonas se refleja en el mayor desarrollo de raíces y parte aérea de los vegetales, el ácido indol acético que es sintetizado por una diversidad de microorganismos es el principal responsable de estas acciones. La inoculación del suelo con bacterias promotoras del crecimiento vegetal, pueden ser una herramienta prometedora en los sistemas integrados de manejo (Di et al., 2017).
En otros ensayos, donde se utilizó cepas como A. chroococcum AC1 y AC10 capaces de fijar nitrógeno, solubilizar fósforo, sintetizar compuestos indólicos y producir enzimas hidrolíticas, y que después de 12 semanas en condiciones de invernadero se observó una influencia positiva en el crecimiento del algodón debido a la inoculación bacteriana con respecto a la fertilización química (Romero-Perdomo et al., 2017). Algunos autores consideran rizobacterias a Arthrobacter giacomelloi, Azospirillum brasilense, Bradyrhizobium japonicum, Bacillus licheniformis; Paeni- bacillus polymyxa en trigo; Pseudomonas fluorescens en soya y Rhizobium leguminosarum en lechuga (Vacheron et al., 2013).
Por otro lado, se ha reportado que la eficacia de los PGPR también depende del tipo de cultivo, clima y la composición del suelo (Srivastava et al., 2015) y con esto también se explicaría, el menor efecto en el crecimiento de la lechuga con la inoculación simple o individual de Azotobacter y Bradyrhizobium en un suelo agrícola estéril, con el que se trabajó, que no tenía la materia orgánica y nutrientes (según análisis fisicoquímico) suficientes para el crecimiento de la bacteria individualmente y por lo mismo no pudieron asociarse con las raíces de la planta; y según lo manifestado por Creus (2017) que una vez introducido el microorganismo del inoculante debe lograr una colonización adecuada de la raíz, así como lo obtenido con la inoculación bacteriana mixta en el desarrollo temprano de cultivares mejora- dos en el cacao (Hipólito-Romero et al., 2017).
4. Conclusiones
Los resultados obtenidos en el presente trabajo de investigación demostraron que se encontró un efecto sinérgico entre A. chroococcum y B. yuanmingense coinoculadas en el crecimiento de L. sativa "lechuga", el cual es significativo en las variables agronómicas evaluadas como: número de hojas, longitud del tallo y raíz, peso seco de la parte aérea y peso seco total de las plantas, asimismo significativo el índice de efectividad de la inoculación bacteriana en la mencionada planta en comparación con el control en condiciones de laboratorio.
Teniendo en cuenta los datos reportados podría realizarse ensayos a nivel de campo con estas bacterias nativas como biofertilizante en la lechuga y en otros cultivos agrícolas para contribuir a una agricultura saludable y amigable al ambiente.
Referencias bibliográficas
Bacilio, H. 2015. Efecto de la inoculación mixta de Rhizobium etli y Bradyrhizobium yuanmingense sobre el crecimiento aéreo y radicular de Oryza sativa var.NIR. REBIOLEST 1:52-62 [ Links ]
Borda, D.; Pardo, J.; Martínez, M.; Montaña, J. 2009. Producción de un biofertilizante a partir de aislamiento de Azotobacter nigricans obtenido en un cultivo de Stevia rebaudiana Bert. Revista Javierana 14: 10-20. [ Links ]
Camelo-Rusinque, M.; Moreno-Galván, A.; Romero-Perdomo, F.; Bonilla-Buitrago, R. 2017. Desarrollo de un sistema de fermentación líquida y de enquistamiento para una bacteria fijadora de nitrógeno con potencial como biofertilizante. Rev Argent Microbiol 49:289-296. [ Links ]
Carranza, C.; Lanchero, O.; Miranda, D.; Chaves, B. 2010. Análisis del crecimiento de lechuga (Lactuca sativa L.) ‘Batavia’ cultivada en un suelo salino de la Sabana de Bogotá. Agronomia colombiana 27: 69-74.
Constantino, M.; Gómez, R.; Álvarez, J.; Pat, J.; Espin, E. 2011. Efecto de la inoculación de Azotobacter chroococcum y Glomus intraradices en el creci- miento y nutrición de plántulas de papaya en fase de vivero. Rev Agronomía Costarricense 35: 15-31. [ Links ]
Creus, C. 2017. Inoculantes microbianos: piezas de un rompecabezas que aún requiere ser ensamblado. Rev Argent Microbiol 49: 207-209. [ Links ]
Di, N.; Corbo, M.; Campaniello, D.; Cataldi, M.; Bevilacqua, A.; Sinigaglia, M.; Flagella, Z. 2017. The role of plant growth promoting bacteria in improving nitrogen use efficiency for sustainable crop production: a focus on wheat. AIMS Microbiology 3: 413-434. [ Links ]
Diestra, E. 2014. Efecto de la coinoculación de Rhizobium etli y Azotobacter chroococcum sobre el crecimiento de Solanum tuberosum "papa" var. Canchan en condiciones de laboratorio. Tesis para optar el título profesional. Universidad Nacional de Trujillo, Perú. 48 pp. [ Links ]
Escobar, C.; Horna, Y.; Carreño, C.; Mendoza, G. 2011. Caracterización de cepas nativas de Azotobacter spp. y su efecto en el desarrollo de Lycopersicon esculentum Mill "tomate" en Lambayeque. Scientia Agropecuaria 2: 39-49. [ Links ]
Esquivel, R.; Gavilanes, M.; Cruz, R.; Huante, P. 2013. Importancia agrobiotecnológica de la enzima ACC desaminasa en rizobacterias. Rev fitotec Mex 36: 251-258. [ Links ]
Glick, B. 2014. Bacteria with ACC deaminase can promote plant growth and help to feed the World. Microbiol Res 169: 30–39. [ Links ]
Hernández-Rodríguez, A.; Rives-Rodriguez, N.; Acebo- Guerrero, Y.; Diaz de la Osa, A.; Heydrich-Pérez, M.; Divan, V. 2014. Potencialidades de las bacterias diazotróficas asociativas en la promoción del crecimiento vegetal y el control de Pyricularia oryzae (Sacc) en el cultivo del arroz (Oryza sativa L). Rev Protección Veg 29: 1-10. [ Links ]
Hipólito-Romero, E.; Carcaño-Montiel, M.G.; Ramos- Prado, J.M.; Vásquez-Cabañas, E.A.; López-Reyes, L.; Ricaño-Rodriguez, J. 2017. Efecto de inoculantes bacterianos edáficos mixtos en el desarrollo temprano de cultivares mejorados de cacao (Theobroma cacao L.) en un sistema agroforestal tradicional del norte de Oaxaca, México. Rev Argent Microbiol 49: 356 - 365. [ Links ]
Jiménez, D.; Montana, J.; Martínez, M. 2011. Characterization of free nitrogen fixing bacteria of the genus Azotobacter in organic Vegetable-grown colombian soils. Brazilian J of microbiology 44: 846-848. [ Links ]
León, Y.; Martínez, R.; Hernández, J.; Rodríguez, N. 2012. Aplicación de Azotobacter chroococcum en la producción de plántulas de Tabaco negro. Cultivos tropicales 33: 29-32. [ Links ]
Malik, K.; Sindhu, S. 2011. Production of indole acetic acid by Pseudomonas sp: effect of coinoculation with Mesorhizobium sp. Cicer on nodulation and plant growth of chickpea (Cicer arietinum). Physiol Mol Biol Plants 17: 25-32. [ Links ]
Molina-Romero, D.; Bustillos-Cristales, M.; Rodríguez- Andrade, O.; Morales-García, Y.; Santiago-Saenz, Y.; Castañeda-Lucio, M.; Muñoz-Rojas, J. 2015. Mecanismos de fitoestimulación por rizobacterias, aislamientos en América y potencial biotecnológico. Revista de la DES Ciencias Biológicas Agrope- cuarias Universidad Michoacana de San Nicolás de Hidalgo 17: 24 – 34. [ Links ]
Neyra, S.; Ramírez, L.; Carranza, L.; Zárate, B.; Soriano, B. 2013. Efecto de la inoculación de Rhizobium etli y Trichoderma viride sobre el crecimiento aéreo y radicular de Capsicum annum var. longum. REBIOL 1: 11-21. [ Links ]
Ogata-Gutiérrez, K.; Alvarado, D.; Chumpitaz-Segovia, C.; Zúñiga-Dávila, D. 2016. Characterization of plant growth promoting rhizobacteria isolated from the rhizosphere of Peruvian highlands native crops. International Journal of Plant & Soil Science 11: 1-8. [ Links ]
Ortuño, N.; Córdoba, M.; Claros, M.; Castillo, J.A. 2018. Evaluación de bacterias endófitas de papa nativa (Solanum tuberosum L.) y el desarrollo de un biofetilizante. Revista Latinoamericana de la papa 22: 12 -37. [ Links ]
Pérez, U.; Ramírez, M.; Zapata, Y.; Córdoba, J. 2015. Efecto de la inoculación simple y combinada con Hongos Formadores de Micorriza Arbuscular (HFMA) y Rizobacterias Promotoras de Crecimiento Vegetal (BPCV) en plántulas micropropagadas de mora (Rubus glaucus L.). Revista Corpoica: Ciencia y Tecnología Agropecuaria 16: 95-103. [ Links ]
Rico, M. 2009. Capacidad promotora de crecimiento vegetal por bacterias del género Azotobacter y Actinomicetos aislados de cultivos de Solanum tuberosum Linnaeus, 1753 (Papa) cultivados en zonas altoandinas del Perú. Tesis para optar el título profesional. Universidad Nacional Mayor de San Marcos, Perú. 152 pp. [ Links ]
Rojas-Rojas, F.; López-Sánchez, D.; Meza-Radilla, G.; Méndez-Canarios, A.; Ibarra, J.A.; Estrada- de los Santos, P. 2018. El controvertido complejo Burkholderia cepacia, un grupo de especies promotoras del crecimiento vegetal y patógenas de plantas, animales y humanos. Rev Argent Microbiol (In press). [ Links ]
Romero-Perdomo, F.; Abril, J.; Camelo, M.; Moreno- Galván, A.; Pastrana, I.; Rojas-Tapias, D.; Bonilla, R. 2017. Azotobacter chroococcum como biofertilizante bacteriano potencialmente útil para el algodón (Gossypium hirsutum L.): efecto en la reducción de la fertilización nitrogenada. Rev Argent Microbiol 49: 377-383. [ Links ]
Saharan, B.; Nehra, V. 2011. Plant Growth Promoting Rhizobacteria: A critical Review. Life Sciences and Medicine Research. 2011:1-30. Disponible en: http://astonjournals.com/lsmr [ Links ]
Sánchez, D.; García, A.; Romero, F.; Bonilla, R. 2014. Efecto de rizobacterias promotoras de crecimiento vegetal solubilizadoras de fosfato en Lactuca sativa cultivar White Boston. Revista Colombiana de Biotecnología. XVI: 122-128 [ Links ]
Santillana, N.; Arellano, C.; Zúñiga, D. 2005. Capacidad del Rhizobium de promover el crecimiento enplantas de tomate (Lycopersicon esculentum Miller). Ecologia Aplicada 4: 48-58. [ Links ]
Santillana, N.; Zúñiga, D.; Arellano, C. 2012. Capacidad promotora del crecimiento en cebada (Hordeum vulgare) y potencial antagónico de Rhizobium leguminosarum y Rhizobium etli. Agrociencia Uruguay 16:11-17. [ Links ]
Soriano, B.; González, A. 2012. Efecto de la inoculación de Rhizobium etli sobre el crecimiento vegetal de páprika, Capsicum annuum var. Longum, y lechuga, Lactuca sativa. REBIOL 32: 31-103. [ Links ]
Srivastava, A.K.; Malhotra, S.K.; Kumar, N.K. 2015. Exploiting nutrient-microbe synergy in unlocking productivity potential of perennial fruits: A review. Indian J Agric Sci 85: 459-481. [ Links ]
Tapia, J.; Ferrera, R.; Varela, L.; Rodriguez, J.; Soria, J.; Tiscareño, M.; Loredo, C.; Alcalá, J.; Villar, C. 2010. Infectividad y efectividad de hongos micorrízicos arbusculares nativos de suelos salinos en el cultivo de lechuga (Lactuca sativa). Rev Mexicana de Micología 31: 69-74. [ Links ]
Thangavel, P.; Sridevi, G. 2015. Environmental Sustainabilit: Role of Green Technologies. Ed. Springer India. Disponible en: http://link.springer.com/10.1007/978-81-322-2056-5. [ Links ]
Vacheron, J.; Desbrosses, G.; Bouffaud, M.; Touraine, B.; Moenne- Loccoz, Y.; Muller D.; Legendre, L.; Wisniewski-Dye, F.; Prigent- Combaret, C. 2013. Plant growth-promoting rhizobacteria and root system functioning. Front Plant Sci 4: 356. [ Links ]
Valdez, R.; Soriano, B.; Prado, G.; Zavaleta, D.; Matsubara, M.; Zúñiga, D.; Dion, P.; Valladolid, A.; Ruesta, A.; Castellano, A.; Correa, D. y Bedmar, E.
2016. Symbiotic and Agronomic Characterization of Bradyrhizobial strains nodulating cowpea in Northern Perú. En: Fernando González- Andrés & Euan, J. (Ed) Biological Nitrogen Fixation and Beneficial Plant-Microbe interactions, UK: Springer Publishing. Pp. 195-212
Vanlnsberghe, D.; Maas, K.; Cardenas, E. 2015. Non- symbiotic Bradyrhizobium ecotypes dominate North American forest soils. The Isme Journal 9: 2435-2441. [ Links ]
* Corresponding author
E-mail: bsoriano@unitru.edu.pe (B. Soriano-Bernilla). DOI:
Received May 1, 2018.
Accepted October 29, 2018.