Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.9 no.4 Trujillo out./dic. 2018
http://dx.doi.org/10.17268/sci.agropecu.2018.04.12
ARTÍCULOS ORIGINALES
Potencial de la flora de la provincia del Azuay (Ecuador) como fuente de microorganismos benéficos
Potential of the flora of the province of Azuay (Ecuador) as a source of beneficial microorganisms
Manuel Alvarez-Vera1,2,*; Jacinto Vázquez3; Jorge Castillo1; Franz Tucta4; Evelyn Quispe4; Victor Meza5
1 Carrera de Ingeniería Ambiental, Universidad Católica de Cuenca (UCACUE), Cuenca, Ecuador.
2 Subdirección de Posgrados, Universidad Católica de Cuenca (UCACUE), Cuenca, Ecuador.
3 Carrera de Ingeniería Agronómica, Universidad Católica de Cuenca (UCACUE), Cuenca, Ecuador.
4 Carrera de Biología, Facultad de Ciencias, Universidad Nacional Agraria La Molina (UNALM), Lima, Perú.
5 Facultad de Ciencias, Universidad Nacional Agraria La Molina (UNALM), Lima, Perú.
Resumen
Se estudió el potencial de especies vegetales de la provincia de Azuay Ecuador para la obtención de microorganismos benéficos. En diferentes pisos altitudinales se recolectaron muestras de plantas de las cuales en condiciones de laboratorio se aisló y se determinaron unidades formadoras de colonias (UFC.ml-1), además ya sea mediante pruebas bioquímicas o amplificación 16S -PCR se identificaron los principales microorganismos con potencial beneficioso para la agricultura, el ambiente y la industria. Se estableció que la planta de altamisa (Artemisia vulgaris) con 5,43 X 106 UFC.ml-1 presenta el mejor potencial para UFC de levaduras, en la planta de ruda (Ruta graveolens L.) con 1,46 X 107 UFC.ml-1 se determinó el mayor número de UFC de Bacillus spp., para Lactobacillus spp., la planta de café (Coffea arabica L.) con 2,31 X 1013 UFC.ml-1 presentó el más alto potencial, la planta de romero (Rosmarinus officinalis) con 1,60 X 105 UFC.ml-1 fue la que evidenció la mayor cantidad de UFC de actinomicetos; se identificó la carga microbiana beneficiosa presente en cada muestra vegetal. Se concluye que de acuerdo a sus características y ubicación geográfica cada especie vegetal posee un determinado potencial para Bacillus spp., levaduras, Lactobacillus spp. y actinomicetos.
Palabras clave: Azuay; microorganismos benéficos; flora; plantas.
Abstract
The potential of vegetal species of the province of Azuay Ecuador for the obtaining of beneficial microorganisms was studied. In different altitudinal floors, samples of plants were collected from which, under laboratory conditions, colony-forming units (CFU.ml-1) were isolated and determined. In addition, either by biochemical tests or 16S-PCR amplification, the main microorganism’s beneficial potential for agriculture, the environment and industry were identified. It was established that the plant of altamisa (Artemisia vulgaris) with 5.43 X 106 CFU.ml-1 presents the best potential for CFU of yeasts, in the rue plant (Ruta graveolens L.) with 1.46 X 107 CFU. ml-1 was determined the largest number of CFU of Bacillus spp., for Lactobacillus spp., the coffee plant (Coffea arabica L.) with 2.31 X 1013 CFU.ml-1 presented the highest potential, the plant of rosemary (Rosmarinus officinalis) with 1.60 X 105 CFU.ml-1 was the one that showed the highest amount of CFU of actinomycetes; the beneficial microbial load present in each plant sample was identified. It is concluded that according to their characteristics and geographic location each plant species has a certain potential for Bacillus spp., yeasts, Lactobacillus spp. and actinomycetes.
Keywords: Azuay; beneficial microorganisms; flora; plants.
1. Introducción
La provincia del Azuay está ubicada al sur del Ecuador, debido a las condiciones climáticas imperantes en la zona la variedad de flora es diversa; las plantas albergan distintas comunidades microbianas dentro y fuera de sus tejidos designados como microbiota vegetal (Schlaeppi y Bulgarelli, 2015), las partes aéreas de las plantas vivas, incluidas las hojas, los tallos, los brotes, las flores y las frutas, proporcionan un hábitat para los microorganismos denominados filósfera (Whipps et al., 2008) y en comparación con la mayoría de los hábitats bacterianos, ha habido relativamente poco examen de la microbiología de la filósfera (Lindow y Brandl, 2003), por lo tanto, es relevante conocer los micro-organismos beneficiosos presentes en especies vegetales de distintos pisos altitudinales.
Se piensa en las plantas como organismos, sin embargo, todos los patólogos de plantas saben que en cada especie vegetal está una comunidad compleja y que en su entorno natural o agrícola las plantas estás colonizadas por una diversidad de microbios, tanto en su superficie exterior como en sus áreas internas (Porras-Alfaro y Bayman, 2011). Hay evidencia significativa de que el genotipo de la planta puede jugar un papel importante en la determinación de la estructura de las comunidades microbianas de la filósfera (Whipps et al., 2008) y que en diferentes pisos altitudinales existen microorganismos benéficos de acuerdo a cada especie vegetal (Alvarez et al., 2018). Las plantas albergan una gran variedad de microorganismos tanto dentro como fuera de sus tejidos (Vandenkoornhuyse et al., 2015), la diversidad microbiana es considerada importante para mantener la sostenibilidad de sistemas de producción agrícola (Yadav et al., 2017), los estudios dirigidos a las interacciones microbianas en los compartimentos de las plantas son fundamentales para comprender la ecología microbiana de los fito biomas, lo que permitirá el desarrollo de tecnologías basadas en micro biomas, en la búsqueda de una agricultura sostenible (Rossmann et al., 2017).
Es de interés identificar especies relevantes de microorganismos benéficos de la filósfera de especies vegetales de la provincia del Azuay con la finalidad de propender a su utilización en la industria, la medicina, la agricultura, etc., de echo los microorganismos benéficos pueden ser aislados, identificados y aplicados en el suelo para mejorar las condiciones de cultivo, debido a que los inóculos bacterianos y fúngicos tienen el potencial de restablecer la fertilidad de la tierra degradada a través de varios procesos (Rashid et al., 2016), para la agricultura orgánica los microorganismos benéficos son una alternativa viable para mejorar la producción de alimentos a la par que se protege el ambiente así como también la salud de las personas (Alvarez et al., 2018), recientemente, se da un gran énfasis a la decodificación de la diversidad microbiana asociada con plantas de diversos hábitats (Yadav et al., 2017).
El desarrollo de productos biotecnológicos que contienen microorganismos beneficiosos para las plantas necesita una extensa investigación que comience con la selección, caracterización, producción y uso de cultivos microbianos formulados para mejorar la nutrición de las plantas (Vassilev y Mendes, 2018). Los inoculantes bacterianos pueden contribuir a aumentar la eficiencia agronómica al reducir los costos de producción y la contaminación ambiental, una vez que el uso de fertilizantes químicos se puede reducir o eliminar si los inoculantes son eficientes (De Souza et al., 2015), el conocimiento de la inmensidad de la diversidad microbiana asociada con las plantas es aún limitado (Rossmann et al., 2017).
El objetivo de la presente investigación fue determinar el potencial que presentan especies vegetales de la provincia de Azuay (Ecuador) para la obtención de microorganismos benéficos.
2. Materiales y métodos
La investigación se efectuó en dos fases: (i) Primera: recolección de muestras de plantas ubicadas en tres pisos altitudinales en Azuay, Ecuador. (ii) Segunda: elaboración de la solución madre, aislamiento e identificación de microorganismos benéficos en los laboratorios de la Universidad Nacional Agraria La Molina, Perú.
2.1 Primera: etapa de campo
Selección de plantas y recolección de muestras vegetales
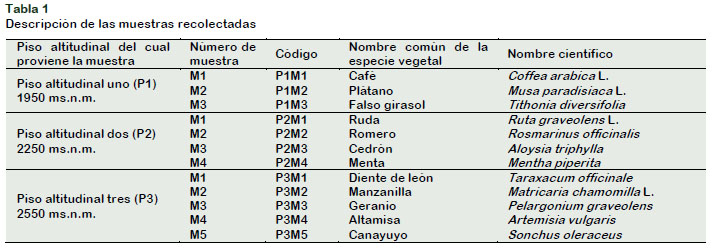
En la provincia de Azuay – Ecuador se recolectaron muestras de plantas ubicadas en tres pisos altitudinales con características climáticas diferentes. El primer sitio se localizó a 1950 ms.n.m. en el cantón Girón al sur de la provincia del Azuay en el sector "El Pongo"; la segunda localidad se determinó a 2250 ms.n.m. en la parroquia central del cantón Gualaceo y la tercera zona se ubicó a 2550 ms.n.m. en la parroquia Daniel Córdova T. En cada zona se seleccionaron e identificaron las especies vegetales de interés.
En total se escogieron 12 especies vegetales, tres en el primer piso altitudinal, cuatro en el segundo y cinco en el tercero; en la Tabla 1 se presenta la descripción de las plantas seleccionadas. Para recolectar las muestras vegetales, se utilizó tijeras de podar debidamente desinfectadas, de cada planta se recogió indistintamente fragmentos de los diferentes órganos aéreos, en primera instancia las muestras se cubrieron con papel y posteriormente se depositaron en bolsas plásticas herméticas debidamente codificadas las cuales se colocaron en cajas plásticas y posteriormente fueron trasladadas hasta la Universidad Nacional Agraria la Molina en Lima-Perú, en el laboratorio de Biología se preparó la solución madre, además se realizó la producción, aislamiento e identificación de los principales microorganismos benéficos.
2.2 Segunda: etapa de laboratorio
Elaboración de la solución madre
En condiciones de laboratorio, cada muestra vegetal se seccionó en pequeños fragmentos, además fue registrado su peso (50 g), a continuación, el material vegetal se depositó en una bolsa plástica correctamente identificada con un código de acuerdo al tipo de planta y piso altitudinal respectivo del cual proviene. Para preparar la solución madre se utilizó la metodología citada por Meza (2009) por lo tanto a la muestra vegetal se adicionó agua libre de cloro en la misma proporción que el peso de la muestra, es decir (50 ml) los cuales constituyeron el peso total de la solución (100 g) sobre la cual se depositó 1% de sal de mesa (1 g), 10% de hígado de res (10 g) y 20% de melaza aproximadamente (20 ml), sin contacto directo se homogenizó la mezcla; para las 12 muestras se repitió el mismo procedimiento y se ubicaron en un sitio sin la incidencia directa del sol por un periodo de diez días. Después de cinco días de iniciado el estudio, en las diferentes bolsas plásticas se evidenció cambio de color de la solución líquida, además se verificó un olor agridulce, en el día diez se observó capas blanquecinas en la superficie del líquido lo cual era un presagio que avanzaba de forma correcta el proceso.
Obtención de microorganismos benéficos
En envases plásticos con capacidad para 500 ml se adicionó 400 ml de agua pura (libre de cloro), a este volumen se añadió10% de melaza (40 ml), 1% de sal de mesa (4 g), 10% de hígado de res (40 g) y se uniformizó la mezcla, este mismo procedimiento se cumplió con todos los biopreparados, posteriormente los 12 frascos se autoclavaron a 121 °C durante 15 minutos y se dejaron enfriar.
De cada bolsa plástica se separó 40 ml de solución madre y se adicionó en los diferentes envases acorde al código de identificación establecido, luego se mezcló homogéneamente cada solución, el mismo procedimiento se cumplió con las 12 muestras; todos los frascos se conservaron por un lapso de diez días a temperatura ambiente en un lugar sin la incidencia directa del sol, a los diez días se observó capas de color blanco en la parte superior de la solución, además se constató olor agridulce lo cual reflejó la presencia de microorganismos beneficiosos.
Aislamiento de microorganismos beneficiosos
En el laboratorio de Biología de la UNALM se aislaron microorganismos beneficiosos de las 12 soluciones líquidas. Se preparó medios de cultivo para levaduras, Bacillus spp., Lactobacillus spp., y actinomicetos. En placas Petri con medios de cultivo indicado para cada microorganismo se adicionó 1 ml de biopreparado, la mezcla se uniformizó con movimientos en sentido horario y anti horario.
Los cultivos de levaduras se conservaron por un periodo de 48 horas a temperatura ambiente, los medios de cultivo para Bacillus spp., se dispusieron en una incubadora a 32 °C por un lapso de 24 horas, los medios para desarrollo de Lactobacillus spp., permanecieron 48 horas en una incubadora a 36 °C, en el caso de actinomicetos los medios se preservaron 12 días en condiciones ambientales; en los diferentes periodos se verificó la presencia de microorganismos, por lo tanto, utilizando la técnica de estrías se purificaron todas las muestras.
Posteriormente en condiciones controladas se sembró los diferentes microorganismos benéficos en tubos de ensayo con medio de cultivo inclinado, los mismos que se conservaron en refrigeración para la identificación microbiana.
Determinación de unidades formadoras de colonias UFC
Se utilizó el Diseño Completo al Azar (DCA), 12 biopreparados de tres pisos altitudinales con tres repeticiones, en total 36 unidades experimentales. Para todas las muestras de los tres pisos altitudinales en tubos de ensayo con agar peptona se realizaron diluciones sucesivas de acuerdo al microorganismo en estudio, de cada solución se utilizó 1 ml que se depositó en placas Petri con medios de cultivo específicos para levaduras, Bacillus spp., Lactobacillus spp. y actinomicetos, con movimientos suaves en sentido horario y anti horario se uniformizó la mezcla, en la Tabla 2 se presentan los detalles del número de diluciones sucesivas y condiciones de conservación de las muestras.
Después de cada periodo de conservación, en las placas Petri se observaron unidades formadoras de colonias, razón por la que se procedió al respectivo conteo.
Identificación de microorganismos benéficos
La identificación de levaduras, Bacillus spp. y Lactobacillus spp. se realizó mediante la ejecución de varias pruebas bioquímicas, con software específico se realizó el análisis de los códigos obtenidos en las diferentes galerías.
Para el caso de levaduras se recurrió a los sistemas miniaturizados API 20 C AUX que contienen 20 microtubos con medio de cultivo específico en su cámara interior, en los cuales se depositaron las muestras, de acuerdo al cambio de color de los sustratos a 72 horas de iniciado el proceso se observó la turbidez de los medios, los cuales se compararon con respecto a la cúpula cero que no cambió de color, de esta manera se estableció un código con siete dígitos. Los sistemas miniaturizados API 50 CHB V4.1 se utilizaron para la identificación de Bacillus spp., y API 50 CHL V5.2 para Lactobacillus spp., cada cámara de incubación con cinco galerías y estas con diez microtubos en su interior en los que se agregaron las respectivas colonias de microorganismos según el caso.
Las cámaras se incubaron a 29 °C ± 2 °C entre 24 horas a 48 horas. En el caso de Bacillus spp., a partir de las primeras 24 horas se observó la reacción manifiesta en el cambio de color de cada pocillo, el microtubo número 25 se tornó de color negro, mientras que todos los demás tomaron diferentes tonalidades de rojo a amarillo, dependiendo de la tonalidad que presentó cada microtubo se estableció un código. En las cámaras de incubación de Lactobacillus spp., en un periodo entre 24 y 48 horas se observó el cambio de color en los pocillos con tonalidades de púrpuras a amarillo, el microtubo 25 se tornó de color negro, se verificó el respectivo código de acuerdo a cada tonalidad.
Para la identificación de actinomicetos se realizó la amplificación 16S-PCR de los lisados de ADN de las cepas en estudio; se emplearon los primers fD1 (5’– CCGAATTCGTCGACAACAGAGTTTGATCC TGGCTCAG–3’) y rD1 (5’– CCCGGGATCCA AGCTTAAGGAGGTGATCCAGCC–3’), los productos de PCR obtenidos y purificados fueron secuenciados por Macro Gen Inc., SeúlKorea.
Análisis estadístico
Para comparar las medias entre tratamientos de las unidades formadoras de colonias, se efectuó el análisis de la varianza ANOVA, se constató que se cumpla la homogeneidad de varianzas y la linealidad de los residuales, con el software para análisis estadístico InfoStat se procesó toda la información. Para determinar los niveles de significancia entre los tratamientos se realizó un test de comparaciones múltiples mediante el análisis de la diferencia mínima significativa LSD (Least significant difference) de Fisher r (p ≤ 0,05).
3. Resultados y discusión
Se determinó las unidades formadoras de colonias (UFC.ml-1) y se identificaron los principales microorganismos benéficos presentes en los medios de cultivo provenientes de especies vegetales de tres pisos altitudinales.
2.2 Unidades formadoras de colonias UFC/ml
De las 12 muestras en estudio se estableció las unidades formadoras de colonias de Levaduras, Bacillus spp., Lactobacillus spp., y actinomicetos.
Unidades formadoras de colonias de levaduras
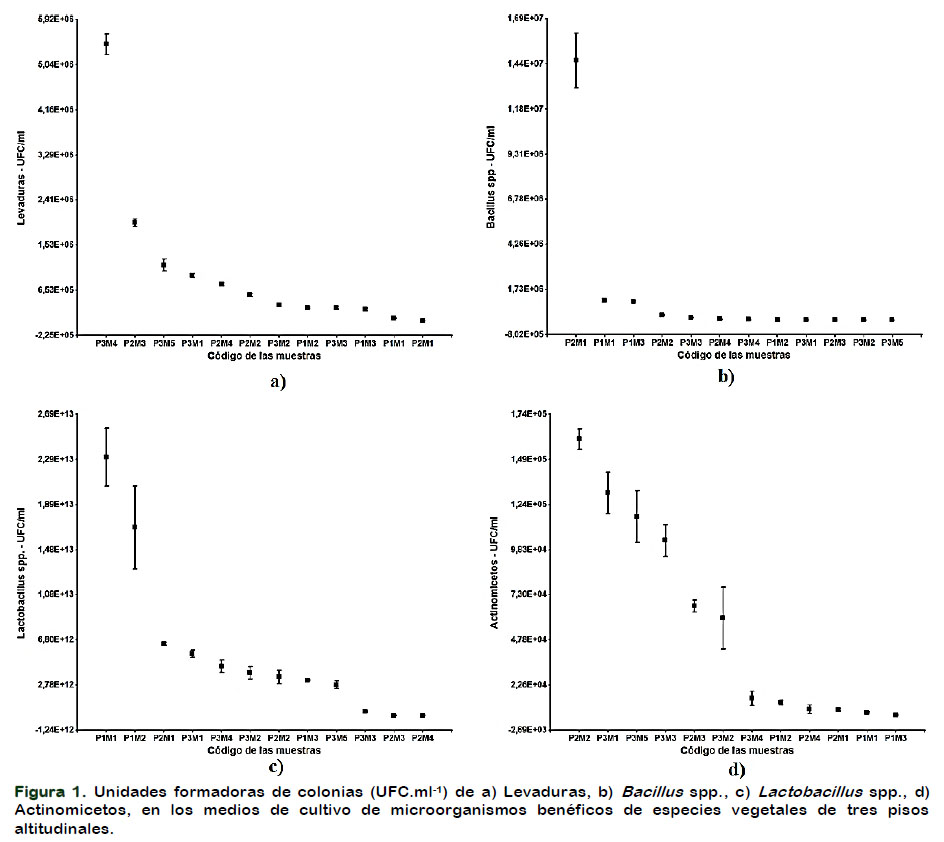
Todas las plantas de los tres pisos altitudinales no presentaron igual potencial para unidades formadoras de colonias de levaduras, en la Figura 1a se observa que la planta de altamisa (Artemisia vulgaris) con una media de 5,43 X 106 UFC.ml-1 fue la que presentó el mayor potencial, mientras que la planta de ruda (Ruta graveolens L.) con 5,50 X 104 UFC.ml-1 evidenció bajo potencial para UFC de levaduras.
Unidades formadoras de colonias de Bacillus spp.
Con respecto a las unidades formadoras de colonias de Bacillus spp., se presentó diferencias estadísticas entre tratamientos (Figura 1b), se destaca como mejor la planta de ruda (Ruta graveolens L.) con una media de 1,46 X 107 UFC.ml-1 mientras que todas las demás presentaron un potencial inferior, las plantas de cedrón (Aloysia triphylla) con una media de 3,70 X 103 UFC.ml-1, manzanilla (Matricaria chamomilla L.) con una media de 3,50 X 103 UFC.ml-1 y canayuyo (Sonchus oleraceus) con una media de 2,97 X 103 UFC.ml-1 fueron los valores de medias más bajo registrados
Unidades formadoras de colonias de Lactobacillus spp.
En la Figura 1c se observa que las unidades formadoras de colonias de Lactobacillus spp., no es uniforme entre especies vegetales de los tres pisos altitudinales, la planta de café (Coffea arabica L.) con una media de 2,31 X 1013 UFC.ml-1 fue la planta con más alto potencial, mientras que planta de cedrón (Aloysia triphylla) con una media de 7,10 X 1010 UFC.ml-1 y la planta de menta (Mentha piperita) con una media de 4,30 X 1010 UFC.ml-1 fueron las que presentaron menor potencial para UFC de Lactobacillus spp.
Unidades formadoras de colonias actinomicetos
En las diferentes especies vegetales fue heterogénea las unidades formadoras de colonias de actinomicetos (Figura 1d), la planta de romero (Rosmarinus officinalis) fue la que presentó el más alto potencial con una media de 1,60 X 105 UFC.ml-1. Mientras que el falso girasol (Tithonia diversifolia) 5,67 X 103 UFC.ml-1 fue la planta con más bajo potencial para UFC de actinomicetos.
2.3 Identificación de microorganismos benéficos
Levaduras
Se confirmaron varios géneros y especies de levaduras. En la muestra M3P2 que corresponde a la planta de cedrón (Aloysia triphylla) se identificó certeramente la presencia de Saccharomyces cerevisiae 2 y Saccharomyces cerevisiae 1. En la muestra M1P3 que concierne a la planta diente de león (Taraxacum officinale Weber.) se identificó claramente la presencia de Rhodotorula minuta mientras que en la muestra M4P2 que corresponde a la planta menta (Mentha piperita) se identificó Kloeckera spp.
Bacillus spp.
Se identificaron varias especies de Bacillus en las muestras vegetales de los tres pisos altitudinales. Bacillus subtilis / amyloliquefaciens se identificó en todos los pisos altitudinales; en el piso altitudinal uno se encontró en la muestra M3P1 que corresponde a la planta falso girasol (Tithonia diversifolia), en el piso altitudinal dos se determinó en la muestra M1P2 que concierne a la planta ruda (Ruta graveolens L.) y en el piso altitudinal tres se encontró en la muestra M5P3 que pertenece a la planta canayuyo (Sonchus oleraceus). Mientras que Bacillus licheniformis se encontró únicamente en muestras vegetales obtenidas a 2250 y 2550 metros sobre el nivel del mar; en el piso altitudinal dos se identificó en la muestra M2P2 concerniente a la planta romero (Rosmarinus officinalis), en el piso altitudinal tres se identificó en la muestras M2P3 que pertenece a la planta manzanilla (Matricaria chamomilla L.), M3P3 que corresponde a la planta geranio (Pelargonium graveolens) y M4P3 que pertenece a la planta altamisa (Artemisia vulgaris).
Lactobacillus spp.
Lactobacillus delbrueckii ssp., se encontraron en las muestras vegetales de todos los pisos altitudinales. En el piso altitudinal uno se constató en la muestra M1P1 que corresponde a la planta café (Coffea arabica L.), así como también en la muestra M3P1 que pertenece a la planta girasol (Tithonia diversifolia); en el piso altitudinal dos se identificó en la muestra M2P2 relativo a la planta romero (Rosmarinus officinalis) y en la muestra M3P2 concerniente a la planta cedrón (Aloysia triphylla); en el piso altitudinal tres se verificó en la muestra M1P3 perteneciente a la planta diente de león (Taraxacum officinale Weber.) y en la muestra M4P3 correspondiente a la planta altamisa (Artemisia vulgaris).
Lactobacillus plantarum se identificó en el piso altitudinal dos en la muestra de la planta de romero (Rosmarinus officinalis) (M2P2) y en el piso altitudinal tres en la muestra M2P3 de la planta de manzanilla (Matricaria chamomilla L.). Se constató la presencia de Pediococcus damnosus 1, en el piso altitudinal tres en la muestra M4P3 de la planta altamisa (Artemisia vulgaris).
Actinomicetos
Se determinó varios géneros de Streptomyces. A 1950 ms.n.m. se identificó Streptomyces sanglieri en la muestra M1P1 que corresponde a la planta café (Coffea arabica L.), además se constató Streptomyces lushanensis en la muestra M2P1 que pertenece a la planta plátano (Musa paradisiaca L.). A 2550 ms.n.m. el género Streptomyces se determinó en dos especies vegetales, Streptomyces griseorubens se verificó en la muestra M4P3 relativo a la planta altamisa (Artemisia vulgaris), mientras que en la muestra M5P3 que pertenece a la planta canayuyo (Sonchus oleraceus) se identificaron Streptomyces thermocarboxydus y Streptomyces bungoensis.
Cada especie vegetal presenta un potencial único para unidades formadoras de colonias de los diferentes microorganismos en estudio, la disponibilidad de nutrientes que contienen carbono en las hojas es un determinante principal de la colonización epífita, además múltiples factores químicos y físicos limitan el crecimiento bacteriano y la supervivencia en la filósfera (Lindow y Brandl, 2003). Las características de las plantas pueden influir en la capacidad de carga microbiana de la hoja (Whipps et al., 2008), las inte-racciones planta-microbio están reguladas por genotipo de bacterias factores eco-lógicos, los exudados filosféricos y metabolitos secundarios son responsables de la colonización de estas epifitas o endófitas (Wagi y Ahmed, 2017). La estructura del micro bioma de la planta está determinado por factores bióticos y abióticos, pero sigue las reglas ecológicas (Berg et al., 2016) ya que las condiciones ambientales inciden principalmente en el crecimiento y supervivencia de los microorganismos benéficos, debido a que los hábitats naturales microbianos son extremadamente diversos (Madigan et al., 2004). Los microorganismos benéficos difieren de acuerdo a cada especie vegetal, se determinó mayor número de unidades formadoras de colonias de Lactobacillus spp., con respecto a levaduras, Bacillus spp., y actinomicetos, se considera que las bacterias son los habitantes microbianos dominantes de la filósfera, aunque las arqueas, los hongos filamentosos y las levaduras también pueden ser importantes (Whipps et al., 2008), las partes aéreas de las plantas normalmente están colonizadas por una variedad de bacterias, levaduras y hongos, en general, se cree que las poblaciones de bacterias aeróbicas cultivables en las hojas están dominadas por unos pocos géneros (Lindow y Brandl, 2003). Algunos estudios han demostrado que los componentes cuticulares son esenciales e importantes impulsores de la estructura y el tamaño de la comunidad bacteriana (Aragón et al., 2017), la cutícula es un compuesto polimérico formado por una matriz de compuestos estructural y químicamente heterogéneos, que incluyen cutina y cera (Aragón et al., 2017), las abundancias relativas de varios taxones bacterianos se correlacionaron con conjuntos de características de la planta huésped (Kembel et al., 2014).
Asumimos que la población microbiana tiene concordancia directa tanto con el estado fenológico de las especies vegetales así como con los pisos altitudinales de donde proceden, ya que la estructura y lasfunciones del microbioma vegetal están determinadas por varios factores, incluidos el genotipo del hospedador y la etapa de desarrollo, la presencia o ausencia de enfermedades y las condiciones ambientales, estos factores pueden conducir a comunidades microbianas distintas en la rizosfera, la endosfera y la filósfera (Rossmann et al., 2017), la radiación solar se ha identificado como un factor de estrés que afecta la colonización de las bacterias asociadas a la filósfera y a su supervivencia durante la producción primaria (Truchado et al., 2017), las características propias de los microorganismos benéficos serían también condicionantes para el éxito de su desarrollo, debido a que además de los factores ambientales y de las plantas, las propias propiedades de las colonias microbianas determinan la medida en que pueden establecerse en la superficie de la hoja (Whipps et al., 2008).
Los géneros y especies de microorganismos son diferente acorde a cada piso altitudinal, la estructura de las comunidades de la filósfera reflejan la inmigración, la supervivencia y el crecimiento de las colonias microbianas, que está influenciado por numerosos factores ambientales, además de propiedades fisicoquímicas de las hojas (Chaudhary et al., 2017), el microbioma de la hoja está influenciado por factores bióticos y abióticos, actualmente, sabemos poco acerca de la importancia relativa de estos factores para determinar la composición y la dinámica de la microbiota (Copeland et al., 2015), por lo que es necesario continuar con trabajos de investigación que permitan comprender mejor la relación entre los microorganismos benéficos y su entorno.
4. Conclusiones
Cada especie vegetal posee un potencial único para unidades formadoras de colonias de microorganismos benéficos. La planta de altamisa (Artemisia vulgaris) con una media de 5,43 X 106 UFC.ml-1 presenta el más alto potencial para UFC de levaduras, mientras que en la planta de ruda (Ruta graveolens L.) se determinó el mayor número de UFC de Bacillus spp., con una media de 1,46 X 107 UFC.ml-1 con respecto a Lactobacillus spp., la planta de café (Coffea arabica L.) con una media de 2,31 X 1013 UFC.ml-1 es la especie vegetal con el más alto potencial, la planta de romero (Rosmarinus officinalis) con una media de 1,60 X 105 UFC.ml-1 es la que presenta el más alto potencial para UFC de actinomicetos.
Estos resultados evidencian que, de acuerdo a las características y ubicación, las plantas presentan diferente potencial para UFC lo cual es relevante con la finalidad de aprovechar las especies vegetales como fuente microbiana benéfica para su aislamiento, multiplicación y aplicación.
En las diferentes muestras vegetales de los tres pisos altitudinales de forma heterogénea se identificaron: Saccharomyces cerevisiae, Kloeckera spp, Bacillus subtilis/amyloliquefaciens, Bacillus licheniformis, Lactobacillus delbrueckii, Lactobacillus plantarum, Pediococcus damnosus 1, Streptomyces sanglieri, Streptomyces lushanensis, Streptomyces griseorubens, Streptomyces thermocarboxydus y Streptomyces bungoensis.
Se constata que la presencia de microorganismos benéficos no es común en las especies vegetales, que mientras en ciertos casos un microorganismo se encontró en un solo piso altitudinal en otros casos el mismo microorganismo se ubica en especies vegetales de los tres pisos altitudinales, estos resultados presagian que los microorganismos se desarrollan de acuerdo a la especie vegetal y piso altitudinal; los hallazgos revisten importancia ya que los microorganismos identificados son de interés agrícola, ambiental e industrial, lo cual evidencia la riqueza microbiana de la zona en estudio y resulta de interés caracterizar microorganismos benéficos en otras especies de la amplia flora que posee el Azuay.
Agradecimientos
El primer autor agradece a la Universidad Católica de Cuenca por la beca otorgada para realizar los estudios de PhD en Ingeniería y Ciencias Ambientales en la Universidad Nacional Agraria La Molina (UNALM), en Lima –Perú; al Programa Doctoral en Ingeniería y Ciencias Ambientales adscrita a la Escuela de Post-grado de la UNALM, por la contribución económica para el secuenciamiento molecular de actinomicetos.
Referencias bibliográficas
Alvarez, M.; Tucta, F.; Quispe, E.; Meza, V. 2018. Incidencia de la inoculación de microorganismos benéficos en el cultivo de fresa (Fragaria sp.). Scientia Agropecuaria 9(1): 33-42. [ Links ]
Aragón, W.; Reina-Pinto, J.J.; Serrano, M. 2017. The intimate talk between plants and microorganisms at the leaf surface. Journal of Experimental Botany 68(19): 5339-5350. [ Links ]
Berg, G.; Rybakova, D.; Grube, M.; Köberl, M. 2016. The plant microbiome explored: implications for experimental botany. Journal of Experimental Botany 67(4): 995-1002. [ Links ]
Chaudhary, D.; Kumar, R.; Sihag, K.; Rashmi; Kumari, A. 2017. Phyllospheric microflora and its impact on plant growth: A review. Agricultural Research Communication Centre 38(1): 51-59. [ Links ]
Copeland, J.K.; Yuan, L.; Layeghifard, M.; Wang, P.W.; Guttman, D.S. 2015. Seasonal Community Succession of the Phyllosphere Microbiome. APS Journals 28(3): 274-285. [ Links ]
Kembel, S.W.; O’Connor, T.K.; Arnold, H.K.; Hubbell, S.P.; Wright, S.J. 2014. Relationships between phyllosphere bacterial communities and plant functional traits in a neotropical forest. PNAS 111(38): 13715-13720.
Lindow, S.E.; Brandl, M.T. 2003. Microbiology of the Phyllosphere. Microbiology of the Phyllosphere 69(4): 1875-1883. [ Links ]
Madigan, M.T.; Martinko, J.M.; Parker, J. 2004. Brock Biología de los microorganismos. Décima Madrid, Pearson Educación, 1089. [ Links ]
Porras-Alfaro, A.; Bayman, P. 2011. Hidden Fungi, Emergent Properties : Endophytes and Microbiomes. Annu. Rev. Phytopathol 49: 291-315. [ Links ]
Rashid, M.I.; Mujawar, L.H.; Shahzad, T.; Almeelbi, T.; Ismail, I.M.I.; Oves, M. 2016. Bacteria and fungi can contribute to nutrients bioavailability and aggregate formation in degraded soils. Microbiological Research 183: 26-41. [ Links ]
Rossmann, M.; Sarango-Flores, S.W.; Chiaramonte, J.B.; Kmit, M.C.P.; Mendes, R. 2017. Plant Microbiome: Composition and Functions in Plant Compartments. The Brazilian Microbiome 2017: 7-20. [ Links ]
Schlaeppi, K.; Bulgarelli, D. 2015. The Plant Microbiome at Work. APS Journals 28(3): 212-217. [ Links ]
De Souza, R.; Ambrosini, A.; Passaglia, L.M.P. 2015. Plant growth-promoting bacteria as inoculants in agricultural soils. Genetics and Molecular Biology 38(4): 401-419. [ Links ]
Truchado, P.; Gil, M.I.; Reboleiro, P; Rodelas, B; Allende, A. 2017. Impact of solar radiation exposure on phyllosphere bacterial community of red-pigmented baby leaf lettuce. Food Microbiology 66: 77-85. [ Links ]
Vandenkoornhuyse, P.; Quaiser, A.; Duhamel, M.; Van, A. Le; Dufresne, A. 2015. The importance of the microbiome of the plant holobiont. New Phytologist 206: 1196-1206. [ Links ]
Vassilev, N.; Mendes, G. de O. 2018. Solid-State Fermentation and Plant-Beneficial Microorganisms. Current Developments in Biotechnology and Bioengineering 2018: 435-450. [ Links ]
Wagi, S.; Ahmed, A. 2017. Phyllospheric Plant Growth Promoting Bacteria. Journal of Bacteriology & Mycology: Open Access 5(1): 1-2.
Whipps, J.M.; Hand, P.; Pink, D; Bending, GD. 2008. Phyllosphere microbiology with special reference to diversity and plant genotype. Journal of Applied Microbiology 105(6): 1744-1755. [ Links ]
Yadav, A.N.; Verma, P.; Kour, D.; Rana, K.L.; Kumar, V.; Singh, B.; Chauahan, V.S.; Sugitha, T.; Saxena, A.K.; Dhaliwal, H.S. 2017. Plant Microbiomes and Its Beneficial Multifunctional Plant Growth Promoting Attributes. International Journal of Environmental Sciences & Natural Resources 3(1): 1-8. [ Links ]
Yadav, K.S.; Prabha, R. 2017. Production of Intracellular Carotenoid Pigment from Wild Strains of Rhodotorula. International Journal of Current Microbiology and Applied Sciences 6(5): 679-683. [ Links ]
* Corresponding author
E-mail: malvarezv@ucacue.edu.ec (M. Alvarez-Vera).
Received May 5, 2017.
Accepted November 23, 2018.