Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.2 Trujillo abr./jun. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.02.05
ARTÍCULOS ORIGINALES
Capacidad antagónica de Trichoderma harzianum frente a Rhizoctonia, Nakatea sigmoidea y Sclerotium rolfsii y su efecto en cepas nativas de Trichoderma aisladas de cultivos de arroz
Antagonistic capacity of Trichoderma harzianum compared to Rhizotecnia, Nakataea sigmoidea, Sclerotium rolfsii and its effect in native strains of Trichoderma isolated form rice crops
Miguel Garrido Rondoy1,* ORCID iD https://orcid.org/0000-0003-2093-1286 Nasstie Vilela Severino2
1 Laboratorio de fitopatología, Universidad Nacional de Tumbes. Facultad de Ciencias Agrarias. Perú. Campus Universitario La Cruz. s/n.
2 Laboratorio de Fitopatología, Universidad Nacional de Tumbes Facultad de Ciencias Agrarias.
Resumen
Se ha estudiado la capacidad antagónica de una cepa comercial de Trichoderma harzianum, frente a Rhizoctonia spp., Nakatea sigmoide y Sclerotium rolfsii, causantes de la Pudrición de tallos y vainas del arroz, así como su efecto en 14 cepas nativas de Trichoderma aisladas de diferentes campos arroceros. La prueba in vitro demostró que T. harzianum presenta una elevada actividad antagónica e hiperparasítica contra Rhizoctonia. La mayor acción de micoparasitismo se presentó con Rhizoctonia, siendo muy frecuente el enrollamiento de hifas y la penetración; en Nakataea se observó sólo enrollamiento y, en Sclerotium no se observó enrollamiento. El desarrollo de la cepa de T. harzianum (comercial), no afecta a las cepas nativas de Trichoderma spp. ensayadas en este trabajo, en la mayoría de los casos, las cepas de Trichodermas nativos mostraron un rápido desarrollo entre las 48 y las 72 horas. Aun cuando las cepas de Trichoderma nativos mostraron un mayor desarrollo vegetativo, la cepa comercial de T. harzianum genera una mayor producción de conidias, con un incremento de 29,53% muy importante en la trasmisión y diseminación de estos antagonistas en el suelo.
Palabras clave: control biológico; antagonismo; cepas nativas; Trichoderma spp; enfermedades del arroz.
Abstract
It has studied the antagonistic capacity a commercial Trichoderma harzianianum, against a Rhizoctonia spp., Nakatea sigmoide y Sclerotium rolfsii, causing the rot of stems and pods of rice, as well as its effect on 14 native strains of Trichoderma isolated of different rice fields. The in vitro test showed that T. harzianum presents a high antagonistic activity and hyperparasitica against Rhizotocnia. The greater action of mycoparasitism arose with Rhizotocnia, being very frequent the curl of hyphae and penetration; in Nakataea, only curl was observed and no curl was observed in Sclerotium. The development of strain of T. harzianum (comercial) does not affect the native strains of Trichoderma spp. Tested in this work, in most cases, strains of Trichodermas native showed a rapid development between 48 and 72 hours. Although the strains of Trichoderma native showed a greater vegetative development, the strain comercial T. harzianum generates a higher production of conidia, with an increase of 29.53% very important in the transmission and dissemination of these antagonists in the soil.
Keywords: Biological control; antagonism; native strains; Trichoderma spp; rice diseases.
1. Introducción
Las pudriciones de tallos y vainas del arroz, es causada por hongos patógenos del suelo que afectan al cultivo durante toda su etapa de desarrollo generando daños en las vainas y afectando la producción. El uso de fungicidas foliares para reducir la severidad de esta enfermedad es una práctica común en el cultivo de arroz (Marcelo y Francisco, 2017), con aplicaciones tempranas desde el embuchado hasta la floración. Las aplicaciones de Trichoderma después del fangueo para controlar estos hongos, por su alto potencial de control biológico, tienen diversas ventajas, pues crece y desarrolla muy rápido, pero además produce una gran cantidad de enzimas (Castañeda et al., 2017), metabolitos secundarios como compuestos orgánicos volátiles (Sinuco et al., 2017) y mecanismos de acción como: una competencia física por el espacio y los nutrientes del medio; la producción de metabolitos secundarios con actividad antibiótica o anti-fúngica; parasitismo directo o inducción de resistencia (Howell et al., 2003; Pérez-Torres et al., 2018a); similar respuesta se encontró con la cepa ZJSX5003 de T. asperellumse con enzimas degradantes de la pared celular (quitnasa, proteasa y β-glucanasas), metabolitos secundarios y peptaiboles, la interacción de estas enzimas y los metabolitos secundarios mejora el antagonismo contra Fusarium graminearum (Li, 2016); convirtiéndose en una alternativa de control para mejorar la nutrición y resistencia de las plantas, así como disminuir la incidencia de enfermedades (Nico et al., 2005; DuarteLeal et al., 2017).
A pesar que la capacidad antagónica de Trichoderma es altamente variable (Martínez et al., 2013b), las cepas nativas de un lugar puedan ser más efectivas que las importadas (Arcia, 1995), pero esta capacidad dependerá de la especificidad de la cepa y sus modos de acción, es decir pueden existir aislamientos que sean más eficientes para el control de un patógeno que de otro (Martínez et al., 2008c), característica mejor establecidas en las cepas comerciales.
Los antecedentes mencionados resaltan la importancia y los efectos benéficos que tiene Trichoderma para la producción de arroz. Sin embargo, los estudios relacionados con la interacción de este género con hongos causantes de la pudrición de tallos y vainas, así como, con cepas de Trichoderma nativos presentes en el suelo, han recibido poca atención. La presente investigación tuvo como objetivo comprobar la capacidad antagónica e hiperparasitica de una cepa comercial de Trichoderma harzianum frente a Fitopatógenos como Rhizoctonia, Nakatae y Sclerotium en arroz y su efecto sobre 15 cepas nativas de campos comerciales de arroz, conservadas en la micoteca de la Facultad de Ciencias Agrarias de la Universidad Nacional de Tumbes.
2. Materiales y métodos
Obtención de cepas de Trichoderma y de hongos fitopatógenos
Las cepas de Trichodermas nativos y hongos fitopatógenos de arroz, fueron tomados de la colección de la micoteca de la Facultad de Ciencias Agrarias, la cepa comercial de T. harzianum fue aislada de una muestra viable de un producto comercial.
Para la identificación de las cepas taxonómicas se tomó en consideración el estudio de las características morfológicas como: micelio, color, tipo de crecimiento, presencia de conidias, presencia de septas, ancho, etc., para Hyphomycetes (Ellis, 1976; Barnett y Hunter, 1997), y Trichoderma (Kubicek, 2002).
Prueba de Antagonismo in vitro (Cultivos duales)
Esta prueba se realizó siguiendo la técnica de cultivo dual de Dennis y Webster (1971), en placas Petri de 9 cm de radio, conteniendo Papa Dextrosa Agar (PDA), se colocó en el extremo de la placa Petri un disco de agar de 5 mm de diámetro con micelio de las cepas en estudio y en el extremo opuesto otro disco de agar (Trichoderma spp.), posteriormente los cultivos se incubaron a 25±1 ºC, durante 10 días, midiendo cada 24 h. el crecimiento radial del micelio de la colonia de los hongos en estudio.
Se calcularon los valores medios de Porcentaje de Inhibición del Crecimiento Radial (Ezziyyani et al. 2004) (PICR) por la fórmula:
PICR = [(R1-R2)/R1]*100
Donde:
R1: Diámetro del testigo
R2: Diámetro del organismo ensayado
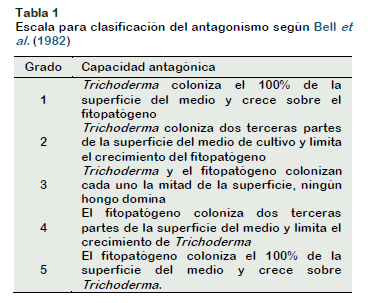
De las zonas de confluencia de las colonias, se tomaron muestras de micelio y se hicieron montajes para observar al microscopio óptico y verificar la interacción hifal característico de los procesos micoparasíticos de cada organismo. También se determinó el grado de antagonismo según la Escala de Clase planteada por Bell et al. (1882) ( Tabla 1).
3. Resultados y discusión
Capacidad antagónica de Trichoderma harzianum frente a Rhizoctonia, Nakatea y Sclerotium en medio de cultivo PDA
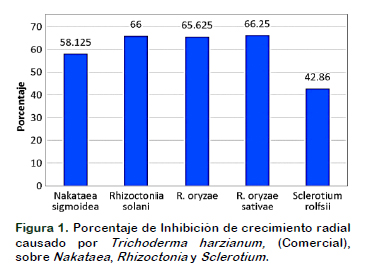
Al hacer la comparación diaria del radio del crecimiento antagonista (RCA), con el radio de crecimiento patógeno (RCP) en cada cultivo dual, se determinó la competencia por nutrientes y espacio, encontrándose que Trichoderma harzianum, contenido en la muestra comercial, presentó un mayor desarrollo sobre la superficie del medio y genera inhibición de crecimiento radial (PICR) de Nakataea sigmoidea, Rhizoctonia solani, R. oryzae, R. oryzae – sativae y Sclerotium rolfsii, siendo mayor en el caso de Rhizoctonia, seguido de Nakataea. (Figura 1). Estos resultados muestran la capacidad competitiva de Trichoderma harzianum frente a los fitopatógeno, al impedirle su crecimiento en el mismo substrato. (Rodríguez-Lacherre y VenerosTerrones, 2011; Sánchez et al., 2015).
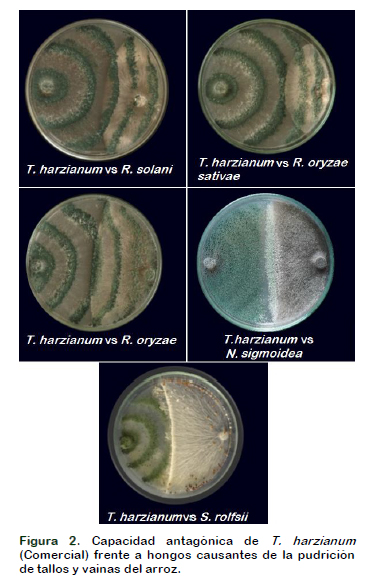
El enfrentamiento de T. harzianum, con los fitopatógenos ocurre a las 72 horas, mientras que el máximo recorrido de Trichoderma en la superficie del medio se logra con Rhizoctonia y el menor recorrido se presenta con Sclerotium. A partir de las 72 h. la colonia crece sobre el fitopatógeno y a las 120, cubre el 100% de la superficie del medio y forma abundante esporulación. Esta acción no se observa con S. rolfsii. en la prueba in vitro, T. harzianum demostró una elevada actividad antagónica e hiperparasítica contra Rhizoctonia, Alarcón et al. (2005) muestra la eficacia de Trichoderma contra hongos del suelo como Rhizoctonia solani, así como una colonización total de la placa en 120 h, similar a lo encontrado en este ensayo (Figura 2).
El desarrollo mostrado por T. harzianum al realizar el contacto entre hifas a los tres días, es similar a lo encontrado por Guédez et al. (2012), pero difiere a lo reportado por Michel-Aceves (2013) a los dos días. Este desarrollo rápido, hacen que Trichoderma sea un buen competidor por espacio o nutrientes, bloqueando el paso al patógeno (Martínez et al., 2013a). Frente a S. rolfsii, T. harzianum coloniza una tercera parte del medio, al ser afectado su desarrollo por este fitopatogeno. Al comparar el control de S. rolfsii y R. solani se encontró que una misma especie de Trichoderma no actúa de la misma manera e intensidad contra ambos patógenos (Hoyos-Carbajal et al., 2008; Rodríguez y Flores, 2018).
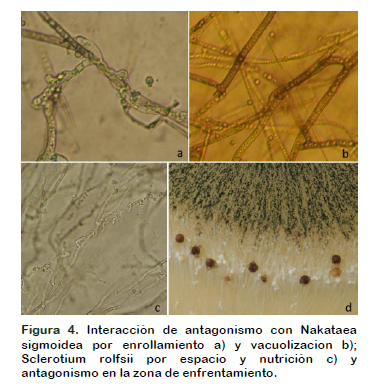
Wells et al. (1972) observó que especies de Trichoderma pueden ser diferencialmente selectivas contra diferentes hongos. De otra parte, Correa et al. (2007), encontró cepas de Trichoderma que no ejercen acción antagonista sobre Sclerotium, éste avanzó sobre ellas y colonizó toda la superficie del medio, Suriyagamon et al. (2018) también reporta que una cepa de T. harzianum UD12-102 mostro una inhibición del 90% contra S. rolfsii, en condiciones Invitro. En nuestro caso, S. rolfsii colonizó unos centímetros de la superficie de la colonia de T. harzianum afectando su desarrollo (Figura 4).
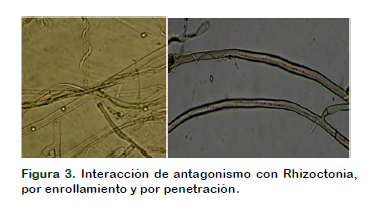
Micoparasitismo
En la zona de enfrentamiento, entre Trichoderma comercial y el fitopatógeno se observa enrollamiento y penetración de hifas. La mayor acción de micoparasitismo se presentó con Rhizoctonia, siendo muy frecuente el enrollamiento de hifas y la penetración; en Nakataea se observó sólo enrollamiento y en Sclerotium no se observó enrollamiento, siendo la competencia por espacio y nutrición en el medio de cultivo (Fig. 3 y 4).
El micoparasitismo es un modo de acción de Trichoderma y puede afectar las hifas de diferentes hongos de diversas maneras (Sandoval, 2001; López-Ferrer, 2017). Cuando Trichoderma reconoce las hifas del fitopatógeno, se adhieren y se enrollan alrededor de estas (Martínez et al., 2008), lo cual conlleva a un debilitamiento del fitopatógeno (Eraso et al., 2014), ésta interacción hifal fue frecuente con Rhizoctonia y Nakataea, mientras que la presencia de hifas dentro del micelio de Rhizoctonia solani, R. oryzae – sativae y R. oryzae. fue menos frecuente.
Infante et al. (2009), explica que en la medida que Trichoderma manifieste varios mecanismos de acción, será eficiente y duradero el control. Estos resultados son similares a los encontrados por Martínez et al. (2008c) y Reyes et al. (2008) con R. solani en arroz, donde Trichoderma spp. muestra alta capacidad antagónica con diferentes tipos de interacción hifal como lisis, vacuolización, enrollamiento y penetración, similar respuesta encontró Pérez et al. (2017b y 2013c) frente a Bypolaris oryzae.
Además del enrollamiento y penetración a las hifas del patógeno, Gato et al. (2014) encontró fragmentación, como en R. orzae – sativae, ocasionadas por la producción de enzimas líticas. No siempre, todas estas interacciones son observadas, pues al parecer dependen del aislamiento de Trichoderma, del patógeno y de las condiciones del ambiente (Coca, 2017).
Alvindia (2018) reporta que la cepa de T. harzianum DGA01 desarrollo enrrollamiento de micelio y esporas y, producción de metabolitos hacia C. gloeosporioides, en medios artificiales y en la superficie de fruta de mango.
Crecimiento radial por nutriente y espacio de T. harzianum comercial frente a hongos causantes de la pudrición de tallos y vainas del arroz
De acuerdo a la escala propuesta por Bell et al. (1982), la capacidad antagónica de T. harzianum, frente a los fitopatógenos causantes de las Pudriciones de Tallos y Vainas del arroz corresponde al Grado 1, mientras que Scleotium rolfsii se ubica en el Grado 3, donde el antagonista y el fitopatógeno se enfrentan sin llegar a un dominio de un hongo sobre otro (Tabla 2). El efecto inhibitorio de Trichoderma sobre otros hongos fitopatógenos antes del contacto hifal se explica con la excreción de metabolitos al medio con efectos fungistaticos, estos resultados se corroboran con lo obtenido por Martínez et al. (2013b) y Schirmbock et al. (1994) quienes afirman que Trichoderma incorpora metabolitos, como trichodermin, trichodermol, harzianum A y harzianolide.
Accion antagonica de Trichoderma harzianum sobre cepas nativas de Trichoderma spp. aisladas de campos de arroz
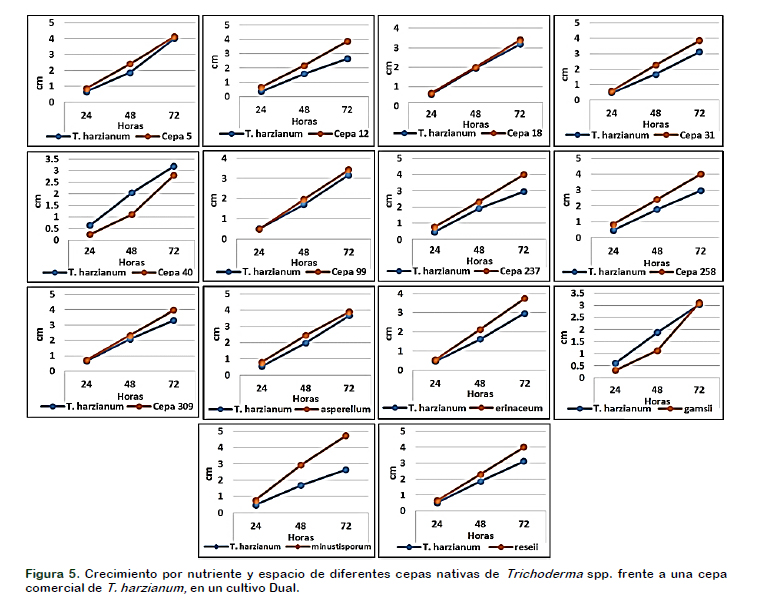
El desarrollo de la cepa de Trichoderma harzianum (comercial), no afecto a las cepas nativas de Trichoderma spp. ensayadas en este trabajo. En la mayoría de los casos, las cepas de Trichodermas nativos mostraron un rápido desarrollo entre las 48 y las 72 horas, compitiendo por espacio y nutrientes en el medio de cultivo con Trichoderma harzianum; sólo con la Cepa 040 y T. gamsii se observa un menor crecimiento frente a T. harzianum entre las 24 y las 48 horas, hasta alcanzar similar desarrollo a las 72 horas.
La acción antagónica de T. harzianum (comercial) sobre cepas nativas, no muestran ningún efecto negativo en el desarrollo de las 14 cepas nativas de arroz; Ortiz–Martínez et al. (2013), también encontraron resultados similares al evaluar 14 cepas nativas de Trichodderma aisladas de un campo de caña frente a T. harzianum (comercial), encontrando que todas presentaban un alto porcentaje de inhibición, superando el área de crecimiento de la cepa comercial a las 72 horas de la inoculación (Figura 5).
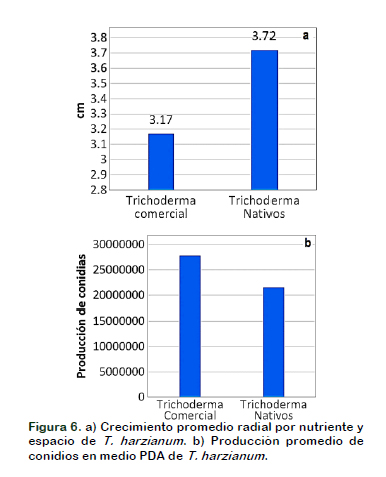
Cuando comparamos el desarrollo radial de la cepa de T. harzianum (Comercial), con las cepas de Trichodermas nativos, en cada cultivo dual, se determinó que estas muestran un mejor desarrollo radial en el medio de cultivo PDA, mostrando un mejor aprovechamiento de los nutrientes y espacio en el medio, que se traduce en un mayor desarrollo vegetativo de la colonia, siendo superior al antagonista comercial.
Aun cuando las cepas de Trichoderma nativos generaron un mayor desarrollo vegetativo, la cepa de T. harzianum de la muestra comercial generó una mayor producción de conidias, con un incremento de producción del 29,53% (Figura 6), muy importante en la trasmisión, la diseminación y en su competencia por espacio durante la colonización de estos antagonistas en el suelo (Castañeda et al., 2017).
4. Conclusiones
Trichoderma harzianum (producto comercial), muestra una alta capacidad antagónica frente a Rhizoctonia y Nakatea, pero no afecta el desarrollo de las 14 cepas de Trichoderma nativos aislados de campos arroz. La mayor acción de micoparasitismo de Trichoderma harzianum (producto comercial) se presentó con Rhizoctonia, siendo muy frecuente el enrollamiento de hifas y la penetración; en el caso de Nakataea sólo se observó enrollamiento y vacuolización. No se observó interacción hifal con Sclerotium rolfsii.
Se recomienda evaluar el efecto de las cepas artesanales de Trichoderma harzia-num en la flora nativa del suelo y en la salud del suelo.
Referencias bibliográficas
Alarcón, P.L.; Reyes, R.T.; Rodríguez, G.G.; Pupo, Z.A. 2005. Efectividad in vitro de Trichoderma harzianum (RIFAI) en el biocontrol de Rhizoctonia solani KÜHN Y Pyricularia grisea (SACC.) en el cultivo de arroz (Oryza sativa L.). Fitosanidad 9(3): 5760. [ Links ]
Alvindia, D.G. 2018. La acción antagónica de la cepa DGA01 de Trichoderma harzianum contra el patógeno causante de la antracnosis en el mango cv. "Carabao". Biocontrol Ciencia y Tecnología 28(6): 591- 602. [ Links ]
Arcia, A. 1995. Uso de Antagonistas en el Control de Fitopatógenos del Suelo. En Curso sobre Control Microbial de Insectos Plagas y Enfermedades en Cultivos. Seminario en la Universidad Centro Occidental (UCLA). Barquisimeto Venezuela. 20 pp. [ Links ]
Barnett, H.L.; Hunter, B.B. 1987. Illustrated Genera of imperfect fungi. Macmillan Publishing Company. New York. London. Fourth Edition. [ Links ]
Bell, D.K.; Well, H.D.; Markham, C.R. 1982. In vitro antagonism of Trichoderma species against sixfungal plant pathogens. Phytopathology 72: 379-382. [ Links ]
Castañeda, C.; Mercad, Y.; Téllez, A.; Mendoza, A.; Anducho, M. 2017. Efectos benéficos de Trichoderma y su regulación de la expresión génica de celulasas y hemicelulasas. Ciencias Biológicas y de la Salud. Proceedings - ©ECORFAN, México, Pachuca. 36-55. [ Links ]
Coca, M. 2017. Bases científico metodológicas para la selección, caracterización y uso de aislamientos de Trichoderma como agente de control biológico del tizón de la vaina (Rhizoctonia solani KÜHN) en arroz. Revista Anales de la Academia de Ciencias de Cuba 7(1): 1-7. [ Links ]
Correa, S.; Mello, M.; Ávila, Z. R.; Braúna, L. M.; Pádua, R. R.; Gomes, D. 2007. Cepas de Trichoderma spp. para el control biológico de Sclerotium rolfsii. SACC. Fitosanidad 11(1): 3-9. [ Links ]
Dennis, C.; Webster. J. 1971. Antagonistic Properties of Species-Groups of TrichodermaI. Production of Non-Volatile Antibiotics, Transactions British Mycological Society 57: 25-39. [ Links ]
Duarte-Leal, Y.; Lamz-Piedra, A. & MartínezCoca, B. 2017. Antagonismo in vitro de aislamientos de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg frente a Sclerotium rolfsii Sacc. Revista De Proteccion Vegetal 32(3): 1-11 [ Links ]
Ellis, M.B. 1976. More Dematiaceous Hyphomycetes. Kew, England: Commonwealth Mycological Institute. 507 pp. [ Links ]
Eraso, C; Acosta Rodríguez, J; Salazar González, C; García, C. 2014. Evaluación de cepas de Trichoderma spp. para el manejo del amarillamiento de arveja causado por Fusarium oxysporum. Corpoica Cienc. Tecnol. Agropecu. 15(2): 237-249. [ Links ]
Ezziyyani, M.; Sánchez, C.P., Requena, M.E.; Rubio, L.; Castillo, M.E.C. 2004 Biocontrol por Streptomyces rochei–Ziyani–, de la podredumbre del pimiento (Capsicum annuum L.) causada por Phytophthora capsici. En Anales de Biología. Servicio de Publicaciones de la Universidad de Murcia. p. 61-68. [ Links ]
Gato, C.Y.; Pérez, Y.; Carreras, B.; Yamilé, Y.; Quesada, Y.; Ramírez, R. 2014. Actividad antagónica de cepas autóctonas de Trichoderma spp. frente a fitopatógenos de suelo. Fitosanidad 18(1): 45-48. [ Links ]
Guédez, C.; Cañizalez, L.; Castillo, C.; Olivar, R. 2012. Evaluación in vitro de aislamientos de Trichoderma harzianum para el control de Rhizoctonia solani, Sclerotium rolfsii y Fusarium oxysporum en plantas de tomate. Revista de la Sociedad Venezolana de Microbiología 32: 44-49. [ Links ]
Hoyos-Carvajal, L.; Chaparro, P.; Abramsky, M.; Chet, I.; Sorduz, S. 2008. Evaluación de aislamientos de Trichoderma spp. contra Rhizoctonia solani y Sclerotium rolfsii bajo condiciones in vitro y de invernadero. Agronomía Colombiana 26(3): 451-458. [ Links ]
Howell, C.R. 2003. Mechanisms employed by Trichoderma species in the biological control of plant diseases: The history and evolution of current concepts. Plant Disease 87: 4-10. [ Links ]
Infante, D.; Martínez, B.; González, N; Reyes, Y. 2009. Mecanismos de acción de Trichoderma frente a hongos fitopatogenos. Rev. Protección Veg. 24: 14-21. [ Links ]
Kubicek, C.P; Harman, G. E. 2002. Trichoderma and Gliocladium V. 1. Basic biology, taxonomy and genetics. Editorial Taylor & Francis e-Library. [ Links ]
Li, Y.; Sun, R.; Yu, J.; Saravanakumar, K.; Chen, J. 2016. Antagonistic and biocontrol potential of Trichoderma asperellum ZJSX5003 against the maize stalk rot pathogen Fusarium graminearum. Indian journal of microbiology 56(3): 318-327. [ Links ]
López-Ferrer, U.; Brito-Vega, H.; López-Morales, D.; Salaya-Domínguez, J. M.; Gómez-Méndez, E. 2017. Papel de Trichoderma en los sistemas agroforestales-cacaotal como un agente antagónico. Tropical and Subtropical Agroecosystems 20(1): 91-100. [ Links ]
Marcelo, C.; Francisco, S. 2017. La problemática de la resistencia de hongos a fungicidas Causas y efectos en cultivos extensivos. Agronomía & Ambiente 37(1): 1-19. [ Links ]
Martínez, B.; Infante, D.; Reyes, Y. 2013a. Trichoderma spp. y su función en el control de plagas en los cultivos. Rev. Protección Veg. 28(1): 1-11. [ Links ]
Martínez, B.; Pérez, J.; Infante, D.; Duarte, Y.; Moreno, M. 2013b. Antagonismos de aislamientos de Trichoderma spp. frente a Didymella bryoniae (Fuckel) Rehm. Rev. Protección Veg. 29(3): 192-198. [ Links ]
Martínez, B.; Reyes, Y.; Infante, D.; González, E.; Baños. H.; Cruz, A. 2008c. Selección de aislamiento de Trichoderma spp. candidatos a biofungicidas para el control de Rhizoctonia sp. en arroz. Rev. Protección Veg. 23(2): 118-125. [ Links ]
Michel-Aceves, A.C.; Otero-Sánchez, M.A.; ArizaFlores, R.; Barrios-Ayala, A.; Alarcón-Cruz, N. 2013. Eficiencia biológica de cepas nativas de Trichoderma spp., en el control de Sclerotium rolfsii Sacc., en cacahuate. Avances en Investigación Agropecuaria 17(3): 89-107. [ Links ]
Nico, A.I.; Mónaco, C.I.; Dal Bello, G.; Alippi, H. 2005. Efecto de la adición de enmiendas orgánicas al suelo sobre la capacidad patogénica de Rhizoctonia solani: II. Micoflora asociada y antagonismo in vitro de los aislados más frecuentes. Rev. Inv. Agrop. 34(1): 29-44. [ Links ]
Ortiz–Martínez, J.; Hernández–Ramírez, G.; Cruz–Tobón, M.; Figueroa–Rodríguez, K.; Figueroa–Sandoval, B.; Hernández–Rosas, F. 2013. Inhibición in vitro de aislamientos nativos de Trichoderma en presencia de la cepa comercial T22. Rev. Colomb. Biotecnol. XV(1): 126-136. [ Links ]
Pérez-Torres, E.; Bernal-Cabrera, A.; MilanésVirelles, P.; Sierra-Reyes, Y.; Leiva-Mora, M.; Marín-Guerra, S.; Monteagudo-Hernández, O. 2018a. Eficiencia de Trichoderma harzianum (cepa a-34) y sus filtrados en el control de tres enfermedades fúngicas foliares en arroz. Bioagro 30(1): 17-26. [ Links ]
Pérez-Torres. E.J.; Bernal Cabrera. A.; Milanés Virelles. P.; Leiva Mora. M.; Sierra Reyes. Y.; Cupull Santana. R. 2017b. Actividad antagónica de Trichoderma harzianum Rifai sobre el agente causal del tizón del arroz (Pyricularia grisea Sacc.). Centro Agrícola 44(3): 13-19. [ Links ]
Pérez Torres, E.J.; Milanés Virelles, P.; Bernal Cabrera, A.; Leiva Mora, M.; García Rivero, G.; Lobato Caisa, L.P.; Cañar Aguirre, L. M.; Sierra Reyes, Y.; Mena Castro, O. 2013c. Antagonismo "in vitro" de Trichoderma harzianum sobre aislados camagüeyanos de Bipolaris oryzae y Sarocladium oryzae. Centro Agrícola 40(3): 29-36. [ Links ]
Reyes, Y.; Martínez, B.; Infante, D. 2008. Evaluación de la actividad antagónica de trece aislamientos de Trichoderma spp. sobre Rhizoctonia sp. Rev. Protección Veg. 23(2): 112-117. [ Links ]
Rodríguez-Lacherre, M; Veneros-Terrones, R. 2011. Control biológico de Trichoderma harzianum RIFAI sobre hongos patógenos de frutos postcosecha de Carica papaya procedente de zonas de distribución del distrito Trujillo (Perú). REBIOL 31(2): 1-9. [ Links ]
Rodríguez, I.C.; Flores, J. 2018. capacidad antagónica in vitro de Trichoderma spp. frente a Rhizoctonia solani Kuhn y Fusarium verticillioides Nirenberg. Bioagro 30: 49 -58. [ Links ]
Sánchez, A.D.; Barrera, V.; Reybet, G. E.; Sosa, M. C. 2015. Biocontrol con Trichoderma spp. de Fusarium oxysporum causal del "mal de almácigos" en pre y post emergencia en cebolla. Revista de la Facultad de Agronomía, La Plata 114(1): 61-70. [ Links ]
Sandoval, I.; Lopez, M.O. 2001. Hiperparasitismo de Trichoderma harzianum, T. Viride y T. pseudokoningii sobre diferentes hongos fitopatogenos. Fitosanidad 5(1): 41-44. [ Links ]
Schirmbock, M.; Lorito, M; Wang, Y. L.; Hayes, C.K.; Arisan-Atac,I.; Scala F.; Harman G.E.; Kubicek C.P.1994. Parallel formation and synergism of hydrolytic enzymes and peptaibol antibiotics, molecular mechanisms involved in the antagonistic action of Trichoderma harzianum against phytopathogenic fungi. Appl Environ Microbiol. 60 (12): 4364-4370. [ Links ]
Sinuco, D. Perez, A.; Moreno, N. 2017. Evaluación de la actividad fungicida e identificación de compuestos orgánicos volátiles liberados por Trichoderma viride. Rev. Colomb. Biote. 19(1): 63-70. [ Links ]
Suriyagamon, S., Phonkerd, N., Bunyatratchata, W., Riddech, N., Mongkolthanaruk, W. 2018. Compost Seed of Trichoderma harzianum UD12-102 in Controlling Collar and Stem Rot of Tomato Caused by Sclerotium rolfsii. Environment and Natural Resources Journal 16(2): 20-28. [ Links ]
Wells, H.D.; Bell, D.K.; Jaworski, C.A. 1972. Efficacy of Trichoderma harzianum as a biocontrol for Sclerotium rolfsii. Phytopathology 62: 442-447. [ Links ]
Corresponding author
E-mail: garridoro@hotmail.com (M. Garrido)
Received August 27, 2018.
Accepted May 10, 2019.