Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.2 Trujillo abr./jun. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.02.11
ARTÍCULOS ORIGINALES
Inducción de embriogénesis somática a partir de explantes foliares en tres variedades de café
Induction of somatic embryogenesis from foliar explants in three varieties of coffee
Sánchez Jhong1; R. Cabrera Pintado1,*; J. Jiménez D.2
1 Instituto Nacional de Innovación Agraria, Av. La Molina 1981, Lima, Perú.
2 Universidad Nacional Agraria La Molina, Av. La Molina s/n, Lima, Perú.
Resumen
El objetivo de la investigación fue establecer un protocolo de inducción de embriogénesis somática en las variedades Castillo, Catuaí y Costa Rica 95. Se instaló un ensayo de desinfección de hojas y otro para la inducción de embriogénesis somática. En el primer ensayo se evaluó diferentes concentraciones de NaClO, tiempo de inmersión y uso de solución antioxidante. El tratamiento de desinfección con mejores resultados fue 2% de NaClO por 5 minutos. En el segundo ensayo, se evaluó el efecto de diferentes tipos y concentraciones de reguladores de crecimiento; las citoquininas BAP y KIN (2,0; 4,0 y 6,0 mg/L), la auxina 2,4-D (0,1; 0,5 y 1,0 mg/L) y la combinación 2,4-D (0,1; 0,5 o 1,0 mg/L) + KIN (1,5 mg/L). Se logró inducir embriogénesis somática, directa e indirecta, en un solo medio de cultivo a partir de la semana 7 de iniciado el ensayo. La tasa de embriogénesis somática alcanzó valores de 100% en las tres variedades en algunos tratamientos. El número promedio de embriones/explante fue de 21,62; 26,84 y 7,4 en las variedades Castillo, Catuaí y Costa Rica 95, respectivamente. De los resultados, se concluyó que los tratamientos con BAP, 2,4-D y 2,4-D+KIN inducen embriogénesis somática según la variedad de café.
Palabras clave: café; embriogénesis somática; callogénesis; cultivo de tejidos.
Abstract
The objective of the research was to establish a protocol of somatic embryogenesis induction in Castillo, Catuai and Costa Rica 95 coffee varieties. Two trials were installed, one for leaf disinfection and other for somatic embryogenesis induction. In the first experiment different concentrations of NaClO, immersion times and use of antioxidant solution were evaluated. The best disinfection treatment was 2% NaClO for 5 minutes. In the somatic embryogenesis induction, different types and concentrations of growth regulators were tested; three concentrations of BAP and KIN (2.0, 4.0 and 6.0 mg/L), three concentrations of 2,4-D (0.1, 0.5 and 1.0 mg/L) were tested including combinations 2,4-D (0.1, 0.5 or 1.0 mg/L) + KIN (1.5 mg/L). Direct and indirect somatic embryogenesis was induced in only one culture medium from seventh week. The somatic embryogenesis rate reached values of 100% in the three varieties in some treatments. The average number of embryos/explant was 21.62, 26.84 and 7.4 in Castillo, Catuaí and Costa Rica 95 varieties, respectively. From the results, it was concluded that treatments with BAP, 2,4-D and 2,4-D+KIN induce embryogenesis according to coffee variety.
Keywords: coffee; somatic embryogenesis; callogenesis; tissue culture.
1. Introducción
El rendimiento, la calidad organoléptica y la resistencia a plagas y enfermedades son características que presentan variedades mejoradas de café. El cultivo de tejidos vegetales se presenta como una herramienta biotecnológica que permite la propagación masiva de distintas especies de importancia económica (Venkataiah et al., 2016; Georget et al., 2017). El cultivo in vitro de café se puede llevar a cabo por dos vías: la micropropagación por microestacas y la regeneración por embriogénesis somática (Berthouly, 1997). Sin embargo, la embriogénesis somática a partir de explantes foliares es la mejor opción para la propagación rápida de genotipos élite de café, en un menor periodo de tiempo (Etienne et al., 2016), debido a su alta tasa de multiplicación y por la abundancia y fácil desinfección de sus hojas (Campos et al., 2017).
La embriogénesis somática es un proceso biológico por el cual células somáticas desarrollan embriones semejantes a los embriones cigóticos, estos embriones se regeneran en plantas genéticamente iguales a la planta madre. Los embriones somáticos se pueden formar a partir de células del explante y previa formación de callo, estas dos vías diferentes se denominan embriogénesis somática directa e indirecta (Campos et al., 2017), respectivamente. La técnica también permite realizar estudios posteriores relacionados al mejoramiento genético; debido a que el cafetal es una planta semiperenne, tomaría más de 30 años obtener cultivares tolerantes a estrés biótico y abiótico mediante el mejoramiento clásico (Etienne-Barry et al., 2002); por ello, con la embriogénesis somática, se liberarían variedades en menor tiempo que por el método convencional.
El éxito de la inducción de embriogénesis somática, entre otros factores, depende de la variedad introducida y del suministro de reguladores de crecimiento en el medio de cultivo; por esta razón el presente trabajo tuvo como finalidad establecer un procedimiento eficiente de inducción de embriogénesis somática para tres variedades de café, determinando el tipo y concentración de regulador de crecimiento.
2. Materiales y métodos
El trabajo de investigación se realizó en el Laboratorio de Cultivo de Tejidos Vegetales de la Subdirección de Biotecnología del Instituto Nacional de Innovación Agraria (La Molina, Lima, Perú).
Material Vegetal
Se usaron plantas madre de seis meses de edad de las variedades Castillo, Catuaí y Costa Rica 95, mantenidas en el invernadero de la Subdirección de Biotecnología del INIA (La Molina, Lima).
Desinfección del explante
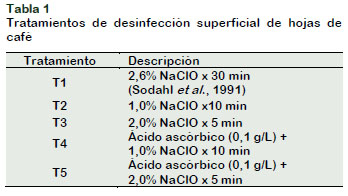
Las hojas de café se lavaron con agua de caño y detergente, y se sumergieron en una solución de fungicida Benomyl (2,0 g/L) por una hora. Luego, bajo condiciones de cámara de flujo laminar, se sometieron a diferentes concentraciones de NaClO, tiempo de inmersión y uso de antioxidante (Tabla 1). A la solución desinfectante se le añadió cinco gotas de Tween 20 y al finalizar el tiempo de inmersión, se enjuagó tres a cuatro veces con agua destilada estéril. Las hojas se diseccionaron, descartando la nervadura central, para obtener explantes de 1 cm2. Los explantes se sembraron en un medio solido con sales Murashige y Skoog (1962) a la mitad de concentración, sacarosa (30,0 g/L) y agar (7,0 g/L), a un pH ajustado a 5,6 ± 0,1; y se incubaron a 26°C, fotoperiodo de 16 horas luz y 70% de humedad relativa, por 15 días. Se evaluó las tasas de contaminación y de oxidación. El diseño experimental completo al azar estuvo compuesto por cinco tratamientos y 10 repeticiones por tratamiento; siendo la unidad experimental, una placa con cinco explantes. Al realizar el análisis estadístico de los datos, estos no cumplían los supuestos de normalidad y homogeneidad de varianzas; por ello, se realizó las funciones de la prueba no paramétrica Kruskal Wallis del paquete agricolae, empleando el software R versión 3.5.0, a un nivel de significación de 0,05.
Inducción de embriogénesis somática
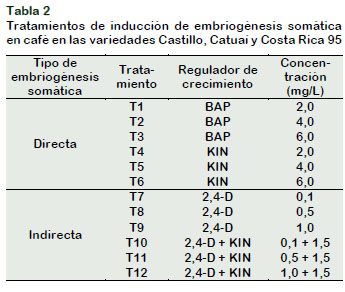
El ensayo consistió en evaluar diferentes tipos y concentraciones de reguladores de crecimiento, citoquininas y auxinas en el medio de cultivo, para la inducción de embriogénesis somática en las variedades Castillo, Catuaí y Costa Rica 95 (Tabla 2).
Se colectaron el primer par de hojas jóvenes de plantas de las tres variedades para ser sometidas al tratamiento de desinfección superficial determinado previamente (T3: 2,0% NaClO por 5 minutos). En condiciones asépticas, se sembraron explantes de 1 cm2 en un medio solido provisto por sales Murashige y Skoog (1962) a la mitad de concentración, vitaminas usadas por Yasuda et al. (1985) para la inducción de embriogénesis somática en café: piridoxina.HCl (1,0 mg/L), ácido nicotínico (1,0 mg/L) y tiamina.HCl (1,0 mg/L); myo-inositol (100,0 mg/L), sacarosa (30,0 g/L), agar (7,0 g/L) y el regulador de crecimiento correspondiente para cada tratamiento. Los explantes se incubaron a 26°C, 70% de humedad relativa y a oscuridad total. Se evaluó tasa de callogénesis, tasa de embriogénesis y número de embriones somáticos. El diseño experimental completo al azar estuvo compuesto por 12 tratamientos y 10 repeticiones por tratamiento; siendo la unidad experimental una placa con cinco explantes. Al realizar el análisis estadístico de los datos, estos no cumplían los supuestos que exige un DCA; por ello, se realizó las funciones de la prueba no paramétrica Kruskal Wallis del paquete agricolae, empleando el software R versión 3.5.0, a un nivel de significación de 0,.05.
3. Resultados y discusión
Desinfección del explante
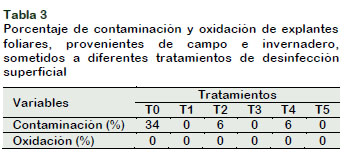
Los resultados de la Tabla 3 indican que los tratamientos T1, T3 y T5 presentaron el 100% de explantes sanos, mientras que en los tratamientos T2 y T4 se obtuvo 94% de explantes sanos. López-Gómez et al. (2010) y Montes-Cruz et al. (2017) reportaron similares resultados al usar mayor concentración de NaOCl y tiempo de inmersión de los explantes en la solución desinfectante. Las plantas de café al mantenerse bajo condiciones controladas, propias de un invernadero, son más fáciles de desinfectar que las provenientes de campo (Mroginski y Roca, 1991).
No se observó explantes oxidados. LópezGómez et al. (2010) obtuvieron más del 50% de explantes oxidados al usar 3,5% NaOCl; Paredes et al. (2013), realizaron la desinfección de hojas de café con 1,5% de NaOCl por 20 minutos y el 10% de los explantes presentaron oxidación. Estos resultados favorables se deben a la baja concentración de NaOCl y tiempo de inmersión utilizados en el experimento. Además, se tuvo en cuenta otras estrategias descritas por Azofeifa (2009) como el estado juvenil de las hojas, las sales del medio de cultivo a la mitad de concentración y la incubación en oscuridad.
El procedimiento de desinfección superficial más eficiente respecto al uso de insumos y tiempo de inmersión fue el tratamiento T3 (2,0% NaClO por 5 minutos).
Inducción de embriogénesis somática directa
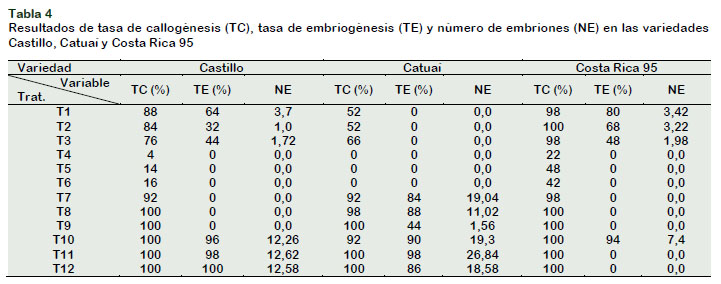
De acuerdo a los resultados expuestos en la Tabla 4, en las tres variedades se indujo la formación de callos en el medio con citoquininas (BAP y KIN), con excepción de la variedad Catuaí que solo se observó callos en los tratamientos con BAP.
El tratamiento que indujo alta tasa de callogénesis fue T1 (88%), T3 (66%) y T2 (100%) para la variedad Castillo, Catuaí y Costa Rica 95, respectivamente; sin embargo, no hubo diferencias estadísticas con los otros niveles de BAP pero sí con los tratamientos con KIN (T4, T5 y T6). La embriogénesis somática directa no se caracteriza por una formación de callos previa a la formación de embriones; a pesar de ello, se observaron callos pequeños y no diferenciados con el borde del explante, por lo que se les denominaron callos de cicatrización, reportado también por LópezGómez et al. (2016).
Los embriones somáticos se observaron a partir de la décima tercera semana de iniciado el cultivo (Figura 1a), en los tres tratamientos con BAP como único regulador de crecimiento, con excepción de la variedad Catuaí que no regeneró embriones somáticos por la vía directa.
La tasa de embriogénesis somática más alta se obtuvo con el tratamiento T1, con porcentajes de 64% y 80% para las variedades Castillo y Costa Rica 95, respectivamente, similares resultados mencionaron AvilaVictor et al. (2018) para la variedad Gran Colombia.
Los explantes y callos de cicatrización se oscurecieron a las cinco semanas de iniciado el cultivo, esto no fue impedimento para la inducción de embriones somáticos, Quiroz-Figueroa (2001) afirma que los compuestos fenólicos pueden actuar como sustancias inductoras o inhibitorias de la embriogénesis somática.
No hubo diferencias estadísticas significativas para el número de embriones somáticos; a pesar de ello, el tratamiento T1 presentó más de 3 embriones por explante, 100% más que en los tratamientos T2 y T3 (Tabla 4). Campos et al. (2017) y Avila-Victor et al. (2018) afirman que el número máximo de embriones regenerados por embriogénesis somática directa es 10 por explante; sin embargo, se observaron en este ensayo explantes con más de 10 embriones al estar en contacto con el medio de cultivo provisto de una de las concentraciones de BAP.
Inducción de embriogénesis somática indirecta
Respecto a la evaluación de callogénesis, todos los tratamientos (T7-T12) presentaron alta tasa de formación de callos (92-100%), en las tres variedades, sin diferencias estadísticas significativas. De Souza et al. (2015) afirman que la adición de la auxina 2,4-D permite la inducción de callo, así lo reportaron Paredes et al. (2013), LópezGómez et al. (2016), Montes-Cruz et al. (2017) y Avila-Victor et al. (2018), al usar diferentes concentraciones de 2,4-D, solo o con una citoquinina, para obtener 100% de explantes con callogénesis en diferentes variedades de café.
La tasa de embriogénesis fue menor a la tasa de callogénesis ya que no todos los callos observados fueron del tipo embriogénico (Figura 1b y 1c). En la variedad Castillo, se presentó embriogénesis somática indirecta en los tratamientos T10, T11 y T12 con tasas de 96%, 98% y 100%, respectivamente. Los explantes de los tratamientos T7-T12 de la variedad Catuaí presentaron sectores embriogénicos; los tratamientos T11 y T10 tuvieron alta tasa de embriogénesis (98% y 90%); seguido por T8, T12 y T7 (88%, 86% y 84%) y el tratamiento T9 obtuvo la tasa más baja (44%), con diferencia estadística significativa con el resto de tratamientos mencionados. En la variedad Costa Rica 95, solo formaron embriones somáticos los explantes del tratamiento T10 con una tasa de 94%. Otras investigaciones obtuvieron menor porcentaje de tasa de embriogénesis con similar combinación de reguladores de crecimiento: Moncada et al. (2004), con 1,0 mg/L 2,4-D y 2,7 mg/L BAP lograron un 17,3% de embriogénesis en la variedad Catuaí; Paredes et al. (2013), usaron 0,5 mg/L 2,4-D y 2,0 mg/L KIN y obtuvieron el 10% de explantes de la variedad Robusta con embriones somáticos; Avila-Victor et al. (2018), al usar 0,5 mg/L 2,4-D y 1,12 mg/L de BAP indujo embriogénesis somática indirecta en el 55% de explantes. Las diferentes respuestas de las variedades de café a la interacción con los reguladores de crecimiento permiten afirmar que para cada variedad se debe contar con un medio de cultivo específico, Silva et al. (2015) mencionan la necesidad de desarrollar protocolos específicos para cada especie o variedad. Muchos investigadores, entre ellos Moncada et al. (2004), Paredes et al. (2013), López-Gómez et al. (2016), Montes-Cruz et al. (2017) y Morales (2017), utilizaron dos medios en sucesión para producir embriones somáticos de café; el primero, con una auxina, sola o en combinación con una citoquinina; y el segundo, disminuyendo o eliminando la auxina del medio de cultivo (Padua et al., 2014). Sin embargo, en la presente investigación se logró obtener embriones somáticos en una sola etapa, con una mezcla de citoquinina y auxina. En el caso de la variedad Catuaí, se observaron embriones somáticos en los medios de cultivo con solo 2,4-D como regulador de crecimiento (T7, T8 y T9), probablemente se debió a que las hojas jóvenes de esta variedad presentan alta concentración de citoquininas endógenas, Sondahl et al. (1991) mencionan que las hojas jóvenes son ricas en citoquininas que inducen el desarrollo embriogénico.
Los primeros sectores embriogénicos se observaron a las 7 semanas de iniciado el cultivo en la variedad Catuaí; a las 10 semanas, en la variedad Castillo y a las 11 semanas, en la variedad Costa Rica 95, a comparación de las investigaciones de Moncada et al. (2004) y Avila-Victor et al. (2018) que obtuvieron embriones somáticos a las 20 y 24 semanas. De esta manera, con las concentraciones de 2,4-D (0,1; 0,5 y 1,0 mg/L) y KIN (1,5 mg/L) en el medio de cultivo, se puede inducir embriogénesis somática indirecta en menor tiempo que otros protocolos.
El mejor tratamiento para el número de embriones inducidos por embriogénesis somática indirecta fue T11 (0,5 mg/L 2,4-D y 1,5 mg/L KIN), con un promedio de 12,62 y 26,84 embriones por explante en la variedad Castillo y Catuaí, respectivamente, superando a los 25,69 embriones por explante obtenidos por Moncada et al. (2004) en un medio similar al utilizado (0,3 mg/L 2,4-D y 2,7 mg/L BAP). Además, se observaron explantes con más de 60 embriones somáticos en las variedades Castillo y Catuaí (Figura 1d).
4. Conclusiones
De los resultados, se concluye que el protocolo de desinfección consiste en el lavado de hojas con agua y detergente, remojo en Benomyl (2 g/L) por una hora; en condiciones de cámara de flujo laminar, sumersión en solución de 2% NaClO y cinco gotas de Tween 20 por 5 minutos; finalmente, tres enjuagues con agua destilada estéril. La oxidación de explantes y callos no representa un problema en el establecimiento in vitro ni en la inducción de embriogénesis somática. Los embriones somáticos se formaron por la vía directa en las variedades Castillo y Costa Rica 95, en un medio de cultivo provisto de BAP, siendo la concentración de 2 mg/L la que mostró mejores resultados. La inducción de embriones somáticos por la vía indirecta es más eficiente que por la vía directa y está influenciado por el efecto de la variedad y el regulador de crecimiento suministrado en el medio de cultivo. En la variedad Costa Rica 95, se indujo únicamente con la combinación de 0,1 mg/L 2,4-D + 1,5 mg/L KIN; en la variedad Catuaí, se indujo embriogénesis somática en las tres concentraciones de 2,4-D y en las tres combinaciones de 2,4-D+KIN; y en la variedad Castillo, en las tres combinaciones de 2,4-D+KIN, siendo 0,5 mg/L + 1,5 mg/L KIN la combinación que presentó mayor número de embriones somáticos por explante.
Los medios de cultivo desarrollados en esta investigación podrían ser evaluados en otras variedades de café de interés científico y comercial.
Referencias bibliográficas
Avila-Victor, C.M.; Martínez-Infante, Á.; Ordaz-Chaparro, V.M.; Arjona-Suárez, E.J.; Iracheta-DonJuan, L.; Gómez-Merino, F.C. Robledo-Paz, A. 2018. Embriogénesis somática directa e indirecta en Coffea arabica var. Colombia. Agroproductividad 11(4): 30-35. [ Links ]
Azofeifa, Á. 2009. Problemas de oxidación y oscurecimiento de explantes cultivados in vitro. Agronomía Mesomeamericana 20(1): 153-175. [ Links ]
Berthouly, M. 1997. Biotecnologías y técnicas de reproducción de materiales promisorios en Coffea arabica. En: Memorias del XVII Simposio Latinoamericano de Caficultura. Heredia, Costa Rica. Pp 25-49. [ Links ]
Campos, N.; Panis, B.; Carpentier, S. 2017. Somatic embryogeneis in coffee: The evolution of biotechnology and the integration of omics technologies offer great opportunities. Frontiers in Plant Science 8: 1460. [ Links ]
De Souza, A.; Paiva, R.; Valquíria, M.; De Figuereido, M.; Cautinho, L.; Pedrosa, D.; Carlota, F.; Silva, T.; Veig, S. 2015. Indução de calos embriogênicos em Coffea arabica L. cv. Catuaí amarelo. IX Simpósio de Pesquisa dos Cafés do Brasil. Curitiba-PR. [ Links ]
Etienne, H.; Bertrand, B.; Dechamp, E.; Maurel, P.; Georget, F.; Guyot, R.; Breitler, J.C. 2016. Are genetics and epigenetic instabilities of plant embryogenic cells a fatality? The experience of coffee somatic embryogenesis. Human Genetics and Embryology 6(1): 136-140. [ Links ]
Georget, F.; Courtel, P.; Malo, G.E.; Hidalgo, M.; Alpizar, E.; Breitler, J.C.; Bertrand, B.; Etienne, H. 2017. Somatic embryogenesis-derived coffee plantlets can be efficiently propagated by horticultural rooted mini-cuttings: A boost for somatic embryogenesis. Scientia Horticulturae 216: 177-185. [ Links ]
López-Gómez, P.; Iracheta-Donjuan, L.; Castellanos-Juaréz, M.; Méndez-López, I.; Sandoval-Esquivez, A.; Aguirre-Medina, J.; Ojeda-Zacarías, Gutiérrez-Díez, A. 2010. Influencia del explante y medio de cultivo en la embriogénesis somática en hojas de café. Revista Fitotecnia Mexicana 33(3): 205-213. [ Links ]
López-Gómez, P.; Iracheta-Donjuan, L.; Ojeda-Zacarías, M.; Ducos, J. Medio de cultivo e inhibidores de etileno en la embriogénesis somatica de café. 2016. Revista Mexicana de Ciencias Agrícolas 7(7): 1749-1757.
Moncada, E.; Vielma, M.; Mora, A. 2004. Inducción in vitro de embriogénesis somática a partir de tejido foliar de Coffea arabica L. variedad Catuaí amarillo. Universidad de los Andes Venezuela 3(6): 23-28.
Morales, R. 2017. Propagación in vitro de café (Coffea arabica L.)-variedades Geisha y Sarchimora partir de láminas foliares y meristemos axilares. Escuela Agrícola Panamericana. Zamorano, Honduras. 17 pp. [ Links ]
Montes-Cruz, S.; Lalama-Aguirre, J.; Echeverría-Féiz, J.; Toromoreno-Arévalo, L.; Salazar-Torres, S.; Benavides-Burgos, E.; Atiaja-Llamba, J. 2017. Obtención de embriones somáticos de cafeto a partir de explantes de hojas de las variedades Bourbón Cidra, Caturra Rojo y SL-28 de plantaciones establecidas en la Provincia del Carchi, Zona 1, Ecuador. Dominio de las Ciencias 3(2): 918-942. [ Links ]
Mroginski, L.; Roca, W. 1991. Establecimiento de cultivos de tejidos vegetales in vitro. En: Roca, W. y Mroginski, L. (eds.). Cultivo de tejidos en la agricultura: Fundamentos y aplicaciones. Centro Internacional de Agricultura Tropical (CIAT). Cali, Colombia. Pp. 19-40. [ Links ]
Murashige, T.; Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant 15: 473-497. [ Links ]
Padua, M.S.; Paiva, L.V.; Silva, L.C.; Livramento, K.G.; Alves, E.; Castro, A.H.F. 2014. Morphological characteristics and cell viability of coffee plants calli. Ciência Rural 44: 660-665. [ Links ]
Paredes, G.; Peña, C.; Jadán, M. 2013. Obtención de embriones en fase cotiledonar de Café Robusta (Coffea canephora) con el empleo de un sistema de inmersión temporal, mediante la técnica de embriogénesis somática a partir de segmentos foliares. ESPE. Sansolquí, Ecuador. 21 pp. [ Links ]
Quiroz-Figueroa, F.R.; Méndez-Zeel, M.; Larqué-Saavedra, A.; Loyola-Vargas, V.M. 2001. Picomolar concentrations of salicylates induce celular growth and enhance somatic embryogenesis in Coffea arabica tissue culture. Plant Cell Reports 20(8): 679-684. [ Links ]
Silva, A.T.; Barduche, D.; do Livramento, K.G.; Paiva, L.V. 2015. A putative BABY BOOM-like gene (CaBBM) is expressed in embryogenic calli and embryogenic cell suspension culture of Coffea arabica L. In Vitro Cellular & Developmental Biology Plant 51(1): 93-101. [ Links ]
Sondahl, M.; Nakamura, T.; Sharp, W. 1991. Propagación in vitro del café. En: Cultivo de tejidos en la agricultura: Fundamentos y aplicaciones. Roca, W. M y Mroginski L. A (eds). CIAT (Centro Internacional de Agricultura Tropical). Cali, Colombia. 622-642. [ Links ]
Yasuda, T.; Fujii, Y.; Yamaguchi, T. 1985. Embryogenic Callus Induction from Coffea arabica Leaf Explant by Benziladenine. Plant Cell Physiology 26(3): 595-597. [ Links ]
Venkataiah, P.; Bhanuprakash, P.; Kalyan, S. S.; Subhash, K. 2016. Somatic embryogenesis and plant regeneration of Capsicum baccatum L. Journal of Genetic Engineering and Biotechnology 14: 55-60. [ Links ]
* Corresponding author
E-mail: rcabrera@inia.gob.pe (R. Cabrera Pintado).
Received Janeiro 8, 2019.
Accepted June 26, 2019.