Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.2 Trujillo abr./jun. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.02.15
ARTÍCULOS ORIGINALES
Efecto del cambio de hábitat en las características nutricionales y funcionales de 16 accesiones de quinua (Chenopodium quinoa Willd.) cultivadas en la Costa Peruana
Effect of habitat change on the nutritional and functional characteristics of 16 quinoa (Chenopodium quinoa Willd.) accessions cultivated in the Peruvian Coast
María Julia Romaní-Morón; Jenny del Carmen Valdez-Arana*
Facultad de Industrias Alimentarias, Universidad Nacional Agraria La Molina, Apartado Postal 12-056, La Molina, Lima, Perú
Resumen
El objetivo de la investigación fue evaluar el efecto del cambio de hábitat en algunas características nutricionales y funcionales de 16 accesiones de quinua con diferente contenido de saponinas, colectadas en la Sierra de Cuzco (promedio 3237 m.s.n.m.) y cultivadas en la Costa de Lima (235 m.s.n.m.) en Perú. Las quinuas se lavaron y secaron, para su posterior análisis. La cantidad promedio de proteínas (18,21±1,00%), cenizas (3,33±0,51%) y fibra dietaria Total (12,94±1,40%), de los cultivos de la Costa, fueron significativamente mayores (p value < α (0,05)), en comparación a sus homólogas originales de la Sierra (15,68±1,57%, 2,40±0,23% y 10,56±1,01%, respectivamente); mientras que la cantidad promedio de carbohidratos (69,74±1,32%), la digestibilidad de almidón in vitro (46,97±23,40%) y la digestibilidad de proteína in vitro (63,62 ±4,32%), fueron significativamente menores respecto las quinuas originales de la Sierra (72,19±3,01%, 59,16 ±23,94%, 67,21 ±6,28%, respectivamente). La humedad, grasa y fibra bruta, el contenido total de polifenoles y los niveles de capacidad antioxidante no mostraron cambios significativos. Se demuestra que el cambio de hábitat influye en algunas de las características nutricionales y funcionales en los granos de quinua.
Palabras clave: Quinua; nutricional; funcional; cambio de habitat.
Abstract
The aim objective was evaluated the effect of habitat change on some nutritional and functional characteristics of 16 accessions of quinoa with different content of saponins, collected in the Sierra of Cuzco (3237 m.a.s.l.) and cultivated in the Coast of Lima (235 m.a.s.l.) in Peru was evaluated. Quinoas were washed, dried and ground, for further analysis. The average amount of proteins (18.21±1.00%), ashes (3.33±0.51%) and total dietary fiber (12.94±1.40%), of the crops of the Coast, were significantly higher (p value <α (0.05)), than their original homologs of the Sierra (15.68±1.57%, 2.40±0.23% and 10.56±1.01% , respectively); while the average amount of Carbohydrates (69.74±1.32%), in vitro starch digestibility levels (46.97±23.40%) and in vitro protein digestibility levels (63.62 ± 4.32%), were significantly lower than the original quinoas of the Sierra (72.19±3.01%, 59.16±23.94%, 67.21±6.28%, respectively). Fat, fiber, total polyphenol content and antioxidant capacity levels did not show significant changes when changing habitat. The habitat change is proved to be an influence on some nutritional and functional characteristics of the quinoa beans.
Keywords: Quinoa; nutricional; functional; habitat change.
1. Introducción
La quinua, grano andino de alto valor nutricional, pertenece a la familia de las Chenopodiaceas. En los últimos años ha habido un creciente interés en ella debido a su calidad nutricional superior comparada con otros granos (Pereira et al., 2019) y a su resistencia a condiciones ambientales extremas, lo que la constituyen una opción alimenticia para afrontar la falta de Seguridad Alimentaria (García–Parra et al. 2018). Contiene proteínas (12,9%) de alto valor biológico, con un buen balance de aminoácidos esenciales (Koziol, 1992), además de carbohidratos (77,6%), lípidos (6,5%) (Hirose et al., 2010) y fibra dietaria (1,1 % a 16,3 %) (Tapia et al., 1997). Cuando se ha sometido a extrusión, la digestibilidad in vitro de la proteína de quinua y la del almidón variaron entre 76,3%-80,5% y 65,1%-68,7% respectivamente (Repo– Carrasco y Serna, 2011). Así mismo, la quinua ha recibido atención como alimento funcional (Escudero et al., 2014) pues contiene un alto nivel de flavonoides (36,2-144,3 mg/100g) y otros compuestos fenólicos (16,8-59,7 mg/100 g) que le confieren una alta capacidad antioxidante (Hirose et al., 2010; Razzeto et al. 2019).
En Perú existen 3 mil ecotipos de quinua (INIA, 2018) y actualmente es el principal productor de este grano en el mundo (ODEPA, 2017). Al respecto, la calidad nutricional y funcional del mismo tiene gran influencia en su valoración comercial. Es asà que seleccionar las accesiones que contengan el menor contenido de saponinas y el mayor valor nutricional y funcional tiene gran importancia tanto para los agricultores, los potenciales compradores y consumidores y aquellos que deseen procesar el cultivo y obtener mayor valor agregado.
Según MINAGRI (2012), la Costa representa 12% del territorio peruano. Ante la alta demanda de quinua en el mundo, este espacio puede ser aprovechado para su cultivo; sin embargo, al ser éste oriundo de los andes, podría sufrir ciertas alteraciones en su composición nutricional y funcional influenciadas por las variaciones agroclimáticas (Geerts et al., 2006; Repo-Carrasco et al., 2003).
Actualmente la mayoría de las investigaciones realizadas sobre la adaptación del cultivo están dirigidas a priorizar el incremento de la producción del grano, la resistencia a enfermedades, la tolerancia al estrés hídrico y al control del contenido de saponinas (Ruíz–Carrasco, 2011; García–Parra et al. 2018, Guevara et al., 2018); muy pocas de estas investigaciones (Miranda et al., 2013; Lee y Sim, 2018) han reportado como varía la composición química y el potencial funcional de la semilla al adaptarla a hábitats diferentes al de su origen.
El objetivo principal de esta investigación fue evaluar el efecto del cambio de habitat en algunas características nutricionales y funcionales de 16 accesiones de quinua con diferente contenido de saponinas, provenientes de diferentes altitudes del departamento de Cuzco, cultivadas en la costa de Lima en el Perú.
2. Materiales y métodos
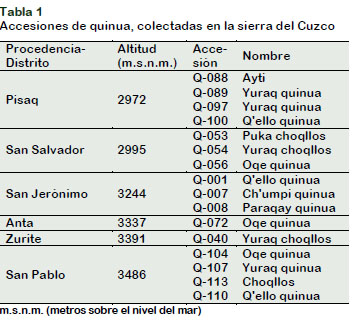
Materia Prima. Accesiones de quinua provenientes de diferentes altitudes de la zona altoandina de Cuzco sembradas en la Costa peruana (12° 04´ latitud sur del Ecuador y 74° 57´ de longitud oeste del Meridiano de Greenwich, a 235 m.s.n.m.) (Tabla 1).
Condiciones climáticas y edáficas
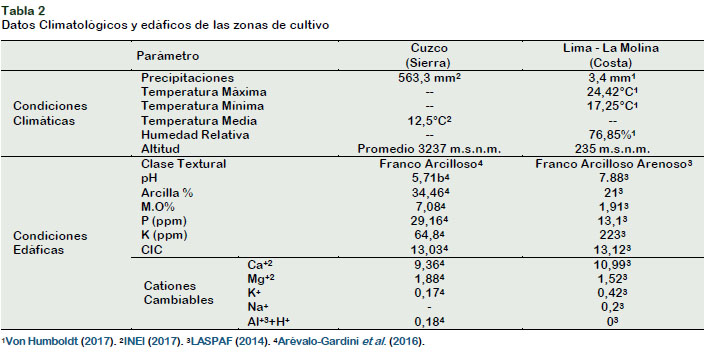
La Tabla 2 muestra los cambios en las condiciones de cultivo de las accesiones de quinua originales de la Sierra (Cuzco) y Costa (Lima).
Herramientas estadísticas
Se empleó el análisis de varianza y la prueba de comparación de medias de Tukey, utilizando el programa Minitab® Versión 17 y Project R.
Métodos de análisis
Determinación del contenido de saponina. Se siguió el método espectrofotométrico (Baccou et al., 1977).
Acondicionamiento de la muestra
Se realizó la desaponificación de las 16 accesiones (Mujica et al., 2006), se secaron a 45 ºC por 12 horas (Argüello y Garzon, 2012) y se almacenaron en bolsas con cierre hermético y en refrigeración (8 °C).
Determinación del análisis proximal
El contenido de humedad, proteína, grasa, fibra, ceniza y carbohidratos (por diferencia de 100), siguiendo lo descrito por la A.O.A.C. (2000).
Digestibilidad in vitro del almidón
Se determinó por el método de Holm et al. (1985).
Digestibilidad in vitro de las proteínas
Se determinó mediante el método de Torry Modificado (Lovern, 1965).
Determinación del potencial Funcional
Se realizó a través de la evaluación del Contenido de polifenoles totales (Singleton y Rossi, 1965); Capacidad antioxidante in vitro (Hirose et al., 2010) y Determinación de fibra dietaria (A.O.A.C., 2000).
3. Resultados y discusión
Saponinas en las accesiones de quinua
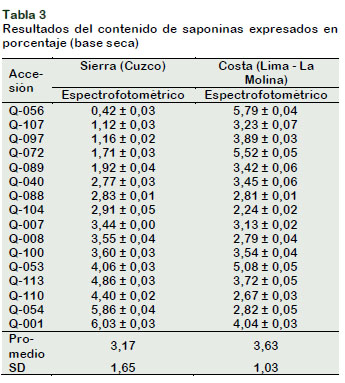
La Tabla 3 muestra el promedio del contenido de saponinas por cada accesión de la Costa como su homólogo original de la Sierra. Los niveles obtenidos para las muestras cultivadas en la Costa (2,24 5,79 mg de saponina/g de muestra) se encuentran acorde a lo reportado por Koziol (1992) quien reporta niveles de 0 a 12,0 mg/g (0 a 1,2%), además, muestran diferencias significativas (p valor < α (0,05)), las que se atribuyen a factores ambientales (De la torre et al., 2015); y/o genéticos (Ahumada et al., 2016).
Se observa que el contenido de saponinas, en promedio, para las quinuas cultivadas en la Costa (3,63 mg/g de m.s.) en comparación con sus homólogas originales de la Sierra (3,17 mg/ g de m.s.), obtenidos por el método espectrofotométrico mostraron diferencias significativas (p value < α (0,05)), siendo mayor en las quinuas de la Costa. De la torre et al. (2015) encontraron que existe una relación entre el alto contenido de saponinas y las condiciones de fotoperiodo corto y altas temperaturas.
El distrito de La Molina en Lima, tuvo una temperatura promedio de 21 ºC por las mañanas y 12 horas de sol al día (aproximadamente), en comparación a la temperatura en Cuzco la cual es en promedio de 12 °C. Estas condiciones ambientales podrían ser la razón por la cual las accesiones de la Costa presentaron mayores niveles de saponinas. Así mismo, Koziol (1992) menciona que la altitud de la siembra tiene influencia en el contenido final de saponinas. Accesiones sembradas en altitudes menores, tienen mayor contenido de saponinas, acorde con lo encontrado en este estudio.
Análisis proximal
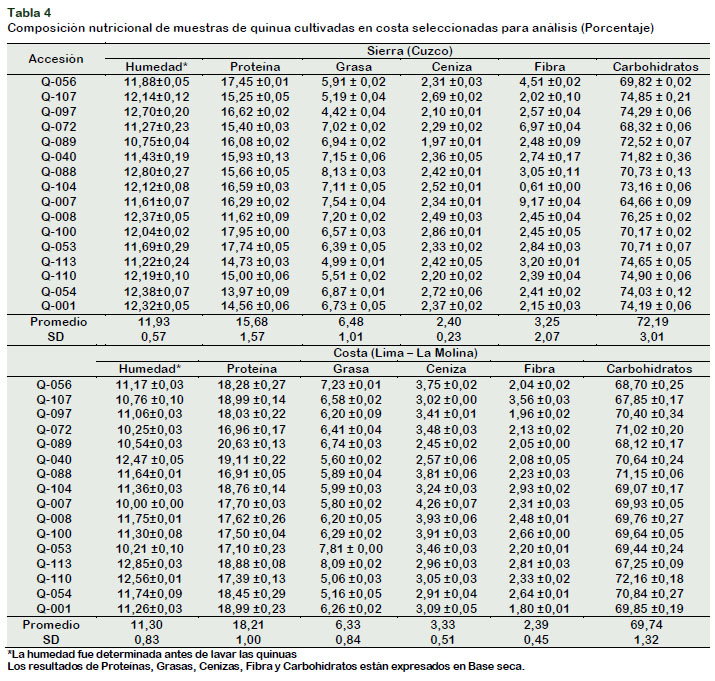
La Tabla 4 presenta el promedio de la composición proximal de las 16 accesiones de quinua de la Costa y sus homólogas originales de la Sierra. Los niveles de humedad para las quinuas de la Costa (10,0012,85%), exceptuando las accesiones Q-110 y Q-113, cumplen con lo establecido por INACAL (2014) que señala como máximo 12,5% de humedad para la quinua procesada (beneficiada). En relación a la evaluación del cambio de hábitat de cultivo de quinua, se observa que el porcentaje de humedad, en promedio, para las quinuas cultivadas en la Costa (11,30%) en comparación con sus homólogas originales de la Sierra (11,93%), no mostraron diferencias significativas (p value < α (0,05)), siendo ligeramente mayor en las quinuas de la Sierra. Miranda et al. (2013) señalan que el contenido de humedad varía de acuerdo a la humedad relativa y la cantidad de precipitación en el lugar en el que se cultiva la quinua. En los resultados de este estudio se encontró que las quinuas sembradas en la sierra, donde las precipitaciones son mayores (563,3mm) a las de la costa (3,4 mm), tuvieron un mayor contenido de humedad. En cuanto al contenido de proteína las muestras de la Costa (16,91-20,63%) cumplen con el nivel mínimo de 10% de proteína establecido por INACAL (2014) y se observó diferencias significativas (p value < α (0,05)) entre el contenido de este componente en las accesiones de la Costa. En relación a la evaluación del cambio de hábitat del cultivo de quinua en estudio, se observa que el porcentaje de proteína, en promedio, para las quinuas cultivadas en la Costa (18,21%) en comparación con sus homólogas originales de la Sierra (15,28%), mostraron diferencias significativas (p value < α (0,05)), siendo mayor en las quinuas de la Costa, aun cuando la materia orgánica disponible en el suelo de La Molina (1,91%) en comparación a los suelos del Cuzco (7,08%), fue menor.
Gonzales et al. (2011) y Miranda et al. (2013) encontraron que no existía una relación exacta entre el contenido de nitrógeno disponible y el porcentaje de materia orgánica en el suelo de siembra, con respecto al contenido final de proteínas en los cultivos. A su vez Gonzales et al. (2011) señalan que la fertilización durante la siembra jugaría un papel principal en el contenido de proteínas de la planta, así como los factores genéticos; y menos influenciado por la altitud de la zona de siembra de los cultivos, cuyo efecto es poco significativos en el contenido de proteínas de los cultivos. En el cultivo controlado realizado en la Costa, se aplicaron 100Kg de N/ha; durante la siembra se colocó la mitad de nitrógeno como fosfato di amonio [(NH4)2 HPO4] y durante el aporque se completó con el nitrógeno para lo cual se utilizó urea [CON2H4]. El aporque, en cultivos como el maíz ha demostrado ser beneficioso en el rendimiento de la planta (León et al., 2004) dado que los nutrientes en el suelo, como el nitrógeno, se ponen a mayor disposición de la planta. Así mismo, cuando los cultivos son nitrificados de manera directa, la absorción del nitrógeno es más rápida y eficiente, como lo observado en este estudio.
En cuanto al contenido de grasas de las accesiones de quinua sembradas en la Costa (5,16-7,81%), cumplen con lo establecido por INACAL (2014) (mínimo 4% de grasa).
En relación a la evaluación del cambio de hábitat de cultivo de las accesiones de quinua en estudio, se observa que el porcentaje de grasas, en promedio, para las quinuas cultivadas en la Costa (6,33%) en comparación con sus homólogas originales de la Sierra (6,48%), mostraron diferencias significativas (p value < α (0,05)), siendo mayores en la Sierra.
Respecto al contenido de cenizas (2,45-4,26%) de las accesiones de quinua sembradas en la Costa, la mayoría cumple con lo establecido por INACAL (2014) (máximo 3,5% porcentaje de cenizas). Las accesiones Q-007, Q-056, Q-008, Q-100 y Q088, presentaron valores ligeramente superiores (4,26%, 3,75%, 3,93%, 3,91% y 3,81%, respectivamente). Según Koziol (1992), el porcentaje de cenizas (en base seca) se encuentra entre 3% y 4%, intervalo dentro del cual se encuentra la mayoría de los resultados obtenidos.
En relación a la evaluación del cambio de zona de cultivo de las accesiones de quinua en estudio, se observa que el porcentaje de cenizas, en promedio, para las quinuas cultivadas en la Costa (3,33%) en comparación con sus homólogas originales de la Sierra (2,40%), mostraron diferencias significativas (p value < α (0,05)), siendo mayor en las quinuas de la Costa. El contenido de cenizas se encuentra supeditado, entre otros factores, a la composición del suelo. Miranda et al. (2013) señalan que un alto contenido de cenizas se puede encontrar en quinuas cultivadas en suelos de alta salinidad, pues en ellos se encuentran mayores contenidos de K+, Mg+2, Na+, Ca+2 y Al+3 (Koyro y Eisa, 2008). El contenido de los cationes antes mencionados es mayor en el suelo de la Molina, en comparación al suelo de Cuzco, razón por la cual se encontraron mayores contenidos de cenizas en las quinuas de la Costa.
El contenido de fibra de las accesiones de quinua sembradas en la Costa (1,80-3,56%) cumple con lo establecido por INACAL (2014) (mínimo 2%). Estos resultados fueron menores a lo reportado por Miranda et al. (2013) (2,11 a 5,7%) en quinuas sin lavar y similares a lo reportado por Repo-Carrasco y Serna (2011) (1,92 y 3,38%) para quinuas lavadas.
En relación a la evaluación del cambio de hábitat de cultivo de las accesiones de quinua en estudio, se observa que el porcentaje de fibra, en promedio, para las quinuas cultivadas en la Costa (2,32%) en comparación con sus homólogas de la Sierra (3,25%), no mostraron diferencias significativas (p value < α (0,05)). Este resultado concuerda con lo reportado por Miranda et al. (2011), quienes señalan que los resultados de fibra no se ven afectados por el cambio de localidad al momento de la siembra del cultivo de quinua, siendo los rasgos genéticos de la semilla determinante en el contenido de fibra; en concordancia con ello, podemos observar que las accesiones Q-007 y Q-056, obtuvieron porcentajes elevados de fibra tanto en la costa (3,43% y 3,16%, respectivamente) como sus homólogas en la Sierra (9,16% y 4,50%, respectivamente).
En cuanto al contenido de carbohidratos de las accesiones de quinua sembradas en la Costa (67,25 a 72,16%) se encuentra dentro del rango reportado de 67% a 74% de la materia seca (Jancurová et al., 2009). La variación en el contenido de carbohidratos en quinuas cosechadas en un mismo ambiente, se atribuye a que estas son de variedades distintas (Repo–Carrasco et al., 2003; Cordeiro et al., 2012).
En relación a la evaluación del cambio de hábitat del cultivo, se observa que el porcentaje de carbohidratos, en promedio, para las quinuas cultivadas en la Costa (69,74%) en comparación con sus homólogas originales de la Sierra (72,19%), mostraron diferencias significativas (p value < α (0,05)), siendo mayor en las quinuas de la Sierra.
Los resultados de Proteínas, Grasas, Cenizas, Fibra y Carbohidratos están expresados en Base seca.
Las quinuas cultivadas en la Costa soportaron una temperatura promedio mayor (21 °C) a las cultivadas en la Sierra (12,5 °C), por lo que el contenido de carbohidratos fue mayor en estas últimas. Martínez et al. (2013) mencionan que mayores niveles de temperatura durante el desarrollo del cultivo, disminuyen el contenido de almidón en el cultivo final, debido a que el periodo de llenado del grano se reduce, disminuyendo el contenido de carbohidratos.
Contenido total de polifenoles y Capacidad antioxidante
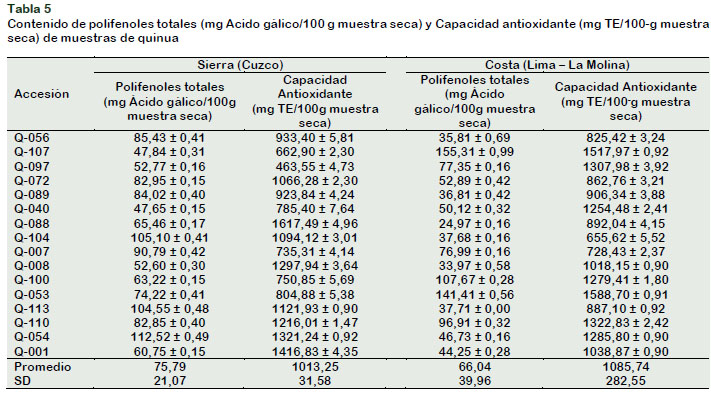
La Tabla 5 muestra el contenido de polifenoles totales y la capacidad antioxidante para las quinuas de la Costa y sus homólogas originales de la Sierra.
El contenido de polifenoles totales para las accesiones de la costa (24,97-155,31 mg de Ácido gálico/100 g de muestra seca) concuerdan con lo obtenido por Miranda et al. (2011) (14-66 mg ácido gálico/100 g m.s) y Repo–Carrasco y Encina (2008), (35 mg-140 mg ácido gálico/100 g m.s); así mismo, los niveles de capacidad antioxidante (655,62-1588,70 µg Trolox Equivalente/g muestra seca) se encuentran dentro del rango reportado por Repo-Carrasco y Encina (2008) (138,91-2400,55 µg TE/g), y
De la Riva (2010) (1498,25 µg TE/g m.s.). Existen diferencias significativas (p value < α (0,05)) en el contenido de polifenoles totales, así como en la capacidad antioxidante, entre las quinuas cultivadas en la Costa. Miranda et al. (2011) señalan que los factores genéticos influencian en la presencia de compuestos fenólicos causando variación entre los resultados para muestras cultivadas en condiciones agronómicas y ambientales iguales.
En relación a la evaluación del cambio de hábitat de cultivo, se observa que el contenido de polifenoles totales, en promedio, para las quinuas cultivadas en la Costa (66,04%) en comparación con sus homólogas originales de la Sierra (75,79%), no mostraron diferencias significativas (p value < α (0,05)). Así mismo, la capacidad antioxidante, en promedio, para las quinuas cultivadas en la Costa (1085,74 µg TE/100g m.s.) en comparación con sus homólogas originales de la Sierra (1013,25 µg TE/100g m.s), no mostró diferencias significativas (p value < α (0,05).
A pesar de lo señalado en el párrafo anterior, los resultados individuales obtenidos para las muestras de la Costa en relación a las accesiones de la Sierra, si mostraron diferencias significativas (p value < α (0,05). Así, se observa que accesiones como Q-053 (141,41 mg ácido gálico/100g m.s.) y Q-107 (155,31 mg ácido gálico/100g m.s.) tienen alto contenido de compuestos fenólicos en la costa a diferencia de sus pares en la Sierra (74,22 y 47,84 mg ácido gálico/100g m.s. respectivamente).
Según Miranda et al. (2011) y Repo– Carrasco y Encina (2008) las condiciones climáticas interfieren en la cantidad de compuestos fenólicos; condiciones extremas de temperatura y radiación, generan un aumento en la cantidad de los mismos. Wahid et al. (2007) señalan que esto se debe al incremento de la actividad de la enzima Fenilalanina amonio liasa (PAL) y un descenso de la actividad de las enzimas peroxidasa y la polifenol liasa.
La temperatura promedio de los distritos de Cuzco de donde provienen las accesiones, es de 12,5 °C, mientras que la temperatura promedio en el distrito La Molina en la Costa, donde fueron sembradas las accesiones, es de 21 °C, por esta razón algunas de las accesiones cultivadas en la costa presentan valores altos en cuanto al contenido de polifenoles totales.
Por último, la capacidad antioxidante y el contenido de compuestos fenólicos totales se encuentran relacionados de forma directamente proporcional; en algunas de las muestras, acorde a lo reportado por Miranda et al. (2013) y Repo-Carrasco y Serna (2011). Las accesiones Q-053 y Q-107 de la Costa y la Q-054 de la Sierra, tienen los valores más altos en ambas pruebas.
Digestibilidad in vitro de almidon, Digestibilidad in vitro de proteína y Fibra dietaria
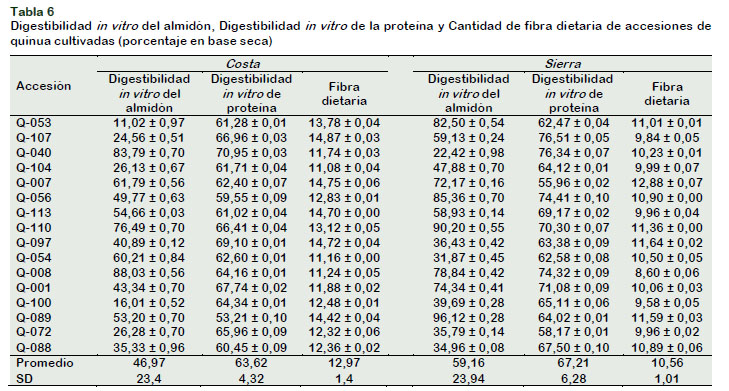
El Tabla 6 muestra los resultados de digestibilidad in vitro de almidón y proteína, y el contenido de fibra dietaria, para las accesiones de la Costa y sus homólogas de la Sierra.
Los niveles de digestibilidad in vitro de almidón de las accesiones de quinua sembradas en la Costa, fueron de 11,02% a 88,03%. Las accesiones Q-107, Q-104 y Q072, presentaron valores similares a los reportados por Navia et al. (2019) (2527,5%); sin embargo, se observaron accesiones con menor nivel de digestibilidad in vitro del almidón, tal es el caso de la accesión Q-053 (11,02%) y Q-100 (16,01%).
Hemalatha et al. (2016) señalan que la presencia de compuestos fenólicos y ácido tífico pueden inhibir la actividad de la α-amilasa reduciendo la velocidad de la digestión del almidón, condición observada en las accesiones Q-053 y Q-100, que presentan altos contenidos de componentes fenólicos (141,41% y 107,67% respectivamente). Así mismo, dado que el almidón de quinua es pequeño tiene una superficie específica más alta y mayor susceptibilidad a la enzima que los almidones de gránulos más grandes, lo que lo hace más digerible que el almidón de otros granos (Li et al., 2015).
Además de la cantidad de compuesto fenólicos presentes en la semilla y el tamaño del granulo de almidón, Srichuwong y Jane (2007) señalan que las diferencias entre los resultados de estudios se atribuyen a las diferencias en la estructura de amilopectina en cada grano, estructura granular del almidón, y la presencia de componentes menores en los almidones como lípidos y proteínas, así como las condiciones experimentales.
En relación a la evaluación del cambio de hábitat del cultivo, se observa que el nivel de digestibilidad in vitro de almidón, en promedio, para las quinuas cultivadas en la Costa (46,97%) en comparación con sus homólogas originales de la Sierra (59,16%), mostraron diferencias significativas (p value < α (0,05)), siendo mayor en las quinuas de la Sierra. Esto se debió a que la temperatura de cultivo de las accesiones, tiene influencia en la digestibilidad del almidón in vitro, dado que a mayores temperaturas se forma mayor cantidad de amilosa (Martínez et al., 2013), la cual según Jukanti et al. (2012) disminuyen la digestibilidad del almidón. Las accesiones de la costa toleraron mayores temperaturas (21 °C) en comparación a las accesiones sembradas en la Sierra (12,5°C).
En relación a la digestibilidad in vitro de proteínas, en promedio, para las quinuas cultivadas en la Costa (63,62%) en comparación con sus homólogas originales de la Sierra (67,21%), mostraron diferencias significativas (p value < α (0,05), siendo mayor en las quinuas de la Sierra.
Wang (1998) señala la digestibilidad de la proteína se ve afectada por el contenido de antinutrientes en el alimento, tales como el ácido fítico y los taninos (polifenoles), quienes forman complejos con estas. En este estudio no se ha podido corroborar esta afirmación debido a que las accesiones de la sierra (quienes muestran un mayor contenido de polifenoles, Tabla 5) fueron las que obtuvieron mayor digestibilidad in vitro de proteínas. Esto podría deberse a que la quinua no posee grades cantidades de taninos (INIA, 2013) y a que la digestibilidad de proteínas, además depende de otros factores, como el score aminoacidico (aminoácido limitante), el cual, según Gonzales et al. (2011), es mayor en zonas de mayor altitud.
Así mismo, los resultados obtenidos para las accesiones de la Costa analizadas (53,21%70,95%) fueron menores que los reportados por Chaparro et al. (2010) (79,04%). Estas variaciones pueden atribuirse al contenido de antinutrientes de cada variedad de quinua.
El contenido de fibra dietaria (11,08-14,87%) de las accesiones de quinua sembradas en la Costa se encuentra por debajo del reportado por Repo-Carrasco y Serna (2011) (15,99%) para la variedad La Molina 89 (cultivada en la Costa); similares a lo obtenido por las mismas autoras respecto a quinuas provenientes de la provincia de Puno (13,80%) y a lo obtenido por Miranda et al. (2013) (11,61%-15,07%); y mayores a lo reportado por Lamothe et al. (2015) (10%). La variación entre el contenido de fibra dietaria entre una y otra accesión, estaría relacionada con factores genéticos. Stoughton-Ens et al. (2010), reportan diferencias significativas (p value < α (0,05) en el contenido de fibra dietaria de alverjas, relacionadas al genotipo de las mismas.
En relación a la evaluación del cambio de hábitat del cultivo, se observa que el porcentaje de fibra dietaria, en promedio, para las quinuas cultivadas en la Costa (12,97%) en comparación con sus homólogas originales de la Sierra (10,56%), mostraron diferencias significativas (p value < α (0,05)), siendo mayor en las quinuas de la Costa. Miranda et al. (2013) y Stoughton-Ens et al. (2010), señalan que condiciones de siembra áridas (baja cantidad de precipitaciones), influyen de forma positiva en el contenido de fibra dietaria soluble. En la Costa, en el año 2014, el nivel de precipitación promedio fue de 3,4 mm/año, mientras que, en la Sierra, fue de 563,3 mm/año, ello explicaría las diferencias en el contenido de fibra dietaria entre ambas regiones.
4. Conclusiones
Las características nutricionales como la proteína, la ceniza y los carbohidratos, así como la fibra dietaria total, la digestibilidad de almidón in vitro y la digestibilidad de proteína in vitro, mostraron diferencias estadísticamente significativas, cuando el cultivo de las accesiones de quinua fue cambiado de hábitat (de la Sierra a la Costa). Las cantidades de proteína, ceniza y fibra dietaria total, aumentaron mientras que las cantidades de carbohidratos, los niveles de digestibilidad de almidón in vitro y los niveles de digestibilidad de proteína in vitro, para las quinuas cultivadas en la Costa disminuyeron en comparación a los contenidos presentados por las quinuas de la Sierra. La humedad, grasa, fibra bruta, los niveles de capacidad antioxidante y el contenido polifenoles totales, no fueron afectados significativamente, cuándo se cambió la zona de cultivo de las accesiones de quinua (de la Sierra a la Costa).
Agradecimientos
La presente investigación ha sido elaborada con financiamiento provisto por el Proyecto de Investigación Aplicada con Contrato Nº 141-FINCyT-IA-2013 "Selección de ecotipos de quinua (Chenopodium quinoa) con mayor potencial nutricional, funcional, tecnológico, sensorial y menor contenido de saponinas, cultivados en costa y sierra", del Fondo para la Innovación, la Ciencia y la Tecnología (FINCyT) del Programa Nacional de Innovación para la Competitividad y Productividad (Innovate Perú).
Referencias bibliográficas
A.O.A.C. (Association of Analytical Chemistry). 2000. Official Methods of Analysis. Editorial Board. U.S.A. [ Links ]
Ahumada, A.; Ortega, A.; Chito, D.; Benítez, R. 2016. Saponinas de quinua (Chenopodium quinoa Willd): un subproducto con alto potencial biológico. Revista Colombiana de Ciencias Químico-Farmacéuticas 45(3): 438-469. [ Links ]
Arévalo-Gardini, E.; Obando-Cerna, M.E.; ZúñigaCernades, L.B.; Arévalo-Hernández, C.; Baligar, V.; He, Z. 2016. Metales pesados en suelos de plantaciones de cacao (Theobroma cacao L.) en tres regiones del Perú. Ecología Aplicada 15(2): 81-89. [ Links ]
Argüello, S.; Garzón, G. 2012. Efecto de la temperatura y el tiempo de remojo en la germinación de maíz morado (Zea mays), quinua (Chenopodium quinoa) Y amaranto (Amaranthus hypochondriacus) para incrementar su valor proteico. Tesis Ing. Agroindustrial. Guaranda, Ecuador. Universidad Estatal de Bolívar. 129 pp. [ Links ]
Baccou, J.; Lambert, F.; Sauvaire, Y. 1977. Spectrophotometric. Method for the determination of total steroidal sapogenin. Analyst. 102: 458-465. [ Links ]
Chaparro, D; Pismag, R; Elizalde, A; Vivas, N.; Erazo, C. 2010 Efecto de la germinación sobre el contenido y digestibilidad de proteína en semillas de amaranto, quinua y soya y guandul. Revista Biotecnología en el Sector Agropecuario y Agroindustrial 8(1): 35-42. [ Links ]
Cordeiro, L; Reinhardt, V; Baggio, C; Werner, M; Moura, L; Sassaki, G; Lacomini, M. 2012. Arabinan and arabinan-rich pectic polysaccharides from quinoa (Chenopodium quinoa) seeds: Structure and gastroprotective activity. Food Chemistry 130: 937–944. [ Links ]
De la Riva, D. 2010. Comparación del contenido de fitatos, polifenoles y capacidad antioxidante de la quinua (Chenopodium quinoa Willd.) cruda y procesada. Variedad Salcedo Inia. Tesis Ing. Agroindustrial. Puno, Perú. Universidad Nacional del Altiplano. 109 pp. [ Links ]
De la torre, J.; Gonzalez, J.; Martinez, E. 2015. Efecto del fotoperiodo y la temperatura sobre la concentración de saponina en tres variedades de quinua (Chenopodium Quinoa Willd.) provenientes de tres latitudes.
Escudero, O; Gonzáles, I; Wells, G; Fischer, S; Hernández, J. 2014. Amino acid profile of the quinoa (Chenopodium quinoa Willd.) using near infrared spectroscopy and chemometric techniques. Journal of Cereal Science 60(1): 67-74. [ Links ]
García-Parra, M., Plazas N., Carvajal D., Ferreira S., Parra, J. 2018. Descripción de las saponinas en quinua (Chenopodium quinoa Willd) en relación con el suelo y el clima: una revisión. Informador Técnico 82(2): 241-249. [ Links ]
Geerts, S.; Raes D.; Garcia M.; Castillo, C.; Del, Buytaer, W. 2006. Agro-climatic suitability mapping for crop production in the Bolivian Altiplano: A case study for quinoa. Agricultural and Forest Meteorology 139(3–4): 399-412. [ Links ]
Guevara, E.; Oliva, M.; Collazos, R. 2018. Comportamiento agronómico de ocho genotipos de quinua (Chenopodium quinoa Willd.) en el distrito Molinopampa, provincia Chachapoyas, Amazonas, 2017. Revista de Investigación Científica UNTRM: Ciencias Naturales e Ingeniería 2(2): 63-71. [ Links ]
Gonzales, J.; Konishi, Y.; Bruno, M.; Valoy, M.; Prado, F. 2011. Interrelationships among seed yield, total protein and amino acid composition of ten quinoas (Chenopodium quinoa) cultivars from two different agroecological regions. Journal of the Science of Food and Agriculture 92(6): 1222-1229. [ Links ]
Hemalatha, P.; Bomzan, D.P.; Sathyendra, B.V.; Sreerama, Y.N. 2016. Distribution of phenolic antioxidants in whole and milled fractions of quinoa and their inhibitory effects on aamylase and a-glucosidase activities. Food Chemistry 199: 330–338 [ Links ]
Hirose, Y.; Fujita, T.; Ueno, N. 2010. Antioxidative properties and flavonoid composition of Chenopodium quinoa seeds cultivated in Japan. Food Chemistry 119: 1300-1306. [ Links ]
Holm, J.; Björck, I.; Asp, N-G.; Sjöberg, L-B.; Lundquist, I. 1985. Starch availability in vitro and in vivo after flaking, steam-cooking and popping of wheat. Journal of Cereal Sciences 3(3): 193-206. [ Links ]
INACAL (Instituto Nacional de Calidad-Perú). 2014. NTP 205.062:2014. Granos Andinos. Quinua. Requisitos. 2 (ed). Lima. Perú. 28 dic 2014. 15 pp. [ Links ]
INEI (Instituto Nacional de Estadística e informática). 2017. Medio Ambiente: Condiciones y calidad ambiental, condiciones físicas. Disponible en: https://www.inei.gob.pe/estadisticas/indice-tematico/a1-condiciones-fisicas-10234/ [ Links ]
INIA-Chile (Instituto de Investigaciones Agropecuarias Chileno). 2013. Programa nacional de recursos Fitogenéticos. Disponible en: http://www.inia.cl/recursosgeneticos/glosario [ Links ]
INIA (Instituto Nacional de Innovación Agraria-Perú). 2018. Encuentro Nacional de Granos Andinos. Disponible en: http://minagri.gob.pe/portal/datero/444-granos-andinos [ Links ]
Jancurová, M.; Minarovicová, L.; Dandár, A. 2009. Quinoa – a review. Czech Journal of Food Sciences 27(2): 71–79. [ Links ]
Jukanti, A.; Gaur, P.; Gowda, L.; Chibbar, R. 2012. Nutritional quality and health benefits of chickpea (Cicer arietinum L.): a review. British Journal of Nutrition 108: 11-16. [ Links ]
Koyro, H.W.; Eisa, S.S. 2008. Effect of salinity on composition, viability and germination of seeds of Chenopodium quinoa Willd. Plant and Soil. 302: 79–90. [ Links ]
Koziol, M.J. 1992. Chemical Composition and Nutritional Evaluation of Quinoa (Chenopodium quinoa Willd.). Journal of food composition and analysis 5: 35-68. [ Links ]
LASPAF (Laboratorio de Análisis de Suelos, Plantas, Aguas y Fertilizantes Universidad Nacional Agraria La Molina. Facultad de Agronomia). 2014. Informe de análisis de suelo. 1 pp. [ Links ]
Lamothe, L; Srichuwong, S; Reuhs, B.; Hamaker, B. 2015. Quinoa (Chenopodium quinoa W.) and amaranth (Amaranthus caudatus L.) provide dietary fibres high in pectic substances and xyloglucans. Food Chemistry 167: 490-496. [ Links ]
Lee, M.-J.; Sim, K.H. 2018. Nutritional value and the kaempferol and quercetin contents of quinoa (Chenopodium quinoa Willd.) from different regions. Korean Journal of Food Science and Technology 50(6): 680-687. [ Links ]
León, P.; Días, L.; Cea, M. 2004. Efecto del aporque en el rendimiento del cultivo del maíz. Revista Ciencias Técnicas Agropecuarias 13(2): 1-10. [ Links ]
Li, G.; Wang, S.; Zhu, F. 2015. Physicochemical properties of quinoa starch. Carbohydrate Polymers. 137 (10): 328-338. [ Links ]
Lovern, J.A. 1965. Quinoa (Chenopodium quinoa). Some analytical problems in the analysis of fish and fish products. Journal of the A.O.A.C. 48:60-68. [ Links ]
Martínez, R.D.; Cerrudo, A.; Andrade, F.; Cirilo, A.; Monzón, J.P.; Izquierdo, N. 2013. Effect of temperature during grain filling on the amylose/starch ratio in maize hybrids with different grain hardness. ASA, CSSA, and SSSA International Annual Meetings. Florida, Estados Unidos. [ Links ]
MINAGRI (Ministerio Nacional de Agricultura y Riego Perú). 2012. La quinua como oportunidad. Disponible en: http://quinua.pe/wp-content/uploads/2013/02/LA-QUINUA-COMO-OPORTUNIDAD-06-02.pdf. [ Links ]
Miranda, M.; Vega-Gálvez, A.; Uribe, E.; López, J.; Martínez, E.; Rodríguez, M.; Quispe, I.; Di Scala, K. 2011. Physico-chemical analysis, antioxidant capacity and vitamins of six ecotypes of chilean quinoa (Chenopodium quinoa Willd). Food Science. 1: 1439 – 1446 [ Links ]
Miranda, M; Vega-Gálvez, A; Martínez, E; López, J; Marín, R; Aranda, M.; Fuentes, F. 2013. Influence of contrasting environments on seed composition of two quinoa genotypes: nutritional and funcional properties. Chilean Journal of Agricultural Research 73(2): 108-116. [ Links ]
Mujica, A.; Ortiz, R.; Bonifacio, A.; Saravia, R.; Corredor, G.; Romero, A.; Jacobsen, S. 2006. Agroindustria de la Quinua (Chenopodium quinoa Willd.) en los Países Andinos. Proyecto Quinua: Cultivo Multipropósito par los Países Andinos INT/01/K01 Perú-Colombia-Bolivia. Editorial El Altiplano EIRL. Puno Perú [ Links ].
Navia, N.; Mollisaca, N.; Luis, G.; Gallardo, M.; Paty, E.; Salcedo, L. 2019. Hidrólisis enzimática en harina de quinua y tarwi por efecto de α-amilasa. Biotecnología en el sector agropecuario y agroindustrial 17(1): 64-73. [ Links ]
ODEPA (Oficina de Estudios y Políticas Agrarias, Chile). 2017. Estudio de la Situación actual de la cadena comercial de la quinoa en la región de Tarapaca. Santiago, Chile. 137 pp. [ Links ]
Pereira, E.; Encina-Zelada, C.; Barrosa, L.; Gonzales-Barrona, U.; Cadaveza, V.; Ferreira, I. 2019. Chemical and nutritional characterization of Chenopodium quinoa Willd (quinoa) grains: A good alternative to nutritious food. Food Chemistry 280: 110–114. [ Links ]
Razzeto, G.; Uñates, M.; Moreno, J.; Lucero López, R.; Aguilar, E.; Sturniolo, H.; Escudero, N. 2019. Evaluation and Comparative Study of the Nutritional Profile and Antioxidant Potential of New Quinoa Varieties. Asian Journal of Agricultural and Horticultural Research 3(3): 1-11. [ Links ]
Repo-Carrasco, R.; Espinoza, R.; Jacobsen, S. 2003. Nutritional Value and Use of the Andean Crops Quinoa (Chenopodium quinoa) and Kañiwa (Chenopodium pallidicaule). Food Reviews International. 19(1/2): 179–189. [ Links ]
Repo-Carrasco, R.; Encina, C. 2008. Determinación de la capacidad antioxidante y compuestos fenólicos de cereales andinos: Quinua (Chenopodium quinoa), Kañiwa (Chenopodium pallidicaule) y Kiwicha (Amaranthus caudatus). Revista de la Sociedad de Química del Perú 74(2): 85-99. [ Links ]
Repo-Carrasco, R.; Serna, L. 2011. Quinoa (Chenopodium quinoa Willd.) as a source of dietary fiber and other functional components. Food Science and Technology 31(1): 225-230. [ Links ]
Singleton V.; Rossi J. 1965. Colorimetry of total phenolics with phosphotungstic acid reagents. American Journal of Enology Viticulture 16: 2349-2351. [ Links ]
Srichuwong, S.; Jane, J.L. 2007. Physicochemical properties of starch affected by 457 molecular composition and structures. Food Science and Biotechnology 16: 663‒674. [ Links ]
Stoughton-Ens, M.; Hatcher, D.; Wang, N.; Warkentin, T. 2010. Influence of genotype and environment on the dietary fiber content of field pea (Pisum sativum L.) grown in Canada. Food Research International 43: 547-552. [ Links ]
Tapia, M. 1997. Cultivos Andinos Sub-explotados y su aporte a la Alimentación. FAO, Santiago, Chile. 273 pp. [ Links ]
Von Humboldt, A. 2017. Estación meteorológica Universidad Nacional Agraria La Molina. Disponible en: http://www.lamolina.edu.pe/FACULTAD/ciencias/CRFM/estacion/index.php/el-observatorio [ Links ]
Wahid, A.; Gelani, S.; Ashraf, M.; Foolad, M.R. 2007. Heat tolerance in plants: An overview. Environmental and Experimental Botany. 61: 199–223. [ Links ]
Wang, J. 1998. Improvement of citric-acid production by Aspergillus niger with addition of phytate to beet molasses. Bioresource Technol. 65: 243-45. [ Links ]
* Corresponding author
E-mail: jvaldez@lamolina.edu.pe (J. Valdez-Arana).
Received December 17, 2018.
Accepted April 2, 2019.