Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.2 Trujillo abr./jun. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.02.17
SHORT COMMUNICATION
Potencial bioquímico de metano de pollinaza adicionada con propionato en condiciones mesofílicas
Biochemical methane potential of chicken litter added with propionate in mesophilic conditions
Flor de María Guerrero-Toledo1; Teodoro Espinosa-Solares1 ORCID iD http://orcid.org/0000-0002-7581-0249; Nagamani Balagurusamy2 ORCID iD http://orcid.org/0000-0001-7818-2818; Diana Guerra-Ramírez1 ORCID iD http://orcid.org/0000-0001-9840-975X; David H. Huber3,4; Guadalupe Hernández-Eugenio5,* ORCID iD http://orcid.org/0000-0002-6305-997X
1 Universidad Autónoma Chapingo, Departamento de Ingeniería Agroindustrial, 56230, Texcoco, Estado de México, México
2 Universidad Autónoma de Coahuila, Escuela de Ciencias Biológicas, 27000, Torreón, Coahuila, México.
3 West Virginia State University, Gus R. Douglas Institute, 25112-1000, West Virginia, EUA.
4 West Virginia State University, Department of Biology, 25112-1000, West Virginia, EUA.
5 Universidad Autónoma Chapingo, Departamento de Irrigación, 56230, Texcoco, Estado de México, México.
Resumen
El objetivo del trabajo fue determinar el potencial bioquímico de metano de pollinaza en combinación con una alta concentración de propionato, empleando un consorcio microbiano previamente adaptado a elevadas cantidades de este metabolito. La pollinaza al 3 % de sólidos totales (ST) con 4895 ppm de propionato fue degradada en condiciones mesofílicas empleando microcosmos con un volumen de trabajo de 250 mL. Los resultados del rendimiento de metano acumulado indicaron un comportamiento triple sigmoidal; lo cual podría atribuirse a la diferencia en las velocidades de degradación de los componentes, tales como macromoléculas y ácidos grasos volátiles. El potencial bioquímico de metano fue de 364,52 mL CH4 gSValimentados-1.
Palabras clave: biogás; digestión anaeróbica; Potencial Bioquímico de Metano; modelo de Gompertz.
Abstract
The objective of the work was to determine the biodegradability potential of chicken litter in combination with a high concentration of propionate, using a microbial consortium previously adapted to high amounts of this metabolite. The chicken litter 3 % of total solids (TS) with 4895 ppm of propionate was degraded under mesophilic conditions using microcosms with a working volume of 250 mL. The accumulated methane yield results indicated triple sigmoidal behavior; which could be attributed to the difference in the degradation rates of the components, such as macromolecules and volatile fatty acids. The biochemical potential of methane was 364,52 mL CH4 gVSfe -1.
Keywords: anaerobic digestion; biogas; Biochemical Methane Potential; Gompertz model.
1. Introducción
La digestión anaeróbica es una biotecnología empleada para el manejo de residuos que emplea un consorcio de microorganismos muy diverso para convertir materia orgánica en biogás rico en metano, este proceso tiene lugar a través de una compleja cascada de reacciones impulsadas por microorganismos que incluyen hidrólisis, fermentación (es decir, acidogénesis y acetogénesis) y metanogénesis (Alvarado et al., 2014). La alta complejidad dentro del microbioma hace que el proceso sea vulnerable a la inestabilidad (perturbación) debido a la inhibición mediante la acumulación de ácidos grasos de cadena larga (AGCL), ácidos grasos volátiles (AGV), amoníaco libre y otros compuestos o condiciones operativas desfavorables, como la temperatura y el pH (Chen et al., 2014), estas perturbaciones pueden tener un impacto importante en las poblaciones microbianas, así como en el rendimiento del biorreactor. La presencia de altos niveles de ácidos grasos volátiles (AGV) disminuye el rendimiento en la producción de biogás; el propionato tiene un impacto perjudicial sobre los microorganismos metanógenos (Rétfalvi et al., 2011), modificando la abundancia de algunos grupos microbianos tales como bacterias sintróficas y géneros Acetanaerobacterium y Ruminococcus (Tian et al., 2015). En este sentido, uno de los retos más importantes es el control de la concentración de propionato mediante la degradación del mismo (Ahlert et al., 2016). Una alternativa para evitar la inhibición de la metanogénesis es obtener un consorcio microbiano resiliente ante la acumulación de propionato. El objetivo de este trabajo fue evaluar el potencial de biodegradabilidad de pollinaza adicionada con un alto nivel de propionato utilizando un consorcio microbiano capaz de degradar propionato, en condiciones mesofílicas, mediante un ensayo de potencial bioquímico de metano (PBM) usando el Modelo modificado de Gompertz ya que, de acuerdo al estudio realizado por Li et al. (2018), este modelo tuvo un mejor ajuste de datos en la determinación del PBM de la digestión anaeróbica de residuos de cultivos vegetales, comparado con el modelo cinético de primer orden y el modelo de Chen y Hashimoto.
2. Materiales y métodos
Ensayo experimental. Como sustratos se emplearon: pollinaza al 3% ST (Tepetlaoxtoc, México) y 4 895 ppm de propionato suministrado como propionato de sodio (Sigma Aldrich, EE.UU.). El experimento se llevó acabo en microcosmos con un volumen de 250 mL; el inóculo añadido fue del 10% (v/v), se obtuvo de un digestor que fue enriquecido durante 4 años con incrementos en la concentración de propionato en la alimentación (hasta 2 000 ppm de propionato de sodio). Los microcosmos fueron purgados con nitrógeno e incubadas a 37 °C ±1 °C durante 280 días.
Métodos analíticos. Sólidos totales (ST), sólidos volátiles (SV) y la demanda química de oxígeno (DQO) fueron determinados empleando métodos estándares (APHA, 2005) mientras que, el nitrógeno amoniacal (N-NH3) fue determinado mediante el método HACH 10031 (HACH, 2014). El pH fue medido con un potenciómetro (Thermo Scientific Orion 5 Star, Singapore), el perfil de AGV se determinó mediante el procedimiento descrito por Meneses-Reyes et al. (2017) utilizando un cromatógrafo de gases (Claurus 500, Perkin Elmer, E.U.A.) equipado con detector de ionización de flama (FID) y una columna capilar Elite-FFAP 30 m x 0,32 mm (Perkin Elmer, E.U.A.). Las condiciones de operación fueron las siguientes: flujo de gas acarreador (helio) 5 mL min-1 a 10,6 psi, temperatura del puerto de inyección de 150 °C, temperatura del horno de 100 °C y del detector de 250 °C. Se utilizaron estándares grado analítico de 9 ácidos grasos volátiles, acetato, propionato, isobutirato, butirato, isovalerato, valerato, isocaproato, caproato y heptanoato (46975-U, Brand Sigma-Aldrich, E.U.A.).
La producción de biogás fue cuantificada por el método de desplazamiento en agua salina 10% (v/v). El contenido de metano se determinó usando un cromatógrafo de gases (Claurus 500, Perkin Elmer, E.U.A.) equipado con detector de ionización de flama (FID), se tomaron muestras de biogás de 10 µL para ser inyectadas en el cromatógrafo bajo las siuientes condiciones de operación: se utilizó helio como gas acarreador a una velocidad de 14 mL min-1 a 14 psi y 100 °C, la temperatura del horno fue de 70 °C y del detector de 100 °C. El porcentaje de metano se obtuvo utilizando una curva de calibración con metano puro (HDSP No. P-4618-F, Praxair, México). El porcentaje de metano se reporta en condiciones estándares de presión y temperatura.
Modelado de la cinética de producción de metano. La producción de metano se ajustó al modelo modificado de Gompertz (Zwietering et al., 1990), el cual se puede observar en la ecuación 1:
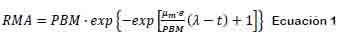
Dónde : rendimiento de metano acumulado y corresponde a la producción de metano acumulada (mL CH4 g-1sv alimentados), a un tiempo t (d); PMB: potencial bioquímico de metano (mL CH4 g-1sv alimentados); um tasabde producción de metano por día (mL NCH4 g-1sv alimentados d-1); e: base de logaritmos naturales (2,718282); : tiempo de la fase de latencia o retraso (d); : tiempo de digestión (d). El modelo se aplicó a cada una de las etapas de la digestión, sin embargo, λ se calculó únicamente en la primera etapa debido a que en la segunda y tercera etapa los microorganismos ya estaban adaptados; y PBM, solamente se consideró en la tercera etapa pues representa la producción total del proceso de digestión. Todos los modelos tuvieron un ajuste de 0,99 ± 0,005. Los parámetros del modelado se obtuvieron con el paquete SigmaPlot versión 13,0.
3. Resultados y discusión
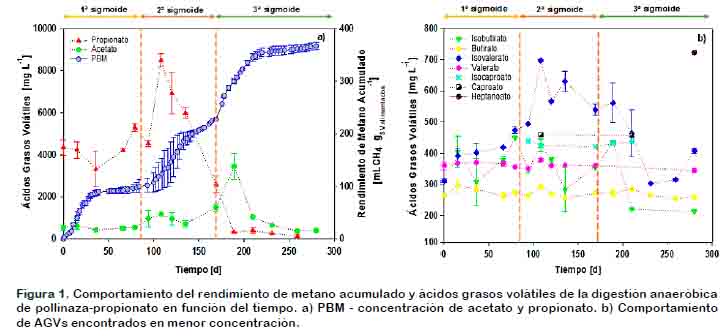
Las características químicas iniciales y finales para los microcosmos fueron las siguientes: C/N de 8,15 para A y B; pH inicial 8,12 para A y B, pH final 7,3 para A y 7.61 para B; DQO (mg L-1) inicial de 30326,89 para A y de 29970,57 para B, final de 20706,45 para A y 14649,15 para B; y NNH3 (mg L-1) incial de 267,45 para A y 267,80 para B, final de 475,95 y 680,30 para A y B respectivamente. El porcentaje de sólidos totales en la alimentación para A y B fue de 3,07%, mientras que la relación SV/ST (%) fue de 43,36 y 43,03 respectivamente. Con base en los resultados obtenidos se infiere que B tuvo una mayor degradación de sólidos totales ya que, presenta una mayor concentración de NNH3 (53,63% más) y una mayor reducción de DQO (59,26% más) en comparación con A. La producción de metano acumulado durante 280 días del experimento se muestra en la Figura 1, donde puede apreciarse un comportamiento de triple sigmoide. Cada sigmoide se analiza acontinuación.
Primera sigmoide: se pueden apreciar los tres periodos típicos de la curva de producción de metano: I) fase lag (tiempo necesario para obtener un 10% de degradación del sustrato); II) fase exponencial (expresada como la pendiente máxima de la curva de producción de metano) y III) fase estacionaria (acumulación asintótica de metano, rendimiento máximo de biodegradabilidad del sustrato); Con base en los resultados observados en la Figura 1 y el valor de µ en la primera etapa (λ = 4,33; µ = 3,86) se puede atribuir la primera sigmoide a una reducción en la concentración de propionato, acompañada de un aligera degradación del butirato e isobutirato, dando lugar a un incremento en la producción de metano. Además, en la fase estacionaria se observa que la concentración de propionato y de isovalerato se eleva, dando lugar a la segunda sigmoide.
Segunda sigmoide: en esta etapa solo se aprecian las fases exponencial y estacionaria (Figura 1). Esta etapa tiene un valor menor de µ (2,70), que puede ser atribuída a una inhibición en el proceso de producción de metano debido a la alta concentración de propionato, sin embargo, posiblemente este mismo es convertido a acetato por los microorganismos acetogénicos, por lo que se logra apreciar en la Figura 1a una disminución de este AGV acompañado de un incremento en la concentración de acetato, además, en la Figura 1b se observa que durante esta etapa existe una acumulación de isovalerato y en menor medida butirato y valerato, los cuales pueden ser convertidos a acetato, lo que permite que la producción de metano se incremente, dando origen a la tercera sigmoide.
Tercera sigmoide: En la Figura 1 se puede apreciar la fase exponencial y la fase estacionaria de esta etapa, las cuales fueron originadas en primer lugar por un incremento en la concentración de acetato (proveniente de la degradación de algunos AGVs en la segunda etapa) y, en segundo lugar por su evidente degradación así como del resto de los ácidos grasos volátiles originando que se alcance la mayor producción de metano.
En esta etapa existe un incremento en µm de 168% y 241% respecto a la primera y segunda sigmoide (valor de µ = 6,50) lo que implica que en esta etapa la velocidad de producción de metano fue mayor posiblemente debido a la disminución en la concentración de propionato en el sistema, lo que pudo ocasionar que se reestableciera la abundancia y diversidad de algunos grupos microbianos tales como bacterias sintróficas y géneros como Acetanaerobacterium y Ruminococcus de acuerdo con lo reportado por Tian et al. (2015).
De acuerdo con Yang et al. (2015), la concentración de ácidos grasos volátiles es un parámetro importante durante el proceso de digestión anaeróbica. Como se observa en la Figura 1, la concentración de AGVs cambia durante todo el experimento; estos cambios pueden deberse principalmente a la transformación de los compuestos orgánicos a ácidos grasos de cadena corta por microorganismos acidogénicos. Posteriormente, el acetato y los AGVs de cadena de más de 2 carbonos que son transformados a acetato por microorganismos acetogénicos, son convertidos a CH4 y CO2 por microorganismos metanogénicos. Por tanto, en la Figura 1 se puede observar que cuando la concentración de AGVs es elevada comienza a producirse una mayor cantidad de metano dando lugar a la siguiente sigmoide.
Se observó que el rendimiento de metano obtenido en esta prueba (PBM: 364,52 mL CH4 g-1SValimentados) fue 340% mayor que el alcanzado con pollinaza pura como sustrato por Meneses-Reyes et al. (2017) y 832,24% mayor que el obtenido a partir de la degradación de propionato de acuerdo a lo reportado por Jing et al. (2017). Este contraste en los resultados posiblemente sea consecuencia de las diferencias en la composición de la comunidad microbiana del inóculo utilizado en el proceso de digestión anaeróbica, lo que genera resultados diferentes en la biodegradabilidad de un sustrato como lo concluyó Raposo et al. (2012) al analizar y comparar diversos trabajos sobre biodegradabilidad anaeróbica de sustratos orgánicos. Asimismo, en un estudio realizado por Rodrigues et al. (2019) al comparar el PBM de diferentes fuentes de sustratos concluyeron que, aquellos provenientes de plantas, vegetales, cereales y estiércol muestran mejores rendimientos en la producción de metano (110 450 mL CH4 g-1SValimentados), debido a su contenido de materia orgánica y fracción biodegradable. Por otro lado, Acharya et al. (2015) al analizar el empleo de cultivos enriquecidos degradadores de propionato, acetato y butirato en el proceso de DA sugiere que aumentan la estabilidad del sistema, lo que se reflejaría en mejores rendimientos en la producción de metano. Esto demuestra que un cultivo microbiano adaptado a condiciones de estrés (resiliente) tiene una mayor capacidad de bio-convertir material orgánico en metano. Varios estudios encontraron que la adición de cultivos que utilizan propionato (Tale et al., 2015) o cultivos de degradación de AGVs (Acharya et al., 2015) podría reducir la acumulación de propionato y mejorar el proceso de digestión anaeróbica. Por otro lado, la tasa de producción de metano por día (μm) se ha identificado como un parámetro apropiado para evaluar la idoneidad del inóculo (Moreno-Andrade y Buitrón, 2004) de tal manera que la μm obtenida en el presente estudio es 42% mayor que la obtenida por Meneses-Reyes et al. (2017) y 34% mayor que la obtenida en el trabajo de Jing et al. (2017), lo que implica que se pueden obte-ner mejores resultados en la degradación del mismo sustrato (pollinaza o propionato) empleando un proceso en co-digestión y un inóculo adapatado a altas concentraciones de propionato, lo que también, se ve reflejado en un menor tiempo de latencia en comparación con los trabajos de pollinaza y propionato.
4. Conclusiones
Se determinó el potencial bioquímico de metano de pollinaza enriquecida con propionato (364,52 mL CH4 g-1SValimentados); el tiempo de latencia fue de sólo 4,33 d, lo cual podría indicar que el consorcio microbiano involucrado en el proceso de digestión anaeróbica estaba adaptado a altas concentraciones de propionato, por lo que es capaz de biodegradar este sustrato. Como recomendación para futuros trabajos, se sugiere hacer pruebas del inóculo utilizando diferentes sustratos y diferentes concentraciones de propionato.
Agradecimientos
Esta investigación fue apoyada por el Consejo Nacional de Ciencia y Tecnología de México (CONACYT) con el proyecto 288716 "Engineering methanogenic microbiomes to maximize bioenergy production from diverse biomass substrates" y la Universidad Autónoma Chapingo. El primerautor agradece al CONACYT por la beca otorgada para la realización de estudios de doctorado. Se agradece también a los integrantes del Laboratorio de Bioprocesos por los comentarios recibidos para la mejora del trabajo.
Referencias bibliográficas
Acharya, S.M.; Kundu, K.; Sreekrishnan, T.R. 2015. Improved stability of anaerobic digestion through the use of selective acidogenic culture. Journal of Environmental Engineering 141: 04015001. [ Links ]
Ahlert, S.; Zimmermann, R.; Ebling, J.; König, H. 2016. Analysis of propionate‐degrading consortia from agricultural biogas plants. MicrobiologyOpen 5: 1027-1037. [ Links ]
Alvarado, A.; Montañez-Hernández, L.E.; Palacio-Molina, S.L.; Oropeza-Navarro, R.; Luévanos-Escareño, M.P.; Balagurusamy, N. 2014. Microbial trophic interactions and mcrA gene expression in monitoring of anaerobic digesters. Frontiers in Microbiology 5: 597. [ Links ]
APHA. 2005. Standard methods for the examination of water and wastewater. American Public Health Association (APHA): Washington, DC, USA. [ Links ]
Chen, J.L.; Ortiz, R.; Steele, T.W.J.; Stuckey, D.C. 2014. Toxicants inhibiting anaerobic digestion: a review. Biotechnol. Adv. 32 (8): 1523–1534. [ Links ]
HACH. 2014. Hach Water Analysis Handbook. Method 10031. Colorado, USA. [ Links ]
Jing, Y.; Wan, J.; Angelidaki, I.; Zhang, S.; Luo, G. 2017. iTRAQ quantitative proteomic analysis reveals the pathways for methanation of propionate facilitated by magnetite. Water research 108: 212-221. [ Links ]
Li, P.; Li, W.; Sun, M.; Xu, X.; Zhang, B.; Sun, Y. 2018. Evaluation of Biochemical Methane Potential and Kinetics on the Anaerobic Digestion of Vegetable Crop Residues. Energies 12(1): 26. [ Links ]
Meneses-Reyes, J.C.; Hernández-Eugenio, G.; Huber, D.H.; Balagurusamy, N.; Espinosa-Solares, T. 2017. Biochemical methane potential of oil-extracted microalgae and glycerol in co-digestion with chicken litter. Bioresource Technology 224: 373-379. [ Links ]
Moreno-Andrade, I.; Buitrón, G. 2004. Influence of the origin of the inoculum on the anaerobic biodegradability test. Water Science and technology 49: 53-59. [ Links ]
Raposo, F.; De la Rubia, M.A.; Fernández-Cegrí, V.; Borja, R. 2012. Anaerobic digestion of solid organic substrates in batch mode: an overview relating to methane yields and experimental procedures. Renewable and Sustainable Energy Reviews 16: 861-877. [ Links ]
Rétfalvi, T.; Tukacs-Hájos, A.; Albert, L.; Marosvölgyi, B. 2011. Laboratory scale examination of the effects of overloading on the anaerobic digestion by glycerol. Bioresource Technology 102(8): 5270-5275. [ Links ]
Rodrigues, R.P.; Rodrigues, D.P.; Klepacz-Smolka, A.; Martins, R.C.; Quina, M.J. 2019. Comparative analysis of methods and models for predicting biochemical methane potential of various organic substrates. Science of The Total Environment 649: 1599-1608. [ Links ]
Tale, V.P.; Maki, J.S.; Zitomer, D.H. 2015. Bioaugmentation of overloaded anaerobic digesters restores function and archaeal community. Water Research 70: 138-147. [ Links ]
Tian, Z.; Zhang, Y.; Li, Y.; Chi, Y.; Yang, M. 2015. Rapid establishment of thermophilic anaerobic microbial community during the one-step startup of thermophilic anaerobic digestion from a mesophilic digester. Water Research 69: 9-19. [ Links ]
Yang, G.; Zhang, P.; Zhang, G.; Wang, Y.; Yang, A. 2015. Degradation properties of protein and carbohydrate during sludge anaerobic digestion. Bioresource technology 192: 126-130. [ Links ]
Zwietering, M.H.; Jongenburger, I.; Rombouts, F.M.; Van’t Riet, K. 1990. Modeling of the bacterial growth curve. Applied Environmental Microbiology 56: 1875–1881.
* Corresponding author
E-mail: ghernandeze@taurus.chapingo.mx (G. Hernández-Eugenio).
Received February 27, 2019.
Accepted May 26, 2019.