Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.3 Trujillo jul./set. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.03.01
ARTÍCULO ORIGINAL
Adsorción del cianuro contenido en solución acuosa usando carbón activo obtenido de residuo de café: eficiencia de absorción, modelado de equilibrio y cinética
Adsorption of cyanide contained in aqueous solution using activated carbon obtained from coffee residue: absorption efficiency, equilibrium and kinetic model
Gonzalo Aranguri-Llerena* ORCID iD: https://orcid.org/0000-0001-5506-9281 ; Wilson Reyes-Lázaro
Universidad Nacional de Trujillo. Av. Juan Pablo II s/n – Ciudad Universitaria, Trujillo, Perú.
Resumen
Esta investigación tuvo como objetivo, evaluar el proceso de adsorción del CN- contenido en solución acuosa sintética, usando carbón activo obtenido de residuo de café; estudiando su eficiencia y los modelos de equilibrio y cinético. Análisis de infrarrojo con transformada de Fourier (FTIR), difracción de rayos X (DRX) y determinación del número de yodo se realizaron para caracterizar al carbón activo. Se aplicó un diseño central compuesto (DCC) con tres factores adaptados a tres niveles cada uno y 6 puntos centrales para estudiar el efecto del pH (A), el tiempo de contacto (B) y la dosificación de adsorbente (C); según el análisis de varianza, todos los factores principales y la interacción AA fueron significativas en la eficiencia de adsorción de cianuro sobre el carbón activo, cuyo valor máximo alcanzado fue de 54,68% y de 67,65% para el nivel predictivo. De acuerdo al coeficiente de determinación (R2), el modelo isotérmico de Freundlich (0,954) y las tres ecuaciones cinéticas de pseudo segundo orden (0,991, 0,993, 0,993) se ajustaron al proceso experimental. De los resultados obtenidos, el carbón activo preparado de residuo de café puede ser utilizado como potencial adsorbente de CN-, contenido en soluciones acuosas de bajas concentraciones.
Palabras clave: Adsorción; carbón activo; cianuro; isotermas; residuos de café.
Abstract
This research aimed to evaluate the adsorption process of CN- contained in synthetic aqueous solution, using activated carbon obtained from coffee residue; studying its efficiency and equilibrium and kinetic models. Fourier transform infrared analysis (FTIR), X-ray diffraction (DRX) and iodine number determination were performed to characterize activated carbon. A composite central design (DCC) with three factors adapted to three levels each and 6 central points was applied to study the effect of pH (A), contact time (B) and adsorbent dosage (C); According to the analysis of variance, all the main factors and the AA interaction were significant in the adsorption efficiency of cyanide on activated carbon, whose maximum value reached was 54.68% and 67.65% for the predictive level. According to the coefficient of determination (R2), Freundlich's isothermal model (0.954) and the three kinetic equations of pseudo second order (0.991, 0.993, 0.993) were adjusted to the experimental process. From the results obtained, the active carbon prepared from coffee residue can be used as a potential adsorbent of CN-, contained in aqueous solutions of low concentrations.
Keywords: Adsorption; active carbon; cyanide; isotherm; coffee waste.
1. Introducción
El CN- es uno de los químicos tóxicos que se encuentran en las descargas de aguas residuales de la galvanoplastia, acabado de metales, temple de acero, minería (extrac- ción de metales como el oro y la plata), fabricación de piezas de automóviles, foto- grafía, farmacéuticos y unidades de procesamiento del carbón (Dwivedi et al., 2014), alimentos y síntesis química (nylon, fibras, resinas, fertilizantes, pesticidas y herbi- cidas) (Halet et al., 2015). Se ha estimado que la liberación de cianuro de las industrias es de más de 14 millones de kg/año en el mundo (Gupta et al., 2012) y puede existir en tres formas: cianuro total (CNT), cianuro WAD (Weak acid disociable) y cianuro libre (CNL). El CNT incluye: los complejos fuertes, como los cianuros de hierro ( [Fe(CN)6]3-, [Fe(CN)6]4-), de oro ([Au(CN)2]- y cobalto ([Co(CN)6]4-) y al cianuro WAD (CN WAD); que comprende a la vez: CNL y los complejos metálicos de cianuro débil y moderadamente fuertes; como el de cadmio ([Cd(CN)4]2-), zinc ([Zn(CN)4]3-, cianuros de cobre ([Cu(CN)2]-, [Cu(CN)3]2-, [Cu(CN)4]3-), de níquel ([Ni(CN)4]2-) y plata ([Ag(CN)2]-); el CNL incluye: CN- y el cianuro de hidrógeno (HCN) (Aranguri y Reyes-lópez, 2018).
El cianuro cuando se emite en concen- traciones que sobrepasan las regulaciones ambientales, constituye un compuesto muy peligroso para el ser humano, organismos acuáticos y el medio ambiente en general, porque ejerce una acción inhibidora sobre ciertas enzimas metabólicas; el principal compuesto afectado es la enzima citocromo c oxidasa; su inhibición origina el bloqueo de la cadena de transporte de electrones a nivel mitocondrial, evitando la absorción del oxígeno (Luque-Almagro et al., 2016). Según Azamat y Khataee (2017); entre 0,5 y 3,5 mg de cianuro por kilogramo de masa corporal en las personas, puede causar la muerte.
La Agencia de Protección Ambiental de los Estados Unidos (USEPA), ha propuesto una reglamentación para las aguas potables y las aguas acuáticas con respecto al CNT de 0,2 y 0,05 mg/L, respectivamente y en términos de CNL para la protección de la vida acuática en agua dulce lo establece en 0,022 y 0,0052 mg/L (Botz et al., 2016). La normatividad peruana para los estándares de calidad del agua (D. S. N° 002 -2008 – MINAM), establece el CN WAD en 0,1 mg/L (categoría 3: riego de vegetales y bebidas de animales) y para CNL en 0,022 mg/L (categoría 4: conservación del ambiente acuático).
Las emisiones líquidas que contienen cianuro sobre los límites permisible, son tratadas por métodos convencionales de tipo químico como: la cloración alcalina, el proceso INCO (SO2/aire) (International Nickel Company`s), peróxido de hidrógeno, el método del ácido de Caro (H2SO4/H2O2), ozonización, osmosis inversa, carbón activado, resinas, entre otros (Aranguri y Reyes-lópez, 2018; Botz et al., 2016); sin embargo para Dwivedi et al.
(2014) los procesos químicos para degradar cianuro no son apropiados para las perspectivas ambientales y económicos; por su elevada demanda de productos químicos y la formación de contaminantes secundarios, que necesitan un tratamiento adicional antes de su eliminación y sostiene que la adsorción es un método simple y atractivo para la eliminación de compuestos tóxicos de efluentes debido a su alta eficiencia, fácil manejo y factibilidad económica.
Según referencias bibliográficas, varios adsorbentes han sido estudiados; con y sin tratamiento para adsorber CN-; a saber: hueso de aceituna y residuos de café molido (Halet et al., 2015), cáscara de semilla de Karité (Tsunatu et al., 2015), cascara de coco (Singh y Balomajumder, 2016), cáscara de arroz (Naeem et al., 2011), cáscara de almendra y hojas de teca (Dwivedi et al., 2016), carbón activo (D 45/2 - Carbo Tech) (Stavropoulos et al., 2015) y en el presente estudió, se utilizó carbón activo, preparado a partir del residuo de café; se exploró un método poco estudiado en la carbonización y activación del precursor; no se usó gas nitrógeno para generar atmósfera inerte.
Según la organización mundial del café, en el año 2018, la producción mundial de café fue de 168,093 millones de sacos de 60 kilos. Su procesamiento genera cantidades significativas de residuos agrícolas, que van del 30% al 50% del peso del café total producido, dependiendo del tipo de proce- samiento (Oliveira y Franca, 2015). Según Mussatto et al. (2011), aproximadamente el 50% de la producción mundial de café se procesa para la preparación de café soluble y los residuos de café molido están en el orden de 6 millones de toneladas por año, a nivel mundial. Se pretende dar un valor agregado a estos residuos.
Así, el propósito del presente trabajo fue, evaluar el proceso de adsorción del cianuro, contenido en solución acuosa; sobre carbón activo, obtenido de residuo de café; estudiando su eficiencia, así como, los modelos de equilibrio y cinético.
2. Materiales y métodos
2.1 Preparación del carbón activo del residuo de café (CARC)
El residuo (luego de tostado, molido y extraído sus saborizantes), de la variedad de Coffea arabica, producida en la pro- vincia de Chanchamayo, Perú, fue colec- tada de cafetería "Valentino" (Mercado Central de Trujillo, Perú); se lavó con agua de caño para eliminar polvo, impurezas y sustancias solubles; seguidamente se lavó con agua destilada hervida, hasta que desaparezca la tintura negra y se secó a 11 °C por 8 h en una estufa Memmert Universal Oven UF55. Posteriormente, se experimentó la carbonización y activación química a 500 y 450 °C respectivamente; en crisoles de arcilla refractaria, provistos de tapa (Guang-zhen et al., 2016); contenidos en una mufla eléctrica Barnstead Thermolyne 6000, durante 1 h para cada etapa. No se usó gas nitrógeno para generar condiciones inertes, se provisionó de su respectiva tapa a cada crisol para evitar atmósfera oxidante.
Previo a la activación química; al carbón se aplicó la impregnación química, con una disolución de ácido fosfórico (H3PO4) (Halet et al., 2015; Shamsuddin et al., 2016) al 40%; se adicionó 3 mL de ácido fosfórico para cada gramo de carbón (3 (v/p) (Reffas et al., 2010) fueron agitados durante 15 horas a 80 °C.
El rendimiento y el burn off en el proceso de carbonizado, fueron medidos de acuerdo a (Reffas et al., 2010). El rendimiento de carbonización o grado de conversión a carbón (Ecuación 1), es el porcentaje del producto obtenido luego de la carbonización con respecto al peso seco del precursor empleado y el burn off o perdida por combustión (Ecuación 2), es el porcentaje de precursor eliminado durante el proceso de carbonización (Fombuena y Valentín, 2010).
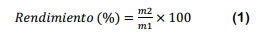
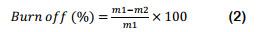
Donde: m1= masa de precursor inicial y m2 = masa de carbón obtenido.
El CARC fue reducido y clasificado a un tamaño de partícula entre +74 y -500 micrones, lavado con agua destilada hasta un pH neutro y secado a 150 °C por 6 h.
2.2. Caracterización del adsorbente
Se determinó los grupos funcionales presentes en las superficies del residuo de café; a su respectivo CARC y al CARC luego de adsorber CN-, aplicando un análisis FTIR en fase sólida, utilizando un espectrómetro ATR Thermo Nicolet IS50 FT-IR. Con la finalidad de identificar la naturaleza amorfa y los óxidos metálicos presentes en el CARC; se realizó un análisis DRX, usando el Difractómetro marca Rigaku, modelo Miniflex 600. Así mismo se le determinó su número de yodo, de acuerdo a NMX-F-296- SCFI, 2011 y ASTM-D4607, 2006. Para los tres análisis, las muestras fueron reducidas a un tamaño de -75 micrones.
2.3 Optimización de la eficiencia de adsorción
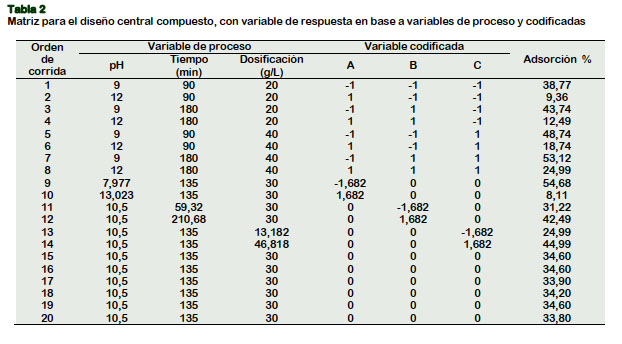
Se planteó el DCC; sus variables independiente y sus respectivos niveles, que determinaron las respuestas del porcentaje de adsorción (Y), figuran en la Tabla 2. Las pruebas de adsorción del CN- (mg/L), fueron realizadas en forma aleatoria; sus resultados fueron evaluados usando el software estadístico Minitab 18, con un nivel "α" de 5% y la eficiencia de adsorción fue calculada de acuerdo a la Ecuación 3.
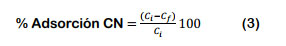
Donde Ci y Cf, representan la concentración inicial y final de CN- (mg/L), para cada prueba, respectivamente.
2.4 Modelo de equilibrio y cinético
Con la finalidad de describir la interacción entre las moléculas de CN- y las superficies de las partículas del CARC, así como iden- tificar una ecuación modelo para predecir la adsorción de equilibrio del CN- por el CARC, se probaron los datos experimentales de equilibrio, con los modelos isotérmicos de Freundlich, Langmuir y Temkin. Para expresar las características eseciales de la isoterma de Langmuir, se usó el factor de separación o parámetro de equilibrio "R", que es una constante sin dimensiones (Ecuación 4).
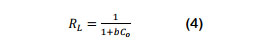
Donde: b es la constante de Langmuir y Co es la concentración inicial de CN- (mg/L). RL indica las condiciones de la isoterma. Si, RL > 1 (desfavorable), RL = 1 (adsorción lineal), RL=0 (irreversible) y si 0<RL<1 (favorable) (Eletta et al., 2016; Gupta et al., 2013).
Se evaluó la eficiencia de transferencia de masa del CN- al CARC, aplicando los modelos pseudo primer y segundo orden. Para determinar si la difusión intrapartícula fue la etapa de limitación para la adsorción de cianuro sobre el CARC, los datos experimentales se ajustaron al modelo de Weber-Morris.
Para el estudio de equilibrio y cinético se midieron las concentraciones de soluciones de CN- y se calculó la capacidad de adsorción en el equilibrio, qe (mg/g); así como la capacidad de adsorción de CN- en el tiempo t, qt (mg/g) para intervalos de tiempo predeterminados; de acuerdo a Ecuación 5 y Ecuación 6.
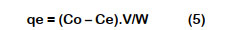
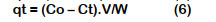
Donde Co (mg/L) es la concentración inicial de CN-; Ce (mg/L) es la concentración de CN- en el equilibrio; Ct (mg/L) es la concen- tración CN- de la solución de cianuro en el momento t (min); V (L) el volumen de la solución de cianuro y W (g) la cantidad de carbón activo (Halet et al., 2015).
La Tabla 1 muestra las formas lineales para las ecuaciones de equilibrio y cinético adaptadas de (Dwivedi et al., 2014) y de (Tsunatu et al., 2015). Las pruebas para el modelo de isoterma y cinéticos, se desarrollarán a condiciones ambientales (30 °C), usando 50 ml de solución sintética de pH 8 con 1,5 g de adsorbente, contenidos en matraces de 250 ml. Las concentraciones conocidas para cada prueba, fueron diluidas a partir de una solución stock de cianuro de 1000 mg/L de CN- y filtradas para su respectivo análisis. Se utilizó un orbital shaker IKA WORKS KS, para toda prueba de agitación.
2.5. Mediciones analíticas y de pH
Dependiendo de la concentración de la solución, el CN- se determinó, bien por el método de electrodo selectivo de ion cianuro o por titulación; para este último se consideró, el "método A" de Vogel (Vogel, 1989) y Standard Methods 4500-CN-D (Greenberg et al., 1992) con la adaptación de una concentración de nitrato de plata (AgNO3) de 2 g/L (0,01 M) y como indicador rodamina (p-dimetilaminobenzalrodanina) en una concentración de 0,1 g/100 mL de acetona. Para el método de electrodo selectivo de cianuro, se utilizó un multiparámetro Thermo Scientific, Orión Versa Star Pro y un electrodo para ion especifico de cianuro, modelo Thermo Scientific, Orión 9606 BNWP. Las lecturas potenciométricas se realizaron sobre un agitador magnético IKA WORKS, modelo C- MAG-HS7. El pH de todas las soluciones se reguló por adición de soluciones de HCl ó NaOH (10 y 1 N para ambos) y fueron medidos utilizando un electrodo marca Thermo Scientific Orión.
3. Resultados y discusión
3.1 Preparación del CARC
Se evaluó el rendimiento y el burn off para la carbonización (14,73% y 85,27%) y acti- vación química (72,86% y 27,14%) del resi- duo de café a 500 y 450 °C, respectiva- mente. Molina-Sabio y Rodríguez-Reinoso (2004) refieren, que en la carbonización de materiales lignocelulósicos, la degradación del precursor toma lugar entre 200 a 350 °C; para el experimento estudiado, ocurrió a una temperatura promedio de 310 °C. El rendimiento de a carbonización (14,73%); es relativamente superior a lo experimentado por Reffas et al. (2010), quien da un valor de 9,7% para simple carbonizaciones del mis- mo material; esto podría ser por diferencia en la temperatura de carbonización.
El rendimiento obtenido en la etapa de activación química es alto (72,86%); compa- rado con el rendimiento de 50% encontrado por Al Bahri et al. (2012) en la activación de semillas de uvas impregnas con H3PO4 (3 p/v), en una sola fase y al 38 y 32% de Reffas et al. (2010) para su activación química con H3PO4 de un solo paso a 450 °C, para residuos de café molido a diferentes ratios de impregnación; esta notable diferencia se debería a que en la primera fase de carbonización del residuo de café, se expulsaron la mayor cantidad de material volátil.
3.2 Caracterización del adsorbente
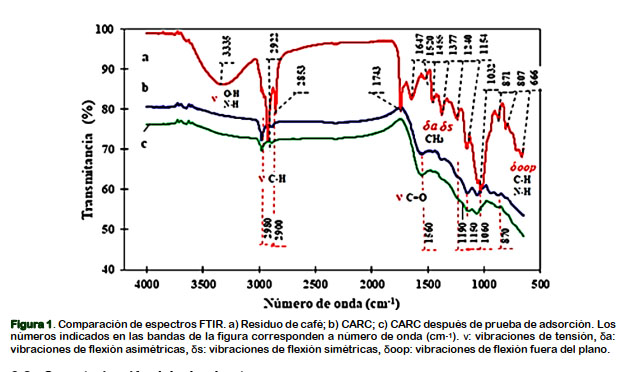
El análisis FTIR del precursor (Figura 1a) revela que tiene una banda ancha debido a la formación de puentes de hidrógeno, con un pico alrededor de 3335 cm-1 y está relacionado con la vibración tipo tensión de los grupos hidroxílicos O-H, traslapado con uniones N-H: alcoholes-fenoles, carboxilo y amino (Reffas et al., 2010), que se corro- bora por la formación de señales a 1154 y 1032 cm-1 para fenoles y alcoholes. La formación de dos bandas agudas a 2922 y 2853 cm-1, se atribuye a la vibración de tensión C-H (alcanos) (Ma y Ouyang, 2013). Los picos a 1743 y 1647 cm-1 se asignan a las vibraciones de tensión C=O en los ácidos carboxílicos, anhídridos y lactonas (Imessaoudene et al., 2016) y del grupo acetilo en la hemicelulosa (Shamsuddin et al., 2016). Las bandas a 1455 y 1377-1240 cm-1 se atribuyen a las flexiones asimétrica y simétricas del grupo CH3; la banda a 1240 cm-1 también se le asocia al estiramiento C- O del grupo arilo en la lignina (Shamsuddin et al., 2016). Las señales entre 666 y 871 cm-1 corresponden a vibraciones de flexión fuera del plano (Rattanapan et al., 2017) y de los grupos amino N-H y aromáticos C-H (Reffas et al., 2010). Similares bandas han sido reportadas por Ballesteros et al. (2014) y Liu et al. (2015), quienes coinciden en sus análisis FTIR, que la borra de café presenta bandas de adsorción de materiales lignocelulósicos.
La Figura 1b muestra el espectro FTIR del CARC; se aprecia que el precursor ha sufrido modificaciones importantes en su estructura que nos sugiere la carbonización completa del precursor al someterlos al proceso de activación. Los compuestos volátiles y orgánicos se han descompuesto o eliminado, resultando una eficiente modificación de la superficie del carbón (Ma y Ouyang, 2013; Rattanapan et al., 2017). La banda ancha del precursor entre 3600 y 3050 cm-1, así como las bandas agudas a 2922, 2853, 1743 y a 1032 cm-1 prácticamente han desaparecido. Solo han quedado un pequeño pico de débil intensidad alrededor de 2980 y 2900 cm-1 productos del estiramiento alifático C-H en un grupo metoxilo aromático (Reffas et al., 2010; Xu et al.,2014) y los picos observados alrededor de 1560 y 1150-1060 cm-1 son debido a las vibraciones tipo tensión C=C y C-C respectivamente. La banda con pico en 1560 cm-1 esta superpuesta con la vibración de flexión del grupo N-H (aminas y amidas). Los picos a 1150-1060 cm-1 está relacionado con la superposición de las vibraciones de tensión C-O de éteres, ésteres (Rattanapan et al., 2017) con hombro a 1190 cm-1; son señales características de compuestos fosforocarbonáceos presentes en los carbones activados con ácido fosfórico (Reffas et al., 2010). La señal a 870 cm-1 está relacionada con las vibraciones de flexión fuera del plano C=C-H (Rattanapan et al., 2017).
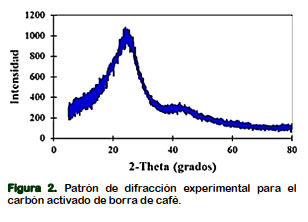
El espectro de la Figura 1c, no ha sufrido cambios importantes en la posición de sus picos con respecto a Figura 1b; sin embargo, ha sufrido un ligero desplazamiento a menores valores del porcentaje de transmitancia. Puede ser debido a la adsorción del CN- sobre el carbón activo. De acuerdo al DRX (Figura 2) se observa dos picos de difracción fuertes y amplios a 23,58° y 43,6° en la escala 2-theta, que corresponde a los planos (002) y (101) del carbono grafítico (Rawal et al., 2018), que son características dominantes y comunes de carbones amorfo (Awasthi et al., 2018; Herrera et al., 2018).
Según Gupta et al. (2013), los patrones de difracción de rayos X en el pico amplio de 15° a 35 indica la presencia de sílice amorfa y wairakita de alúmina (CaAl2 (SiO3)4.2H2O), mordenita (Ca, Na2K2) Al2Si10O24.7H2O, ferroaxinita (Ca2Al2BSi4O15OH), latiumita (Ca, K2)8Al8 (Si, Al)7O25 (SO3) y varios otros óxidos de calcio y aluminio.
Se determinó el número de yodo del CARC en 215,15 mg I2/g; como un índice del área de la superficie; es relativamente bajo, se presume que se debió a la impregnación con H3PO4 luego de la carbonización, por lo que algunos sitios activos fueron ocupados por las moléculas del mencionado ácido. Sin embargo, el carbón en estudio si presenta una aceptable capacidad de adsorción de CN- a un pH de 8. En contraste para similar soporte, Halet et al., (2015) encontraron el número de yodo en 460 mg I2/g, la diferencia pudo ser, al uso de una mayor temperatura de activación (700 °C); según Ghanizadeh y Asgari (2010) lo determinaron en 134,44 mg I2/g para el carbón de hueso sin ninguna impregnación.
3.3 Optimización de la eficiencia de adsorción
El DCC se aplicó con tres factores adaptados a tres niveles cada uno y 6 puntos centrales; se estudió el efecto del pH, el tiempo de contacto y la dosificación del CARC, sobre la eficiencia de adsorción del CN-. Los porcentajes de adsorción obtenidos de los experimentos, se ingresaron como respuesta a la matriz generada a partir del DOE (Minitab 18) de acuerdo a la Tabla 2. Los datos fueron analizados utilizando la metodología de superficie de respuesta (RSM) a partir de la cual se derivó un análisis de varianza ajustado; donde todos los factores principales y la interacción AA así como los coeficientes de la Ecuación 7, fueron significativos (valor p < α=0,05). Los valores F significativos indicaron la idoneidad del modelo y el cuadrado del coeficiente de regresión (98,60%) sugiriere que el modelo estudiado fue significativo y consistente.

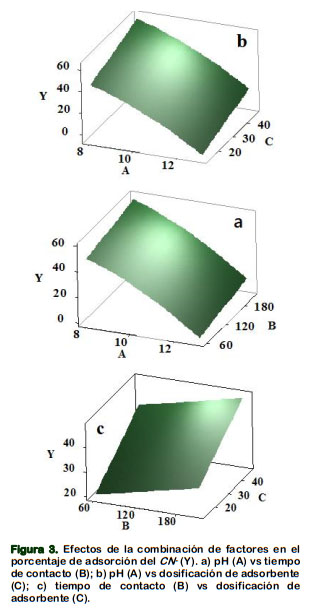
La Figura 3 muestra las gráficas 3D de la superficie de respuesta, que estima los valores óptimos para los tres factores en estudio. Así, la Figura 3a muestra el efecto combinado del pH y el tiempo de contacto; la adsorción incrementó hasta un 55% , cuando el pH bajó a 8 y el tiempo de contacto se incrementó hasta 220 minutos.
La Figura 3b muestra el efecto combinado del pH y la dosificación del CARC; se notó que cuando el pH bajó a 8 y la dosificación incrementó a 50 g/L, se logró un porcentaje de adsorción de 55% aproximadamente. La Figura 3c representó el efecto combinado del tiempo de contacto y la dosificación de reactivo; se obtuvo el menor porcentaje de adsorción de 45% aproximadamente, cuando el tiempo de contacto y la dosis de adsobente incrementaron hasta alrededor de 220 minutos y de 50 g/L respectivamente. Similares tendencias obtuvo Eletta et al. (2016) para los efectos de la combinación de su factores al usar cascara de huevo calcinado para la adsorción de cianuro.
De acuerdo a la MSR; el máximo ajuste para la adsorción del CN- de 67,65%, se logró con un pH de 7,98, tiempo de contacto de 210,68 minutos y dosificación de 46,82 g/L del CARC; similar tendencia para un pH de 8, obtienen Gebresemati et al. (2017) en el mejoramiento de la adsorción de cianuro por cáscara de café.
3.4 Modelo de equilibrio y cinético
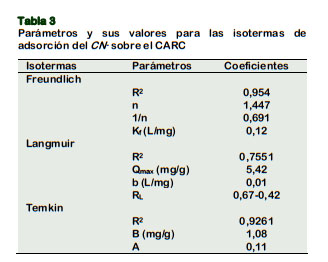
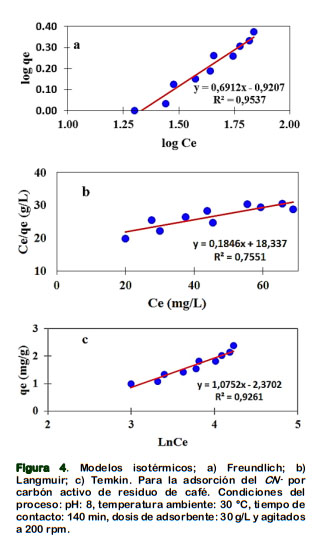
La Tabla 3 muestra los valores experimentales de las isotermas de equilibrio estudiados: modelo de Freundlich (Figura 4a), Langmuir (Figura 4b) y Temkin (Figura 4c). Los datos experimentales se obtuvieron a temperatura ambiente (30 °C), pH de 8, usando 50 mL de solución con concentraciones iniciales de 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 mg de CN- /L y 1,5 g de adsorbente; agitados a 200 rpm durante 140 min.
Los valores R2 están en el siguiente orden: Freundlich (0,954) > Temkin (0,9261) > Langmuir (0,7551); nos sugiere que los valores experimentales de la adsorción de CN- sobre el CARC, se ajustan al modelo de Freundlich; su valor de n>1, respalda que la adsorción del CN- es favorable y ocurrió en multicapas (fisiosorción) ; esto de acuerdo con Tsunatu et al. (2015) y Halet et al. (2015); ambos encuentran que sus datos se ajustan al modelo de Temkin y Freundlich, refieren que la adsorción de CN- no ocurrio en monocapa.
Para la isoterma de Langmuir, se encontró que la capacidad máxima de adsorción en monocapa, fue de 5,42 mg CN-/g de CARC; su valor 0< RL (0,67) <1 nos indica que la adsorción es favorable, acorde con Mondal et al. (2019) y Tsunatu et al. (2015) que encontraron, valores experimentales de 0<RL<1 al remover cianuro con carboncillo de coque y cáscara de semilla de karité respectivamente. Sin embargo la capa- cidad máxima de adsorción obtenida en el equilibrio; es relativamente baja, compa- rado con el resultados obtenidos por Halet et al. (2015) y de Stavropoulos et al. (2015); el primero al emplear carbón activo de similar soporte obtiene 20,04 mg CN-/g a 20°C; se debería, que aplicó mayor tem- peratura (700 °C) y tiempo de activación (2 h); el segundo, al usar carbón activo D45/2 - Carbo Tech obtiene capacidades máximas de adsorción de 28,3 y 21, 25 mg CN-/g, para 20 °C y 30 C° respectivamente y refiere que a baja capacidad de adsorción hay un mecanismo de adsorción débil entre el cianuro y el carbón.
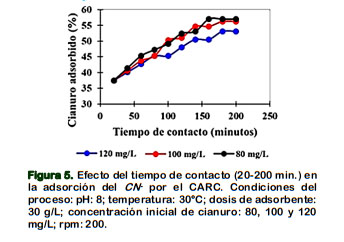
Se estudió el efecto del tiempo de contacto (Figura 5). Los resultados experimentales de las concentraciones de equilibrio (Ce) se desarrollaron a temperatura ambiente (30°C), con diferentes tiempos (20 - 200 min) y concentraciones iniciales de 80, 100 y 120 mg/L a pH de 8. La adsorción del cianuro sobre el CARC, fue muy gradual y el porcentaje de cianuro adsorbido in- crementó, para las bajas concentraciones iniciales. Esto es, la eficiencia de adsorción dependió de la concentración inicial del cianuro (Asgari et al., 2012), esto se explica por la saturación de los sitios activos del CARC a medida que la concentración de CN- es mayor en la solución (Eletta et al., 2016; Dwivedi et al., 2016).
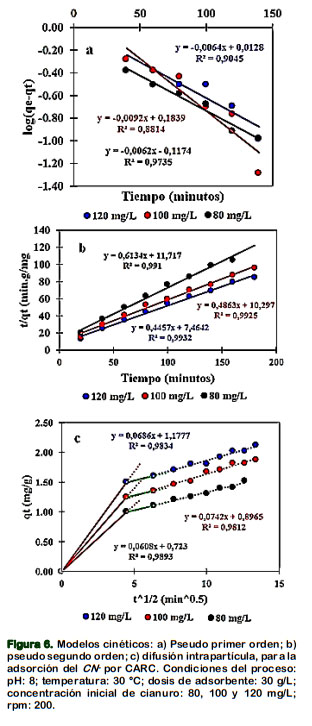
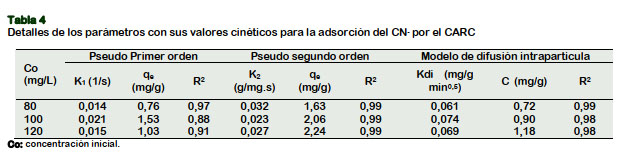
La cinética de adsorción del CN- sobre el CARC, fue estudiada de acuerdo a modelos cinéticos de pseudo primer (Figura 6a) y segundo orden (Figura 6b), así como del modelo de difusión intrapartícula (Figura 6c).
Los parámetros cinéticos con sus resultados (Tabla 4), sugieren que la cinética de adsorción del CN- sobre el CARC, se ajusta al modelo pseudo segundo orden. Para las tres concentraciones iniciales en estudio (80, 100, y 120 mg/L), sus valores R2 de las tres ecuaciones: 0,991, 0,993, 0,993, son mayores a los R2 del modelo de difusión intrapartícula (0,989, 0,981, 0,983) y al de pseudo primer orden (0,974, 0,881, 0,905. Eletta et al. (2016) y Tsunatu et al. (2015), en sus estudios encontraron que los modelos cinéticos de pseudo segundo orden explicaba la adsorción del cianuro sobre la cáscara de huevo calcinado y el carbón de cáscara de semilla de Karité, respectivamente.
La Figura 6c, representa la correlación de los datos experimentales a tres concentraciones iniciales diferentes y muestra multilinealidad; la primera porción lineal de 0 a 4,47 min0,5, es la parte más empinada, explica la utilización inmediata de los sitios activos del CARC por el CN-; se atribuye generalmente a la difusión de la capa límite (Dwivedi et al., 2016). El tramo de 4,47 a 6,32 min0,5, sugiere que el proceso de difusión interna es una etapa muy gradual e ilustra la difusión de macro poros. La tercera porción, representa la etapa final de equilibrio o proceso de adsorción propiamente dicha, ilustra la difusión de micro y meso poros (Gupta et al., 2012); gradual para la adsorción del CN- sobre el CARC. Según los valores de R2 > 0.98, (para las tres ecua- ciones), el modelo de difusión intrapartícula responde a la cinética de adsorción del CN- sobre el CARC y sugieren la difusión de CN- de forma directa dentro los poros (Halet et al., 2015), por lo que la difusión intrapartícula no fue la etapa limitante, durante el proceso de adsorción del CN- sobre el CARC.
4. Conclusiones
Se realizó el estudio de optimización y evaluaron los modelos de equilibrio de Freundlich, Langmuir y Temkin así como, los modelos cinéticos de pseudo primer orden, pseudo segundo orden y difusión intrapartícula del proceso de adsorción CN- sobre el CARC obtenido de residuo de café. Los análisis FTIR, XRD, confirmaron el cambio estructural del precursor hacia carbón activo. El estudio de optimización nos sugiere que el proceso de adsorción de CN- por el CARC, es sensible al pH; con su valor de 8, alcanzó el 54,68% de porcentaje de adsorción y de 67,65% para el nivel predictivo. El coeficiente de regresión factorial de 98,59% de su análisis de varianza, mostró que el estudio fue consistente. Los mayores R2, para los estudios de equilibrio y cinéti- cos mostraron que los datos experimentales para la adsorción de cianuro sobre el CARC, se ajustan al modelo de Freundlich (0,954) y pseudo segundo orden (> 0,99) respectivamente y la difusión intrapartícula (> 0,98) responde a la cinética de adsorción del CN- sobre el CARC. La adsorción máxima de 5,42 mg de CN-/g De CARC, se obtiene de la isoterma de equilibro de Langmuir y los valores de 0< RL (0,67) < 1 y n (1,45) > 1, para las isotermas de Langmuir y Freundlich respectivamente nos sugieren que la adsorción de CN- sobre el CARC es favorable. Se demuestra la factibilidad de preparar carbón activo usando como soporte el residuo de café agotado y podría ser usado como potencial adsorbente en la descontaminación de aguas residuales que contienen bajas concentraciones de CN-; sin embargo, nuevos procedimientos de activación del residuo de café, a diferentes ratios de impregnación de H3PO4 y temperaturas para la activación química, podrían ser estudiados para modificar su superficie y mejorar su capacidad de adsorción de CN-.
Agradecimientos
Al Dr. Raúl Siche Jara por su apoyo en los análisis FTIR en la Facultad de Ciencias Agropecuarias y al Dr. Segundo Jáuregui Rosas por el ensayo XRD del carbón activo en el Dpto. Académico de Física, de la Universidad Nacional de Trujillo.
How to cite this article:
Aranguri-Llerena, G.; Reyes-Lázaro, W. 2019. Adsorción del cianuro contenido en solución acuosa usando carbón activo obtenido de residuo de café: eficiencia de absorción, modelado de equilibrio y cinética. Scientia Agropecuaria 10(3): 315– 325.
Referencias bibliográficas
Al Bahri, M.; Calvo, L.; Gilarranz, M.; Rodriguez, J. 2012. Activated carbon from grape seeds upon chemical activation with phosphoric acid: Application to the adsorption of diuron from water. Chemical Engineering Journal 203: 348-356. [ Links ]
Aranguri, G.; Reyes-lópez, I. 2018. Cyanide degradation from mining effluent using two reagents: Sodium metabisulphite and the metabisulphite mixture with hydrogen peroxide. Tecciencia 13 (25): 1-9. [ Links ]
Asgari, G.; Ramavandi, B.; Mohammadi, S. M.; Pour, A. M. 2012. The investigation of kinetic and isotherm of cyanide adsorption onto bone charcoal. En 4th International Conference on Chemical, Biological and Environmental Engineering 43: 119-124. [ Links ]
ASTM-D 4607. 2006. Determination of iodine number of activated carbon. En Estandard Test Method International. Estados Unidos. Pp. 1-5. [ Links ]
Awasthi, G.P.; Bhattarai, D.P.; Maharjan, B.; Kyung-Suk, K.; Park, C.H.; Kim, C.S. 2019. Synthesis and characterizations of activated carbon from Wisteria sinensis seeds biomass for energy storage applications. Journal of Industrial and Engineering Chemistry 72: 262-272. [ Links ]
Azamat, J.; Khataee, A. 2017. Molecular dynamics simulations of removal of cyanide from aqueous solution using boron nitride nano- tubes. Computational Materials Science 128: 8-14. [ Links ]
Ballesteros, L.; Teixeira, J.; Mussatto, S. 2014. Chemical, functional, and structural proper- ties of spent coffee grounds and coffee silverskin. Food and Bioprocess Technology 7(12): 3493-3503. [ Links ]
Botz, M.M.; Mudder, T.H.; Akcil, A.U. 2016. Cyanide treatment: Physical, chemical and biological processes. En M. D. Adams (Comp.), Gold Ore Processing: Project Development and Operations. Elsevier, Amsterdam. Pp. 619-645. [ Links ]
Dwivedi, N.; Balomajumder, C.; Mondal, P. 2016. Comparative investigation on the removal of cyanide from aqueous solution using two different bioadsorbents. Water Resources and Industry 15: 28-40. [ Links ]
Dwivedi, N.; Balomajumder, C.; Mondal, P. 2014. Studies of kinetic and equilibrium isotherm models for the sorption of cyanide ion on to almond shell. Research Journal of Chemical Sciences 4(2): 20-24. [ Links ]
Eletta, O.A.; Ajayi, O.A.; Ogunleye, O.O.; Akpan, I.C. 2016. Adsorption of cyanide from aqueous solution using calcinated eggshells: Equilibrium and optimisation studies. Journal of Environmental Chemical Engineering 4(1): 1367-1375. [ Links ]
Fombuena, M.; Valentín, A. 2010. Manual del carbón activo. Universidad de Sevilla. [ Links ]
Gebresemati, M.; Gabbiye, N.; Sahu, O. 2017. Sorption of cyanide from aqueous medium by coffee husk: Response surface methodology. Journal of Applied Research and Technology 15: 27-35. [ Links ]
Ghanizadeh, G; Asgari, G. 2010. Adsorption kinetics and isotherm of methylene blue and its removal from aqueous solution using bone charcoal. Reac Kinet Mech Cat 102(1): 127-142. [ Links ]
Greenberg, A.E., Clesceri, L.S., Eaton, A.D. 1992. Standard Methods for the Examination of Water and Wastewater. 18 th edition. American Public Health Association. Washington. [ Links ]
Guang-zhen, Z.; Xian-lun, D.; Hou, M.; Sun, K.; Yan-ping, Z.; Li, P.; Fang-min, L. 2016. Comparative study on characterization and adsorption properties of activated carbons by phosphoric acid activation from corncob and its acid and alkaline hydrolysis residues. Fuel Processing Technology 144: 255-261. [ Links ]
Gupta, N.; Balomajumder, C.; Agarwa, V. K. 2013. Adsorptive treatment of cyanide bearing wastewater: a prospect for sugar industry waste. Chemical Engineering Communications 200: 993-1007. [ Links ]
Gupta, N.; Balomajumder, C.; Agarwal, V. 2012. Adsorption of cyanide ion on pressmud surface: A modeling approach. Chemical Engineering Journal 191: 548-556. [ Links ]
Halet, F., Yeddou, A. R., Chergui, A., Chergui, S., Boubekeur, N.; Ould-Dris, A. 2015. Removal of cyanide in aqueous solution by adsorption on activated carbon prepared from lignocellulosic by products. Journal of Dispersion Science and Tecnology 36(12): 1736-1741. [ Links ]
Herrera, E.L.; Feijoo, C.Y.; Alfaro, R.; Solís, J.L.; Gómez, M.M.; Keiski, R.L.; Cruz, G.J. 2018. Producción de biocarbón a partir de biomasa residual y su uso en la germinación y crecimiento en vivero de Capparis scabrida (Sapote). Scientia Agropecuaria 9: 569-577. [ Links ]
Imessaoudene, D.; Hanini, S.; Bouzidi, A.; Ararem,A. 2016. Kinetic and thermodynamic study of cobalt adsorption by spent coffee. Desalination and Water Treatment 57(13): 6116-6123. [ Links ]
Liu, C.; Pujol, D.; Olivella, M.; De la Torre, F.; Fiol, N.; Poch, J.; Villaescusa, I. 2015. The Role of Exhausted Coffee Compounds on Metal Ions Sorption. Water Air Soil Pollut 226: 1- 10. [ Links ]
Luque-Almagro; V., Moreno-Vivián, C.; Roldán, M. 2016. Biodegradation of cyanide wastes from mining and jewellery industries. Biotechnology 38:9-13. [ Links ]
Ma, X.; Ouyang, F. 2013. Adsorption properties of biomass-based activated carbon prepared with spent coffee grounds and pomelo skin by phosphoric acid activation. Applied Surface Science 268: 566-570. [ Links ]
Molina-Sabio, M.; Rodríguez-Reinoso, F. 2004. Role of chemical activation in the development of carbon porosity. Colloids and Surfaces A: Physicochem. Eng. Aspects 241: 15-25. [ Links ]
Mondal, M.; Mukherjee, R.; Sinha, A.; Sarkar, S.; De, S. 2019. Removal of cyanide from steel plant effluent using coke breeze, a waste product of steel industry. Journal of Water Process Engineering 28: 135-143. [ Links ]
Mussatto, S.I.; Machado, E.M.; Martins, S.; Teixeira, J.A. 2011. Production, composition, and application of coffee and its industrial residues. Food Bioprocess Technology 4: 661-672. [ Links ]
Naeem, S.; Zafar, U.; Amann, T. 2011. Adsorption studies of cyanide (CN)- on rice husk ash (RHA). Bangladesh Journal of Scientific and industrial Research 46: 101-104. [ Links ]
NMX-F-296-SCFI. 2011. Norma mexicana NMX-F- 296-SCFI-2011 Industria azucarera y alcoholera - determinación del número de yodo en muestras de carbones activados empleados en la refinación de azúcar. Mexico: 1-11. [ Links ]
Oliveira, L.S.; Franca, A.S. 2015. An overview of the potential uses for coffee husks. En V. Preedy (Ed.), Coffee in Health and Disease Prevention. Elsevier. Londres. Pp. 283-291. [ Links ]
Rattanapan, S.; Srikram, J.; Kongsune, P. 2017. Adsorption of methyl orange on coffee grounds activated carbon. Energy Procedia 138: 949-954. [ Links ]
Rawal, S.; Joshi, B.; Kumar, Y. 2018. Synthesis and characterization of activated carbon from the biomass of Saccharum bengalense for electrochemical supercapacitors. Journal of Energy Storage 20: 418-426. [ Links ]
Reffas, A.; Bernardet, V.; David, B.; Reinert, L.; Lehocine, B.; Dubois, M.; Btisse, N.; Duclaux, L. 2010. Carbons prepared from coffee grounds by H3PO4 activation: Characterization and adsorption of methylene blue and Nylosan Red N-2RBL. Journal of Hazardous Materials 175(1-3): 779-788. [ Links ]
Shamsuddin, M.; Yusoff, N.; Sulaiman, M. 2016. Synthesis and characterization of activated carbon produced from kenaf core fiber using H3PO4 activation. Procedia Chemistry 19: 558-565. [ Links ]
Singh, N.; Balomajumder, C. 2016. Simultaneous removal of phenol and cyanide from aqueous solution by adsorption onto surface modified activated carbon prepared from coconut shell. Journal of Water Process Engineering 9: 233-245 [ Links ]
Stavropoulos, G.G.; Papadopoulou, M.; Papadimitriou, K. 2015. A kinetic and thermodynamic study of cyanide adsorption in activated carbon. Desalination and Water treatment 57(46): 1-5. [ Links ]
Tsunatu, D. Y.; Taura, U. H.; Jirah, E. U. 2015. Kinetic studies of bio-sorption of cyanide ions from aqueous solution using carbon black developed from shea butter seed husk as an adsorbent. American Chemical Science Journal 8: 1-12. [ Links ]
Vogel, A.I. 1989. Text book of quantitative chemical analysis. 5ta Edicion. Longman Group UK Limite, Londres. 358 pp. [ Links ]
Weber, W.J.; Morris, J.C. 1963. Kinetics of adsorption carbon from solutions. Journal Sanitary Engeering Division Proceedings. American Society of Civil Engineers 89: 31-60. [ Links ]
* Corresponding author
E-mail: garanguri@hotmail.com (G. Aranguri-Llerena)
Received March 6, 2019.
Accepted August 26, 2019.