Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.3 Trujillo jul./set. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.03.10
ARTÍCULO ORIGINAL
Bacterias promotoras del crecimiento en plantas con potencial agente biocontrolador a Fusarium oxysporum f. sp. Lycopersici, y Moniliophthora roreri
Plant growth promoting bacteria with potential biocontrol agent of Fusarium oxysporum f. sp. Lycopersici, and Moniliophthora roreri
Jefferson Javier Guato-Molina1,* ORCID iD: https://orcid.org/0000-0002-6442-0149; Javier Andrés Auhing-Arcos2 ORCID iD: https://orcid.org/0000-0003-4537-7234; Jorge Abel Crespo-Ávila2 ORCID iD: https://orcid.org/0000-0002-7127-2818; Gabriel Alejandro Esmeraldas-García2 ORCID iD: https://orcid.org/0000-0001-8744- 8905; Antonio Francisco Mendoza-León2 ORCID iD: https://orcid.org/0000-0001-5103-0152; Hayron Fabricio Canchignia-Martínez3,* ORCID iD: https://orcid.org/0000-0003-1195- 5446
1 Nestle, Estación Experimental El Chollo, Quevedo, Los Ríos-Ecuador.
2 Facultad de Ciencias Agropecuarias, Carrera de Ingeniería Agropecuaria, Universidad Técnica Estatal de Quevedo, Los Ríos-Ecuador.
3 Facultad de Ciencias Agrarias, Carrera de Agronomía, Universidad Técnica Estatal de Quevedo, Laboratorio de Microbiología Molecular del Departamento de Biotecnología, km 1.5 a Santo Domingo de los Tsáchilas, EC. 120501, Los Ríos-Ecuador.
Resumen
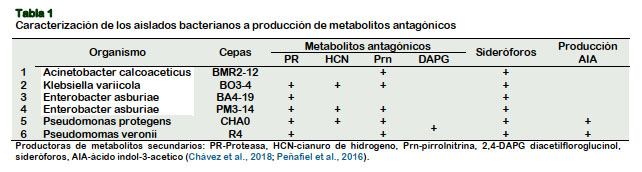
El objetivo se enfocó en caracterizar el potencial antagonista de PGPR en inhibición al desarrollo micelial, conidios en F. oxysporum y esporas en M. roreri. La técnica de PCR se empleó para la identificación de F. oxysporum y M. roreri. Seleccionando las bacterias: Acinetobacter calcoaceticus BMR2-12, Klebsiella variicola BO3-4, Enterobacter asburiae BA4-19, Enterobacter asburiae PM3-14, Pseudomonas protegens CHA0, Pseudomonas veronii R4 y Bacillus subtilis. Se evaluaron actividades antagónicas: a) Inhibición micelial en F. oxysporum y M. roreri; b) Reducción en producción de conidios y esporas por 12 y 15 días post-incubación. La PCR confirmó la amplificación de 670 pb para F. oxysporum. La secuenciación de 750 pb definió un grado de similitud del 99% a M. roreri, al compararse con el GenBank de NCBI. La aplicación de B. subtilis es de mayor actividad antagónica a inhibición (micelial y conidios) con (95 y 90%) a F. oxyporum. La actividad de BO3-4 en M. roreri inhibe totalmente el desarrollo micelial y la producción de esporas 12 y 15 días post-incubación respectivamente. La selección de estos bio-controladores y su aplicación como consorcio ofrecerá una alternativa para beneficiar en la reducción de agroquímicos al cultivo de tomate y cacao.
Palabras clave: F. oxysporum; M. roreri; micelio; conidios; esporas; antagónico.
Abstract
The objective was to characterize the potential PGPR antagonist in the inhibition of mycelial development, conidia in F. oxysporum and spores in M. roreri. The PCR technique was used for the identification of F. oxysporum and M. roreri. Selecting the bacteria: Acinetobacter calcoaceticus BMR2-12, Klebsiella variicola BO3-4, Enterobacter asburiae BA4-19, Enterobacter asburiae PM3-14, Pseudomonas protegens CHA0, Pseudomonas veronii R4 and Bacillus subtilis ATCC-5540. Antagonistic activities were evaluated: a) Mycelial inhibition in F. oxysporum and M. roreri; b) Reduction in production of conidia and spores for 12 and 15 days’ post-incubation. The PCR confirmed the 670 bp amplification for F. oxysporum. The 750 bp sequencing defined a degree of similarity of 99% to M. roreri, when compared to the NCBI GenBank. The application of B. subtilis is of greater antagonistic activity to inhibition (mycelial and conidia) with (95 and 90%) to F. oxyporum. The activity of BO3-4 in M. roreri totally inhibits mycelial development and spore production 12 and 15 days post - incubation respectively. The selection of these biocontrollers and their application as a consortium will offer an alternative to benefit in the reduction of agrochemicals in the cultivation of tomato and cocoa.
Keywords: F. oxysporum; M. roreri; mycelium; conidia; spores; antagonistic.
1. Introducción
Las enfermedades fúngicas que afectan el sector agrícola en producción de fruta fresca, leguminosas y hortalizas son ocasionadas por F. oxysporum causante de la marchitez vascular en una amplia gama de especies vegetales como: Lycopersicon esculentum, Carica papaya, Zea mays, Passiflora edulis y Phaseolus vulgaris (Fernández y Suárez, 2009; Figueroa et al., 2010; Guédez et al., 2012; Montiel et al., 2005). Este hongo se agrupan en formas especiales basando a sus especies hospederas y la especificidad del cultivar (Lievens et al., 2007). La M. roreri (monilia) que origina la podredumbre de mazorca al cultivo Theobroma cacao (cacao) (Bowers et al., 2001), es la enfermedad causante de pérdidas mayores al 30%, pero en muchas localidades alcanzan el 100% (Phillips, 2006). La presencia de estos hongos patogénicos reducen significativamente la producción agrícola y estrategias en contención de estas enfermedades se emplea compuestos químicos, sin embargo, estos tienen diversas consecuencias negativas al ambiente (Kah y Brown, 2006).
La pérdida en producción Solanum lycopersicum L. (tomate) es ocasionada por la marchitez por F. oxysporum f. sp. lycopersici (FOL) (Srivastava et al., 2010). F. oxysporum provoca la muerte prematura por marchitamiento asocia a la obstrucción de haces vasculares (Viana et al., 2003). Alternativas al control de la enfermedad que se vienen desarrollan son cultivares con resistencia a la marchitez, pero la continua aparición de razas de patógenos sigue siendo un problema continuo (Jones et al., 1991). Las estrategias al control biológico, se reportan al empleo de P. fluorescens LRB3W1 que inhibe el desarrollo y germinación de esporas in vitro de Fusarium oxysporum f. sp. conglutinans, y su aplicación en invernadero en combinación con benomyl mejora su eficacia al control de esta enfermedad (Someya et al., 2007). Trabajos en contención de FOL, se basan en aplicaciones de P. fluorescens por su versatilidad de aplicación con Glomus intraradices y Trichoderma harzianum, reduciendo el índice de la enfermedad por FOL al 67% en campo (Srivastava et al., 2010).
La M. roreri infecta cualquier estadio aln desarrollo de la mazorca del cacao, trasladándose directamente a través de la epidermis con síntomas en forma de necrosamiento, deformación de mazorca y madurez irregular (Evans, 2007). Los biocontroladores reportados para M. roreri, se basan en aplicaciones de especies endofíticos de Trichoderma, como estrategia de contención a enfermedades del cacao. El empleo de T. harzianum DIS110a, T. hamatum DIS219b, T. asperellum TA, son eficientes al procesos de colonización del cacao (Bailey et al., 2008). La búsqueda de bio-controladores a M. roreri se enfocan al empleo de Trichoderma sp. (Bateman et al., 2005), y Bacillus sp. (Suárez y Rangel, 2013).
Las rizobacterias están asociados a partículas del suelo generando interacciones en el sistema radicular y la zona de rizosfera (Peña y Reyes, 2007). Las bacterias al género Pseudomonas spp son las más estudiadas, al tener la capacidad de producir metabolitos secundarios y antibióticos que actúan como compuesto fúngicos: pioluteorina (Plt), pirrolnitrina (Prn), ácido fenazina-1-carboxilico (PCA) y 2,4-diacetilfloroglucinol (2,4 DAPG), que ejercen antagonismo a géneros de hongos como Pythium (Anjaiah et al., 1998), Rhizoctonia (Hill et al., 1994), Sclerotinia (Mcloughlin et al., 1992). Las rizobacterias productoras de estos compuestos volátiles como cianuro de hidrogeno (HCN), proteasa (PR), antibióticos como (Prn y PCA) demuestran actividad antagonista a problemas fitopatógenos (Fischer et al., 2010). Donde la presencia de estos metabolitos antagónicos PR y HCN por P. fluorescens UTPF5 tiene efecto inhibitorio al desarrollo micelial de Rhizoctonia solani (Afshar-manesh et al., 2010). La aplicación de P. aeruginosa JO y JO7 tienen un potencial bio-controlador por su aplicación en tomate, que proporciona el desarrollo vegetativo y suprime la severidad de la enfermedad a F. oxysporum y Alternaria solani (Paramanandham et al., 2017). La efectividad de las rizobacterias como Serratia plymuthica AS13 se ha corroborado su mayor funcionalidad al control de R. solani (Neupane et al., 2015).
Las inadecuadas y excesivas aplicaciones de pesticidas al control de enfermedades dentro del cultivo de tomate y cacao, han originado cambios en su biodiversidad. Donde el empleo continuo de fungicidas incrementa el grado de tolerancia y su efectividad es variable a las estaciones húmedas. El trabajo se enfoca en evaluar alternativas al control biológico con la disponibilidad de Rizobacterias Promotoras del Crecimiento en Plantas (PGPR) de actividad antagonista a hongos Ascomycota y Basidiomycota. Donde su objetivo se enfatizó en caracterizar el potencial antagonista de PGPR en inhibición al desarrollo micelial, de conidios en F. oxysporum f. sp. lycopersici y esporas en M. roreri.
2. Materiales y métodos
La investigación se ejecutó en el Laboratorio de Microbiología y Biología Molecular de la Universidad Técnica Estatal de Quevedo (UTEQ), localizado en el Campus Universitario "Manuel Haz Álvarez" ubicado en el km 1,5 vía Quevedo – Santo Domingo. Sus coordenadas geográficas 01° 01" de latitud Sur y 79° 47" de longitud Occidental, ubicada a 73 msnm.
Hongos patogénicos
La plantación de cacao CNN51 localizado Campus "La María", de la UTEQ, km 7 vía Quevedo-El Empalme, se recolectaron mazorcas con síntomas a la enfermedad a M. roreri. Para el aislamiento de M. roreri, se ejecutó el protocoló descrito por Evans et al. (2013) ajustando modificaciones, donde se realizó un triple lavado con agua estéril y alcohol, con un corte en la epidermis se recuperó segmentos de (0,2 cm2) al área del corcho de mazorcas enfermas. Las muestras de tejido se incubaron en cajas monopetri con PDA suplementado con chloramphenicol (13 µg/mL), ampicillina (40 µg/mL) e incubadas por 15 días a 28 oC para el desarrollo completo del hongo. Su identificación se realizó por similitud de morfo-fisiología de la colonia del hongo (Phillips, 2003). La cepa patogénica FOL fue donada por Carmita Suarez del Laboratorio de Fitopatología de la UTEQ. Las muestras miceliales de (4 mm Ø), de los hongos patogénicos se ubicaron en crio-tubos con PDA, dejándolo crecer durante 5 días a 18 oC y procediendo a agregarle 400 uL de Glicerol para su almacenamiento a – 40 oC.
Extracción de ADN
La extracción de ADNg para FOL, se recuperó 1 g de micelio del hongo y pulverizado con N2 líquido, obteniendo 400 mg de tejido macerado. En M. roreri se recuperó (4 mm Ø) del micelio y se incubó en medio líquido Caldo de Papa Dextrosa a 165 rpm por 10 días en (Benchmark, Incu-Shaker) hasta obtener un considerable desarrollo micelial, rescatando la parte sólida con 400 mg de muestra. La extracción de ADNg se realizó siguiendo las intrusiones del fabricante por DNeasy Plant Mini Kit de (QIAGEN-Start EE.UU.), para la purificación de ADNg, y diluido en 50 µL del tampón TE (Ácido trisetilendiaminotetraacético 10 mM y EDTA pH 8,2). Las muestras de ADNg se visualizaron en geles de agarosa al 0,9% teñidos en bromuro de etidio.
Caracterización molecular
Se realizó la identificación por PCR empleando los oligonucleótidos específicos UniF (5´-ATCATCTTGTGCCAACTTCAG-3´) y UniR (5´-GTTTGTGATCTTTGAGTTGCCA- 3´), que genera un fragmento entre 670 a 672 bp (Hirano y Arie, 2006). Para M. roreri se empleó los cebadores universales ITS4- F (5´TCCTCCGCTTATTGATATGC-3´) y ITS5-R (5’GGAAGTAAAAGTCGTAACAAGG- 3´) (White et al., 1990), que amplifican las regiones ribosomales, ITS (espacios de transcripto interno) que corresponde al gen del ADNr constituido por (ITS1 - 5.8S - ITS2) con un fragmento de 750 pb (Suárez, 2016).
La PCR se desarrolló en un volumen de 20 µL que contenía 4 uL Buffer (1X); 1,2 µL de MgCl2 (6 mM); 1 µL de DNTP`s (0,2 mM); 1 µL/cada primer (0,2 mM); 0,2 µL de Taq pol (Promega®); 1 µL de ADN (60 ng/mL); 10,6 µL de H2O. La reacción de la PCR se desarrolló en el termociclador (TECHME®). El perfil térmico en la PCR para FOL es: 94 oC por 2 min; 35 ciclos a 94 oC por 30 seg; 55 oC por 60 seg; 72 oC por 1 min; extensión final de 72 oC por 10 min. La condición de PCR para M. roreri: 94 oC por 2 min; 35 ciclos a 94 oC por 30 seg; 60 oC por 1 min; 72 oC por 1 min; extensión final de 72 oC por 10 min. Los productos amplificados se verificaron por electroforesis en gel de agarosa al 1,2% y teñidos en bromuro de etidio. Los fragmentos se determinaron por comparación con el marcador de peso molecular 100 bp (Invitrogen®). La secuencia única obtenida para M. roreri se purificó empleando el kit Invitrogen PureLink™ (GERMANY®), siguiendo el protocolo descrito por el fabricante. El fragmento fue secuenciado por MACROGEN y comparado con la base de datos de GenBank de NCBI (https://www.ncbi.nlm.nih.gov), empleando Basic Local Alignment Search Tool (BLAST).
Selección y preparación de inoculó bacteriano
Del Banco de Germoplasma del Laboratorio de Microbiología de la UTEQ, se seleccionaron las rizobacterias provenientes de cultivares endémicos de Musáceas con su clasificación a metabolitos antagónicos (Tabla 1). Además, se emplearon cepas control P. protegens CHA0 (donadas por Dieter Haas Ph.D), P. veronii R4 y Bacillus subtilis ATCC 5540 (donada por Humberto Prieto Ph.D). Las rizobacterias se incubaron en King B líquido a 170 rpm/48 h a 28 oC [(g/L): peptona, 20; glicerol, 15 mL; K2HPO4, 1,5; MgSO4 x 7H2O, 1,5; agar, 15; agua destilada (pH 7,2)], suplementado con chloramphenicol (13 µg/mL), ampicillina (40 µg/mL) (King et al., 1954).
Inhibición al desarrollo micelial y producción de conidios/esporas
Las bacterias se incubaron en King-B líquido a 170 rpm/24 h a 28 oC, recuperando 0,6 mL del crecimiento bacteriano y homogenizadas en placas Petri con 14,4 mL de PDA e incubado por 16 h/28 oC, posterior se añadió un disco de (6 mm Ø) micelial de FOL e incubados a 28 oC, para su evaluación por 4, 8 y 12 días post- incubación (DPI). El ensayo antagonista se diferencia con el anterior patógeno al crecimiento lento de M. roreri en PDA, donde su evaluación se realizó añadiendo un disco de (6 mm Ø) en el extremo de la placa Petri con PDA que corresponde al micelio del hongo, enfrentándose al disco de agar con la bacteria previamente incubada a 16 h/28 oC, evaluando por 9, 12 y 15 DPI. Los dos patógenos se evaluó el porcentaje de inhibición micelial desde el borde del tarugo hasta el crecimiento del hongo por la fórmula: % inhibición = (crecimiento del control – crecimiento del tratamiento / crecimiento del control) x 100. Al final de la evaluación en inhibición micelial por 12 y 15 DPI, se procedió el conteo de conidios y esporas (C y E) para FOL y M. roreri, homogenizando el micelio de las placas Petri con (10 mL de H2O + Tween 20). Recuperando 1 mL de cada placa y transfirido a tubos eppendorf de 1,5 mL que contenían gaza estéril, que permitió la separación del micelio de (C y E). Las muestras de 20 µL se ubicaron al centro de la cámara de Neubauer, realizando el conteo en cinco de los cuadrantes de 0,20 mm2, observando por el microscopio OLYMPUS (ocular 10X y objetivo 40X). Se determinó la cantidad de (C y E) /mL = (# de (C y E) contadas x 25000 x factor de dilución). Además, se verificó porcentaje de inhibición a (C y E) = (número de (C y E) del control – número de (C y E) del tratamiento / número de (C y E) del control) x 100.
En todos los experimentos los tratamientos contenían seis replicas experimentales y cada una con cuatro unidades experimentales. Los valores a cada condición están representados con el error estándar promedio individual (±), los tratamientos fueron sujetos al análisis de varianza por ANOVA, y separados por procedimiento de comparación múltiple de Tukey SD, al nivel de significancia de (p ≤ 0,05), empleando Statgraphics.
3. Resultados y discusión
Identificación de F. oxysporum y M. roreri
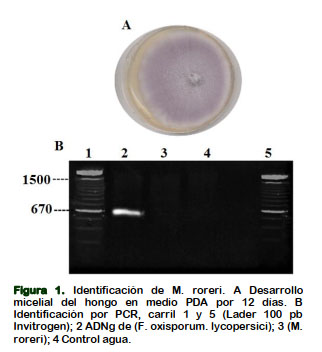
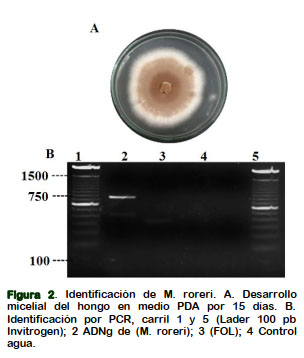
La identificación molecular de Fusarium oxysporum. f. sp. lycopersici, se realizó por PCR, empleando los oligonucleótidos específicos UniF y UniR para este hongo, generando el fragmento de 670 bp. La veracidad de la amplificación fue determinada al no visualizar el producto de amplificación teniendo como control el ADNg de M. roreri, y agua (Figura 1). El alineamiento de los oligonucleótidos resultan ser específico para este patógeno, permitiendo diferenciar entre otras formas especiales para F. oxysporum (Hirano y Arie, 2006). Las mazorcas del cultivar CCN51 de la Finca la María con síntomas de la enfermedad se recuperó la parte seccional del corcho, obteniendo el crecimiento micelial del M. roreri (Cepa 1), observando la formación del borde regular y textura polvorienta de un rango de color (café oscuro - crema - blanco) (Figura 2A). La técnica de PCR confirmo un producto de amplificación de 750 bp (Figura 2B).
El alineamiento de secuencia al ADNr de las regiones ITS1 y ITS2 ha conducido en la identificación con fidelidad y discriminar de otras especies a Moniliophthora spp. La secuenciación y su alineamiento de la región (ITS1- 5.8S - ITS2) de M. roreri (cepa 1) tiene 99% de homología con la secuencia del ITS a la cepa aislada de cacao en Ecuador (AY194150) con diferencia en los nucleótidos 1315 y 1317 (Figura 3) (Griffith y Nicholson, 2002). Estas herramientas moleculares se complementan a los caracteres morfológicos en la identificación de especies para evaluar de forma rápida y confiable la diversidad biológica.
Aplicación de PGPR en inhibición al desarrollo micelial en F. oxysporum
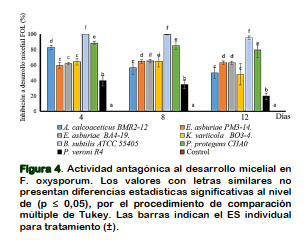
El proceso de evaluación antagónico obtenido en FOL a 4 DPI se destacan las bacterias A. calcoceaticus BMR2-12, B. subtilis y P. protegens CHA0 que superan el 80% en inhibición a crecimiento micelial. Donde la efectividad antagónica solo se mantiene por B. subtilis y P. protegens CHA0 hasta 8 y 12 DPI. Además, se verifica un constaste efecto antagónico superior al 60% a 12 DPI por E. asburiae PM3-14 y BA4- 19 (Figura 4). La actividad antagónica de las bacterias estaría regulada por la producción de metabolitos antagónicos como PR y Prn. También, se observa una baja actividad antagónica por aplicación de A. calcoaceticus BMR2-12, K, varicola BO3- 4 y P. veronii R4 que no superan el 50% en inhibición a 12 DPI (Figura 4).
Estos procesos de evaluación inicial in vitro han permitido seleccionar microor- ganismos antagónicos de mayor potencial en inhibición al desarrollo micelial a FOL, donde la producción diferencial de metabo- litos antifúngicos lideran las respuestas antagónicas entre (60 y 70%) por P. protegnes CHA0, E. asburiae PM3-14 y E. asburiae BA4-19 (Figura 4). Las aplicaciones de bacterias promotoras a crecimiento como B. subtilis MAA03 y P. fluorescens MAA10 solas o combinadas actúan como bio-control a F. graminearum (Moussa et al., 2013).
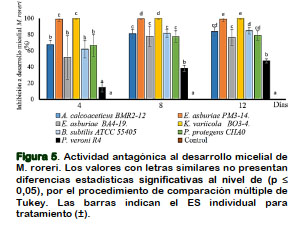
Aplicación de PGPR en inhibición al desarrollo micelial en M. roreri
La actividad antagónica en inhibición al desarrollo micelial a M. roreri se destaca E. asburiae PM3-14 y K. variicola BO3-4 que imposibilitó la formación de micelio del 100% hasta los 15 DPI. En este hongo se acentúa una mejor eficacia por A. calcoaceticus BMR2-12 y E. asburiae BA4- 19 que superan el 75% de inhibición hasta los 15 DPI (Figura 5). La rizobacteria P. veronii R4 se verifica la menor actividad antagónica al desarrollo micelial en M. roreri y FOL.
Estas bacterias gram-negativas E. asburiae PM3-14 y K. variicola BO3-4 tienen la característica en producir (PR, HCN, Prn) (Chávez et al., 2018), donde la efectividad de estos metabolitos secundarios inhiben el desarrollo micelial a FOL y M. roreri. Esto se corrobora con Nutaratat et al. (2017), que el empleo in vitro de Enterobacter sp DMKU-RP2016 tiene actividad antagonista a F. moniliforme y R. solani. La síntesis de metabolitos secundarios a (HCN y sideróforos), cumplen un rol importante como bio-control en Macrophomina phaseolina, R. solani y Alternaria spp (Sandhya et al., 2017), determinando que esta clase de género de bacterias endófitas son fuentes importantes de rizobacterias promotoras de crecimiento.
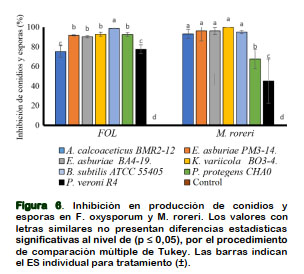
Inhibición de conidios en F. oxysporum y esporas en M. roreri
El mecanismo de dispersión del hongo por producción de conidios en FOL se verificó con la reducción significativa in vitro en presencia de B. subtilis, K. variicola BO3-4, P. protegens CHA0, E. asburiae BA4-19 y PM3-14, demostrando efectividades superiores al 90% en la reducción de conidios. El hongo a no ser sometido con las bacterias genera 1475593 conidios/ mL a 12 DPI (Figura 6). La eficacia de B. sutilis ATCC 55405 a FOL con el 95% inhibición al desarrollo micelial del hongo y la reducción del 75% de las esporas estaría participando en inhibir la fase sexual y asexual del ciclo vida de F. oxysporum; donde la producción de enzimas hidrolíticas como: surfactina e iturrina A degradan la membrana citoplasmática de hongos filamentosos (Cazorla et al., 2007; Chitarra et al., 2003). En los ensayos antagonistas a inhibición de esporas de M. roreri revelaron una efectividad superior al 90% en presencia de K. variicola BO3-4, B. subtilis, A. calcoaceticus BMR2-12, E. asburiae BA4- 19 y PM3-14. Con baja efectividad antagónica por P. protegens CHA0 y P. veronii R4 que no superan el 65% de inhibición de esporas. El hongo a no estar expuesta a ensayos antagónicos genera 180125 esporas/mL a 12 DPI. La eficacia de K. varicola BO3-4 está determinada por la producción de tres metabolitos antagó- nicos, donde la funcionalidad del HCN tiene una toxicidad de amplio espectro para hongos, nematodos e insectos por la sensibilidad del grupo-hemo en las células eucariotas (Zdor, 2014). La funcionalidad del HCN microbiano producido en la rizosfera depende de la geoquímica del suelo (Rijavec y Lapanje, 2016). Este tipo de género a K. variicola DX120E, producen sideróforos y enzimas que degradan de pared celular de hongos fitopatógenos (Lin et al., 2015).
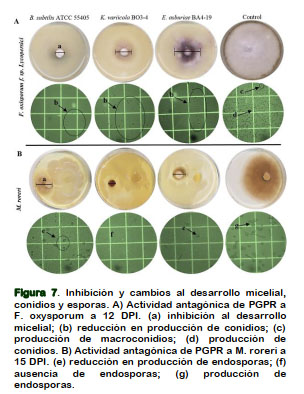
Cambios estructurales del micelio, conidios y esporas
El efecto antagónico de B. subtilis ejerce cambios estructurales in vitro en FOL de inhibición a desarrollo y degradación del micelio con ausencia de macroconidios. En presencia de K. variicola BO3-4 y E. asburiae BA4-19 se determinó la disminución y mal formaciones de macroconidios y conidios (Figura 7A). Esto concuerda con Gu et al. (2017), ellos explican que la producción de Bacilomicina D por B. subtilis interrumpe las membranas plasmáticas de las hifas y los conidios de F. graminearum, provocando la filtración del citoplasma y plasmólisis. Donde el esterol de la membrana plasmática de las paredes celulares de hifas y conidios estaban dañados por la adición de Bacilominina D, por perdida de turgencia y estructuras con huecos al visualizarse por microscopia electrónica (Gu et al., 2017).
El caso de M. roreri expuesta al antagonismo con K. variicola BO3-4 se observó un ligero desarrollo micelial, pero total ausencia de endosporas. Además, se verifica la disminución en producción de endosporas por el enfrentamiento con E. asburiae PM3-14, B. subtilis, E. asburiae BA4-19 y A. calcoaceticus BMR2-12. Sin aplicación bacteriana se observa un crecimiento normal de micelio con presencia de endosporas (Figura 7B). La respuesta antagónica está liderada por la actividad proteolítica de K. variicola BO3-4, A. calcoaceticus BMR2-12, E. asburiae BA4-19 y PM3-14 que reducen el desarrollo micelial y formación de esporas. Esta enzima lítica degrada la pared celular de hongos fitopatógenos que actúan como factores bio-controladores (Infante et al., 2009). Donde se explica que estas enzimas sintetizadas por Pseudomonas y Bacillus tiene capacidad en degradar los componentes estructurales (proteínas, quitina y lípidos) permitiendo la colonización de las bacterias a los tejidos internos del patógeno (Yang et al., 2013).
La presencia de Prn en K. variicola BO3-4, A. calcoaceticus BMR2-12, E. asburiae PM3-14 seria unos de los componentes que responden como antagonismo a M. roreri. La actividad de Prn se dirige a las mitocondrias y perjudica al aceptor de electrones terminales, siendo los sitios objetivo para este biopesticida (Anderson y Kim, 2018). Además, Prn altera la señalización del estrés osmótico en hongos (Okada et al., 2005). Los factores minerales en la rizosfera pueden influir en la síntesis de Prn, donde la disponibilidad de Fe es importante para la síntesis de este antibiótico (De Laurentis et al., 2007).
Los resultados en este trabajo al mecanismo antagónico de las bacterias difieren entre ellas, donde la efectividad B. subtilis prevalece para hongos Ascomycota, a diferencia que la aplicación de K. variicola BO3-4, A. calcoaceticus BMR2-12, E. asburiae BA4-19 y PM3-14 ejerce mayor actividad a Basidiomycota. Donde intervienen los cambios osmóticos del patógeno por la producción de Prn. La PR degradando los componentes estructurales del hongo como (proteínas, quitina y lípidos). El HCN modificando la sensibilidad del grupo-hemoproteínas en las células eucariotas.
4. Conclusiones
El proceso de inhibición por B. subtilis es efectiva en desarrollo micelial y producción de conidios de FOL, a diferencia al trabajar con M. roreri se verificó que la aplicación de E. asburiae PM3-14 y K. variicola BO3-4 son de mayor eficiencia en inhibir el micelio y esporas. Estas diferencias estarían acentuadas por la disponibilidad y producción del metabolito antagónico secretado por la batería. El trabajo se proyecta en la aplicación de estas PGPR a manera sola o la formación de consorcios bacterianos para determinar su actividad bio-controladora y evaluar su rol en promover el desarrollo en plantas.
Agradecimientos
El trabajo se financió por el Proyecto FOCICYT- 2016 (Actividad nematicida a Radopholus similis por rizobacterias nativas y comerciales del género Pseudomonas spp.), otorgado por la Universidad Técnica Estatal de Quevedo.
How to cite this article:
Guato-Molina, J.J; Auhing-Arcos, J.A.; Crespo-Ávila, J.A.; Esmeraldas-García, G.A.; Mendoza-León, A.F.; Canchignia- Martínez, H.F. 2019. Bacterias promotoras del crecimiento en plantas con potencial agente biocontrolador a Fusarium oxysporum f. sp. Lycopersici, y Moniliophthora roreri. Scientia Agropecuaria 10(3): 393 – 402.
Referencias bibliográficas
Afsharmanesh, H.; Ahmadzadeh, M.; Javan, M.; Behboudi, K. 2010. Characterization of the antagonistic activity of a new indigenous strain of Pseudomonas fluorescens isolated from onion rhizosphere. Journal of Plant Pathology 92: 187–194. [ Links ]
Anderson, A.; Kim, Y. 2018. Biopesticides produced by plant-probiotic Pseudomonas chlororaphis isolates. Crop Protection 105: 62–69. [ Links ]
Anjaiah, V.; Koedam, N.; Nowak. B.; Loper, J; Höfte, M.; Tambong, J.; Cornelis, P. 1998. Involvement of phenazines and anthranilate in the antagonism of Pseudomonas aeruginosa PNA1 and Tn 5 derivatives toward Fusarium spp. and Pythium spp. Molecular Plant-Pathology 11: 847–854. [ Links ]
Bailey, B.; Bae, H.; Strem, M.; Crozier, J., Thomas, S.; Samuels, G.; Holmes, K. 2008. Antibiosis mycoparasitism and colonization success for endophytic Trichoderma isolates with biological control potential in Theobroma cacao. Biological Control 46: 24–35. [ Links ]
Bateman, R.; Hidalgo, E.; García, J.; Arroyo, C.; Ten Hoopen, G.; Adonijah, V.; Krauss, U. 2005. Application of chemical and biological agents for the management of frosty pod rot (Moniliophthora roreri) in Costa Rican cocoa (Theobroma cacao). Annals of Applied Biology 147:129–138. [ Links ]
Bowers, J.; Bailey, B.; Hebbar, P.; Sanogo, S.; Lumsden, R. 2001. The impact of plant diseases on world chocolate production. Plant Health Progress. Disponible en: http://www.plantmanagementnetwork.org/ph p/elements/sum.aspx?id=111&photo=87. [ Links ]
Cazorla, F.; Romero, D.; Pérez, A.; Lugtenberg, B.; Vicente, A.; Bloemberg, G. 2007. Isolation and characterization of antagonistic Bacillus subtilis strains from the avocado rhizoplane displaying biocontrol activity. Journal of Applied Microbiology 103: 1950–1959. [ Links ]
Chávez, K.; Guato, J.; Peñafiel, M.; Mestanza, C.; Canchignia, H. 2018. Bacterias fluorescentes productoras de metabolitos antagónicos de cultivares nativos de Musa sp. y su diversidad filogenética al gen ARNr 16S. Agricultural Sciences 11: 17–29. [ Links ]
Chitarra, G.; Breeuwer, P.; Nout, M.; Van Aelst, A.; Rombouts, F.; Abee, T. 2003. An antifungal compound produced by Bacillus subtilis YM 10-20 inhibits germination of Penicillium roqueforti conidiospores. Journal of Applied Microbiology 94: 159–166. [ Links ]
De Laurentis, W.; Khim, L.; Anderson, J.; Adam, A.; Phillips, R.; Chapman, S.; Naismith, J. 2007. The second enzyme in pyrrolnitrin biosynthetic pathway is related to the hemedependent dioxygenase superfamily. Biochemetry 46: 12393–12404. [ Links ]
Evans, H. 2007. Cacao diseases-The trilogy revisited. Phytopathology 97: 1634–1639. [ Links ]
Evans, H.; Bezerra, J.; Barreto, R. 2013. Of mushrooms and chocolate trees : aetiology and phylogeny of witches broom and frosty pod diseases of cacao. Plant Pathology 7: 728–740. [ Links ]
Fernández, R.; Suárez, C. 2009. Antagonismo in vitro de Trichoderma harzianum rifai sobre Fusarium oxysporum Schlecht f. sp passiflorae en maracuyá (Passiflora edulis Sims var. Flavicarpa). Revista Facultad Nacional de Agronomía Medellín 62: 4743–4748. [ Links ]
Figueroa, M.; Rodríguez, R.; Zulema, B.; González, M.; Pons, J. 2010. Caracterización de especies de Fusarium asociadas a la pudrición de raíz de maíz. Revista Mexicana de Fitopatología. 28: 124–134. [ Links ]
Fischer, S.; Jofré, E.; Cordero, P.; Gutiérrez, F.; Mori, G. 2010. Survival of native Pseudomonas in soil and wheat rhizosphere and antagonist activity against plant pathogenic fungi. International Journal of General and Molecular Microbiology. 97: 241–251. [ Links ]
Griffith, G.; Nicholson, J. 2002. Genetic diversity in the Crinipellis perniciosa (Stahel) Sing. species complex. Institute of Biological Sciences 40: 1953–1959. [ Links ]
Gu, Q.; Yang, Y.; Yuan, Q.; Shi, G.; Wu, L.; Lou, Z. 2017. Bacillomycin D produced by Bacillus amylolique-faciens is involved in the antagonistic interaction with the plantpathogenic fungus Fusarium graminearum Qin. Applied and Environmental Microbiology 83: 1–17. [ Links ]
Guédez, C.; Cañizalez, L.; Castillo, C.; Olivar, R. 2012. Evaluación in vitro de aislamientos de Trichoderma harzianum para el control de Rhizoctonia solani, Sclerotium rolfsii y Fusarium oxysporum en plantas de tomate Clemencia. Revista de La Sociedad Venezolana de Microbiología 32: 44–49. [ Links ]
Hill, D.; Stein, J.; Torkewitz, N.; Morse, A.; Howell, C.; Pachlatko, J.; Ligon, J. 1994. Cloning of genes involved in the synthesis of pyrrolnitrin from Pseudomonas fluorescens and role of pyrrolnitrin synthesis in biological control of plant disease. Applied and Enviromental Microbiology. 60: 78–85. [ Links ]
Hirano, Y.; Arie, T. 2006. PCR-based differentiation of Fusarium oxysporum ff. sp. lycopersici and radicis-lycopersici and races of F. oxysporum f. sp. lycopersici. Journal of General Plant Pathology 72: 273–283. [ Links ]
Infante, D.; Martínez, B.; González, N.; Reyes, Y. 2009. Mecanismo de acción de Trichoderma frente a hongos fitopatógenos. Revista de Protección Vegetal 24: 14–21. [ Links ]
Jones, J.; Jones, P.; Stall, R.; Zitter, T. 1991. Compendium of tomato Diseases. The American Phytopathogical Society Press. Minnesota: APS Press. Pp 73. [ Links ]
Kah, M.; Brown, C. 2006. Adsorption of ionisable pesticides in soils. Reviews of Environmental Contamination and Toxicology 188: 149–217. [ Links ]
King, E.; Ward, M.; Raney, D. 1954. Two simple media for the demonstration of pyocyanin and fluorescin. The Journal of Laboratory and Clinical Medicine 44: 301–307. [ Links ]
Lievens, B.; Claes, L.; Vakalounakis, D.; Vanachter, A.; Thomma, B. 2007. A robust identification and detection assay to discriminate the cucumber pathogens Fusarium oxysporum f. sp. cucumerinum and f. sp. radicis-cucumerinum. Environmental Microbiology 9: 2145–2161. [ Links ]
Lin, L.; Wei, C.; Chen, M.; Wang, H.; Li, Y.; Li, Y.; Yang, L. 2015. Complete genome sequence of endophytic nitrogen-fixing Klebsiella variicola strain DX120E. Standards in Genomic Sciences 10: 1–7. [ Links ]
Mcloughlin, T.; Quinn, J.; Bettermann, A.; Booklandt, R. 1992. Pseudomonas cepacia suppression of sunflower wilt fungus and role of antifungal compounds in controlling the disease. Applied ana Environmental Micro-biology 12: 1760–1763. [ Links ]
Montiel, L.; González, F.; Sánchez, B.; Guzmán, S.; Gámez, F.; Acosta, J.; Rodríguez, R. 2005. Especies de Fusarium presentes en raíces de frijol (Phaseolus vulgaris L.) con daños de pudrición, en cinco Estados del Centro de México. Revista Mexicana de Fitopatologia 23: 1–7. [ Links ]
Moussa, T.; Almaghrabi, O.; Moneim, A. 2013. Biological control of the wheat root rot caused by Fusarium graminearum using some PGPR strains in Saudi Arabia. Annals of Applied Biology, 163: 72–81. [ Links ]
Neupane, S.; Finlay, R.; Alström, S.; Elfstrand, M.; Högberg, N. 2015. Transcriptional responses of the bacterial antagonist Serratia plymuthica to the fungal phytopathogen Rhizoctonia solani. Environmental Microbio-logy Reports: 7: 123–127. [ Links ]
Nutaratat, P.; Monprasit, A.; Srisuk, N. 2017. High-yield production of indole-3-acetic acid by Enterobacter sp. DMKU-RP206, a rice phyllosphere bacterium that possesses plant growth-promoting traits. 3 Biotech 7: 1–15. [ Links ]
Okada, A.; Banno, S.; Ichiishi, A.; Kimura, M.; Yamaguchi, I.; Fujimura, M. 2005. Pyrrolnitrin interferes with osmotic signal transduction in Neurospora crassa. Pesticide Science Society of Japan 30: 378–383. [ Links ]
Paramanandham, P.; Rajkumari, J.; Pattnaik, S.; Busi, S. 2017. Biocontrol potential against Fusarium oxysporum f. sp. lycopersici and Alternaria solani and Tomato plant growth due to plant growth–promoting rhizobacteria. International Journal of Vegetable Science 23: 294–303. [ Links ]
Peña, H.; Reyes, I. 2007. Aislamiento y evalua- ción de bacterias fijadoras de nitrógeno y disolventes de fosfatos en la promoción del crecimiento de la lechuga (Lactuca sativa L.). Interciencia 32: 560–565. [ Links ]
Peñafiel, M.; Torres, E.; Barrera, A.; Prieto, H.; Carriel, J.; Canchignia, H. 2016. Producción de ácido indol-3-acético por Pseudomonas veronii R4 y formación de raíces en hojas de vid "Thompson seedless" in vitro. Ciencia y Tecnología 9: 31–36. [ Links ]
Phillips, W. 2003. Origin, biogeography, genetic diversity and taxonomic affinities of the cacao (Theobroma cacao L.) fungus Moniliophthora roreri ( Cif .) Evans et al. as determined using molecular, phytopatholo- gical and morpho-physiological evidence. Tesis doctorado, The University of Reading. USA. 373 pp. [ Links ]
Phillips, W. 2006. La moniliasis del cacao: un enemigo que podemos y debemos vencer. Taller regional andino de aplicación tecnológica en el cultivo de cacao. Documento desarrollado en cumplimiento del Convenio de Cooperación suscrito entre la Agencia de los Estados Unidos para el Desarrollo Internacional (USAID) y el Instituto Interamericano de Cooperación para la Agricultura (IICA) Disponible en: http://www.iica.int. [ Links ]
Rijavec, T.; Lapanje, A. 2016. Hydrogen cyanide in the rhizosphere: Not suppressing plant pathogens, but rather regulating availability of phosphate. Frontiers Microbiology 7: 1–14. [ Links ]
Sandhya, V.; Shrivastava, M.; Ali, S.; Shiva, V. 2017. Endophytes from Maize with plant growth promotion and biocontrol activity under drought stress 1. Russian Agricultual Sciences, 43: 22–34. [ Links ]
Someya, N.; Tsuchiya, K.; Yoshida, T.; Sawada, H. 2007. Combined application of Pseudomonas fluorescens strain LRB3W1 with a low dosage of benomyl for control of cabbage yellows caused by Fusarium oxysporum f. sp. conglutinans. Biocontrol Science and Technology. 17: 20–31. [ Links ]
Srivastava, R.; Khalid, A.; Singh, U.; Sharma, A. 2010. Evaluation of arbuscular mycorrhizal fungus, fluorescent Pseudomonas and Trichoderma harzianum formulation against Fusarium oxysporum f. sp. lycopersici for the management of tomato wilt. Biological Control 53: 24–31. [ Links ]
Suárez, L. 2016. Molecular identification of Moniliophthora roreri isolates from cocoa orchards in Norte de Santander. Genomics, Molecular Genetics and Biotechnology, 65: 51–57. [ Links ]
Suárez, L.; Rangel, A. 2013. Aislamiento de microorganismos para control biológico de Moniliophthora roreri. Acta Agronomica 62: 370–378. [ Links ]
Viana, F.; Freire, F.; Cardoso, J.; Vidal, J. 2003. Principais doenças do maracujazeiro na região nordeste e seu controle. Comunicado Técnico 86: 1–11. [ Links ]
White, T.; Bruns, T.; Lee, S.; Taylor, J. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In Academic Press 2: 315–322. [ Links ]
Yang, J.; Liang, L.; Li, J.; Zhang, K. 2013. Nematicidal enzymes from microorganisms and their applications. Applied Microbiology and Biotechnology 97: 7081–7095. [ Links ]
Zdor, R. 2014. Bacterial cyanogenesis: impact on biotic interactions. Journal of Applied Microbiology 5: 267–274. [ Links ]
* Corresponding author
E-mail: hcanchignia@uteq.edu.ec (H. Canchignia-Martínez).
Received June 12, 2019.
Accepted August 27, 2019.