Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.4 Trujillo oct. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.04.02
ARTÍCULO ORIGINAL
Reguladores de crecimiento en el cultivo in vitro de tres cultivares portainjertos de vid (Vitis vinifera L.) para su uso en la industria del pisco
Growth regulators for in vitro culture of three grapevine rootstocks (Vitis vinifera L.) used in the pisco industry
Antonietta Gutierrez-Rosati* ORCID iD: https://orcid.org/0000-0003-4593-4731; Patrick Gonzales B.
Centro de Investigación en Recursos Genéticos, Biotecnología y BioseguridadCIRGEBB, Facultad de Ciencias, Universidad Nacional Agraria La Molina. Av. La Molina S/N, La Molina, Lima 12 – Perú.
Resumen
El objetivo del estudio fue evaluar el uso de reguladores de crecimiento en medios de cultivo para tres cultivares portainjertos de la especie Vitis vinifera L. variedad Harmony, Freedom y Paulsen utilizadas en la industria pisquera. Se estudiaron la bencilaminopurina (BAP) y del ácido naftalenacético (ANA), como reguladores de crecimiento en distintas concentraciones y combinaciones, sobre el medio de cultivo MS/2. Se analizaron 21 tratamientos para cada cultivar. Las variables evaluadas fueron longitud de planta, número de hojas, longitud de raíz y características visuales no cuantitativas a los 15 y 45 días después de la siembra. De los resultados obtenidos, para los cultivares de Harmony, Freedom y Paulsen, se concluye que el mejor medio de propagación es MS/2 + ANA 0,5 ppm; MS/2 + ANA 0,05 ppm; MS/2 + ANA 0,075 ppm respectivamente. También, se observó una respuesta genotipo dependiente para los efectos de la auxina y citoquinina sobre los esquejes. Sin embargo, todos los esquejes desarrollaron tejidos callosos al utilizarse BAP.
Palabras clave: ácido naftalenacético (ANA); bencilaminopurina (BAP); micropropagación; Harmony; Paulsen; Freedom.
Abstract
The objective of the study was to evaluate the use of growth regulators in culture media for three grapevine rootstock cultivars (Vitis vinifera L.) variety Harmony, Freedom and Paulsen used in the pisco industry. Benzylaminopurine (BAP) and naphthalenacetic acid (ANA), were tested as growth regulators in different concentrations and combinations, supplemented to the MS/2 culture medium. 21 treatments were analyzed for each cultivar. The variables evaluated were plant length, number of leaves, root length and other non-quantitative characteristics at 15 and 45 days after sowing. From the results obtained, it is concluded that the best media of propagation is MS/2 + ANA 0.5 ppm for Harmony; MS/2 + ANA 0.05 ppm for Freedom and MS/2 + ANA 0.075 ppm for Paulsen cultivar. Also, a genotype-dependent response was observed for the effects of auxin and cytokinin on the cuttings. However, all cuttings developed callous tissues when BAP was added to the media.
Keywords: naphthaleneacetic acid (ANA); benzylaminopurine (BAP); micropropagation; Harmony; Paulsen; Freedom.
1. Introducción
La vid (Vitis vinifera L.) es un cultivo antiguo y de gran importancia económica (Borja-Bravo et al., 2016; González et al., 2015; Romero, 2017). En el año 2014 se cultivaron más de 7,5 millones de hectáreas (ha) de vid en el mundo; en los últimos 10 años, en el Perú, la producción de Piscose ha duplicado (Gestión, 2019). Siendo el departamento de Ica donde se concentra la mayor área cultiva de uva pisquera y la mayor producción de Pisco en Perú, representando un porcentaje importante para la economía regional (Cáceres y Julca, 2018). Por ello, la necesidad de incrementar la producción de vid, por la mayor demanda en el mercado nacional e internacional. Superando una producción de 30 toneladas por hectárea (MINAGRI, 2016).
El pisco, según Pszczólkowski y Lacoste (2016) se produce a partir de variedades de uvas criollas y algunas variedades introducidas en el Perú desde las Islas Canarias, donde las expediciones se abastecían de agua y víveres. Por la superficie cultivada con vid a nivel mundial, los bancos de germoplasma son una alternativa para conservar la diversidad genética (Schuck et al., 2011) a corto, mediano y largo plazo (Engelmann, 2011). Por ello, Melyan et al. (2015) recomiendan hacer uso de métodos biotecnológicos como el cultivo de tejidos vegetales, herramienta utilizada exitosamente en varios países del mundo que han desplazado a los sistemas tradicionales de producción de plántulas como la propagación por sarmiento.
Existen investigaciones con cultivos de vid para la producción de pisco. Cáceres et al. (2017) caracterizó ocho variedades de uvas pisqueras (Torontel, Italia, Mollar, Quebranta, Negra criolla, Albilla, Moscatel y Uvina)" a fin de describir las variedades que aportan mayor precisión a la caracterización y sirven de guía a los productores de Pisco y productores de uvas. La caracterización busca información técnica de referencia a las prácticas productivas y la productividad en el lugar de estudio, entender la toma de decisión de los productores en relación con el funcionamiento de sus sistemas de producción e identificar los principales factores limitantes (físicos, biológicos y económicos) y las posibilidades de generar alternativas para los sistemas de caracterización (Santistevan, 2016). Cáceres (2019) en un estudio realizado caracterizó, tipificó y evaluó la sustentabilidad de las fincas productoras de vid para Pisco en la provincia de Ica, Perú. Stavrakaki y Biniari (2016) concluyen que la genotipificación es una técnica molecular que analiza el ADN de las plantas e identifica las distintas variedades de Vitis. Existen variedades de vid para la producción de pisco (Morón, 2017).
La propagación in vitro de cultivos de vid bajo condiciones de cultivo estándar (Melyan et al., 2015), su respuesta suele estar relacionada por la variedad utilizada (Morón, 2017), el genotipo y medio de cultivo (Valdéz, 2005), y los reguladores de crecimiento vegetal (Nookaraju et al., 2008). Cavazos-Galindo et al. (2018) realizó estudios de Propagación clonal de dos cultivares adultos de vid (Vitis vinífera L.) para su conservación in vitro.
La conservación in vitro consiste en el cultivo de plantas o explantes, obtenidos mediante micropropagación en condiciones de asepsia, libres de patógenos, a bajo costo y condiciones controladas en cámaras de cultivo (Bonilla et al., 2015). Sin embargo, es importante regenerar frecuentemente la colección mantenida in vitro para evitar el envejecimiento fisiológico del material vegetal.
En este sentido, la presente investigación, se realizó en las instalaciones del Centro de Investigación en Recursos Genéticos, Biotecnología y Bioseguridad (CIRGEBB) de la Universidad Nacional Agraria La Molina (UNALM), con el objetivo de evaluar el uso de reguladores de crecimiento en el medio de cultivo in vitro para tres cultivares de vid de uso comercial como portainjertos, Harmony, Paulsen y Freedom, eligiendo el o los medios de cultivo con la mejor respuesta con relación al balance de reguladores de crecimiento para cada cultivar a partir de la evaluación de las variables longitud del explante (cm), número de hojas y longitud de raíz (cm).
2. Materiales y métodos
El presente estudio fue conducido en el laboratorio del Centro de Investigación de Recursos Genéticos, Biotecnología y Bioseguridad (CIRGEBB) de la Universidad Nacional Agraria La Molina (UNALM), distrito de La Molina, departamento de Lima, Perú. Localizado a 12° 4’ 55’’ S y 76° 56’ 53’’ O.
El material vegetal utilizado fueron microesquejes, de la especie Vitis vinifera L. de tres cultivares portainjertos, de uso comercial, variedad Harmony, Freedom y Paulsen. Los esquejes provienen del invernadero del CITE Vid.
El material vegetal de inicio son plántulas previamente introducidas a condiciones in vitro por el CIRGEBB de la UNALM, se mantuvieron en incubación en el medio de manutención, se le denominó medio control compuesto por medio basal Murashige y Skoog (1962); sin reguladores de crecimiento; a mitad de concentración, suplementado con sacarosa al 3%, pH 5,5 y 7,5% de agar. 60 días después los explantes de plántulas desarrolladas en este medio fueron sembrados en los diferentes tratamientos experimentales, transcurrido 15 y 45 días, se evaluaron las variables longitud del explante (cm) y número de hojas, mientras que la longitud de raíz (cm) se midió solo a los 45 días.
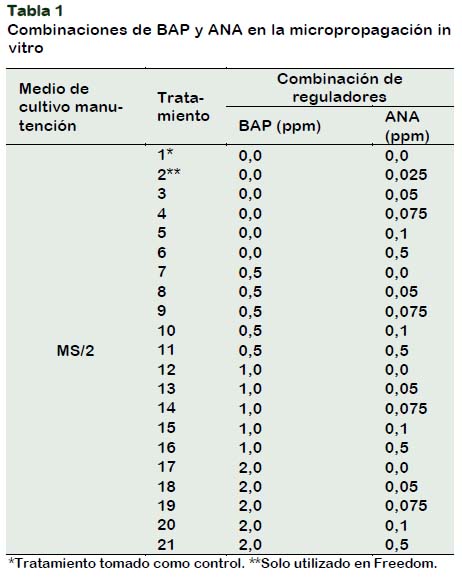
A partir de estudios realizados en propagación in vitro en Vitis vinifera L. por varios autores como Poudel et al. (2005); Khan et al. (2015); Melyan et al. (2015); Beza et al. (2017) y con portainjertos de Vitis vinifera (Abido et al., 2013; Singh, 2014). Se determinó el medio de cultivo y las concentraciones reguladoras de crecimiento que conforman los 21 tratamientos del estudio. Es así que para el acondicionamiento del material de ex vitro a in vitro, se utilizó el medio basal MS a concentración completa (1x), mientras que, para la micropropagación, MS a mitad de concentración (x/2 o MS/2); medio ampliamente usado por varios autores como medio para el establecimiento de explantes in vitro. En cuanto al uso de reguladores de crecimiento, las concentraciones varían de autor en autor, según el genotipo estudiado. La presente investigación se utilizaron auxinas y citoquininas en un rengo de 0,0 – 2,0 ppm BAP y de 0,0 – 0,5 ppm ANA.
Los tratamientos (Tabla 1) consistieron en distintas concentraciones de bencilaminopurina (BAP) y de ácido naftalenacético (ANA).
3. Resultados y discusión
Cultivar Harmony (1613 couderc x dog ridge)
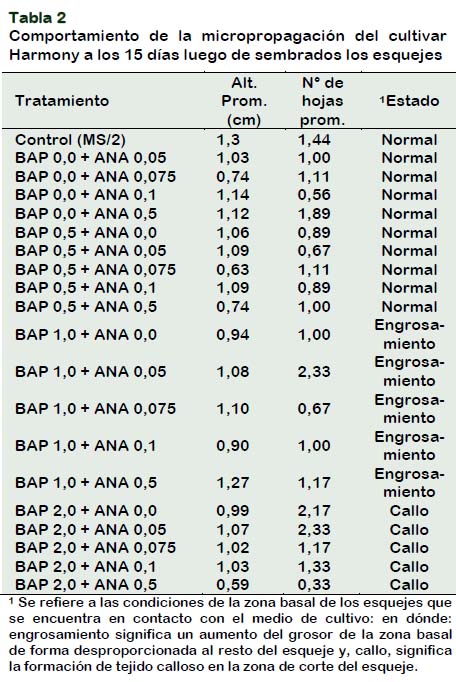
Al evaluar las variables en estudio a los 15 días de tratamiento se pudo apreciar que el cultivar mostró un buen crecimiento en el medio control (sin reguladores de crecimiento) en comparación a los tratamientos con reguladores de crecimiento (Tabla 2). Observándose buen desarrollo de las hojas y raíces (Figura 1A). Mientras que, el tratamiento BAP 2,0 + ANA 0,5 presentó el menor crecimiento. Similar resultado fue reportado por Rodríguez et al. (2012), al evaluar Lepidium peruvianum Chacón "maca" in vitro, concluyen que el ácido naftalenacético al 0,01; 0,05 y 0,10 mg/L de medio, no favorece la germinación ni el crecimiento de las plántulas, mientras que el bencilaminopurina a las mismas concentraciones no promueve el crecimiento de las plántulas; aunque al 0,10 mg/L favorece el número de hojas. Borges et al. (2011) en estudios realizados en plantas micropropagadas de Dioscorea alata L. con combinación de los reguladores de crecimiento, ANA/BAP (0,01/0,01 mg/L-1), en el medio de cultivo MS, incrementaron los indicadores de desarrollo de las plantas in vitro obteniendo en el número de nudos de novo (3,5), longitud del vástago (4,1 cm), número de hojas (3,8), número de raíces (5,7) y longitud de las raíces (6 cm).
Todos los tratamientos en donde la citoquinina estuvo ausente la planta presentaron buen desarrollo, en especial el tratamiento con ANA 0,5 ppm, el cual presentó buen desarrollo radicular (Figura 1B). Todos los tratamientos en donde se utilizó BAP, solo o combinado con ANA, presentaron formaciones inusuales en los cortes de los esquejes, y formación de tejido calloso, esta condición complica el desarrollo de la raíz de la zona de corte por lo que planta tendrá problemas en su crecimiento, asimismo se observó la formación de raíces tipo zanco que no favorecen la aclimatación de las futuras plántulas.
Las evaluaciones realizadas a los 15 y 45 días mostraron semejante comportamiento. El cultivar Harmony presentó un buen crecimiento en el medio MS/2 sin presencia de reguladores, tanto en su nivel radicular como aéreo. Las raíces tuvieron importantes longitudes, y sus hojas pasaron los 2 cm de largo, observándose asimismo buena respuesta en el medio MS/2 suplementado con ANA 0,5 ppm (Figura 1B y 1C).
1103 Paulsen (V. berlandieri x V. rupestris)
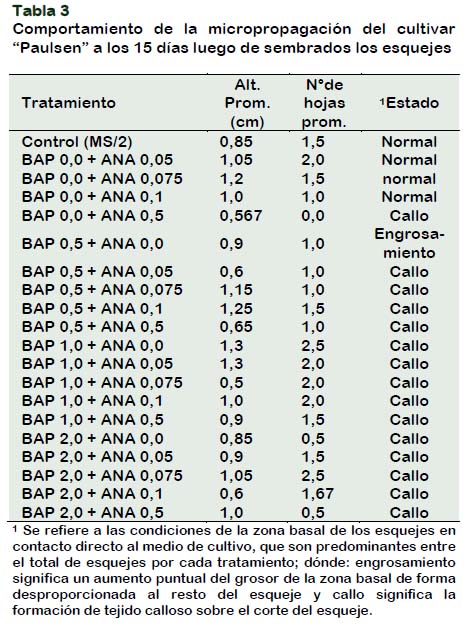
Los resultados observados a los 15 días de instalado los tratamientos indican que el crecimiento del cultivar Paulsen es ligeramente más lento que el cultivar Harmony.
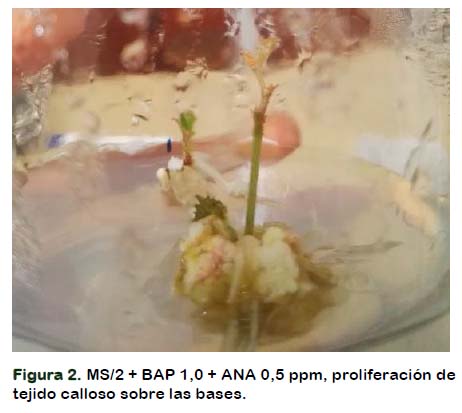
La variedad Paulsen presenta mayor susceptibilidad ante la presencia de los reguladores de crecimiento, en especial de las citoquininas exógenas como BAP, esto resulta evidente al visualizar una gran cantidad de esquejes con tejido callos en la zona de corte del esqueje, incluso a concentración baja de BAP (Tabla 3 y Figura 2).
Es importante precisar que a concentraciones elevadas de BAP se produjeron múltiples brotes deformes, pequeños y con claros indicios de hiperhidratación y crecimiento de callo en la zona de corte. Similar resultado fue reportado por Gonzales (2017). Bhojwani y Dantu (2013) reportaron que, concentraciones elevadas de BAP pueden provocar callos, hojas de forma inusual e inducir la hiperhidratación o cristalización.
La mejor organogénesis se logra con un balance específico para la variedad entre auxinas y citoquininas (Gonzales, 2017).
A los 45 días fue notoria la susceptibilidad del cultivar Paulsen a concentraciones elevadas de reguladores de crecimiento. La susceptibilidad de este cultivar a los reguladores de crecimiento, indicaría que el cultivar Paulsen presenta cantidades considerables de auxinas y citoquininas endógenas, por lo que las dosis de elevadas concentraciones alteraron drásticamente su desarrollo.
Si bien el tratamiento control manifestó buen desarrollo, este fue superado por las respuestas a los medios MS/2+ ANA (0,05; 0,075 y ANA 0,1) ya que las hojas manifestaron mayor tamaño y una coloración verde más intensa y un mayor grosor del tallo.
Freedom (1613 couderc x dog ridge)
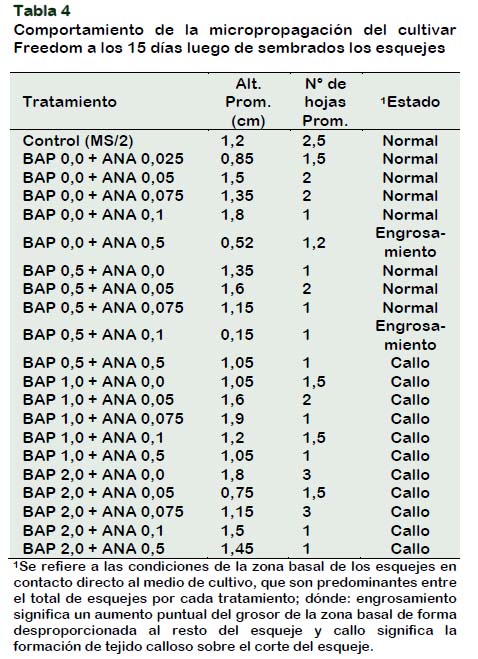
El crecimiento de las plantas en el cultivar Freedom manifestó ser ligeramente superior a los dos cultivares anteriormente descritos. Al igual que en los otros cultivares, el tratamiento control mostró buen crecimiento de plántulas, con buenos tamaños y buena producción de hojas. Sin embargo, se evidenció que este cultivar presenta una mayor susceptibilidad a la presencia de ANA en el medio de cultivo, como se nota en el Tabla 4.
El cultivar Freedom responde mejor en aquellos medios que incorporan concentraciones bajas de ANA (Gonzales, 2017), Por ello, se utilizó concentraciones muy bajas de ANA (0,025 ppm) para micropropagar este cultivar.
Las variedades Freedom y Harmony presentaron tolerancia de las citoquininas, mientras que la variedad Paulsen no presentó tolerancia a las citoquininas. El resultado obtenido podría deberse a que las dos primeras variedades comparten parentales en su origen genético (Walker, 2004).
A los 45 días los resultados evidenciaron buena respuesta a bajas concentraciones de BAP. Concentraciones de ANA superiores a 0,1 ppm, generan alteraciones en el desarrollo de las plántulas. Esto nos indicaría que este cultivar tendría una producción endógena mejor balanceada de fitohormonas a comparación de las demás.
En los demás cultivares, la presencia de BAP en el medio de cultivo generó mayor producción de brotes y por ende follaje, es decir más yemas; sin embargo, estas no son material óptimo para ser usado en la propagación y, menos deseables para el proceso de aclimatación.
Longitud de las plántulas
Todos los cultivares desarrollaron rápidamente bajo condiciones in vitro, en los primeros 15 días, tuvieron la mayor longitud los tratamientos que incluían BAP, con excepción en la zona de corte donde se formaron callos. Esto se pudo deber a uno de los efectos de las citoquininas que es romper la dormancia de las yemas y la dominancia apical (Singh, 2014). Williams y Stahly (1968), reportaron que la aplicación de citoquininas a las yemas axilares de los manzanos y los brotes de albaricoquero, permiten romper la dominancia apical. Los mismos resultados fueron obtenidos por Weaver (1976) en yemas de Vitis vinifer. Con el paso de los días estos esquejes manifestaron estancamiento en su desarrollo, siendo superados por los tratamientos con ausencia de BAP. Sajid et al. (2006) y Tehrim et al. (2013) observaron que a mayor concentración de BAP más decrece la elongación de los esquejes. Ello se debería a que, elevada concentración de citoquininas conlleva a una producción elevada de etileno que, a su vez, limita la regeneración de brotes e inhibe la elongación de los entrenudos (Khan et al., 2015). No obstante, otros estudios encontraron resultados opuestos como los encontrados por Poudel et al. (2005), quiénes en su estudio observaron que los brotes continuaban creciendo aun cuando incrementaba la concentración de BAP, para dos genotipos de vides. Otros autores evidenciaron que la elongación de los esquejes es influenciada por las concentraciones de los reguladores de crecimiento (San Pedro et al., 2017), contrarrestando su desarrollo a elevadas concentraciones (Kadota y Niimi, 2003). En el presente estudio se pudieron apreciar resultados mixtos en referencia a los mencionados autores.
Generación foliar
Los resultados indicarían, que existió una correlación positiva entre incremento de concentraciones de hormonas y el número de hojas. El aumento en el número de hojas se debió, principalmente, a la formación de múltiples brotes de la mano de concentraciones de BAP por encima de 1,0 ppm. Poudel et al. (2005) en un estudio realizado en dos genotipos de vid (una variedad de vid silvestre y un cultivar híbrido interespecífico de Vitis vinifera L.) obtuvieron la mayor cantidad de brotes 3,8 y 3,1 respectivamente, en el tratamiento con 10 μM de BAP aproximadamente 2,0 ppm. Estos resultados concuerdan con los encontrados por Tehrim et al. (2013) y Khan et al. (2015), todos en distintos cultivares de vid, donde obtuvieron entre 4-5 brotes por explante en concentraciones superiores a 1,0 ppm. Por otro lado, Zur et al. (2015) reportaron que la combinación de citoquininas y auxinas tienen acción en el control y división celular. Rodríguez et al. (2014) obtuvieron respuesta caulogénica en callos de cotiledones en un medio sin reguladores de crecimiento y la rizogénica en callos de hojas con 0,1 mg L-1 de ANA + 1,0 mg L-1 de BAP. Křižan et al. (2012) encontró que la combinación de citoquininas y auxinas significa una mejora en el desarrollo de brotes a comparación de citoquininas individuales. Usando 2,0 ppm de BAP obtuvo, en promedio, 3,62 brotes, y cuando le agregó a esa concentración 0,01 ppm de ANA logró obtener 8,77 brotes en promedio. También, hay cultivares cuya tolerancia a las concentraciones elevadas es superior. Abido et al. (2013) ensayó con combinaciones de concentraciones de 1,0; 2,0; 3,0 y 4,0 ppm BAP y 0,1; 0,2 y 0,3 ppm
ANA en Vitis vinifera L. cv. Moscatel de Alejandría. El máximo número de brotes se produjo con el medio conteniendo 3,0 ppm BAP + 0,2 ppm ANA. Esta combinación de reguladores es bastante superior a la que podría resistir cualquiera de las tres plantas usadas en la presente investigación. Además, San Pedro et al. (2017), encontraron que, al suplementar al medio con citoquininas, se mejoró la tasa de multiplicación de brotes en vid al promover, posiblemente, el crecimiento de las yemas axilares en el cultivo de tejidos.
No existe una relación lógica precisa para determinar qué tratamiento fue el que produjo más brotes, pues dependió bastante del desarrollo del callo, del corte durante el sembrado, la longitud inicial del esqueje, etc. Pero sí se puede hablar de una tendencia.
Enraizamiento
El desarrollo de raíces entre los diferentes esquejes, incluso en un mismo tratamiento, fue altamente irregular; Según lo enuncia Ludwig-Müller (2005), las raíces adventicias son menos predecibles en su lugar de origen celular que ningún otro tejido.
En general, el enraizamiento fue según lo esperado, es decir, aquellos tratamientos con solo auxinas en el medio presentaron raíces con mayores longitudes que aquellos con solo citoquininas o en combinación. Esto coincide con lo reportado por San Pedro et al. (2017). Sin embargo, no es excluyente el uso de citoquininas para el enraizamiento. Van Staden et al. (2008) demuestra la inducción de raíces adventicias en ausencia de auxinas y en presencia de citoquininas, pero pueden provocar formas inusuales en las hojas e inducir al brote a que hiperhidrate (Van Staden et al., 2008). En muchos casos, incluso sobre los callos producidos por las elevadas concentraciones de reguladores hubo crecimiento de raíces, pero los tejidos se mostraron deformes y quebradizos. Este hecho no es singular, pues el crecimiento de raíces advénticias se puede dar por tanto organogénesis de células diferenciadas como por tejido calloso.
Proliferación de callos
El principal inconveniente de tener explantes con formaciones callosas en la base de los explantes es básicamente la reducción dramática de asimilación de nutrientes en la etapa temprana, y en etapa avanzada, es la dificultad que representa la aclimatación del esqueje al tener estructuras tan friables en sus raíces. También, en aquellas micropropagaciones que involucra la regeneración de todo un individuo, representa un inconveniente la alta variabilidad generada, es decir, la uniformidad genética no se puede asegurar. Se conoce que altas concentraciones de ANA podrían inducir a la formación de callos, a pesar de ello se prefiere su uso sobre AIA o IBA en plantas leñosas (Bhojwani y Dantu, 2013). La exposición prolongada, además, podría causar clorosis en las hojas dificultando la aclimatación de las futuras plántulas (Bhojwani y Dantu, 2013).
Son muchos los autores que consideran a las concentraciones endógenos de fitohormonas como pieza clave en la órganogénesis in vitro (Aremu et al., 2014; Wang et al., 2015; Cosic et al., 2015). En el presente estudio, si bien cada cultivar tuvo su propia respuesta a la formación de callos en los explantes entre los reguladores de crecimiento estudiados, la presencia de BAP fue sin duda, el principal factor detonante en la formación de callos.
La mejor organogénesis se logra con un balance específico entre auxinas y citoquininas, específico para cada variedad.
Conclusiones
De los resultados obtenidos en el presente estudio se concluye que, el cultivo in vitro de los cultivares Harmony, Paulsen, Freedom responde independientemente a un medio óptimo de propagación. La expresión en el desarrollo in vitro es genotipo dependiente. El medio de cultivo con el mejor balance de reguladores de crecimiento para el cultivar Harmony es MS/2 + ANA 0,5 ppm; para el cultivar Freedom es MS/2 + ANA 0,05 ppm; y para el cultivar Paulsen es MS/2 + ANA 0,075 ppm. Se recomienda realizar un monitoreo constante de la evolución en el tiempo de los esquejes mientras estos se mantengan en medio con reguladores.
Agradecimientos
Los autores agradecen a INNOVATE Perú FIDECOM por el apoyo financiero para desarrollar esta investigación.
Referencias bibliográficas
Abido, A.I.A.; Aly, M.A.M.; Hassanen, S.A.; Rayan, G.A. 2013. In vitro propagation of grapevine (Vitis vinifera L.) Muscat of Alexandria cv. for conservation of endargerment. Middle-East. Journal of Scientific Research 13: 328-337. [ Links ]
Aremu, A.O.; Placˇková, L.; Bairu, M.W.; Novák, O.; Szu¨œvá, L.; Doležal, K.; Finnie, J.F.; Van Staden, J. 2014. Endogenous cytokinin profiles of tissue-cultured and acclimatized ‘Williams’ bananas subjected to different aromatic cytokinin treatments. Plant Sci 214: 88–98.
Beza, K.; Feyissa, T.; Girma, B. 2017. In vitro micropropagation of grape vine (Vitis vinifera L.) from nodal culture. African Journal of Biotechnology 16: 2083-2091. [ Links ]
Bhojwani, S.S; Dantu P.K. 2013. Plant Tissue Culture: an introductory text. Springer, Agra, Uttar Pradesh. India. [ Links ]
Bonilla, M.; Mancipe, C.; Aguirre, A. 2015. Conservación in vitro: una perspectiva para el manejo de los recursos fitogenéticos. Revista de Investigación Agraria y Ambiental 6(1): 67-82. [ Links ]
Borges, M.; Destrade, R.; Meneses, S.; Gómez, R.; Malaurie, B.; Hamon, P.; Charles, L. 2011. Optimización de un medio de cultivo para plantas micropropagadas de Dioscorea alata L. Revista Colombiana de Biotecnología 13(2): 221-228. [ Links ]
Borja-Bravo, M.; García-Salaza, J.A.; Reyes-Muro, L.; Arellano-Arciniega, S. 2016. Rentabilidad de los sistemas de producción de uva. Revista Agricultura, Sociedad y Desarrollo 13(1): 151-168. [ Links ]
Cáceres, H.; Julca, A. 2018. Caracterización y tipología de fincas productoras de vid para Pisco en la región Ica-Perú. Idesia 36(3): 35-43. [ Links ]
Cáceres, H.; Quispe, P.; Pignataro, D.; Orjeda, G.; Lacombe, T. 2017. Caracterización morfológica de variedades de vid para producción de Pisco bajo condiciones de la zona media del valle de Ica, Perú. Scientia Agropecuaria 8(1): 63-72. [ Links ]
Cáceres, H. 2019. Caracterización y sustentabilidad de fincas productoras de vid para pisco en Ica, Perú. Tesis de doctorado, Universidad Nacional Agraria La Molina, Lima, Perú. 149 pp. [ Links ]
Cavazos-Galindo, J.; Alvarado-Gómez, O.G.; Santos-Haliscak, J.; Moreno-Degollado, G.; Rodríguez Fuentes, H.; Ojeda-Zacarías, Ma. 2018. Propagación clonal de dos cultivares adultos de vid (Vitis vinifera L.) para su conservación in vitro. Polibotánica 45: 181-190. [ Links ]
Cosic, T.; Motyka, V.; Raspor, M.; Savic, J.; Cingel, A.; Vinterhalter, B.; Vinterhalter, D.; Trávníčková, A.; Dobrev, P.; Bohanec, B.; Ninkovic, S. 2015. In vitro shoot organogenesis and comparative analysis of endo-genous phytohormones in kohlrabi (Brassica oleracea var. gongylodes): effects of geno-type explant type and applied cytokinins. Plant Cell Tissue and Organ Culture 121: 741-760. [ Links ]
Engelmann, F. 2011. Use of biotechnologies for the conservation of plant biodiversity. In Vitro Cell. Dev. Biol. Plant. 47: 5-16. [ Links ]
Gestión. 2019. Producción de Pisco crecerá más de 7% el 2019, ¿qué factores impulsarán este resultado? Disponible en: https://gestion.pe/economia/produccion-pisco-crecera-7-2019-factores-impulsaran-resultado-257603-noticia/ [ Links ]
Gonzales, P. 2017. Optimización del uso de reguladores de crecimiento para el cultivo in vitro de tres cultivares portainjertos en Vitis vinifera L. (Vid) para uso en la industria pisquera: "Harmony", "Paulsen" y "Freedom. Tesis de Biólogo, Universidad nacional Agraria La Molina, Lima, Perú. 114 pp. [ Links ]
González, A.; Ramón, A.; Hernández, S. 2015. El cultivo del viñedo como recurso turístico cultural: el caso de la geria (Lanzarote. Islas Canarias, España). Papeles de Geografía 61: 109-121. [ Links ]
Kadota, N.; Niimi, Y. 2003. Effects of cytokinin types and their concentrations on shoot proliferation and hyperhydricity in in vitro pear cultivar shoots. Plant Cell Tissue Organ Cult 72: 261-265. [ Links ]
Khan, N.; Ahmed, M.; Hafiz, I.; Abbasi, N.; Ejaz, S.; Anjum, M. 2015. Optimizing the concentrations of plant growth regulators for in vitro shoot cultures, callus induction and shoot regeneration from calluses of grapes. OENO One 49(1): 37-45. [ Links ]
Křižan, B.; Ondrušiková, E.; Moudrá, J. 2012. The effect of media composition on multiplication of grape rootstocks in vitro. Acta Universitatis Agriculturae et Silviculturae Mendelianae Brunensis 60(8): 141-144.
Ludwig-Müller, J; Vertocnik, A.; Town, C.D. 2005. Analysis of indole-3-butyric acid-induced adventitious root formation on Arabidopsis stem segments. J. Exp. Bot. 56: 2095-2105. [ Links ]
Melyan, G.; Sahakyan, A.; Harutyunyan, A. 2015. Micropropagation of grapevine (Vitis vinifera L.) seedless cultivar "Parvana" through lateral bud development. Vitis. Journal of Grapevine Research 54: 253-255. [ Links ]
MINAGRI [Ministerio de Agricultura y Riego, PE]. 2016. Series Históricas de Producción Agrícola: Compendio Estadístico. Lima, PE. Disponible en: http://frenteweb.minag.gob.pe/sisca/?mod=co nsulta_cult. [ Links ]
Morón, J. 2017. La vid en el Perú y la elaboración del Pisco en Ica. Cultura, Ciencia y Tecnología. ASDOPEN 11: 35-48. [ Links ]
Murashige, T.; Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15: 473-479. [ Links ]
Nookaraju, A.; Barreto, S.M.; Agrawal, D.C. 2008. Rapid in vitro propagation of grapevine cv. Crimson Seedless-Influence of basal media and plant growth regulators 10(1): 44-49.
Poudel, P.R.; Kataoka, I.; Mochioka, R. 2005. Effect of plant growth regulators on in vitro propagation of Vitis ficifolia var. ganebu and its interspecific hybrid grape. Asian Journal of Plant Sciences 4: 466-71. [ Links ]
Pszczólkowski, P.; Lacoste, P. 2016. Variedades criollas, una oportunidad para el pisco de Chile. Rev. FCA Uncuyo 48(1): 239-251. [ Links ]
Rodríguez, C.; Nomberto, C.; Murga, S.; Ilich, S. 2012. Efecto del ácido naftalenacético y 6 bencilaminopurina en la germinación y crecimiento de Lepidium peruvianum Chacón "maca" in vitro. Revista Ciencia y Tecnología 8(2): 35-42. [ Links ]
Rodríguez, M.; Latsague, M.; Chacón, M.; Astorga, P. 2014. Inducción in vitro de callogénesis y organogénesis indirecta a partir de explantes de cotiledón, hipocótilo y hoja en Ugni molinae. BOSQUE 35(1): 111-118. [ Links ]
Romero, Y. 2017. Variación de la edafología y estrés hídrico en Vitis vinifera L. con relación al relieve en un viñedo del Valle de Guadalupe, B.C., México. Tesis de maestría, Centro de Investigación Científica y de Educación Superior de Ensenada, Baja California, Mexico. 66 pp. [ Links ]
Sajid, G.M.; Ilyas, M.K.; Anwar, R. 2006. Effect of diverse hormonal regimes on in vitro growth of grape germplasm. Pakistan Journal of Botany 38: 385-391. [ Links ]
San Pedro, T.; Peiro, R.; Villanova, J.; Olmos, A.; Gisbert, C. 2017. In vitro propagation of Vitis vinifera L. cv. ‘Monastrell’. Electron. J. Biotechnol. 27: 80-83.
Santistevan, M. 2016. Sustentabilidad de las fincas cafetaleras en Jipijapa (Manabí-Ecuador). Revista Saber y Hacer 3(1): 23-35. [ Links ]
Schuck, M.R.; Biasi, L.A.; Mariano, A.M.; Lipski, B.; Riaz, S.; Walker, M.A. 2011. Obtaining interspecific hybrids, and molecular analysis by microsatellite markers in grapevine. Pesquisa Agropecuária Brasileira 46(11): 1480-1488. [ Links ]
Singh, A. 2014. Studies on in vitro propagation of promising grape (Vitis vinifera L.) rootstocks. Tesis de maestría, Punjab Agricultural University, Ludhiana. India. 59 pp. [ Links ]
Stavrakaki, M.; Biniari K. 2016. Genotyping and phenotyping of twenty old traditional Greek grapevine varieties (Vitis vinifera L.) from Eastern and Western Greece. Scientia Horticulturae 209: 86–95. [ Links ]
Tehrim, S.; Mirza, M.Y.; Sajid, G.M. 2013. Comparative study of different growth regulators for efficient plant regeneration in grapes. Pakistan Journal of Agricultural Research 26: 275-289. [ Links ]
Valdéz, J.G. 2005. Immature embryo rescue of grapevine (Vitis vinifera L.) after an extended period of seed trace culture. Vitis Journal of Grapevine Research 44(1): 17-23. [ Links ]
Van Staden, J.; Zazimalova, E.; George, E.F. 2008. Plant Growth Regulators II: Cytokinins, their Analogues and Antagonists. En Plant propagation by tissue culture. 3era Edición. v. 1, C6. Editorial Springer. Dordrecht, Holanda. 205-227. [ Links ]
Wang, H.; Li, M.; Yang, Y.; Dong, J.; Jin, W. 2015. Histological and endogenous plant growth regulators changes associated with adventitious shoot regeneration from in vitro leaf explants of strawberry (Fragaria x ananassa cv. ‘Honeoye’). Journal of Plant Biotechnology 123(3): 479-488.
Walker, A. 2004. Potential rootstocks for use in Chile with regard to soil conditions and limitations. En Seminario Vides Injertadas Asociación Gremial de Viveros Frutales de Chile. Santiago, 4 de agosto, 2004. 1-13. [ Links ]
Weaver, R. 1976. Reguladores de crecimiento de las plantas en la agricultura. Editorial Trillas. México D.F., México. 65 pp. [ Links ]
Williams, M.V.; Stahly, E.A. 1968. Effect of cytokinins on apple shoot development from axillary buds. HortScience 3: 68-69. [ Links ]
Zur, I.; Dubas, E.; Krzewska, M.; Janowiak, F. 2016. Current insights into hormonal regulation of microspore embryogenesis. En Seguí-Simarro, J. (Ed). Doubled haploidy in model and recalcitrant species. Lausanne: Frontiers Media 6(1): 624. [ Links ]
* Corresponding author
E-mail: antonietta@lamolina.edu.pe (A. Gutierrez-Rosati).
Received April 2, 2019.
Accepted October 21, 2019.