Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.4 Trujillo out. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.04.06
ARTÍCULO ORIGINAL
Bioherbicida a partir de extracto fenólico obtenido de residuos de almazaras
Bioherbicide from phenolic extract obtained from almazara waste
Juan Guevara González*; Claudia Narváez Flies; Aurora Marín Navarrete; Javiera Gutiérrez López; Constanza Troncoso Troncoso
Universidad Católica del Maule, Facultad de Ciencias Básicas, Departamento de Biología y Química. Avenida San Miguel 3605, Talca, Chile.
Resumen
El uso de herbicidas sintéticos ha demostrado tener efectos nocivos en el medio ambiente y en la salud humana. Una alternativa al uso de estos compuestos sintéticos es el desarrollo de pesticidas derivados de principios activos, encontrados en plantas o metabolitos secundarios provenientes de microorganismos, que presenten propiedades fitotóxicas, pero de poca o nula toxicidad en mamíferos y utilizables en agricultura orgánica. En este contexto, el presente trabajo analizó la capacidad bioherbicida de un extracto fenólico obtenido de alpechín, que es un residuo líquido producido en la obtención de aceite de oliva. El efecto fitotóxico fue evaluado a través de pruebas de germinación de semillas de trigo (Triticum aestivum). La efectividad del extracto fenólico fue comparada con un herbicida comercial cuyo principio activo es Simazina. Los resultados muestran que a concentraciones de 100 ppm (equivalentes de ácido gálico) aproximadamente el 10% de las semillas germinan. Las pruebas a concentraciones de 480 y 1050 ppm inhiben todas las etapas de la germinación. A diferencia de las pruebas con el extracto fenólico, el herbicida comercial no detiene la emergencia radicular en las semillas. Sin embargo, ellas aparecen con deformaciones y no logran desarrollarse de manera normal.
Palabras clave: fenol; bioherbicida; alpechín; germinación; fitotoxicidad.
Abstract
The use of synthetic herbicides has been shown to have harmful effects on the environment and human health. An alternative to the use of these synthetic compounds is the development of pesticides derived from active principles, found in plants or secondary metabolites from microorganisms, which have phytotoxic properties, but of little or no toxicity in mammals and that can be used in organic agriculture. In this context, the present work analyzed the bioherbicidal capacity of a phenolic extract obtained from olive mill wastewater, which is a liquid residue produced in the olive oil production. The phytotoxic effect was evaluated through germination tests of wheat seeds (Triticum aestivum). The effectiveness of the phenolic extract was compared with a commercial herbicide whose active principle is Simazine. The results show that at concentrations of 100 ppm (gallic acid equivalents) approximately 10% of the seeds germinate. Tests at concentrations of 480 and 1050 ppm inhibit all stages of germination. Unlike the tests with the phenolic extract, the commercial herbicide does not stop the radicular emergence in the seeds. However, they appear with deformations and fail to develop normally.
Keywords: phenol; bioherbicide; alpechin; germination; phytotoxicity.
1. Introducción
Los herbicidas químicos han constituido un método efectivo y económico para combatir las malezas; sin embargo, la población ha comenzado a preocuparse respecto a la cantidad de residuos químicos que se pueden encontrar en alimentos y en el medioambiente, así como los efectos que éstos pueden tener en la salud humana (Gavrilescu et al., 2015; Van Bruggen et al., 2018; Jumarie et al., 2017; Diepens et al., 2017; Mikó et al. 2017; Špoljarić et al., 2018; Hasenbein et al., 2017; Hernandes et al. 2017). Existen variados estudios científicos que asocian la exposición crónica a pesticidas, especialmente herbicidas y fungicidas, con malformaciones congénitas y disminución de la fertilidad en mujeres dedicadas a actividades laborales relacionadas con dichos compuestos. El glifosato ha sido relacionado con diferentes tipos de cáncer, autismo, Alzheimer y Parkinson (Cavieres, 2004; Van Bruggen et al., 2018, Gouveia et al., 2018; Varona et al., 2012; Thundiyil et al., 2008). Junto a los efectos en la salud humana, también se han reportado efectos negativos en el medioambiente. Un problema que actualmente ha tomado gran importancia es el efecto de los pesticidas en la disminución de los polinizadores, en especial las abejas (Stanley et al., 2015).
Una alternativa al uso de herbicidas sintéticos, que ha tomado cada vez más importancia, es el desarrollo de pesticidas derivados de principios activos presentes en plantas o metabolitos secundarios provenientes de microorganismos (Reichert et al., 2019; Lawrance et al., 2019; Masi et al., 2019). Las características deseables en estos compuestos son: ser de rápida degradación, de poca o nula toxicidad en mamíferos y utilizables en agricultura orgánica (Seiber et al., 2014, Morra et al., 2018). Diversos compuestos bioactivos han sido aislados desde plantas como potenciales bioherbicidas (Kadioglu y Yanar, 2004). El aceite de clavo de olor (Eugenia caryophyllus) (Copping y Duke, 2007) y ácidos grasos obtenidos de Achillea gypsicola Hub-Mor y Achillea biebersteinii afan han sido probados como herbicidas naturales (Kordali et al., 2009). Pruebas de fitotoxicidad exitosas fueron realizadas con ácido pelargónico y gluten de maíz (Copping y Duke, 2007). Los fenoles y polifenoles también se encuentran entre los principios activos encontrados en plantas. Junto a sus ya conocidas propiedades antioxidantes (Balasandram et al., 2006; Yangui y Abderrabba, 2018) también han mostrado propiedades fitotóxicas, bactericidas y fungicidas (Martin et al., 2002; Medina et al., 2011; Yangui et al., 2010; Reigosa et al., 1999; Reigosa y PazosMalvido, 2007; El-Abbassi et al., 2017). Se ha demostrado que ellos influyen en variados procesos fisiológicos, tales como extensión celular para la migración, permeabilidad de membrana, síntesis de proteínas, actividad enzimática, balance iónico, síntesis de clorofila, fotosíntesis, relación agua-planta y respiración (Araniti et al., 2014). De acuerdo a estudios realizados por Patterson (1981), los ácidos fenólicos ferúlico, p-cumárico y vanilico, reducen la biomasa al disminuir el contenido de clorofila en las hojas de soya (Patterson, 1981). Esta reducción está asociada a la disminución de la Mgquelatasa lo que produce una disminución en la acumulación de los contenidos de clorofila y porfirina. El ácido Vanilico, ha demostrado actuar como interferente en el metabolismo mitocondrial al reducir el Ca+2 (Yang et al., 2002).
Una fuente de obtención de fenoles y polifenoles son los residuos de la industria hortofrutícola. El alpechín y alperujo son residuos derivados de la manufactura de aceite de oliva, altamente contaminantes por su elevado contenido fenólico (Martin et al., 2002; Mantzavinos et al., 2009) por lo tanto, no se pueden eliminar directamente al suelo agrícola o cuerpos de agua. Diversos autores han extraído fenoles a través de diferentes métodos y probado sus propiedades fitotóxicas. Paraskeva et al. (2007) a través de una planta piloto de ultrafiltración, nanofiltración y osmosis reversa trataron alpechín para recuperar agua detoxificada con calidad para riego. Las propiedades fitotóxicas de la fracción fenólica fueron determinadas por pruebas de germinación de semillas de Avena sterilis L., Setaria sp L., Sinapis alba L., y Sonchus oleraceus L. Por su parte, Isidori et al. (2005), analizaron la fitotoxicidad de 15 fenoles comerciales de bajo peso molecular que se encuentran en el alpechín (catecol, cuatro ácidos benzoicos, tres ácidos fenilacéticos, tres feniletanoles y cuatro ácidos cinámicos). A través de pruebas de germinación de semillas de Cucumis sativus, Lepidium sativum y Sorghum bicolor, determinaron que el fenol más tóxico fue el catecol seguido de hidroxitirosol.
El presente trabajo tiene como objetivo comparar la germinación de semillas de trigo (Triticum aestivum), sometidas a dos tratamientos: a) extracto fenólico obtenido de alpechín y b) herbicida comercial cuyo principio activo es Simazina (6-Cloro-N,N'dietil-1,3,5-triazina-2,4-diamina).
2. Materiales y métodos
Muestreo de Alpechín
El muestreo de alpechín fue realizado en junio de 2016 en una Almazara ubicada en el Valle de Lontué, Provincia de Curicó, Región del Maule Chile. Se recolectaron aproximadamente 40 litros de alpechín proveniente del procesamiento de aceituna, variedad arbequina. El residuo fue congelado a -4 °C para su preservación y la posterior extracción de fenoles.
Extracción de fenoles desde alpechínLa extracción de fenoles desde alpechín se realizó utilizando una columna de intercambio iónico. La fase estacionaria estuvo compuesta de 300 g de una resina de intercambio anionica fuerte (DowexTM MarathonTM A). La masa de alpechín utilizada fue de 1000 g. Ésta fue eluida cinco veces a través de la columna. Posteriormente, los fenoles adsorbidos en la resina fueron recuperados utilizando 1000 ml de etanol los cuales fueron eluidos cinco veces a través de la columna. La solución final fue concentrada en rotavapor a 40 °C.
Determinación de la concentración de fenoles totalesLa concentración de fenoles totales en el extracto fue determinada a través de la técnica de Folin-Ciocalteu. La metodología utilizada fue la de Cicco et al. (2009). En viales se preparan estándares de ácido gálico de 2, 3, 5, 7 y 10 mg/l, adicionando
volúmenes de 30, 45, 75, 105 y 150 µl desde una solución madre de 100 mg/l y volúmenes de agua de 1070, 1055, 1025, 995 y 950 µl respectivamente. Posteriormente, a cada vial se le adiciona 100 µl del reactivo de FolinCiocalteu 2 N. Después de 5 minutos, se adicionan 300 µl de una solución de NaCO3 al 20%. Los viales se agitan suavemente a 40°C por 30 min en un baño termoregulado. El volumen final de cada mezcla es de 1500 µl. La absorbancia de las muestras se determina a 750 nm. Los resultados se expresan en equivalentes de ácido gálico
Pruebas de germinación con extracto fenólico a diferentes concentracionesLa evaluación del efecto herbicida se realizó a través de pruebas de germinación de semillas de trigo desinfectadas de procedencia comercial. Las pruebas se realizaron en triplicado según se describe a continuación. En placas Petri, previamente desinfectada con una solución acuosa de hipoclorito de sodio al 10%, se dispusieron 30 semillas. Se evaluaron 4 soluciones de diferente concentración de fenoles totales, 50, 100, 480 y 1050 ppm más un control (agua destilada). En cada placa se colocó un sustrato de celulosa al cual se le vertieron 20 mL de la solución de extracto o agua. Las placas fueron depositadas en una incubadora a 25°C ± 0,1 °C. Las semillas se evaluaron por cinco días.
El porcentaje de germinación de semillas fue calculado contando el número de semillas germinadas respecto al total de cada placa (30 semillas).
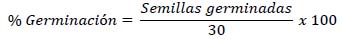
Comparación de la actividad herbicida del extracto fenólico y herbicida comercial
La evaluación de la actividad herbicida se realizó utilizando la misma metodología de la etapa anterior. Se usaron dos concentraciones del herbicida comercial (Simazina al 90% p/p), 250 ppm y 500 ppm, se comparó su efecto con el extracto fenólico a 500 ppm. Se utilizó un control con agua destilada como referencia.
Análisis estadísticos
Se utilizó la Prueba de Levene para análisis de varianza. En los casos que no existan diferencias estadísticamente significativas en las desviaciones estándares se utilizó el método LSD para verificar que medias son estadísticamente diferentes. En los casos que existan diferencias estadísticamente significativas en las desviaciones estándar se utilizó la Prueba de Kruskal-Wallis para evaluar las diferencias entre las medianas de las muestras.
3. Resultados y discusión
Pruebas de germinación con extracto fenólico a diferentes concentraciones
La concentración inicial total de fenoles del extracto de alpechín fue de 1400 ppm (medidos como equivalentes de ácido gálico). De esta solución se prepararon las diluciones para las pruebas de fitotoxicidad.
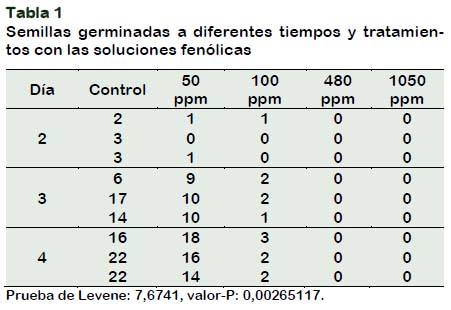
El efecto herbicida del extracto de alpechín, se evaluó a través de pruebas de germinación. Se probaron cuatro concentraciones diferentes de fenoles totales, 50, 100, 480 y 1050 ppm (medidos como equivalentes de ácido gálico) más un control con agua destilada. Los datos de germinación y el análisis de varianza se muestran en la Tabla 1. Las semillas tratadas con las soluciones de 480 y 1050 ppm de extracto no germinaron (Figura 1).
El análisis de varianza de las germinaciones de semillas del control y las tratadas con las diferentes soluciones fenólicas, indica que existen diferencias estadísticamente significativas, al 95% de confianza, entre las desviaciones estándar de las muestras (estadístico de Levene: 7,6741, valor-P: 0,00265117).
Para verificar la existencia de diferencias estadísticamente significativas entre el control y los diferentes tratamientos, se aplicó la prueba no paramétrica de Kruskal-Wallis. Este estadístico (10,0656, valor-P = 0,00652068) da cuenta de la existencia de diferencias estadísticamente significativa entre las muestras.
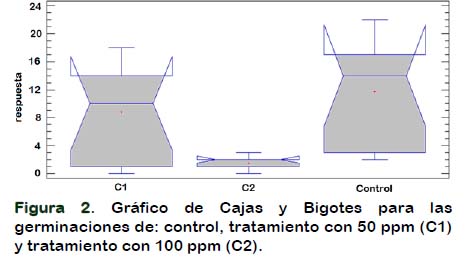
La Figura 2 corresponde a la gráfica de cajas y bigotes del control, solución fenólica de 50 ppm (C1) y 100 ppm (C2). Los resultados muestran que estadísticamente no existe diferencias en la germinación entre el control y la solución fenólica de 50 ppm, pero si con la de 100 ppm.
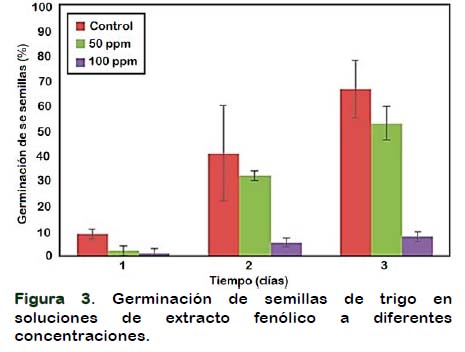
En la Figura 3 se presentan las medias de germinación respecto al tiempo. A concentraciones de 100 ppm de fenol total, la germinación no es más del 10% al tercer día, mientras que, en el mismo tiempo, para el control y tratamiento con 50 ppm de fenol total, la germinación alcanza aproximadamente el 65 y 50 % (respectivamente).
Actividad fitotóxica del extracto fenólico y herbicida comercial
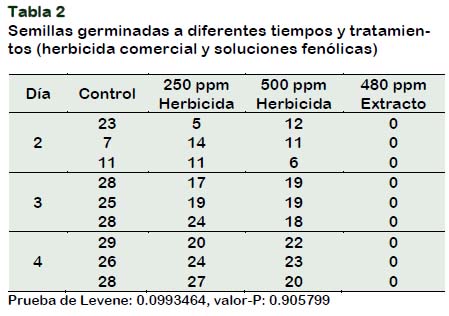
A través de pruebas de germinación, se contrastó el efecto herbicida del extracto de alpechín respecto a un herbicida comercial cuyo principio activo es Simazina (al 90% p/p). Este último se probó en dos concentraciones 250 ppm y 500 ppm. La concentración de extracto fenólico utilizada fue de 480 ppm. El control fueron semillas tratadas con agua destilada. Los datos de germinación y el análisis de varianza se muestran en la Tabla 2. Las semillas tratadas con el extracto fenólico no germinaron.
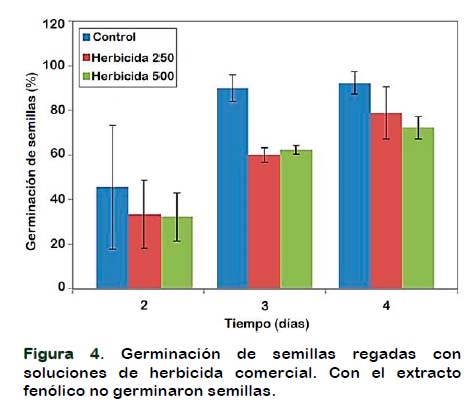
El análisis de varianza de las germinaciones de semillas del control y las tratadas con las diferentes concentraciones de herbicida comercial no muestra diferencias estadísticamente significativas, al 95% de confianza, entre las desviaciones estándar de las muestras (estadístico de Levene: 0,0993464, valor-P: 0,905799). El método LSD, muestra que no existe diferencias entre las medias, del control y los dos tratamientos con el herbicida comercial. En la Figura 4 se presentan las medias de germinación de trigo respecto al tiempo del control y de los tratamientos con herbicida comercial (250 y 500 ppm).
La Figura 5 muestra los resultados del ensayo de germinación al cuarto día. Se observa que las semillas de trigo se encuentran en una primera etapa de germinación (emergencia de radícula) tanto en el control como en las tratadas con herbicida comercial (250 y 500 ppm). Las primeras (control), formaron radícula normal y las últimas deforme (herbicida). Por otro lado, semillas las tratadas con el extracto fenólico no germinaron ni formaron radícula.
Todos los grupos de semillas probadas imbibieron, observándose hinchadas por el ingreso de líquido (respecto a control sin líquido), por lo que, en estos ensayos, tanto el herbicida como el extracto fenólico, no impiden la imbibición, si no que penetran en la semilla y afectan su proceso de germinación. Por otra parte, la radícula formada en ambas concentraciones de herbicida se generó con deformaciones vistas como varios ejes protuberantes cortos, sin proseguir su desarrollo. A diferencia de lo observado con el extracto fenólico, donde la semilla imbibió, pero no fue capaz de generar radícula. El efecto herbicida se observó también en la inhibición del crecimiento del coleoptilo, que no emergió de la testa, es decir, no se observó. Los efectos tanto en la radícula como en el coleoptilo, en las semillas tratadas con herbicida, son similares en ambas dosis.
4. Conclusiones
En la búsqueda de principios activo menos dañinos con el medio ambiente y la salud de las personas que pueden ser utilizados en el desarrollo de nuevos bioherbicidas, en este trabajo se ha evaluado el efecto fitotóxico de un extracto fenólico obtenido desde un residuo de la industria agrícola. Los resultados confirman la inhibición de la germinación de semillas. A concentraciones de 100 ppm (equivalentes de ácido gálico) aproximadamente sólo el 10% de las semillas germinan. Las pruebas a concentraciones de 480 y 1050 ppm inhiben todas las etapas de la germinación. A diferencia de las pruebas con el extracto fenólico, el herbicida comercial no detiene la emergencia radicular en las semillas. Sin embargo, ellas aparecen con deformaciones y no logran desarrollarse de manera normal.
Si bien los resultados obtenidos indican el potencial del extracto fenólico como bioherbicida, es necesario complementar estos estudios con pruebas de campo para establecer la eficacia del extracto al ser utilizado en diferentes tipos de suelo.
Agradecimientos
Los autores desean agradecer a la Vicerrectoría de Investigación y Postgrado de la Universidad Católica del Maule por financiar este trabajo a través del Proyecto Interno 434186.
Referencias bibliográficas
Araniti, F.; Sunseri, F.; Abenavoli, M.R. 2014. Phytotoxic activity and phytochemical characterization of Lotus ornithopodioides L., a spontaneous species of Mediterranean area. Phytochemistry Letters 8: 179–183. [ Links ]
Balasundram, N.; Sundram, K.; Samman., S. 2006. Phenolic compounds in plants and agriindustrial by-products: Antioxidant activity, occurrence, and potential uses. Food Chemistry 99(1): 191–203. [ Links ]
Cavieres, M.F. 2004. Exposición a pesticidas y toxicidad reproductiva y desarrollo en humanos. Análisis de la evidencia epidemiológica y experimental. Rev. Méd. Chile 132(7): 873-879. [ Links ]
Cicco, N.; Lanorte, M.; Paraggio, M.; Viggiano, M.; Lattanzio, V. 2009. A reproducible, rapid and inexpensive Folin–Ciocalteu micromethod in determining phenolics of plant methanol extracts. Microchemical Journal 91(1): 107–110. [ Links ]
Copping, L.; Duke, S. 2007. Natural products that have been used commercially as crop protection agents. Pest. Manag. Sci. 63(6): 524-554. [ Links ]
Diepens, N.J.; Buffan-Dubau, E.; Budzinski, H.; Kallerhoff, J.; Merlina, G.; Silvestre, J.; Auby, I.; Tapie, N.; Elger, A. 2017. Toxicity effects of an environmental realistic herbicide mixture on the seagrass Zostera noltei. Environmental Pollution 222: 393-403. [ Links ]
El-Abbassi, A.; Saadaoui, N.; Kiai, H.; Raiti, J.; Hafidi, A. 2017. Potential applications of olive mil wastewater as biopesticide for crops protection. Sci. Total Environ. 576: 10-21. [ Links ]
Gavrilescu, M.; Demnerová, K.; Aamand, J.; Agathos, S.; Fava, F. 2015. Emerging pollutants in the environment: present and future challenges in biomonitoring, ecological risks and bioremediation. New Biotechnology 32(1): 147-156. [ Links ]
Gouveia, I.; Lima, C.; de Carvalho, L.; Kaiser, C.; Gibara, A. 2018. Evidence of risks of renal function reduction due to occupational exposure to agrochemicals: A systematic review. Environmental Toxicology and Pharmacology 63: 21-28. [ Links ]
Hasenbein, S.; Peralta, P.; Lawler, S.; Connon, R. 2017. Environmentally relevant concentrations of herbicides impact non-target species at multiple sublethal endpoints. Science of the Total Environment 607–608: 733–743. [ Links ]
Hernandes, F.; de Quadros, N.; Mattos, L.; Escarrone, A.; Primel, G.; Martí, D; da Rosa, C. 2017. Exposure to atrazine alters behaviour and disrupts the dopaminergic system in Drosophila melanogaster. Comparative Biochemistry and Physiology, Part C 202: 94–102. [ Links ]
Isidori, M.; Lavorgna, M.; Nardelli, A.; Parrella A. 2005. Model Study on the Effect of 15 Phenolic Olive Mill Wastewater Constituents on Seed Germination and Vibrio fischeri metabolism. J. Agric. Food Chem. 53(21): 8414−8417.
Jumarie, C.; Aras, P.; Boily, M. 2017. Mixtures of herbicides and metals affect the redox system of honey bees. Chemosphere 168: 163-170. [ Links ]
Kadioglu, I.; Yanar, Y. 2004. Allelopathic Effects of plant extracts against seed germination of some weeds. Asian Journal of Plant Sciences 3(4): 472-475. [ Links ]
Kordali, S.; Cakir, A.; Akcin, T.; Mete, E.; Akcin, A.; Aydin, T.; Kilic., H. 2009. Antifungal and herbicidal properties of essential oils and nhexane extracts of Achillea gypsicola HubMor. and Achillea biebersteinii Afan. (Asteraceae). Industrial Crops and Products 29(2-3): 562–570. [ Links ]
Lawrance, S.; Varghese, S.; Varghese, E.; Asok, A.; Jisha, M. 2019. Quinoline derivatives producing Pseudomonas aeruginosa H6 as an efficient bioherbicide for weed management. Biocatalysis and Agricultural Biotechnology 18: 101096. [ Links ]
Mantzavinos, D.; Federici, F.; Fava, F.; Kalogerakis, N. 2009. Valorisation of agro-industrial by-products, effluent and waste: concept, opportunities and the case of olive mill wastewaters. J. Chem. Technol. Biotechnol. 84: 895-900. [ Links ]
Martin, J.; Sampedro, I.; García-Romera, I.; García-Garrido, J.M.; Ocampo, J.A.; 2002. Arbuscular mycorrhizal colonization and growth of soybean (Glycine max) and lettuce (Lactuca sativa) and phytotoxic effects of olive mill residues. Soil Biol. Biochem. 34(11): 1769-1775. [ Links ]
Masi, M.; Freda, F.; Sangermano, F.; Calabrò, V.; Cimmino, A.; Cristofaro, M.; Meyer, S.; Evidente, A. 2019. Radicinin, a fungal phytotoxin as a target-specific bioherbicide for invasive buffelgrass (Cenchrus ciliaris) control. Molecules 24(6): 1086. [ Links ]
Medina, E.; Romero, C.; de los Santos, B.; de Castro, A.; García, A.; Romero, F.; Brenes, M. 2011. Antimicrobial activity of olive solution from stored alpeorujo against plant phatogenic microorganisms. J. Agric. Food Chem. 59(13): 6927-6932. [ Links ]
Mikó, Z.; Ujszegi, J.; Gál, Z.; Hettyey, A. 2017. Effects of a glyphosate-based herbicide and predation threat on the behaviour of agile frog tadpoles. Ecotoxicology and Environmental Safety 140: 96–102. [ Links ]
Morra, M.; Popova, I.; Boydston, R. 2018. Bioherbicidal activity of Sinapis alba seed meal extracts. Industrial Crops & Products 115: 174–181. [ Links ]
Paraskeva, C.; Papadakis, V.; Kanellopoulou, D.; Koutsoukos, P.; Angelopoulos, K. 2007. Membrane Filtration of Olive Mill Wastewater and Exploitation of Its Fractions. Water Environ. Res. 79(4): 421-429. [ Links ]
Patterson, D.T. 1981. Effects of Allelopathic Chemicals on Growth and Physiological Responses of Soybean (Glycine max). Weed Science 29(1): 53-59. [ Links ]
Reichert, F.; Albertoni, M.; Forte, C.; Pandolfi, L.; Dil, J.; Weirich, S.; Carezia, C.; Mulinari, J.; Mazutti, M.; Fongaro, G.; Galon, L.; Treichel, H.; Mossi, A. 2019. New perspectives for weeds control using autochthonous fungi with selective bioherbicide potential. Heliyon 5: e01676. [ Links ]
Reigosa, M.J.; Souto, X.C.; González, L. 1999. Effect of phenolic compounds on the germination of six weeds species. Plant Growth Regulation 28(2): 83–88. [ Links ]
Reigosa, M.J.; Pazos-Malvido, E. 2007. Phytotoxic Effects of 21 Plant Secondary Metabolites on Arabidopsis thaliana Germination and Root Growth. J Chem Ecol. 33: 1456–1466. [ Links ]
Seiber, J.; Coats, J.; Duke, S.; Gross, A. 2014. Biopesticides: State of the Art and Future Opportunities. J. Agric. Food Chem. 62(48): 11613−11619.
Špoljarić, D.; Štolfa, I.; Horvatić, J.; Žuna, T.; Stević, F.; Žarković, N.; Waeg, G.; Jaganjac, M. 2018. S-metolachlor promotes oxidative stress in green microalga Parachlorella kessleri A potential environmental and health risk for higher organisms. Science of the Total Environment 637–638: 41–49.
Stanley, J.; Sah, K.; Jain, S.; Bhatt, J.; Sushil, S. 2015. Evaluation of pesticide toxicity at their field recommended doses to honey bees, Apis cerana and A. mellifera through laboratory, semi-field and field studies. Chemosphere 119: 668–674. [ Links ]
Thundiyil, J.; Stober, J.; Besbelli, N.; Pronczuk, J. 2008. Acute pesticide poisoning: a proposed classification tool. Bulletin of the World Health Organization 86(3): 205-209. [ Links ]
Van Bruggen, A.H.C.; He, M.M.; Shin, K.; Mai, V.; Jeong, K.C.; Finckh, M.R.; Morris, J.G. Jr. 2018. Environmental and health effects of the herbicide glyphosate. Science of the Total Environment 616–617: 255–268. [ Links ]
Varona, M.; Castro, R.; Páez, M.; Carvajal, N.; Barbosa, E.; León L.; Díaz, S. 2012. Impacto en la salud y el medio ambiente por exposición a plaguicidas e implementación de buenas prácticas agrícolas en el cultivo de tomate, Colombia, 2011. Rev Chil Salud Pública 16(2): 96-106. [ Links ]
Yang, C.M.; Lee, C.N.; Zhou, C.H. 2002. Effects of three allelopathic phenolics on chlorophyll accumulation of rice (Oryza sativa) seedlings: I. Inhibition of supply-orientation. Bot. Bull. Acad. Sin. 43: 299-304. [ Links ]
Yangui, T.; Sayadi, S.; Rhouma A.; Dhouib, A. 2010. Potential use of hydroxytyrosol-rich extract from olive mill wastewater as a biological fungicide against Botrytis cinerea in tomato. J Pest Sci. 83: 437–445. [ Links ]
Yangui, A.; Abderrabba, M. 2018. Towards a high yield recovery of polyphenols from olive mill wastewater on activated carbon coated with milk proteins: Experimental design and antioxidant activity. Food Chemistry 262: 102–109. [ Links ]
* Corresponding author
E-mail: jguevara@ucm.cl (J. Guevara).
Received May 3, 2019.
Accepted October 31, 2019.