Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.10 no.4 Trujillo oct. 2019
http://dx.doi.org/10.17268/sci.agropecu.2019.04.13
REVIEW
Principais fungos e micotoxinas em grãos de milho e suas consequências
Fungi and mycotoxins in corn grains and their consequences
Isabele D. Prestes; Liliana O. Rocha ORCID iD: https://orcid.org/0000-0003-2820-4470; Karen V. M. Nuñez*; Nathália C.C. Silva ORCID iD: https://orcid.org/0000-0002-2839-1416
Department of Food Science, Faculty of Food Engineering (FEA), University of Campinas (UNICAMP), 13083-862, Campinas, Sao Paulo, Brazil.
Resumo
O milho é uma das culturas mais importantes no mundo, utilizada extensivamente para alimentação animal e consumo humano, no entanto, são susceptíveis à contaminação por micotoxinas. Esses compostos são produzidos por cepas toxigênicas de fungos e podem estar presentes no solo, na água, ou transportados pelo vento. A ocorrência e proliferação de fungos em grãos de milho pode ser estimulada por fatores como o maior teor de umidade nos grãos, maior temperatura e tempo de armazenamento que levam à redução na produtividade e qualidade, com perdas econômicas significativas. O problema não acaba perdas de produção, devido que as micotoxinas representam um risco potencial para a saúde humana e animal. Os limites máximos aceitáveis de micotoxinas variam muito entre países, e os produtores de grãos de milho, devem adotar as regulamentações estabelecidas do país originário e as legislações dos países de destino. Esta revisão foca na presença de micotoxinas em grãos ardidos, oriundos de espigas de milho doentes devido à presença de fungos, em especial, as produzidas pelos fungos Fusarium spp., Penicillium spp. e Aspergillus spp. Foi concluído que devido aos efeitos tóxicos das micotoxinas tem que ser realizados controles rigorosos tal como aplicação das práticas de manejo integradas, uso de novas tecnologias para detecção de contaminantes e utilização das recomendações feitas pelos produtores para garantir que os grãos de milho sejam seguros para o consumo.
Palabras clave: Micotoxinas; grãos ardidos; aflatoxinas; segurança.
Abstract
Corn is one of the most important crops in the world, used extensively for animal feed and human consumption, however, is susceptible to mycotoxin contamination. These compounds are produced by toxigenic strains of fungi and may be present in soil, water, or transported by the wind. The migration and proliferation of corn grains can be stimulated by factors such as the higher grain moisture content, higher temperature and storage time, leading to reduction in productivity and quality, with economic losses. The problem does not end production losses, since mycotoxins pose a potential risk to human and animal health. Acceptable maximum limits for mycotoxins vary widely between countries and maize grain producers must adopt the regulations established of the originating country and the laws of the destination countries. This review focuses on the presence of mycotoxins in rot grains from diseased corn cobs due to the presence of fungi, especially mycotoxins produced by the fungi Fusarium spp., Penicillium spp. and Aspergillus spp. It was concluded that due to the toxic effects of mycotoxins must be carried out rigorous controls such as the application of integrated management practices, use of new technologies for contaminant detection and the use of recommendations made by producers to ensure that maize grains are safe for consumption.
Keywords: Mycotoxins; burned grains; aflatoxins; safety.
1. Introdução
O milho (Zea mays L.) é a terceira cultura alimentar mais importante, depois do arroz e do trigo. Os maiores produtores de milho no mundo são Estados Unidos, China e Brasil, produzindo aproximadamente 563 das 717 milhões de toneladas/ano. O país mais poderoso no mercado mundial de milho, assim como o maior produtor vem a ser os EUA, que entre 2016/2017 realizaram 36,3% (384,8 milhões de toneladas) da produção total de milho no mundo. A produção mundial de milho é atendida majoritariamente pelo continente americano, sendo os países que dirigem o mercado de milho: Brasil, com 64,1 milhões de toneladas; Argentina, com 39,8 milhões de toneladas, e o México, com 28,2 milhões de toneladas de produção de milho (IGC, 2018).
Segundo Martins et al. (2012), o milho apresenta um papel importante na fonte alimentícia da população brasileira, além disso, juntamente com o farelo de soja, o milho é o principal insumo utilizado para a alimentação animal, como a suinocultura e a avicultura. Para produzir um quilo de carne de aves, são necessários dois quilos de ração, com composição média de 70% de milho mais 20% de farelo de soja (Embrapa Milho e Sorgo, 2014).
Dentre os fatores que podem prejudicar a qualidade dos grãos e consequentemente a economia gerada a partir deles, os fungos devem ser observados. Estes são a principal causa da ocorrência de grãos ardidos. Segundo o MAPA (2011), grãos ardidos são grãos que apresentam escurecimento total, por ação do calor, umidade ou fermentação avançada, sendo classificados como ardidos devido à semelhança aos grãos "queimados". Entretanto, já são classificados nesta categoria quando possuem mais de um quarto de sua superfície descolorida e sua cor varia em tons de marrom, roxo e vermelho (Pinto, 2007). Na maioria das agroindustrias, a presença máxima permitida de grãos ardidos por lote comercial é de 6%. Os principais problemas gerados por fungos são causados durante a précolheita, onde pode-se identificar podridões de espigas e consequente formação de grãos ardidos; na pós-colheita com o beneficiamento, armazenamento e o transporte, os grãos podem mofar ou embolorar dependendo das condições ambientais que forem sujeitos (Embrapa, 2006).
Grãos contaminados com metabólitos fúngicos causam uma grande preocupação na saúde de animais e humanos pelo perigo representado com a presença de micotoxinas (Gromadzka et al., 2016). Isso influencia na desvalorização de lotes danificados no mercado.
Micotoxinas são formadas pelo metabolismo secundário de algumas espécies de fungos, produzidos quando esses microorganismos estão sujeitos às condições climáticas favoráveis. Em humanos, algumas destas toxinas possuem características cumulativas e podem ser cancerígenas, mutagênicas e imunossupressoras (Bennett et al., 2003).
O controle de fungos geralmente é realizado por aplicação de fungicidas na produção de sementes e utilização das práticas de manejo agrícolas no campo. Porém, o desenvolvimento de maior resistência dos fungos perante os fungicidas tende a aumentar com o passar dos anos, e com isso as formas de controles precisam ser melhoradas (Hawkins et al., 2018).
Nesta revisão bibliográfica iremos focar na presença de micotoxinas em grão ardidos, oriundos de espigas de milho doentes devido à presença de fungos, em especial, as micotoxinas produzidas pelos fungos Fusarium spp., Penicillium spp. e Aspergillus spp.
2. Importância econômica
O milho é um cereal de grande importância econômica mundial, com expectativa de produção anual acima de 1 bilhão de toneladas (Mendes, 2016). Os Estados Unidos exportam aproximadamente um terço do comércio mundial de milho, estando no topo do comércio, assim como da produção (IGC, 2018). Atualmente o Brasil é o terceiro maior produtor de milho no mundo, ocupando as primeiras posições no ranking de produção, os Estados Unidos e a China de acordo com o Departamento de Agricultura dos Estados Unidos (USDA, 2018). Na safra 2016/2017, a área plantada no país foi igual a 17,6 milhões de hectares com produção de 97,7 milhões de toneladas (CONAB, 2018).
Devido às diferenças nas estações, Argentina e Brasil têm a vantagem de fornecer a demanda de milho nos países do hemisfério norte, nos meses em que não tem produção nesses setores, no entanto, em que a necessidade de consumo continua (IGC, 2018).
Segundo dados do Instituto Brasileiro de Geografia e Estatística IBGE 2017, a produção de milho no Brasil representa aproximadamente 41,1% da produção agrícola nacional de grãos. Aproximadamente 4% desse valor, o que representa 1,6 milhão de toneladas, é direcionado para a alimentação humana e outros 10% da produção é destinado às indústrias alimentícias (Embrapa, 2016). A grande maioria, 70% é utilizada para alimentação animal (Marcondes, 2012).
A Organização das Nações Unidas – ONU, prevê que a população mundial aumente para mais de 9 bilhões de habitantes até 2050. Com base nessa previsão, a Food and Agriculture Organization FAO, diz que não existirá alimento suficiente para suprir essa demanda. A produção de grãos deve aumentar em um bilhão de toneladas e a produção de carnes em 200 milhões de toneladas para que haja suprimentos sufícientes para toda população em 2050 (FAO, 2009). Esse fato implica no necessário aumento da produtividade de cereais, como o milho, que tem ampla forma de utilização, desde a alimentação animal e humana, até utilização em indústrias tecnológicas, como a produção de biocombustível (Embrapa, 2006). Aproximadamente 70% da produção deste grão é direcionada à alimentação animal, principalmente suinocultura e avicultura (Embrapa, 2006). Ou seja, além de ser utilizado para alimentação e indústrias alimentícias, o milho também é necessário para compor a ração de animais de corte, produzindo maior variedade de alimentos à comunidade.
Ao pensar em produtividade, um dos fatores de grande influência é o índice de grãos ardidos. A podridão da espiga é ocasionada por fungos e causa danos físicos aos grãos e diminuem a qualidade do rendimento na produção dos grãos assim como o valor alimentício e, em alguns casos podem resultar na produção de substâncias tóxicas no alimento (Bello et al., 2012; Costa et al., 2011). Com isso, é comprometido o valor do produto na comercialização, provocando perdas econômicas pelo menor valor das vendas.
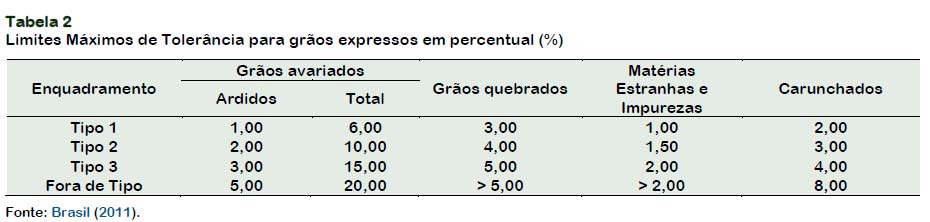
A redução no valor é aplicada conforme a porcentagem presente dos grãos danificados que classifica o milho da seguinte maneira: tipo 1 (até 1%), 2 (até 2%) e 3 (até 3%) e acima de 6% os grãos são considerados fora do padrão de qualidade (Marcondes, 2012). Acima deste valor (6%) o lote é descartado, e consequentemente dinheiro, tempo e espaço são perdidos.
Além de afetar a qualidade do grão, a presença de fungos indica a possibilidade da existência de micotoxinas. Do ponto de vista da alimentação animal, não é interéssante lotes de baixa qualidade, pois eles podem causar micotoxicoses aos animais, acarretando diminuição do ganho de peso corporal, imunossupressão, doenças hepáticas, doenças renais e deficiências nos órgãos reprodutores. Doses baixas, como 75ppb de aflatoxina, toxina produzida por fungos do gênero Aspergillus, pode causar reduções de até 10% do ganho de peso em aves (Embrapa, 2006).
Como as toxinas produzidas por fungos podem ocasionar efeitos indiretos aos animais e pessoas através do consumo de alimentos contaminados, é muito complicado mensurar valores relacionados aos prejuízos causados. Mitchell et al. (2016) avaliaram que a contaminação por aflatoxina pode causar prejuízos à indústria de milho que variam de US $ 52,1 milhões a US $ 1,68 bilhão anualmente nos Estados Unidos. Além disso, devem ser considerados prejuízos referentes à saúde humana e animal.
3. Principais fungos e doenças
A incidência de doenças na cultura de milho está se tornando mais frequente com os anos, indicando vulnerabilidade dos híbridos. Dentre os fatores que explicam esse aumento, podem ser citados: a expansão do plantio para duas safras, a intensificação do cultivo em áreas irrigadas, variedades não recomendadas para determinadas regiões, ampla utilização de defensivos, elevada população de plantas e atraso na colheita. Esses motivos colaboram na sobrevivência de insetos vetores, na consequente perpetuação e acúmulo de patógenos, agravando o aparecimento de diversas doenças (Juliatti, 2007).
A contaminação por fungos usualmente ocorre na pré-colheita, provocando a podridão de espigas ou no pós-colheita, gerando grãos mofados durante o armazenamento e beneficiamento. A podridão também pode ser facilitada por deficiência hídrica durante o período de enchimento e alto nível de chuva após a maturidade fisiológica do grão. Plantas atacadas por insetos, acamadas, ou com espigas mal empalhadas estão mais expostas a penetração de água da chuva e de esporos fúngicos (Marcondes, 2012).
Há diversas variedades de fungos que podem ocasionar podridões em espigas de milho, dentre todos, os que mais se destacam são: Aspergillus flavus, Fusarium verticillioides, F. subglutinans, F. proliferatum, Stenocarpella maydis e S. macrospora (Marcondes, 2012; Benedit, 2016).
A podridão branca da espiga diminui o peso dos grãos e transforma a cor, para marrom com crescimento de micélios brancos entre as fileiras. Ela é causada pelos fungos S. maydis e S. macrospora. Alto índice pluviométrico durante a época de maturação dos grãos colabora para o aparecimento desta doença. Quanto a umidade do cultivar abaixa, atingindo de 21 a 22%, a evolução da doença cessa. Tendo que o milho é o único hospedeiro desses patógenos, o controle da podridão branca pode ser feito com a utilização de variedades mais resistentes, com destruição de restos de culturas de milho infectados e aplicação de rotação de culturas (Embrapa, 2006). Esses fungos estão entre os mais comuns nos cultivos de milho, o S. macrospora também pode causar podridão de colmo, base do colmo, morte de plântula e mancha foliar.
A podridão rosada da espiga é causa pelo Fusarium verticillioides (F. moniliforme), Fusarium subglutinans e Fusarium proliferatum (F. graminearum) (Silva, 2001). Esses fitopatógenos contaminam também outros cultivares, o aparecimento e desenvolvimento da doença normalmente está associado a injúrias causadas por insetos ou pássaros. Os grãos infectados adquirem coloração avermelhada e, com o avanço da doença, uma camada cotonosa rosada. Quando infectados mais tardiamente podem aparecer estrias brancas no pericarpo. Os grãos da espiga que não apresentam sintomas também podem possuir o patógeno em seu interior (Marcondes, 2012). A evolução desta podridão cessa quando os grãos atingem 18 a 19% de umidade (Embrapa, 2006).
O desenvolvimento desses fungos é favorecido em temperaturas próximas a 30 °C e altitudes menores que 700 m. Acredita-se que o início da cultura, com o período de elevadas temperaturas e ambiente seco, seguido de por chuvas frequente no florescimento, colabora muito para o crescimento do Fusarium nas culturas. Ele sobrevive facilmente em restos de vegetais, e se dissemina através de ventos e chuvas (Silva, 2001).
A giberela, doença de infecção floral e que também causa perdas substanciais à economia, é causada principalmente por espécies toxigênicas do gênero Fusarium e não toxigênicas de Microdochium spp. A doença se caracteriza pela formação de uma camada cotonosa avermelhada na ponta da espiga, podendo se espalhar até a base com o avanço da contaminação. Esta também está associada a presença de micotoxinas produzidas por Fusarium, neste caso, principalmente por F. graminearum, tornando o produto impróprio para consumo (Nielsen et al., 2012).
Outra espécie de fungos que atinge grãos de milho e causa podridão é Aspergillus flavus, estes são característicos de clima seco e quente, observados em plantas com deficiência hídrica e de nutrientes. São capazes de se desenvolverem em umidades relativas baixas e são mais observados na fase madura do cultivo, quando há um maior ataque de insetos à plantação. Sua presença é detectada quando há sobre os grãos micélio amarelo-esverdeado. Esse fungo pode chegar a causar até a morte do cultivar, porém sua presença é mais detectada em grãos mais oleaginosose, encontrados menos frequentemente em substratos ricos em amido (Woloshuk e Wise, 2011).
4. Micotoxinas, seus problemas e complicações
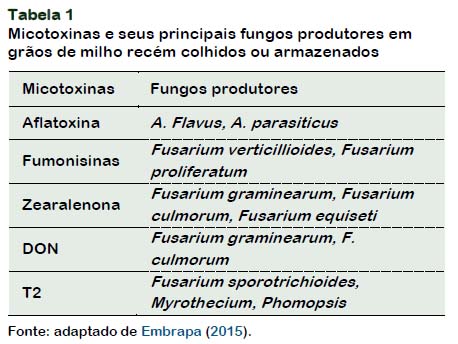
Nem todos os fungos que causam grãos ardidos são capazes de produzir micotoxinas. Micotoxinas são metabólitos secundários com carácter tóxico, de algumas espécies de fungos, tais como Aspergillus spp. (aflatoxinas e ocratoxinas), Fusarium verticillioides e F. subglutinans (fumonisinas), Fusarium graminearum (zearalenona tricotecenos), Fusarium sporotrichioides (toxina T-2), Penicillium spp. (ocratoxinas) (Embrapa, 2006).
Na Tabela 1 é possível visualizar as micotoxinas que podem contaminar o milho e seus respectivos fungos.
Uma das grandes questões relacionadas às micotoxinas é a periculosidade que apresentam à saúde dos seres humanos e animais. Mesmo em baixas concentrações são capazes de provocar doenças crônicas como cirrose hepática, imunossupressão, carcinogenicidade, mutagenicidade e nefropatias. Além disso, também podem causar doenças agudas como anorexia, apatia, hemorragias, edema pulmonar, necroses cerebral e hepática (Bragotto, 2016).
As micotoxinas possuem caráter cumulativo, dessa forma, elas podem também alcançar a cadeia alimentar humana indiretamente. Quando ingerida por animais através de rações contaminadas, os produtos alimentícios derivados destes, como carne, leites e ovos, também estarão contaminados. Tratamentos térmicos e processamentos industriais podem eliminar os fungos presentes, mas não são capazes de eliminar as toxinas dos alimentos (Bragotto, 2016).
4.1 Principais fungos produtores de micotoxinas em grãos de milho
FusariumFusarium spp. produz diversas micotoxinas, as fumonisinas, que são encontradas com elevada frequência no milho e são produzidas pelas mesmas espécies que causam a podridão da espiga (F. verticillioides, F. subglutinans, F. graminearum e F. proliferatum) (Mesterházy et al., 2012; Thompson et al., 2013).
Há 16 tipos de fumonisinas descritas (Embrapa, 2007), porém, duas são mais importantes, a FB1 e a FB2, devido a frequência de ocorrência e toxicidade. A FB1 geralmente é produzida em maiores quantidades, sendo também mais tóxica (Benedit, 2016). Segundo Vitorino (2011), cerca de 90% do F. verticillioides existente é encontrado no milho e, aproximadamente 70% do total de fumonisinas encontrada em alimentos contaminados, correspondem a FB1. Essa toxina provoca toxicidade aguda em diversos animais, especialmente aves, suínos e equinos, podendo leva-los até a morte (Oliveira et al., 2015). A produção de fumonisinas pode ocorrer durante o desenvolvimento do milho, sendo afetado pela interação do patógeno fúngico com a planta hospedeira e o ambiente (Maiorano et al., 2009).
A ingestão de alimentos contaminados com fumonisinas, por mulheres grávidas, está associada à má formação do tubo neural (espinha bífida), provocada pela interferência na utilização do ácido fólico (Benedit, 2016; Pereira, 2012). Também, são considerados possíveis carcinogênicos, relacionados a alta ocorrência de câncer de esôfago nas regiões de Transkei, no sul da África, também na China e no nordeste da Itália (Embrapa, 2007). Além disso, segúndo Embrapa (2007) existem outras doenças associadas à essa toxina como: leucoencefalomácia dos equinos e coelhos; hidrotórax e edema pulmonar em suínos; efeitos hepatotóxicos, carcinogênicos e apoptose (morte celular programada) em fígado de ratos. Vitorino (2011) também acrescenta que animais intoxicados apresentam diminuição na alimentação e na produção de leite (no caso dos bovinos); podem apresentar irritações e hemorragias no trato digestivo, deficiência no sistema imunológico, alterações nos órgãos reprodutivos, e decréscimo no processo regenerativo na medula óssea e no baço.
A explicação do caráter carcinogênico das fumonisinas, se deve ao bloqueio na biossíntese de esfingolipídios, substância predominante no sistema nervoso, essencial para a manutenção e integridade da membrana celular, e para o transporte iônico entre células (Mendes, 2009). A pausa na síntese de esfingolipídios gera o acúmulo de esfinganina e esfingosina, provocando os efeitos tóxicos e carcinogenicidade (Vitorino, 2011).
Além das fumonisinas, esse gênero também pode produzir: zearalenona, desoxinivalenol – DON ou vomitoxinas, toxina T-2, ácido fusárico e moniliformina (Marcondes, 2012).
A zearalenona é outro tipo de micotoxina produzida por Fusarium, mais exatamente pelas espécies F. graminearum, F. culmorum, F. equiseti e F. cerealis, que contaminam cereais, incluindo o milho, e frutas como banana e tomate (Rufatto, 2011). Sua produção ocorre em períodos com temperaturas amenas e com elevada umidade (Embrapa, 2008).
Desde 1920, essa toxina é relacionada ao hiperestrogenismo em suínos, que pode causar diversos distúrbios na concepção e abortos. Vacas e ovinos também apresentaram problemas reprodutivos (Embrapa, 2007). No caso de roedores, eles apresentaram redução no tamanho da ninhada, diminuição da fertilidade e mudanças nos níveis hormonais séricos (Rufatto, 2014).
A relação da zearalenona com problemas hormonais é explicada pelo fato de que o αzearalenol possui a capacidade de se ligar aos receptores de estrógenos 17 vezes mais forte do que o etinilestradiol (Vitorino, 2011). A partir dessa ligação que surgem os efeitos citados acima. Outros exemplos de reações provocadas por essa toxina também são citados por Vitorino (2011), como: puberdade precoce, fibrose do útero, cancro da mama, carcinoma do endométrio, hiperplasia do útero, alterações nas atividades das glândulas adrenal, tireoide e pituitária. Além disso, segundo Rufatto (2014) a zearalenona possui características de toxicidade hematológica e renal; e Vitorino (2011) cita que a micotoxina é capaz de provocar a peroxidação lipídica e bloquear a síntese proteica e de DNA.
A micotoxina desoxinivalenol é uma das mais importantes dentre os tricotecenos. Também conhecida como vomitoxina, quando ingeridas por animais em altas quantidades, causa náuseas, vômitos e diarreia. Por conta disso, rações contaminadas por DON são frequentemente recusadas por animais (Bennett e Klich, 2003). A toxicidade de tricotecenos em seres humanos está relacionada à inibição da síntese de proteínas (McCormick et al., 2011). Rufatto (2014) descreve um estudo proposto por Signorini et al. (2012), na Argentina, que avaliou o risco quantitativo da presença de micotoxinas no leite de vaca da região, através de um modelo de simulação estocástica. Em diversas etapas do processo de industrialização do leite, foram verificadas a presença majoritária de AFM1, DON e zearalenona, que excederam os níveis máximos europeus em 25,07%, 0,0% e 8,9%, respectivamente. O fator que foi correlacionado para explicar esses números foi a presença de micotoxinas em silagem de milho e rações (Rufatto, 2014).
AspergillusO principal grupo de micotoxinas produzidas por Aspergillus spp. é conhecida como aflatoxinas e seus tipos são diferenciados com base na fluorescência sob luz ultravioleta, que pode ser azul ou verde. Por esse motivo elas recebem nomes como B1 e B2 (blue) referente a cor azul ou G1 e G2 (green) referente a cor verde. Estes são os principais tipos de aflatoxinas e são produzidas principalmente pelas espécies A. flavus, A. parasiticus, A. nomius, A bombycis, A. pseudotamarii e A. ochraceoroseus. Aspergilus flavus, que é a espécie mais encontrada no milho, produz as aflatoxinas B1 e B2 (Vitorino, 2011). Aspergillus vem a ser o fungo mais disseminado, sendo frequentemente encontrado em diversos ambientes. O fungo pode formar um grande número de unidades resistentes a condições ambientais inapropriadas, dessa forma pode crescer em amplas faixas de condições de umidade e calor (Eltariki et al., 2018).
Vitorino (2011) afirma que a primeira vez que a palavra micotoxina foi utilizada, foi em 1962, após um episódio na Inglaterra, onde muitos perus jovens morreram após a ingestão de ração à base de amendoim proveniente do Brasil e da África. Foi confirmado que a fatalidade ocorreu devido a um metabólito secundário de A. flavus, com isto foram iniciados os estudos sobre o assunto. Mais tarde, outros surtos também ocorreram: em 1974, no nordeste da Índia, houve um surto de aflatoxina B1, relacionado a ingestão de milho contaminado. Aproximadamente 400 pessoas adoeceram e cerca de 100 faleceram. Em 1982, no Quênia, houve outro episódio semelhante, porém menor, foram cerca de 20 pessoas contaminadas e 12 falecimentos (Embrapa, 2008).
No organismo, as aflatoxinas são metabolizadas por enzimas hepáticas, produzindo epóxidos reativos, capazes de formarem ligações covalentes com a guanina. Essa interação é capaz de afetar a síntese proteica da célula, e também ocasionar danos macromoleculares, incluindo a produção de uma mutação no gene característico supressor de tumor. Por esse motivo a aflatoxina B1 é classificada como um cancerígeno do Grupo 1 pela IARC (Rufatto, 2014).
Além de ser considerada carcinógeno humano, a aflatoxina também é relacionada com doenças como necrose hepática, anorexia, apatia, mutagenicidade, teratogenicidade, cirrose hepática e imunodepressão (Bragotto, 2016).
Legislação e controle na comercializaçãoA toxicidade das micotoxinas nos alimentos tem um grande efeito no comércio internacional, causando enormes perdas. Diante disso vários países estabeleceram legislações com o objetivo de proteger os consumidores contra a nocividade pela ingestão de alimentos contaminados por micotoxinas, com base em regulações governamentais e dessa forma evitar consequências adversas para a saúde humana e animal (Anukul et al., 2013). Entretanto, não todos os países adotam essas normas, que geralmente atuam apenas em alimentos que são processados industrialmente e destinados à exportação, mas não a aqueles processados localmente, assim também, ainda são desconhecidos valores máximos de tolerância para muitas micotoxinas, apenas as mais perigosas e as mais estudadas, entram na legislação. Segundo a Food and Agricultural Organization (FAO), um total de 77 países estabeleceram normas e regulamentações sobre micotoxinas em alimentos e rações para o controle nos níveis desses compostos (Ferrão et al., 2017).
Quando se trata de estabelecer limites seguros para a saúde humana, o assunto é complicado, já que vários fatores devem ser considerados para fixar um número seguro. Para estabelecer limites que apoiem a aplicação das regulamentações em micotoxinas, é preciso melhorar continuamente as metodologias analíticas que analisem tais compostos (Shephard, 2016). Dentre outros fatores, deve-se levar em conta os fatores científicos de risco, disponibilidade dos dados toxicológicos, consumo de alimentos, além de fatores econômicos (Benedit, 2016). Esses números também devem ser revisados continuamente por agências reguladoras governamentais em todo o mundo, tornando-se mais restritos quando necessário e dessa forma reduzir o risco que representam pela exposição.
Para exportação do milho, os produtores além seguir as regulamentações dos países de origem, devem acompanhar as legislações dos países de seus clientes, como da Legislação Europeia e dos Estados Unidos. Os níveis de micotoxinas no milho, são de importância não só para os produtores de milho, mas também para as indústrias que o utilizam como matéria prima e para os produtores agropecuários, já que isto influenciará na qualidade e nos níveis de toxinas também do produto final produzidos por eles.
O MAPA (Brasil, 2011) classifica o milho em 3 tipos, de acordo com a qualidade dos grãos. Na Tabela 2 estão expostos os limites máximos permitidos para cada categoria, os grãos que não obedecem aos limites das categorias são considerados "fora de tipo" e só poderão ser comercializados desta forma, ou deverão ser rebeneficiados, desdobrados ou recompostos para efeito de enquadramento em tipo.
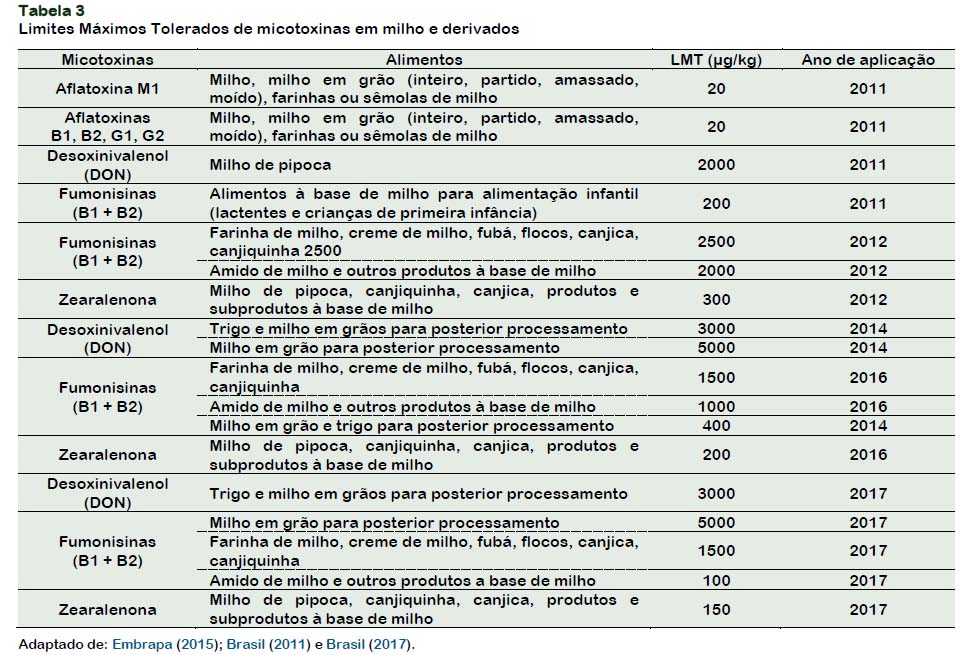
Em fevereiro de 2011 a ANVISA (Agência Nacional de Vigilância Sanitária) definiu limites máximos tolerados para micotoxinas em alimentos através da Resolução N° 7, com uma medida de aplicação imediata. Nesta mesma Resolução foi proposto dois anexos em forma de cronograma de implementação de novos limites no ano de 2012, 2014 e 2016 (Brasil, 2011). Em fevereiro de 2017, entrou em vigor uma nova Resolução, N°138, também com aplicação imediata, atualizando e incrementando alguns valores. Nesta Resolução também há um anexo com cronograma para 2019 (Brasil, 2017). Na Tabela 3 estão apresentados os limites máximos tolerados de micotoxinas em milho e derivados, determinados pelas Resoluções acima.
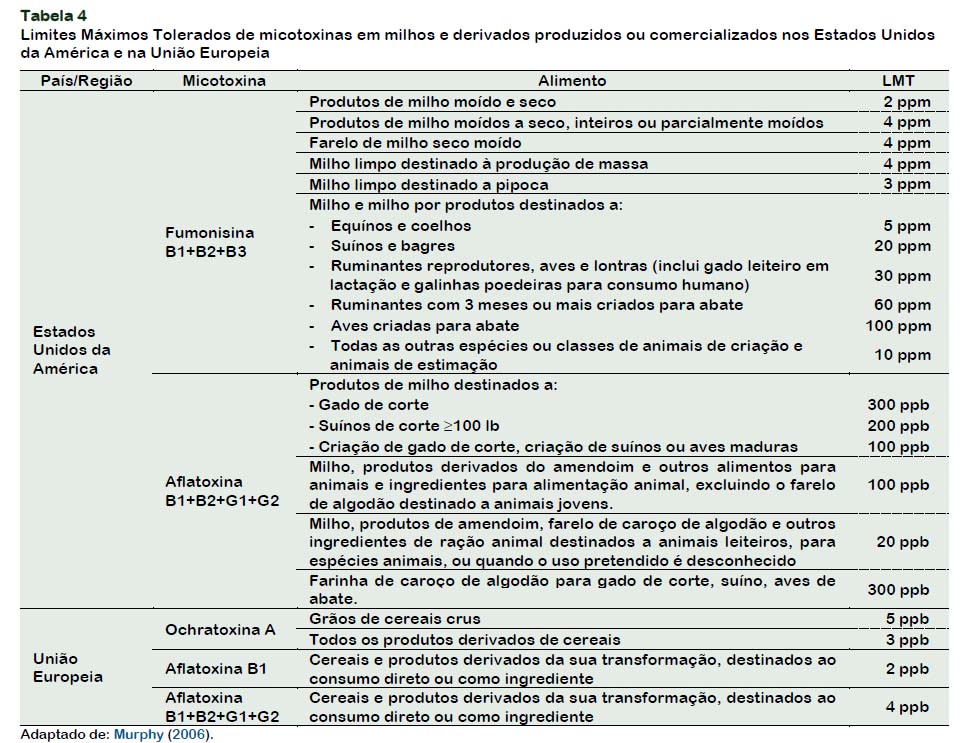
Para detecção e quantificação desses contaminantes métodos oficiais foram desenvolvidos pelas agências reguladoras governamentais. Está apresentado na Tabela 4, um resumo dos limites máximos regulamentados de micotoxinas permitido em diversos alimentos, nos EUA e na União Europeia.
6. Formas de manejo e armazenamento, como prevenir grãos ardidos e micotoxinas
Para ser possível reduzir a contaminação do milho em alta escala, é necessário cuidado e atenção em cada parte do processo produtivo, desde a escolha da semente até o processamento na indústria (Embrapa, 2015). A escolha de híbridos mais resistentes, próprios para a região de plantio, é essencial, mas não é a única medida a ser adotada. A destruição de restos culturais infectados; a rotação de culturas para reduzir os índices de patógenos específicos; a escolha de sementes sadias com o plantio na densidade recomendada (De Souza et al., 2013); adubação equilibrada, com potássio e nitrogênio; o plantio em épocas mais quentes e secas; a colheita no momento certo (Marcondes, 2012); e o controle de plantas daninhas hospedeiras de Fusarium spp. Todas essas são medidas capazes de aumentar a resistência da cultura e diminuir a incidência de patógenos, como fungos. A aplicação desses cuidados em conjunto é denominada como Práticas de Manejo Integradas.
A questão ambiental é determinante na proliferação de fungos e na produção de micotoxinas. Eles são favorecidos pela umidade e não se multiplicam em substratos devidamente secos (Embrapa, 2006). Por esse motivo, o processo de secagem dos grãos deve ser realizado preferentemente dentre as 48 horas após colheita e devem ser controladas as condições de armazenamento, temperatura e humidade relativa do ar e vetores (Dorn e JacksonZiems, 2013; Valmorbida, 2016).
A contaminação das culturas agrícolas por fungos depende de fatores como região geográfica, colheita, e condições climáticas que podem ser prejudiciais como temperatura, chuva a e umidade relativa (Valmorbida, 2016), isto pode ocasionar maior propensão às doenças e diminui a produtividade e a qualidade dos cultivos. Assim também, práticas no manejo poscolheita são cruciais uma vez que invasão de espécies como Fusarium e Aspergillus em arroz podem começar no campo e a situação pode piorar devido às más práticas pós-colheita (Bertuzzi et al., 2019). A concentração de micotoxinas está relacionada à produção de fungos em grãos e por sua vez com os altos níveis de umidade no armazenamento dos grãos, assim, os limites para ter um armazenamento seguro do grão dependerão do conteúdo inicial o
primário de umidade (Eltariki et al., 2018). As injúrias provocadas por insetos é outro fator que aumenta o risco da infecção fúngica de grãos, por facilitar sua penetração. Isso pode ocorrer tanto na lavoura quanto durante o armazenamento. No campo, não há muitas opções além de seguir o manejo do cultivar da forma correta, porém é fundamental que os armazéns estejam livres de insetos, se não a presença de fungos se torna inevitável. Além das pragas danificarem o grão, podem aumentar os níveis de umidade e agirem como vetores (Dorn e Jackson-Ziems, 2013; Valmorbida, 2016).
Para garantir que todos os fatores de qualidade citados acima sejam acatados, após a colheita o milho deve ser dirigido para uma Unidade de Beneficiamento de Sementes (UBS), onde as espigas são despalhadas, secas, submetidas à debulha e pré-limpeza, limpeza, classificação, tratamento e armazenamento das sementes, para posterior distribuição. O beneficiamento oferece uma maior segurança as sementes, pois durante as suas etapas, grãos não sadios e sujidades são eliminados, diminuindo também as chances de contaminação (Trogello, 2013; Vieira, 2013). Além disso, o beneficiamento garante melhores índices de germinação, vigor e sanidade.
O cultivo de produtos orgânicos cresceu muito nos últimos anos, necessitando de agentes naturais para ajudar na produtividade das culturas. Esse é um dos motivos que a aplicação de controle biológico para a diminuição da contaminação por fungos e patógenos, vem sendo estudado como alternativa ao controle químico. Entretanto, sua eficácia não é a mesma (Chulze, 2014). Muitas bactérias que reduzem acúmulo de micotoxinas ou atividades de patógenos já foram identificadas. Segundo Chulze (2014), um estudo realizado na Argentina, obteve reduções significativas na concentração de FB1 em ensaios de campo, alcançando valores em torno de 75%. Eles utilizaram biocontroles liofilizados, formulados com Bacillus amyloliquefaciens e Microbacterium oleovorans para analisar o controle de F. verticillioides. Além disso, as espécies Bacillus, em geral, colaboram com o milho na resistência contra patógenos de raiz.
Bacon (2001) realizou um experimento para avaliar a performance de Bacillus subtilis, bactéria presente na fase de crescimento endofítico do milho, e Trichoderma sp. como controle biológico no desenvolvimento de F. verticillioides. Ambos microorganismos foram bem-sucedidos no estudo: o B. subtilis mostrou-se muito eficiente na redução dos níveis de fumonisinas na fase de crescimento da planta; e Trichoderma sp. mostrou-se promissora no controle do crescimento do fungo e na redução do acúmulo de micotoxinas durante o armazenamento do milho.
Um estudo mais recente realizado por Agbetiameh et al. (2019), utilizou isolados de Aspergillus flavus Africanos (AAVs) atoxigênicos, geneticamente diversos, obtidos de culturas de milho e amendoim cultivados em Gana. O estudo determinou que o uso combinado de isolados apropriados de AAVs são efetivos agentes de controle biológico para a mitigação de aflatoxinas e, portanto podem ser utilizados para reduzir a exposição às aflatoxinas em humanos e animais.
Apesar do controle biológico ser geralmente utilizado como uma alternativa às práticas de manejo integradas, uma possível melhoria para o controle de doenças seria utilizar as duas medidas em conjunto. Segundo Juliatti (2007) existem também tecnologias para a descontaminação dos alimentos, mas ainda são muito caras e de eficiência questionável. Seriam necessários mais estudos, e os resultados concretos sobre eficácias seriam obtidos à longo prazo.
Desafios atuais e futuros
No decorrer dos anos, grandes esforços foram feitos para controlar ou minimizar a ocorrência de micotoxinas em grãos, mas a contaminação por micotoxinas permanece problemática. O desafio é complexo e precisa de esforços coordenados. Com a finalidade de garantir a produção segura de grãos e prevenir problemas econômicos de contaminação em larga escala, é preciso desenvolver continuamente e aplicar modernos métodos específicos e seletivos que consigam detectar e reduzir a contaminação em grãos e ração, assim como a implementação sistemática de monitoramento nacional, e dessa forma minimizar a exposição humana e animal às micotoxinas (Alshannaq e Yu, 2017; Pleadin, 2015).
A prevalência de micotoxinas pode variar de acordo com as diferenças geográficas e climáticas. As condições podem aumentar a ocorrência de fungos e as concentrações de micotoxinas nos grãos. Consequentemente, o risco para a saúde humana e animal cresce e as estratégias tornam-se mais complexas para o controle dos efeitos adversos. Isso também eleva as perdas econômicas (Ksenija, 2018). Portanto, é importante que a comunidade cientifica realize avaliações de predição e dessa forma adote medidas de prevenção para controlar a presença de micotoxinas nos grãos.
Para avaliar a presença de micotoxinas e contaminantes de fungos toxigênicos têm que ser continuamente pesquisadas novas técnicas para detecção e avaliação desses contaminantes nos alimentos. Estudos indicam que técnicas baseadas em imagem hiperespectral (HSI) fornecem uma melhor classificação dos grãos contaminados com aflatoxinas ajudando na remoção deles de forma rápida e não destrutiva nas indústrias de milho, no entanto tais estudos foram realizados com concentrações irrealisticamente altas de aflatoxina nos alimentos ou em amostras inoculadas artificialmente, portanto são necessários estudos que demonstrem a viabilidade dessa técnica testando com alimentos contami-nados naturalmente com aflatoxinas (Xing et al., 2019). Outra tecnologia nova e extremamente útil como método auxiliar às técnicas convencionais é a baseada em biossensores, que permitem a baixo custo uma detecção rápida, sensível e seletiva de micotoxinas nos alimentos e pode ser aplicada na indústria de grãos (Santana et al., 2019). Na maioria dos países já existem legislações que quantificam valores aceitáveis para o consumo, entretanto, os índices de contaminação em alimentos ainda podem ser melhorados, fornecendo maior segurança e evitando desperdícios.
A colaboração contínua por parte das autoridades governamentais é indispensável, além da participação de cientistas e indústria, para verificar a produção de micotoxinas em campo, inibir o crescimento de fungos toxigênicos em alimentos e rações, e melhorar as técnicas de detecção para assim aumentar a segurança alimentar (Alshannaq e Yu, 2017). As atuais ações regulatórias em relação as micotoxinas podem não estar de acordo com o cenário real em termos de segurança, regulamentos e recomendações. Ao longo dos anos, a comunidade científica envolvida na segurança alimentar e na avaliação de riscos têm dado enormes passos à frente na identificação de micotoxinas e seu destino metabólico, mas ainda é um desafio para os cientistas o fornecimento de dados confiáveis para apoiar a avaliação de risco de micotoxinas transmitidas por alimentos (Dellafiora e Dall’Asta, 2017).
É importante que sejam realizados mais estudos sobre ocorrência, importância econômica e efeitos na saúde da população. A gestão deste problema requer um esforço coordenado de todos os participantes nos sistemas de produção de alimentos. Espera-se que as autoridades de
segurança alimentar melhorem a eficiência da inspeção com base nas avaliações de risco de micotoxinas. Assim também é importante que proprietários ou agricultores conheçam o impacto que as micotoxinas podem causar em grãos.
7. Conclusões
A contaminação de alimentos pelas micotoxinas tornou-se uma preocupação global que exige ações urgentes. Com esta revisão, fica evidente que a ingestão de micotoxinas apresenta grande risco à saúde humana e animal. A detecção adequada de micotoxinas na produção de milho é a base para lidar com o potencial impacto negativo na saúde humana e animal pelo consumo desse produto.
É necessário o controle regulatório e análises de detecção rápidas e efetivas para garantirmos a qualidade durante a produção do milho. Dessa forma, enfatizamos a importância da aplicação das práticas de manejo integradas e da utilização das recomendações feitas pelos produtores de sementes. Além disso, a utilização de controle biológico agregado as práticas de manejo é uma estratégia promissora para redução dos problemas decorrentes da contaminação por fungos e toxinas associadas.
Referencias bibliográficas
Agbetiameh, D.; Ortega-Beltran, A.; Awuah, R.T.; Atehnkeng, J.; Islam, M.; Callicott, K.A.; Cotty, P.J.; Bandyopadhyay, R. 2019. Potential of atoxigenic Aspergillus flavus vegetative compatibility groups Associated with maize and groundnut in Ghana as biocontrol agents for aflatoxin management. Frontiers in Microbiology 10: 2069. [ Links ]
Alshannaq, A.; Yu, J.H. 2017. Occurrence, toxicity and analysis of major mycotoxins in food. International Journal of Environmental Research and Public Health 14: 632-652. [ Links ]
Anukul, N.; Vangnai, K.; Mahakarnchanakul, W. 2013. Significance of regulation limits in mycotoxin contamination in Asia and risk management programs at the national level. Journal of Food and Drug Analysis 21(3): 227-41. [ Links ]
Bacon, C.W.; Yates, I., Meredith, H. 2001. Biological control of Fusarium moniliforme in maize. Environmental Health Perspectives 109: 325–332. [ Links ]
Benedit, P. 2016. Impacto Económico de la Infección con Fusarium verticillioides y Acumulación de Fumonisinas em Maíz. Escuela de Ciencias Agrarias, Naturales y Ambientales. Universidad Nacional del Nor-oeste de la Provincia de Buenos Aires. Pergamino. [ Links ]
Bennett, J.W.; Klich, M. 2003. Mycotoxins. Clinical Microbiology Reviews 16: 497−516.
Bello, O.B.; Ganiyu, O.T.; Wahab, M.K.A.; Azeez, M.A.; Abdulmaliq, S.Y.; Ige, S.A.; Mahmood, J.; Oluleye, F.; Afolabi, M.S. 2012. Yield and Disease Reactions of Quality Protein Maize Varieties in the Southern Guinea Savanna Agro-Ecology of Nigeria. International Journal of Agriculture and Forestry 2(5): 203-209. [ Links ]
Bertuzzi, T.; Romani, M.; Rastelli, S.; Giorni, P. 2019. Mycotoxins and Related Fungi in Italian Paddy Rice During the Growing Season and Storage. Toxins 11(3): 151. [ Links ]
Bragotto, A.P.A. 2016. Compostos Tóxicos de Origem Natural: Fungos. Faculdade de Engenharia de Alimentos – UNICAMP. Campinas – SP. [ Links ]
Brasil. 2007.Ministério da Agricultura, Pecuária e Abastecimento. Cadeia produtiva do milho. Brasília: IICA/MAPA/SPA. [ Links ]
Brasil. 2011. Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa MAPA nº6. Diário Oficial da União, 23/12/2011. [ Links ]
Brasil. 2011. Resolução RDC nº 7, Agência Nacional de Vigilância Sanitária. Diário Oficial da União, 18/02/2011. [ Links ]
Brasil. 2017. Resolução RDC nº 138, Agência Nacional de Vigilância Sanitária. Diário Oficial da União n°29, 09/02/2017. [ Links ]
Chulze, S.N.; Palazzini, J.M.; Torres, A. M.; Barros, G.; Ponsone, M.L.; Geisen, R.; Schmidt-Heydt, M.; Köhl, J. 2014. Biological control as a strategy to reduce the impact of mycotoxins in peanuts, grapes and cereals in Argentina. Food Additives and Contaminants: Part A 32(4): 471-479. [ Links ]
CONAB Companhia Nacional de Abastecimento. 2018. Grãos: Série Histórica 2016/2017. Disponível em: http://www.conab.gov.br [ Links ]
Costa, R.V.; Cota, L.V.; Cruz, J.C.; Silva, D.D.; Queiroz, V.A. V.; Guimarães, L.J.M.; Mendes, S.M. 2011. Boletim de Pesquisa e Desenvolvimento 38. Recomendações para a Redução da Incidência de Grãos Ardidos em Milho. Sete Lagoas MG, Embrapa Milho e Sorgo. [ Links ]
Dellafiora, L.; Dall'Asta, C. 2017. Forthcoming Challenges in Mycotoxins Toxicology Research for Safer Food-A Need for Multi-Omics Approach. Toxins (Basel) 9(1): E18. [ Links ]
De Souza, S.C.; Da Silva, D.D.; Lanza, F.E.; Da Costa, R.V.; Cota, L.V. 2013. Efeito cultivar na incidência de grãos ardidos em milho. Faculdade Santo Agostinho – FASASETE. [ Links ]
Dorn, T.W.; Jackson-Ziems, T.A. 2013. Grain Storage Management to Minimize Mold and Mycotoxins. Papers in Plant Pathology 538: 14–15. [ Links ]
Eltariki, F.E.M.; Tiwari, K.; Ariffin, I.A.; Alhoot, M.A. 2018. Genetic Diversity of Fungi Producing Mycotoxins in Stored Crops. Journal of Pure and Applied Microbiology 12(4): 18151823. [ Links ]
Embrapa. Dezembro, 2006. Aspectos Físicos, Químicos e Tecnológicos do Grão de Milho. Circular Técnica 75. Sete Lagoas – MG. [ Links ]
Embrapa. Dezembro, 2006.Doenças na Cultura do Milho. Circular Técnica 83, ISSN 16791150. Sete Lagoas – MG. [ Links ]
Embrapa Milho e Sorgo. Dezembro, 2014. Diagnóstico dos Problemas e Potencialidades da Cadeia Produtiva do Milho no Brasil. Documentos 168, ISSN 1518-4277. Sete Lagoas – MG. [ Links ]
Embrapa. Outubro, 2007. Micotoxinas: Importância na Alimentação e na Saúde Humana e Animal. Documentos 110, ISSN 1677-1915. Fortaleza – CE. [ Links ]
Embrapa. Setembro, 2008.Cultivo do Milho. Sistemas de Produção, 2. ISSN 1679-012X – 4ª edição. [ Links ]
Embrapa. Dezembro, 2015. Micotoxinas em Cadeias Produtivas do Milho: Riscos à Saúde Animal e Humana. Documentos, 193. ISSN 1518-4277. Sete Lagoas – MG. [ Links ]
FAO Food and Agriculture Organization. How to Feed the World in 2050. Disponível em: http://www.fao.org/fileadmin/templates/wsfs/docs/expert_paper/How_to_Feed_the_World_in_2050.pdf [ Links ]
Ferrão, J.; Bell, V; Chabite, I.T.; Fernandes, T.H. 2017. Mycotoxins, food and health mycotoxins, food and health. Journal of Nutritional Health & Food Science 5 (7): 1-10. [ Links ]
Gromadzka, K.; Górna, K.; Chełkowski, J.; Waśkiewicz, A. 2016. Mycotoxins and related Fusarium species in preharvest maize ear rot in Poland. Plant, Soil and Environment 62(8): 348-354. [ Links ]
Hawkins, N.J.; Bass, C.; Dixon, A.; Neve, P. 2018. The evolutionary origins of pesticide resistance. Biological Reviews 94(1): 135-155. [ Links ]
Instituto Brasileiro De Geografia e Estatística IBGE. 2017. Levantamento sistemático da produção agrícola. Disponível em: https://www.ibge.gov.br/ [ Links ]
International Grain Council (IGC), 2018. Corn Supply & Demand Statistics in the World. Disponível em: http://www.igc.int/en/default.aspx [ Links ]
Juliatti, F.C.; Zuza, J.L.M.F.; Souza, P.P.; Polizel, A.C. 2007. Efeito do Genótipo de Milho e da Aplicação Foliar de Fungicidas na Incidências de Grãos Ardidos. Bioscience Journal, Uberlândia 23(2): 34-41. [ Links ]
Ksenija, N. 2018. Mycotoxins – climate impact and steps to prevention based on prediction. Acta Veterinaria 68(1): 1-15. [ Links ]
Maiorano, A.; Reyneri, A.; Sacco, D.; Magni, A.; Ramponi, C. 2009. A dynamic risk assessment model (Fumagrain) of fumonisin synthesis by Fusarium verticillioides in maize grain in Italy. Crop Protection 28: 243-256. [ Links ]
MAPA Ministério da Agricultura, Pecuária e Abastecimento. 2011. Regulamento Técnico do Milho. Instrução Normativa Nº 60. 9 pp. [ Links ]
Marcondes, M.M. 2012. Incidência de podridão de colmo e grão ardidos em híbridos de milho sob diferentes densidades de plantas e épocas de colheita. Universidade Estadual do Centro-Oeste. Guarapuava – PR. [ Links ]
Martins, F.A.; Ferreira, F.M.D.; Ferreira, F.D.; Bando, E.; Nerilo, S.B.; Hirooka, E.Y.; Machinski, M.J.R. 2012. Daily intake estimates of fumonisins in corn-based food products in the population of Parana, Brazil. Food Control 26(2): 614-618. [ Links ]
McCormick, S.P.; Stanley, A.M.; Stover, N.A.; Alexander, N.J. 2011. Trichothecenes: from simple to complex mycotoxins. Toxins 3: 802– 814. [ Links ]
Mendes, C. 2016. EUA 2016/17: USDA estima aumento de área, produção e estoques de milho e redução na soja. Notícias Agrícolas. Disponível em: https://www.noticiasagricolas.com.br/noticia s/usda/ [ Links ]
Mendes, M.C. 2009. Micotoxinas, Aspectos Químicos e Bioquímicos Relacionados a Grãos Ardidos em Híbridos de Milho. Universidade Federal de Lavras – UFLA. Lavras – MG. [ Links ]
Mesterházy, Á.; Lemmens, M.; Reid, L.M. 2012. Breeding for resistance to ear rots caused by Fusarium spp. in maize A review. Plant Breeding 131(1): 1–19. [ Links ]
Mitchell, N.J.; Bowers, E.; Hurburgh, C.; Wu, F. 2016. Potential economic losses to the US corn industry from aflatoxin contamination. Food Addit Contam Part A Chem Anal Control Expo Risk Assess 33(3): 540-550. [ Links ]
Murphy, P.A.; Hendrich, S.; Landgren, C.; Bryant, C.M. 2006. Food Mycotoxins: An Update. Institute of Food Technologists. Journal of Food Science 71(5): 51-65. [ Links ]
Nielsen, L.K.; Jensen, J.D.; Rodriguez, A.; Jorgensen, L.N.; Justesen, A.F. 2012. TRI12 based quantitative real-time PCR assays reveal the distribution of trichothecene genotypes of F. graminearum and F. culmorum isolates in Danish small grain cereals. International Journal of Food Microbiology 157: 384-392. [ Links ]
Oliveira, E.M.; Tanure, C.B.G.S.; Castejon, F.V.; Castro, R.M.A.D.; Rocha, F.R.T.; Carvalho, F.B.; Andrade, M.A; Stringhini, J.H. 2015. Performance and nutrient metabolizability in broilers fed diets containing corn contaminated with Fumonisin B1 and esterified glucomannan. Revista Brasileira de Ciência Avícola, Campinas 17(3): 313-318. [ Links ]
Pereira, V.L.; Fernandes, J.O.; Cunha, S.C. 2012. Micotoxinas em Portugal: Ocorrência e Toxicidade. Acta Farmacêutica Portuguesa 1(2): 61-73. [ Links ]
Pinto, N.F J. De A. 2005. Grãos ardidos em milho. Sete Lagoas: Embrapa Milho e Sorgo, 6 p. (Embrapa Milho e Sorgo. Circular técnica, 66). [ Links ]
Pleadin, J. 2015. Mycotoxins in grains and feed: Contamination and toxic effect in animals. Biotechnology in Animal Husbandry 31(4): 441-456. [ Links ]
Rufatto, M. 2014. Micotoxinas e acometimentos à saúde humana ênfase no potencial carcinogênico. Revista Brasileira de Nutrição Clínica Funcional ano 14, nº 60. [ Links ]
Santana, I.; da Silva Junior, A.G.; de Andrade, C.A.S.; Lima Oliveira, M.D. 2019. Biosensors for early detection of fungi spoilage and toxigenic and mycotoxins in food. Current Opinion in Food Science 29: 64-79. [ Links ]
Shephard, G.S. 2016. Current status of mycotoxin analysis: A critical review. Journal of AOAC International 99: 842–848. [ Links ]
Silva, H. Fantin, G.M.; Resende, I.C.; Pinto, N.F.J.A.; Carvalho, R.V. 2001. Manejo Integrado de Doenças na Cultura do Milho de Safrinha In: Seminário Nacional De Milho Safrinha. 2001, Londrina: Iapar. 113-144. [ Links ]
Signorini, M.L.; Gaggiotti, M.; Molineri, A.; Chiericatti C.A.; Zapata De Basílico M.L., J.C.; Pisani M. 2012. Exposure assessment of mycotoxins in cow´s milk in Argentina. Food and Chemical Toxicology 50: 50-257. [ Links ]
Thompson, R.S.; Aveling, T.A.S.; Prieto, R.B. 2013. New semiselective medium for Fusarium graminearum, F. proliferatum, F. subglutinans and F. verticillioides in maize seed. South African Journal of Botany 84: 94101. [ Links ]
Trogello, E.; Nobre, D.A.C.; Kolling, E.M; Modolo, A.J.; Trogello, A.G. 2013. Acompanhamento de uma Unidade Beneficiadora de Sementes de Milho – Estudo de Caso. Revista Brasileira de Milho e Sorgo 12(2): 193-201. [ Links ]
United States Department of Agriculture USDA. Foreign Agricultural Service (FAS). Grain: world markets and trade. United States: USDA/FAS. Disponível em: https://www.fas.usda.gov/data/grain-worldmarkets-and-trade [ Links ]
Valmorbida, R. 2016. Fungos e micotoxinas em grãos de milho (Zea mays l.) e seus derivados produzidos no estado de Rondônia, Região Norte do Brasil. Dissertação de mestrado, Programa de pós-graduação em Ciência dos alimentos, Universidade Federal de Santa Catarina, Florianápolis. [ Links ]
Vieira, R.A. 2013. Avaliação de Perdas no Processo de Beneficiamento de Milho para Semente. Trabalho de Conclusão de Curso (Bacharelado em Engenharia Agronômica) Faculdade de Agronomia e Medicina Veterinária. Universidade de Brasília, Brasília – DF. [ Links ]
Vitorino, O.C.L. 2011. Micotoxinas na Alimentação e na Saúde Animal e Humana. Dissertação (Mestrado em Engenharia Zootécnica) Departamento de Ciências Agrárias, UAC, Universidade dos Açores, Angra do Heroísmo. [ Links ]
Woloshuk, C.; Wise, K. 2011. Diseases of corn: Aspergillus ear rot. Purdue University, 3 pp. [ Links ]
Xing, F.; Yao, H.; Liu, Y.; Dai, X.; Brown, R. L.; Bhatnagar, D. 2019. Recent developments and applications of hyperspectral imaging for rapid detection of mycotoxins and mycotoxigenic fungi in food products. Critical Reviews in Food Science and Nutrition 59(1): 173-180. [ Links ]
* Corresponding author
E-mail: kvmunive@gmail.com (K.V.M. Nuñez).
Received May 2, 2019.
Accepted November 25, 2019.