Introducción
El género Lilium pertenece a la familia Liliácea, subclase monocotiledónea, comprende entre 80 a 110 especies de zonas templadas y montañosas del hemisferio norte, este género ha sido introducido en diversas partes del mundo por el valor comercial de sus flores, y reúne a la mayoría de las plantas conocidas como azucenas o lilium (Hurrell et al., 2019; Laguna et al., 2016; Facchinetti y Marinangeli, 2008). Las especies que más se cultivan son L. longiflorum, de inflorescencia color blanco y los híbridos propagados por cruzamientos, principalmente L. speciosum y L. auratum Lindl. (Schiappacasse et al., 2006). En nuestro país la azucena (Lilium sp.) es cultivada en Caraz, región Ancash (Jara, 2002), asimismo, en las zonas alto andinas de la región Amazonas, siendo las zonas de mayor área cultivada los anexos de Taquia, Maripata y Opelel, distrito de Chachapoyas, región Amazonas, donde estas plantas se han adaptado a las condiciones de clima y suelo, siendo la producción de flores una alternativa productiva de ingreso económico a los productores de esta zona del país, y que abastece a los mercados locales y de la costa del país (Millones et al., 2015; Leiva et al., 2017).
Generalmente el género Lilium es propagado vegetativamente a partir de la formación natural de nuevos bulbos, desarrollados principalmente en las axilas de las hojas, bulbos de tallos, bulbillos desarrollados a partir de las escamas, siendo este último el método de mayor uso en la propagación de Lilium, sin embargo, el tamaño de bulbo comercial se obtiene entre 3 y 4 años (Panda y Mohanty, 2016). Para mejorar la multiplicación de bulbillos a partir de escamas de Lilium, Millones et al. (2015), emplearon reguladores de crecimiento ácido naftalenacético (ANA), bencilaminopurina (BAP) y 6-furfurilaminopurina (KIN) en la inducción de bulbillos a partir de escamas de bulbillos de azucena (Lilium sp.), Akçal y Kahraman (2016) emplearon ácido indolbutírico (AIB) en la formación de bulbillos, Panda y Mohanty (2016), estudiaron la posición de las escamas en la propagación de Lilium, Daneshvar (2019) empleó thidiazuron (TDZ) solo o en combinación con ANA en la inducción de bulbillos in vitro a partir de escamas de L. candidum, Youssef et al. (2019) emplearon TDZ más ácido 2,4-diclorofenoxiacetico (2,4-D) en la inducción de bulbillos in vitro a partir de escamas de L. orientalis. Por lo antes considerado, es necesario el establecimiento de una metodología para la inducción de bulbos en escamas de azucena empleando reguladores de crecimiento como auxinas y citocininas con la finalidad de desarrollar una propuesta en la obtención de semilla prebásica de azucena, y esté disponible en futuro a los productores de azucena. La presente investigación tuvo como objetivo evaluar la inducción de bulbillos de azucena (Lilium sp.) a partir de escamas empleando auxina y citocinina, asimismo, evaluar la etapa de establecimiento de los bulbillos inducidos.
Materiales y métodos
El material vegetativo utilizado en la presente investigación fueron bulbos de azucena (Lilium sp.) de plantas con mayor vigorosidad y libres de plagas y enfermedades, cosechados en junio de 2018 en el anexo de Taquia, región Amazonas, y trasladados al Laboratorio de Biología, UNTRM para el procesamiento respectivo. Los bulbos colectados fueron lavados con agua corriente hasta extraer por completo todas las impurezas provenientes del campo agrícola, luego fueron colocados en una solución de hipoclorito de sodio al 2,5% (lejía comercial Clorox) por un periodo de 25 minutos, se realizaron lavados con agua corriente hasta eliminar por completo los restos de lejía, posteriormente se orearon para volatilizar la lejía, por último fueron empacados y refrigerados para su posterior uso en los ensayos correspondientes.
Los análisis biométricos consistieron en el registro de datos de peso de bulbo y medida del diámetro ecuatorial y polar con ayuda de un vernier mecánico marca Stansa precisión 0,02 mm. Los datos de diámetro ecuatorial fueron procesados y se determinó los calibres: calibre menor [3,36 - 4,00 cm] y calibre mayor [4,01 - 4,75 cm].
En la etapa de inducción de bulbillos a partir de escamas de bulbos de azucena, se extrajeron las escamas de la periferia del bulbo, seleccionando aquellas que no mostraron daños mecánicos, y colocadas en solución de lejía al 10% por 30 minutos, luego se lavaron con agua corriente hasta eliminar por completo los residuos de lejía y posteriormente fueron oreados por una hora. Acondicionadas las escamas, fueron introducidas por un periodo de 30 minutos en soluciones con reguladores de crecimiento: 100 ppm ANA + 100 ppm BAP, 100 ppm ANA + 50 ppm BAP, 100 ppm ANA, 100 ppm BAP, 50 ppm BAP. Posteriormente, estas fueron colocadas en número de 18 en bolsas negras que contenían substrato PREMIX #3 humedecido a capacidad de campo, luego las bolsas fueron colocadas en contenedor plástico y llevados a estufa con temperatura de 24 °C ± 2 por cuatro semanas.
Realizada la etapa de inducción de bulbillos a partir de escamas de bulbos de azucena, se seleccionaron cuatro tratamientos de la etapa anterior para evaluar el establecimiento de los bulbillos de azucena inducidos, siendo T1: calibre mayor, sin reguladores, T2: calibre mayor + 100 mg BAP, T3: calibre menor + 100 ANA + 50 BAP y T4: calibre mayor + 100 ANA + 50 BAP. Las escamas con los bulbillos inducidos fueron colocadas en un sustrato constituido por aserrín y pajilla de arroz, en una relación 1:1. A la sexta semana fueron evaluadas las plántulas.
Los datos de inducción de bulbillos fueron analizados a través del número de bulbillos, porcentaje de inducción, peso, área, diámetro ecuatorial (DE), diámetro polar (DP) y relación DE/DP de bulbillos, empleando un experimento bifactorial 2A x 6B bajo un DCA con 18 repeticiones, los resultados obtenidos fueron evaluados con un ANOVA, en el caso cuando hubieron interacciones entre los factores se realizó una prueba de comparaciones múltiples de Tukey, posteriormente, se evaluó la correlación de las variables efectuando el análisis de coeficiente de correlación simple de Pearson de las respuestas morfogénicas en azucena empleando la prueba t. Los datos de establecimiento de bulbillos inducidos fueron evaluados con un ANOVA, y las comparaciones de medias se empleó la prueba Tukey, posteriormente para evaluar la correlación de las variables se efectuó el análisis de coeficiente de correlación simple de Pearson de las respuestas en el establecimiento de bulbillo inducidas a partir de escamas de azucena, empleando la prueba t. El ANOVA, la prueba Tukey y la prueba t con ρ < 0,05 fue considerado estadísticamente significativo, asimismo, los datos registrados fueron procesados empleando el paquete estadístico SAS (Statical Analysis System) para Windows V8.
Resultados y discusión
En la Tabla 1 se muestran las evaluaciones biométricas de los bulbos colectados en el distrito de Taquia, los datos registrados del diámetro ecuatorial permitieron determinar los calibres de los bulbos, calibre mayor en el intervalo de confianza [40,1 - 47,5] y calibre menor en el intervalo de confianza [32,6 - 40,0], respectivamente. Referente a los caracteres biométricos de los bulbos en Lilium, Almeida et al. (2017) registró valores de diámetro y peso en bulbos de L. longiflorum, diámetro de 3,2 - 3,8 cm con peso de bulbo de 50,4 g, diámetro de 2,5 - 3,2 cm con peso de 34,7 g y diámetro de 1,9 - 2,5 cm con peso de 19,9 g parámetros que influyeron en mejor respuesta fisiológica para la producción de flores y altura de tallo. Similares resultados de diámetro y peso fueron registrados en los bulbos de azucena calibre menor en la presente investigación (diámetro de 3,3 - 4,0 cm con peso de 40,1 g), sin embargo, no se registró respuesta morfogénica en las escamas de los bulbos, en tanto, la mejor respuesta morfogénica se obtuvo cuando se utilizaron bulbos de mayor calibre y peso.
Los bulbos de azucenas donadores de escamas para la inducción de bulbillos en función del intervalo de confianza al 95% registraron rangos con diámetro ecuatorial entre 3,3 a 4 cm (calibre menor) y 4 a 4,8 cm (calibre mayor) (Tabla1). Millones et al. (2015) en un trabajo similar con reguladores de crecimiento emplearon bulbos de azucena similar al calibre menor, con diámetro ecuatorial promedio de 4 cm, no registraron respuestas morfogénicas en las escamas al compararse con un testigo sin reguladores de crecimiento.
Tabla 1 Intervalos de confianza y promedios de la caracterización biométrica en los bulbos de azucena (Lilium sp.) colectados en el distrito de Taquia, región Amazonas
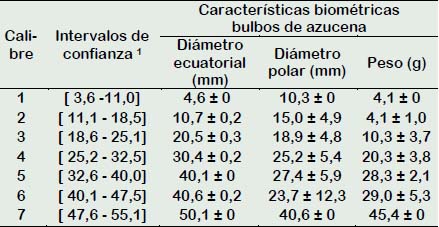
1 Realizados en función al diámetro ecuatorial del bulbo, 95% de confianza.
Las respuestas morfogénicas de las escamas estuvieron influenciadas por el calibre del bulbo de azucena donador de escamas en comparación con la influencia de los reguladores de crecimiento (Factor B), esto corroborado por la escasa significación en este factor. En la Tabla 2 se puede apreciar que el calibre del bulbo (Factor A) registró diferencias significativas en los parámetros evaluados: peso del bulbillo, porcentaje peso de bulbillos, número de bulbillos y relación diámetro ecuatorial/diámetro polar, registrando los mayores valores.
Tabla 2 Análisis del Factor A: calibre de bulbo de azucena (Lilium sp.) colectados en el distrito de Taquia, región Amazonas
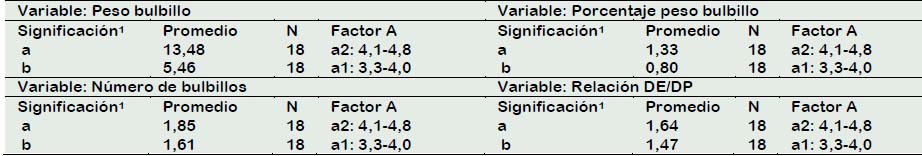
1 Diferentes letras indican diferencias significativas entre los tratamientos para ρ≤ 0,05 de acuerdo a la prueba de Tukey.
Estas respuestas morfogénicas probablemente puedan deberse a una mayor presencia de carbohidratos en las escamas de la periferia. Al respecto, Li et al. (2014) manifiestan que el metabolismo del almidón y la sacarosa presente en las escamas del bulbo son cruciales para la formación y desarrollo de los bulbillos, por tanto, la morfogénesis y crecimiento de los bulbillos demandan la participación de carbohidratos, asimismo, Islam et al. (2017) indican que el almacenamiento interno y el trasporte de la sacarosa en las escamas del bulbo juega un rol importante en la regeneración y desarrollo de los bulbillos.
En la Tabla 3 se aprecia la interacción de los factores calibre de bulbo y regulador de crecimiento, el número de bulbillos en los tratamientos T6, T8, T9, T10, y T11 donde se empleó escamas de bulbo de mayor calibre y reguladores de crecimiento 100 mg/L de ANA, 100 mg/L de BAP solos o combinados mostraron valores superiores al testigo (sin regulador de crecimiento) siendo la prueba significativa. Youssef et al. (2019), quienes estudiaron la formación y regeneración de bulbos en L. orientalis manifiestan que bajo condiciones in vitro la auxina es efectiva para promover la emergencia de los brotes, y es esencial su uso con una citocinina para la inducción de brotes, similares respuestas morfogénicas de los reguladores de crecimiento auxinas y citocininas fueron también registradas bajo condiciones ex vitro de Lilium en la presente investigación.
El empleo de reguladores de crecimiento 100 mg/L ANA + 50 mg/L BAP registró el mayor porcentaje de peso de bulbillos; similares resultados fueron registrados cuando no se empleó reguladores de crecimiento o se empleó 100 mg/L BAP (Tabla 3). Respecto al área de bulbillo y porcentaje de inducción de bulbillos en escamas de azucena provenientes de bulbos de mayor calibre, registró los mayores valores cuando no se empleó reguladores de crecimiento, asimismo en ANA 100 mg/L combinada con la citocinina BAP en 50 y 100 mg/L, respectivamente (Tabla 3).
Los reguladores de crecimiento ANA y BAP fueron efectivos para obtener un mayor número de bulbillos en comparación con el testigo cuando se empleó escamas externas de los bulbos con calibre mayor (Tabla 1). De acuerdo con Marinangeli et al. (2003), quienes emplearon bulbos de calibre aproximado 2 a 2,5 cm, manifestaron que las escamas externas tienen un alto potencial de multiplicación, lo cual se corrobora con que en el presente trabajo donde se empleó también las escamas externas de los bulbos. Por otra parte, en el estudio realizado por Millones et al. (2015), no registraron diferencias entre el testigo y los reguladores de crecimiento ANA y BAP, eso principalmente pudo deberse a que utilizaron un menor calibre del bulbo (diámetro 4 cm) donador de escamas; escasa respuesta morfogénica fueron también registrados en la presente investigación cuando se utilizó un bulbo de calibre menor (3,3 - 4 cm) no se encontraron diferencias significativas entre el testigo y cuando se empleó ANA 100 mg/L combinado con 50 o 100 mg/L de BAP.
Por otro lado, los reguladores de crecimiento ANA y BAP empleados en la presente investigación indujeron una escasa inducción de raíces adventicias en los bulbillos inducidos, tal como lo registraron Millones et al. (2015), esos resultados pueden deberse a que fue empleando una variedad o híbrido diferente, y tal como manifiestan Schuster (2001) que los cultivares, en función de las variedades tienen una forma distinta de respuesta morfogénica según el nivel de fitohormonas, que en parte puede explicar esa distinta respuesta en la inducción de raíces adventicias en los bulbillos inducidos de azucena.
Tabla 3 Respuestas morfogénicas de las escamas de azucena (Lilium sp.) sometidos a reguladores de crecimiento ANA y BAP
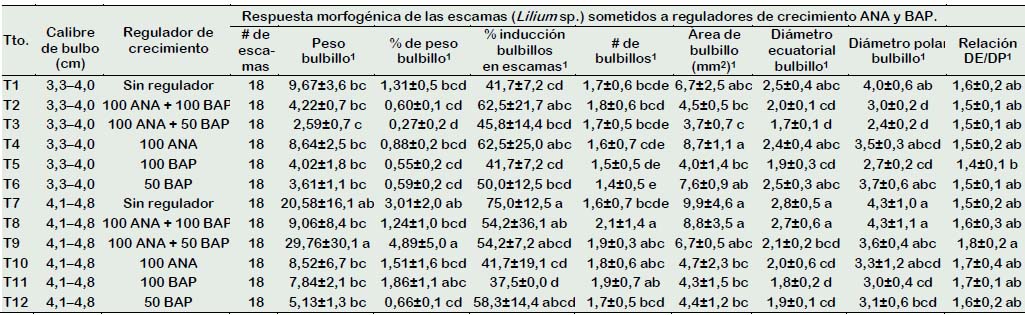
1 Diferentes letras indican diferencias significativas entre los tratamientos para ρ≤ 0,05 de acuerdo a la prueba de Tukey.
En la Tabla 4 se puede apreciar que el área del bulbillo se encuentra correlacionada con el porcentaje de inducción de bulbillo, así mismo, la relación de diámetro ecuatorial/diámetro polar se encuentra correlacionado con el número de bulbillos. Por último, existió una muy alta correlación entre el área del bulbillo, el diámetro polar y el diámetro ecuatorial. Estas correlaciones son importantes porque permitirán optimizar las evaluaciones en las respuestas morfogénicas de las escamas de azucena sometidas a reguladores de crecimiento.
En la Tabla 5 se puede apreciar que los bulbillos inducidos en bulbos de calibre mayor empleando reguladores de crecimiento 100 mg/L de ANA + 50 mg/L BAP, mostrando plantas con mayor longitud de hojas en comparación con los bulbillos inducidos de bulbos de calibre mayor sin reguladores de crecimiento, o empleo de 100 mg/L BAP. Por otro lado, se registraron mayores valores de longitud de raíces y ancho de hoja cuando los bulbillos provenían de escamas de bulbos de mayor calibre (Tabla 5). Por último, el diámetro ecuatorial y el diámetro polar mostraron mayores valores cuando se empleó escamas de bulbillos de calibre mayor y reguladores de crecimiento 100 mg/L ANA + 100 mg/L BAP, o sin la presencia de estos (Tabla 5). Castro y Londoño (2008), quienes obtuvieron bulbillos mediante cultivo in vitro, las variables de crecimiento mostraron que los bulbillos inducidos tomaron un lapso de 45 días, al cabo de los cuales las plántulas formaron en promedio 3,5 hojas, alcanzaron una altura de 8 cm y los bulbillos tuvieron un peso de 0,85 g. En tanto, la presente investigación el establecimiento de bulbillos inducidos a partir de escamas de azucena, el tratamiento donde se empleó escamas extraídas de bulbos de mayor calibre y sometido a reguladores de crecimiento 100 mg/L de ANA + 50 mg/L de BAP desarrollaron plántulas a las 8 semanas con una mayor longitud de hojas en comparación con aquellas plántulas donde no se empleó reguladores de crecimiento, o se empleó menor calibre o sólo 100 mg/L (Tabla 4). Por otro lado, en la fase de establecimiento se pudo evidenciar que el calibre mayor (4,1 - 4,8 cm) del bulbo de azucena donador de escamas influenció en una mayor longitud de raíces y ancho de hojas del bulbillo inducido e establecido, y por ende reflejó que los bulbos de estás plántulas mostraran mayores valores de diámetro ecuatorial y polar respectivamente (Tabla 4). Cuéllar et al. (2016), quienes trabajaron en dos clones de lirio oriental in vitro, indicaron que para inducir un mayor número de yemas en Lilium asiático y oriental, se requieren concentraciones bajas (0,5 mg/L) de la auxina AIA y la citocinina BAP, en la presente investigación las escamas acondicionadas en sustrato PREMIX #3, se requirieron la combinación de reguladores de crecimiento ANA (50, 100 mg/L) y BAP (50, 100 mg/L) solos o combinados, para la inducción de bulbillos en escamas provenientes de bulbos de mayor calibre.
En la presente investigación se obtuvieron adecuadas respuestas en el uso de las escamas de la periferia de bulbo, y tal como indica Marinangeli et al. (2003), para propósitos de producción, las escamas externas, sumadas a las escamas medias, deben ser utilizadas en los procesos de propagación. La identificación de la ubicación de la escama en el bulbo para procesos de producción de semilla vegetativa es importante, porque las escamas que comprenden un bulbo existe variabilidad en la respuesta a la propagación, razón por ello se deben estandarizar las escamas a utilizar (Marinangeli et al., 2003).
Tabla 4 Coeficiente de correlación simple de Pearson de las respuestas morfogénicas en escamas de azucena (Lilium sp.) sometidas a reguladores de crecimiento ANA y BAP
| Inducción de bulbillo | Número de bulbillo | Diámetro polar | Diámetro ecuatorial | Relación DP/DE | Área de bulbillo | |
| Inducción de bulbillo | 1 | - 0,11 ns | 0,42 ns | 0,54 ns | - 0,18 ns | 0,60* |
| Número de bulbillo | 1 | 0,23 ns | - 0,08 ns | 0,71* | 0,01 ns | |
| Diámetro polar | 1 | 0,91* | 0,36 ns | 0,90* | ||
| Diámetro ecuatorial | 1 | - 0,05 ns | 0,94* | |||
| Relación DP/DE | 1 | 0,07 ns | ||||
| Área de bulbillo | 1 |
*Significativo al 5% de probabilidad, por la prueba de t; ns: no significativo.
Tabla 5 Respuestas morfogénicas del establecimiento de bulbillos inducidos a partir de escamas de azucena (Lilium sp.) sometidos a reguladores de crecimiento ANA y BAP
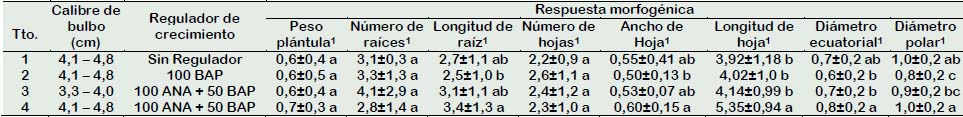
1 Diferentes letras indican diferencias significativas entre los tratamientos para ρ≤ 0,05 de acuerdo a la prueba de Tukey.
Tabla 6 Coeficiente de correlación simple de Pearson entre los parámetros de establecimiento de azucena (Lilium sp.) sometidos a reguladores de crecimiento ANA y BAP
| Peso total | N° Raíces | Longitud de raíz | N° Hojas | Ancho hoja | Longitud de hoja | DE | DP | |
| Peso total | 1 | - 0,67 ns | 0,73 ns | - 0,36 ns | 0,90 ns | 0,98* | 0,91 ns | 0,81 ns |
| N° Raíces | 1 | - 0,02 ns | 0,31 ns | - 0,56 ns | - 0,54 ns | - 0,58 ns | - 0,52 ns | |
| Longitud de raíz | 1 | - 0,41 ns | 0,79 ns | 0,80 ns | 0,79 ns | 0,74 ns | ||
| N° Hojas | 1 | - 0,72 ns | - 0,23 ns | - 0,70 ns | - 0,83 ns | |||
| Ancho de hoja | 1 | 0,84 ns | 1,00* | 0.98* | ||||
| Longitud de hoja | 1 | 0,85 ns | 0,73 ns | |||||
| DE | 1 | 0.98* | ||||||
| DP | 1 |
*Significativo al 5% de probabilidad, por la prueba de t; ns: no significativo.
Es así, que en la presente investigación fue estandarizado el método de propagación empleando sólo escamas externas (escamas a la periferia del bulbo). Mallqui (2019) manifiesta que empleando un sustrato constituido por arena y aserrín en la relación 1:1, registraron a los 5 meses el mayor números de bulbillos por escama (02 bulbillos por escama), en la presente investigación se logró inducir a la cuarta semana 2,13 bulbillos por escama, cuando se empleó 100 mg/L de ANA + 100 mg/L de BAP, asimismo, en la presente investigación el uso de los reguladores de crecimiento ANA y BAP en escamas de bulbo calibre mayor permitieron obtener una mayor inducción de bulbillos en comparación con el testigo sin uso de reguladores de crecimiento. Por otro lado, los bulbillos inducidos a partir de las escamas de Lilium sp. se caracterizaron por la ausencia de raíces adventicias, en tanto, Mallqui (2019) y Millones et al. (2015), registraron inducción de raíces en los bulbillos. Quizá pudo deberse a que se empleó otra variedad o híbrido diferente al utilizado en el presente trabajo.
En la Tabla 6 se puede observar que la longitud de hojas estuvo altamente correlaciona-da con el peso de bulbillo. Asimismo, el diámetro ecuatorial y el diámetro polar estuvieron altamente correlacionadas con el ancho de hojas, por último, el diámetro polar estuvo altamente correlacionado con el diámetro ecuatorial, la correlación de estos parámetros registrados permitirá optimizar las evaluaciones en la etapa de establecimiento de bulbillos inducidos en escamas de azucena.
Conclusiones
Los reguladores de crecimiento empleados 100 mg/L ANA, 100 mg/L de BAP, solos o combinados permitieron inducir un mayor número de bulbillos a partir de escamas de bulbos con mayor calibre (4,1 - 4,8 cm) en comparación con el testigo sin reguladores de crecimiento.
Los reguladores de crecimiento ANA y BAP, solos o en combinación indujeron una escasa inducción de raíces adventicias en los bulbillos de azucena.
Se determinó que las variables relación DE/DP del bulbillo y el área de bulbillo se encuentran correlacionadas con el porcentaje de inducción y número de bulbillos, respectivamente. Asimismo, el área de bulbillo está altamente correlacionada con el DE y DP, respetivamente.
En la etapa de establecimiento se determinó que los bulbillos inducidos a partir de escamas de bulbos de mayor calibre y sometidos a concentraciones de reguladores de crecimiento 100 mg/L de ANA + 50 mg/L de BAP, las plantas desarrollaron una mayor longitud de hoja en comparación con aquellos bulbillos inducidos en escamas sin uso de reguladores de crecimiento.
Fue posible desarrollar un protocolo para la inducción de bulbillos a partir de escamas de azucena en el desarrollo de semilla prebásica de azucena.















