Introdução
A cerveja é a bebida alcoólica mais conhecida e consumida mundialmente devido a diversas razões econômicas e sociais. A junção de uma grande quantidade de empresas transnacionais faz com que o mercado cervejeiro se expanda cada vez mais e, com isso, algumas marcas acabam dominando o mercado em detrimento de outras.
A descoberta e o desenvolvimento de diferentes técnicas de fabricação de cerveja representam um dos maiores efeitos tecnológicos da humanidade. Antigamente, as matérias-primas e os processos utilizados na fabricação dessa bebida variavam significativamente. Há evidências que as primeiras produções de cerveja aconteceram na China e na Mesopotâmia, porém, devido a uma mudança drástica nas condições climáticas desta região, a produção foi desfavorecida. Além disso, a produção inicial atingiu outras regiões, como o Antigo Egito que, devido à alta contaminação da água, houve um aumento no consumo de cerveja, sendo esta parte da dieta básica dos egípcios, juntamente com o pão (Cabras e Higgins, 2016).
A água é responsável por 90% da composição da cerveja, além de alguns carboidratos não fermentados pela levedura, etanol, dióxido de carbono, glicerol e compostos orgânicos. Estes são muitas vezes encontrados em concentrações muito baixas, assim, apenas os que apresentam sabor significante são perceptíveis ao paladar e ao olfato. Grande parte do aroma presente na cerveja é proveniente da matéria-prima (malte e lúpulo) ou é derivado do metabolismo das leveduras durante a fermentação (Buiatti, 2009).
O uso de diferentes adjuntos na produção de cerveja como cevada, trigo, arroz e milho têm diversas razões como, por exemplo, a modificação sensorial da cerveja e maior disponibilidade de carboidratos fermentescíveis. Assim, o uso de determinado adjunto varia conforme a disponibilidade e preços mais baixos no mercado local (Piacentini et al., 2017). Esses cereais pertencem à família Poaceae, sendo que nesta família incluem as plantas utilizadas na alimentação humana e animal (Sarwar et al., 2013).
Os cereais podem ser acometidos por uma série de fungos no campo, podendo ocasionar doenças na etapa da pré-colheita, ou ainda, colonizar estas plantas de forma endofítica. Dentre os gêneros mais comumente encontrados em cereais, destacam-se: Alternaria, Aspergillus, Fusarium e Penicillium, que são capazes de produzir micotoxinas, produtos do metabolismo secundário fúngico, que quando ingeridos proporcionam efeitos tóxicos em animais vertebrados (CAST, 2003). De acordo com a Food Agriculture Organization (FAO), os prejuízos econômicos gerados por alimentos contaminados por micotoxinas estão em torno de 100 milhões de toneladas por ano (CAST, 2003).
O gênero Fusarium é bastante recorrente em grãos do mundo todo. De acordo com Nijs et al. (1996), diferentes espécies de Fusarium são detectadas em alimentos crus como cereais, legumes e frutas. A espécie F. graminearum é comumente encontrada em cereais utilizados para produção de cerveja e é capaz de produzir tricotecenos, como desoxinivalenol (DON), nivalenol (NIV) e diacetoxiscirpenol (DAS), além de zearalenona. Outra espécie comumente isolada de grãos de milho é F. verticillioides, capaz de produzir elevados níveis de fumonisinas (Leslie e Summerell, 2006). Vale ressaltar que as micotoxinas presentes nesses cereais podem permanecer na cerveja, devido à estabilidade de alguns destes compostos frente às operações unitárias (Bullerman e Bianchini, 2007).
Fusarium graminearum também pode causar uma doença conhecida como giberela ou Fusarium Head Blight, que tem aumentado nos últimos anos; sua ocorrência se dá, principalmente, devido às condições climáticas favoráveis, tais como elevada precipitação pluvial e temperaturas que variam de 20 a 25ºC, provocando diversos prejuízos econômicos (Embrapa, 2006).
O trabalho em questão tem como objetivo abordar a contaminação por fungos do gênero Fusarium e suas principais micotoxinas de ocorrência na cevada, além de avaliar o efeito do processamento de cervejas industriais nos tricotecenos, zearalenona e fumonisinas e explorar as principais formas de controle dessas micotoxinas em cervejas.
Micotoxinas de Fusarium presentes em cervejas: características e toxicidade
Os fungos filamentosos que contaminam alimentos, quando expostos às condições ambientais favoráveis, tais como umidade e temperatura, podem crescer e, como consequência, produtos do metabolismo são liberados no substrato utilizado pelo micro-organismo (Pascari et al., 2018a).
Grãos de cereais constituem importantes fontes de energia e proteína e, quando estes são colonizados por fungos há a possibilidade da contaminação por seus metabolitos secundários tóxicos, conhecidos como micotoxinas, que são capazes de causar intoxicações em humanos e outros animais (Placinta et al., 1999).
As micotoxinas são compostos de baixo peso molecular que podem provocar efeitos tóxicos no organismo mesmo quando consumidos em baixa concentração. Portanto, qualquer contato com fungos toxigênicos pode ser consideravelmente perigoso. Além disso, as micotoxinas são encontradas em todos os níveis da cadeia alimentar, desde o período pré-colheita, pós-colheita até o armazenamento ou ainda pós-processamento do alimento e, dentre os efeitos mais graves encontrados estão a neurotoxicidade e hepatoxicidade, além da carcinogenicidade, imunotoxicidade e mutagenicidade, por isso devem ser drasticamente controladas desde a produção agrícola até o processamento final (Benełová et al., 2012).
Os fungos do gênero Fusarium são produtores das principais micotoxinas presentes em cereais utilizados para a produção de cerveja. Espécies pertencentes ao gênero têm sido associadas aos diversos climas, de temperado ao tropical, requerendo elevada atividade de água para seu crescimento e produção de micotoxinas (Antonissen et al., 2014).
Os tricotecenos são micotoxinas provenientes do metabolismo do sesquiterpenos e são produzidas por algumas espécies de Fusarium e, também, outros fungos da ordem Hypocreales (Piacentini et al., 2017). Esses tricotecenos são capazes de interromper a função celular através da inibição da síntese de proteínas. Em relação à toxicidade, há uma grande diferença em relação a diferentes espécies, sendo o porco a espécie mais sensível ao DON, seguido por roedores, cães, gatos e ruminantes (Pestka e Smolinski, 2005).
A zearalenona, também bastante encontrada em grãos para produção de cervejas industriais, é produzida por Fusarium e é rapidamente absorvida após administração oral, embora o grau de absorção seja difícil de dimensionar devido à extensa excreção biliar (Zinedine et al., 2007).
As fumonisinas são micotoxinas produzidas principalmente por fungos do complexo de espécies Fusarium fujikuroi (CEFF), sendo Fusarium verticilloides a principal espécie produtora desta micotoxina, capaz de produzir níveis acima de 5000 μg/kg (Piacentini et al., 2017).
De acordo com Piacentini et al. (2017), há diversos efeitos toxicológicos provocados pela fumonisina tipo B1, como por exemplo edema pulmonar em suínos, leucoencefalomalácia (LEME) equina e câncer de esôfago em humanos, podendo levar à óbito. Ao ingerirem alimentos contaminados com essas micotoxinas, há também diversos efeitos adversos em gestantes, como por exemplo, a má formação do tubo neural (Benedit, 2018). Ainda em relação aos efeitos toxicológicos produzidos por essa fumonisina encontra-se uma diminuição na produção de leite e mudanças nos órgãos de reprodução (Vitorino, 2011). A Tabela 1 contém as principais espécies de Fusarium produtoras de micotoxinas associadas aos cereais utilizados para a produção de cerveja.
Tabela 1 Principais substratos, micotoxinas, espécies de Fusarium toxigênicas e efeitos toxicológicos
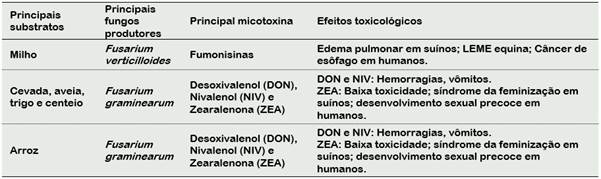
Fonte: adaptado de Leslie e Summerell (2006).
Incidência de micotoxinas de Fusarium em cereais utilizados na produção de cerveja
A cevada é o cereal mais comumente utilizado na produção de cerveja e é bastante afetada pela doença conhecida como Fusarium Head Blight (FHB) ou giberela (Wolf-Hall, 2007), que causa um impacto negativo nas taxas de germinação, resultando em uma pior qualidade de maltagem e redução da produtividade (Pascari et al., 2018a). O principal fungo responsável pela doença é a espécie F. graminearum, capaz de produzir elevados níveis de tricotecenos do tipo B, como o DON e a micotoxina estrogênica zearalenona (Wolf-Hall, 2007).
Estudos realizados no Brasil demonstraram que 94% das amostras brasileiras de cevada colhidas em 2015 estavam contaminadas por DON, com níveis médios entre 1.700 e 7.500 μg/kg. Enquanto 73,6% apresentaram contaminação por zearalenona, com níveis médios entre 350 e 630 μg/kg. Vale ressaltar que em safras anteriores, os níveis de DON foram inferiores ao referido (Piacentini et al., 2015; Piacentini et al., 2018). De fato, condições climatológicas tais como aumento da temperatura e precipitação, podem influenciar nos resultados, destacando a importância do monitoramento dessas condições durante o desenvolvimento da planta (Piacentini et al., 2018).
Na Europa a contaminação da cevada por DON possui ocorrência entre 15 e 55%, conforme relatos nos últimos anos (EFSA, 2013). As concentrações médias foram de 484 μg/kg em cevada não processada, 152 μg/kg em cevada destinada para consumo humano e 187 μg/kg em grãos destinados para a alimentação animal (EFSA, 2013; Varga et al., 2013). Comparando estes dados com os obtidos no Brasil, observa-se maior contaminação nos grãos brasileiros, fato que pode ser explicado pelo menor controle dos grãos do plantio à colheita, ou condições climatológicas que favorecem o crescimento do fungo e a produção de DON.
Em razão da necessidade de grandes quantidades de cevada para produção de cerveja, as empresas buscam, constantemente, novas estratégias de reduzir os custos e adotaram a utilização de outros cereais, como arroz, milho e trigo, para substituição parcial do malte e complementar as fontes de carboidratos fermentescíveis (Zhang et al., 2017; Mastanjević et al., 2018; Humia et al., 2019; Mathias et al., 2019).
O arroz também é um cereal que pode ser afetado pela doença FHB, assim como a cevada (Kim et al., 2018). Outros fungos pertencentes ao gênero Fusarium também podem ser encontrados neste substrato, destacando o complexo de espécies Fusarium fujikuroi, que contém representantes capazes de infectar a planta e causar a doença bakanae no arroz, além disso, diversas espécies são capazes de produzir micotoxinas como ácido fusárico, beauvericina, fumonisinas e moniliformina (Desjardins, 2000; Munkvold, 2017).
Algumas espécies de Fusarium podem ser associadas ao milho, dentre estas, destaca-se F. verticillioides, fungo capaz de ocasionar a podridão do colmo e produzir elevados níveis de fumonisinas nos grãos (Leslie e Summerell, 2006; Rocha et al., 2009). O milho, por sua vez, pode ser utilizado como adjunto na produção de cerveja, podendo contribuir na contaminação por fumonisinas. De fato, Piacentini et al. (2017), demonstraram que cervejas comercializadas no Brasil, apresentaram elevados níveis de FB1, ressaltando a importância do controle e monitoramento desta micotoxina na referida bebida.
O trigo, utilizado como adjunto ou ainda na produção integral de cerveja (Faltermaier et al., 2014), também pode contribuir para o acúmulo de micotoxinas na bebida. A planta pode ser acometida por FHB sendo que, F. graminearum, é capaz de produzir DON e ZEA nos grãos (Tralamazza et al., 2016; Dweba et al., 2017). No estudo realizado por Tralamazza et al. (2016), elevada frequência e concentrações de DON foram obtidas em amostras de trigo do Brasil, com níveis entre 183 a 2150 µg/kg.
Incidência de micotoxinas de Fusarium em cerveja
Como o milho é um dos principais adjuntos utilizados na produção de cerveja no Brasil, é esperada a ocorrência de fumonisinas B1 e B2 (FB1 e FB2), já que estas são as micotoxinas que mais prevalecem nesse cereal e em seus subprodutos, sendo que FB1 é a mais tóxica e a que ocorre em maior frequência e concentração. Fusarium verticillioides, a principal espécie produtora de fumonisinas, sendo capaz de produzir níveis acima de 5000 μg/kg (Leslie e Summerell, 2006).
A zearalenona e os tricotecenos do tipo B, principalmente DON, são encontrados em cervejas do mundo todo, uma vez que F. graminearum é um fungo com distribuição mundial e isolada com frequência de grãos de cevada (Leslie e Summerell, 2006).
Na África, em estudo realizado com cerveja artesanal à base de milho, altos níveis de fumonisinas foram recuperados (média: 1898 μg/kg). Esse resultado se mostrou preocupante, mediante o elevado consumo da bebida pela população na região de Malawi, sendo este, aproximadamente 5-6 L/dia (Matumba et al, 2014).
Na Polônia, Kuzdraliński et al. (2013) demonstraram que 100% das amostras de cerveja apresentaram contaminação por DON com níveis entre 7,5 μg/L e 70,2 μg/L, enquanto ZEA foi detectada em apenas 14,3% das amostras e, em níveis inferiores. Diferentemente de estudo realizado na Alemanha, em que 100% das amostras de cerveja apresentaram contaminação por ZEA, com níveis entre 0,35 e 2,0 μg/L. Cerca de 75% das amostras apresentaram contaminação por DON, com níveis entre 2.2-20 μg/L (Bauer et al., 2016). Piacentini et al. (2017), ao analisar 114 amostras de cerveja do Brasil, observou que nenhuma continha níveis detectáveis de DON, já os níveis de FB1 foram relevantes, sendo encontradas em aproximadamente 50% das amostras, com níveis variando de 201,70 μg/L a 1568,62 μg/L (média: 367,47 μg/L). Estudos mais recentes na Espanha (Pascari et al., 2018b) e no México (Wall-Martínez et al., 2019) foram detectados a presença de DON, ZEA, toxina HT-2 e FB1 em amostras de cerveja, entretanto a sua frequência foi baixa (menos de 30% de amostras positivas).
Estudos realizados anteriormente também mostraram que a contaminação de micotoxinas para a cerveja final está relacionada à infecção da safra, às práticas agrícolas e às condições tecnológicas aplicadas durante o processo de fermentação. Além disso, durante o processo de fermentação, a quantidade de DON pode ser eliminada ou reduzida, e por essas razões pode-se explicar a ausência dessa micotoxina nas amostras analisadas de cerveja industrial (Campagnollo et al., 2015).
Legislação mundial para as toxinas de Fusarium
Ao longo dos anos, foi-se adquirindo um maior conhecimento a respeito das micotoxinas e seus efeitos toxicológicos, e com isso criaram-se legislações para estabelecer um limite máximo para ingestão dessas substâncias, com o propósito de proteger a saúde do consumidor (Varga et al., 2013).
Para criar essas legislações e estabelecer esses limites máximos, diversos fatores devem ser levados em consideração, como por exemplo, fatores de risco, consumo dos alimentos e disponibilidade de dados toxicológicos (CAST, 2003).
Com isso, os níveis de toxinas presentes em grãos de cevada, assim como em outros adjuntos utilizados para a produção de cerveja são bastante importantes já que estes influenciam diretamente na qualidade do produto.
No ano de 2017 foi aprovada a Resolução (nº 138), alterando a Resolução nº 7, de 18 de fevereiro de 2011, com relação aos limites máximos tolerados de micotoxinas para algumas categorias de alimentos, focando nas categorias em que a matéria prima utilizada na produção de cerveja se enquadra. E, juntamente, foi proposto novos limites a serem vigorados a partir do ano de 2019 (BRASIL, 2017). Abaixo, se encontra a Tabela 2, com as principais micotoxinas de Fusarium e seus limites tolerados em cada alimento, de acordo com a atual legislação do Brasil.
Devido ao fato de que a maioria da produção do Brasil, tanto agrícola quanto pecuária, é destinada à exportação, legislações de outros países devem ser consideradas também. Portanto, abaixo se encontram as Tabelas 3 e 4 com os limites máximos permitidos para as principais micotoxinas de Fusarium nos Estados Unidos e da União Européia para alimentação humana.
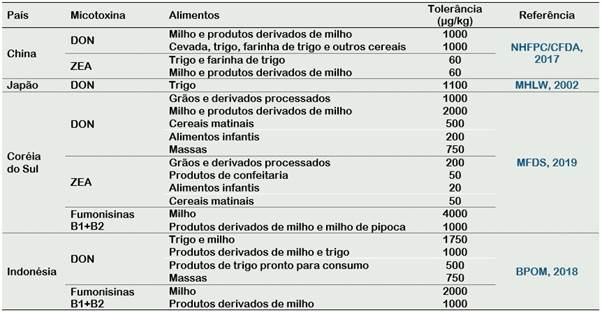
Muitos países utilizam as legislações dos EUA e da União Européia como referência para os limites de micotoxinas em alimentos, entretanto na Ásia, em alguns países como China, Japão, Coréia do Sul e Indonésia, possuem legislação própria que regulamentam o limite máximo de desoxinivalenol, zearalenona e fumonisina, como observa-se na Tabela 5.
É importante considerar que não foram implementadas regulamentações para micotoxinas em cerveja, uma vez que diversos países aplicam limites estritos para as matérias-primas utilizadas na produção da bebida. Desta forma, espera-se que os níveis de micotoxinas encontrados na cerveja sejam abaixo dos estabelecidos para a matéria-prima (Bertuzzi et al., 2018).
Estratégias de controle das toxinas de Fusarium na cerveja
O processamento de cerveja consiste em três reações químicas fundamentais: i) ativação enzimática em grãos de cevada durante o processo de germinação, ii) a degradação do amido em açúcares fermentescíveis, iii) fermentação alcoólica realizada por leveduras do gênero Saccharomyces com formação de etanol e gás carbônico. Além disso, a qualidade das matérias-primas na produção de cerveja (cevada, lúpulo, água e leveduras) está diretamente relacionada com as características organolépticas do produto (Pascari et al., 2018a).
O malte é produzido pela germinação da semente de cevada sob condições favoráveis de temperatura e umidade. Além disso, é fonte de enzimas do tipo amilase, que irão atuar sobre o amido resultando em açúcares mais simples para serem metabolizados pelas leveduras durante a fermentação (Wolf-Hall, 2007).
A maioria dos processamentos de alimentos possuem diversos efeitos sobre as micotoxinas, sendo os maiores efeitos aqueles que utilizam temperaturas mais altas. Em geral, os processos diminuem significativamente as concentrações de micotoxinas, porém, sem eliminá-las completamente (Bullerman e Bianchini, 2007).
De acordo com Wolf-Hall (2007), uma das etapas da maltagem é a maceração, que consiste em ciclos de pulverização de água ou imersão no liquido até que os grãos atinjam um teor de umidade de aproximadamente 45%, sendo que essa umidade está relacionada ao tipo de malte que se pretende obter. O objetivo dessa etapa é criar condições favoráveis dentro do grão e ativar as enzimas responsáveis pela germinação. Como o processo de maceração implica em um tratamento do grão com uma grande quantidade de água, este processo pode ter um impacto no nível de micotoxinas solúveis em água, como por exemplo, o DON. Porém, embora o desoxinivalenol possa ser reduzido durante esse processo, o fungo Fusarium ainda é capaz de crescer, se desenvolver e produzir micotoxinas na fase de maceração e germinação. O uso da técnica de irradiação como forma de prevenir o crescimento do fungo durante a etapa de maltagem é promissor, além de tratamentos químicos como a ozonização, desde que não deixem resíduos químicos no produto, porém ainda são necessários estudos mais concretos a respeito desse assunto (Wolf-Hall, 2007; Mastanjević et al., 2018).
Depois da maltagem ocorre a moagem, que tem como objetivo aumentar a superfície de contato entre o líquido de infusão e o malte. Normalmente, para esse processo são utilizados rolos ou moinhos de martelo para a obtenção de melhores resultados, já que desta forma as cascas se mantêm intactas, evitando a liberação de taninos e outros compostos que podem causar características indesejáveis ao produto final. Quanto menor for o tamanho das partículas, melhor será a quebra do malte em açúcares mais simples, porém, se a partícula for muito pequena pode ter um impacto negativo, resultando em um mosto mais turvo. Nessa etapa não há um impacto direto sobre os níveis de micotoxinas, porém, essa etapa poderia resultar em uma disseminação da micotoxina por todo o malte e, consequentemente, em sua solubilização na água utilizada na etapa de brassagem (Pascari et al., 2018a).
A brassagem nada mais é do que a mistura do malte em uma grande quantidade de água sob temperaturas ideais para a ativação de todas enzimas ali presentes, permitindo a conversão de amido em açúcares fermentescíveis. Nesta etapa, pode haver um aumento da concentração da micotoxina do tipo DON (Pascari et al., 2018a), porém, de acordo com Kostelanska et al. (2011), as concentrações de DON no produto final estão diretamente relacionadas com as concentrações dessa micotoxinas na matéria-prima. Nesta etapa deve-se prestar bastante atenção também aos adjuntos adicionados, como por exemplo o milho, já que este é um ingrediente propenso à presença de fumonisinas.
As etapas de separação e fervura do mosto são feitas após a separação das partículas sólidas, e nesta etapa também é adicionado o lúpulo. As principais etapas da fervura do mosto são: inativação enzimática, evaporação da água, volatilização de compostos, precipitação de proteínas e reação de Maillard. Seguido dessas etapas, o mosto é resfriado, filtrado e transferido para tanques de fermentação. O lúpulo é um ingrediente susceptível à contaminação fúngica, porém, como utilizado em pequenas quantidades, não possui um grande impacto. Além disso, a fervura do mosto como ocorre em temperaturas acima de 100 ºC pode provocar uma diminuição das micotoxinas (Pascari et al., 2018a).
De acordo com Campagnollo et al. (2015), em um estudo foi investigada a presença de micotoxinas nos resíduos de fermentação de cerveja, pelo fato de ocorrer uma ligação glicosídica da micotoxina com a parede celular da levedura. Porém, a presença de micotoxinas no mosto, mesmo que em altas concentrações, não tem influência direta nos parâmetros da fermentação (Nathanail et al., 2016).
A etapa de maturação consiste em melhorar os aspectos qualitativos do processo final. Essa etapa dura em torno de três meses e envolve a redução da temperatura para cerca de 0ºC. Além disso, durante esse processo, há a combinação de proteínas e taninos, resultando na clarificação da cerveja, que pode ser acelerado através da filtração ou centrifugação. As próximas etapas, como a pasteurização, visam principalmente a estabilização microbiológica da cerveja e inativar células de leveduras que possam estar presentes após a etapa de filtração, a fim de evitar uma fermentação posterior. O uso de aditivos para ajudar na clarificação da cerveja pode estar envolvido também na diminuição do nível de micotoxinas no produto final, caso estes funcionem como adsorventes (Pascari et al., 2018a).
Para reduzir a incidência das micotoxinas no produto final, diversas estratégias podem ser consideradas em todas as etapas de produção, como o tratamento dos cereais no campo para evitar a contaminação por fungos, uso de bactérias láticas durante a maltagem, ozonização e tratamento dos grãos de cevada com água, para as micotoxinas hidrossolúveis (Pascari et al., 2018a).
Nos dias de hoje, o controle atual mais eficaz relacionado às cevadas infectadas é simplesmente evitar o seu uso. Porém, para os locais produtores de cevada e que dependem dessa produção, evitar o seu uso pode trazer sérios problemas econômicos. Portanto, várias técnicas estão sendo estudadas para que se consiga utilizar pelo menos uma parte da cultura infectada (Wolf-Hall, 2007).
Além disso, sabe-se que o crescimento e desenvolvimento dos fungos estão diretamente relacionados ao ambiente em que vivem, ou seja, são favorecidos pela umidade. Portanto, a secagem dos grãos posteriormente à colheita é uma forma de prevenir a contaminação dos mesmos (Mastanjević et al., 2018).
Deve-se também proteger os grãos ao máximo durante o processo de secagem, evitando qualquer tipo de dano, uma vez que os grãos com qualquer tipo de avaria tendem a ter uma maior invasão por fungos, podendo resultar na contaminação por micotoxinas. Por esse motivo, deve-se evitar também a presença de insetos no setor de armazenamento, já que eles também são responsáveis por provocar danos aos grãos (Agriopoulou et al., 2020).
Dessa forma, alguns estudos sugerem utilizar estratégias de controle contra FHB, como o uso de agentes de biocontrole, que incluem bactérias e fungos para reduzir a contaminação por F. graminearum e suas micotoxinas associadas nas plantas de trigo e cevada (Khan e Doohan, 2009; Matarese et al., 2012). Contudo, são necessários mais estudos para avaliar a efetividade e a interação agro-ecológica que esses agentes podem provocar no ambiente (Dweba et al., 2017). Além disso, o controle por agentes químicos como fungicidas podem se mostrar eficazes, entretanto, muito fatores devem ser considerados como o cultivar utilizado, o clima, custos econômicos, tipo e dose do fungicida (Dweba et al., 2017).
Conclusões
Como as micotoxinas apresentam efeitos toxicológicos em humanos e animais, é necessária a aplicação de regulamentações de limites toleráveis em alimentos que são passíveis de contaminação pelas mesmas. Através dessa revisão, foi observado que não existe legislação para micotoxinas em cerveja no Brasil, embora a regulamentação seja expressiva para os cereais utilizados como ingredientes da cerveja, como no caso trigo, milho e cevada. E, em diversos países, é adotado um controle de qualidade rigoroso nas matérias-primas utilizadas na produção da bebida.
Neste sentido, trabalhos visando formas de maximizar a produção de cerveja, incluindo estratégias para controle (ou biocontrole) de micotoxinas em cereais e utilização de outros adjuntos menos susceptíveis à contaminação fúngica são essenciais para redução dos custos e melhoria da qualidade do produto final. Também, há a necessidade da adoção de medidas regulatórias para cerveja, uma vez que, foram relatados em estudos de diversas localizações do mundo, a presença de micotoxinas produzidas por Fusarium em níveis significativos.