Introducción
Los sistemas acuapónicos han surgido debido a la necesidad de reducir el consumo de recursos naturales y los riesgos de contaminación. Este entorno simbiótico se constituye de la producción de peces (acuicultura), cultivo de hortalizas, frutos (hidroponía) y bacterias nitrificantes asociadas a raíces de plantas, quienes se benefician mutuamente en un sistema de circulación de agua (Monsees et al., 2019; Millares et al., 2017; Lobillo et al., 2014).
Esta tecnología agrícola moderna presenta diversos diseños y escalas de sistemas acoplados o desacoplados que aportan beneficios económicos, mantienen el equilibrio entre la producción de peces y plantas, optimizan el empleo de nutrientes disponibles eficientemente para disminuir el desperdicio, así como evitar el estrés y lesiones externas entre los peces (Baßmann et al., 2020).
También, permiten el aprovechamiento de residuos (peces), reducción de tierra y agua utilizados en la producción tradicional por lo cual muchos trabajos han reportado el cultivo de combinaciones de tilapia- lechuga, carpa-orégano- tilapia-tomate, trucha-lechuga (Hernández, 2017). En consecuencia, para este trabajo se seleccionó la combinación paco-lechuga-col.
Asimismo, la oferta constante de alimentos orgánicos y sin interferencia climática también justifica su expansión, bien como la alta posibilidad de agregar valor al producto final. Por otro lado, patógenos, insectos y algas pueden ocurrir en estufas agrícolas, demostrando adaptabilidad a ese tipo de ambiente tan simplificado desde el punto de vista biológico (Da Mata, 2018).
De esta forma el uso de acuaponía permite conciliar la producción de alimentos sanos con la preservación del medio ambiente. Además de eso, promueve la producción intensiva animal y vegetal en zonas urbanas y en áreas donde son insuficientes la tierra y el agua, genera empleo e ingresos y poca inversión en su aplicación (Dong et al., 2020; Mechado Filho y Da Silva, 2018).
Sin embargo, existe un desafío en acuaponía que es el manejo de plagas y enfermedades de plantas, parásitos y enfermedades de peces; además de la preocupación creciente del uso irracional de productos químicos debido a la elevada demanda por alimentos libres de pesticidas, antibióticos, etc., tornándose necesario eliminar plagas y enfermedades (Dong et al., 2020; Moreira et al., 2017; Das Chagas et al., 2016).
En ese sentido, tornase necesario la búsqueda de técnicas de manejo para el control de plagas y enfermedades como plantas con acción insecticida, destacándose el control biológico como opción al control químico de plagas, por reducir riesgos a la salud humana y al ambiente, el cual viene siendo cada vez más utilizado como importante paso para una agricultura sustentable (Souza et al., 2019; Lorencetti et al., 2018; Hauschild, 2016; Zambiazzi et al., 2016).
Así, son crecientes las investigaciones científicas que visan disminuir las agresiones al ecosistema, destacándose el interés por organismos capaces de promover el control biológico de plagas, sobre todo, por aquellos que pueden ser manipulados en laboratorios y/o en escala industrial (Bautista et al., 2018).
Aun sobre el uso de microrganismos para el control biológico, el empleo de bioinsecticidas a base de hongos entomopatógenos como Beauveria bassiana (Bals.) Vuill (Ascomycota: Hypocreales) y Metarhizium anisopliae (Metsch.) Sorokin (Hypocreales: Clavicipitaceae), son alternativas muy eficientes y su elevado uso se basa principalmente en su gran variabilidad genética, una gama inmensa de hospederos, fácil producción en escala industrial, formulación y aplicación (Gómez et al., 2014; Chiriboga et al., 2015; Dos Santos, 2016; Ashraf et al., 2017; Pacheco et al., 2019).
Además de eso pueden atacar en diversas fases de desarrollo del insecto, siendo el mecanismo de infección por penetración de tegumento, diferente de bacterias y virus cuya infección es exclusivamente por ingestión (Ribeiro, 2016; Gonçalves, 2017).
No en tanto, para que estos entomopatógenos sean eficientes en el control de estos microrganismos, es necesario que estén en condiciones de temperatura y humedad relativa adecuadas, que fueron proporcionados por las condiciones climatológicas de la ciudad y de los sistemas acuapónicos (Athanassiou et al., 2017; Rohini y Awaknavar, 2017).
Con todo lo expuesto se justifica la realización de este trabajo debido a que existe escasa información actualizada sobre el biocontrol de plagas en cultivos acuapónicos.
El objetivo de este experimento fue evaluar la compatibilidad y eficiencia de Beauveria bassiana y Metarhizium anisopliae para el control de plagas en col y lechuga cultivados en un sistema acuapónico.
Materiales y métodos
Los experimentos fueron conducidos en el Instituto de Educación Superior Pedagógico Público Bilingüe - IESPPB, Carretera San José 0,63 km., con coordenadas geográficas de latitud: 8 °21’ 47’’, longitud: 74 °34’ 00’’, altitud: 154 m y condiciones climáticas de temperatura ambiental: 32 °C y humedad relativa: 85% en el distrito de Yarinacocha, provincia de Coronel Portillo, Región Ucayali - Perú.
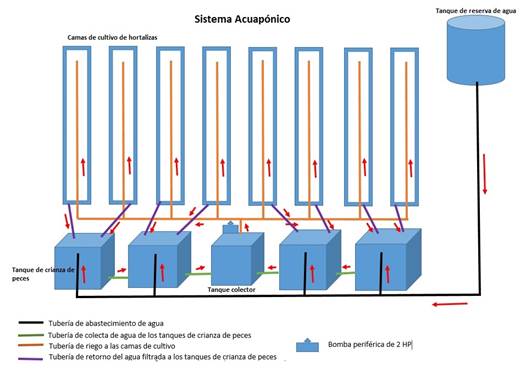
Sistema acuapónico
Fueron instalados tanques de cultivo de alevinos de Piaractus brachypomus (densidad de 50 alevinos/m3) y el agua proveniente de ellos rico en excretas y bacterias nitrificadoras (Nitrosomonas sp. y Nitrobacter sp.) fueron distribuidas mediante tuberías con ayuda de una bomba periférica de 2 HP a camas de cultivo con dimensiones de 7 m de largo por 1,20 m de ancho y rellenas con grava de 0,5 cm de diámetro durante 15 minutos de regado y 45 minutos de receso (Colagrosso, 2015).
La siembra de semillas se desarrolló en tubetes e instalación de plántulas de col y lechuga en las camas del sistema acuapónico (Figura 1).
Las semillas de col y lechuga se sembraron en 4 casilleros de tubetes conteniendo substrato previamente preparado y regados a diario. Posteriormente, plántulas de 13 cm de altura y raíces de 6 cm de longitud se trasplantaron a las camas de cultivo del sistema acuapónico con distancias de 0,20 m entre surco y 0,20 m entre planta.
Monitoreo y evaluación de la presencia de insectos plagas en las hortalizas col y lechuga
Diariamente, fueron observadas la presencia de insectos plaga en el haz y envés de las hojas. Preparación de hongos entomopatógenos
Para los bioensayos, fueron adquiridos 800 g de arroz cultivados con Beauveria bassiana y Metarhizium anisopliae, procedentes del Laboratorio de Entomopatóge nos del SENASA, ubicado en el Cercado de Lima 15491, Perú.
Soluciones de esporas de B. bassiana y M. anisopliae fueron preparadas por separado, con 7 g de arroz colonizado, diluidos en 1 L de agua y adicionados de 6 mL de aceite agrícola orgánico a base de soya.
Por otro lado, soluciones combinadas de B. bassiana y M. anisopliae, fueron preparadas con 3,5 gramos de arroz colonizado de cada hongo, diluidos en 1 L de agua, acrecentados de 6 mL de aceite agrícola orgánico a base de soya y dejados en reposo por 6 horas para finalmente ser pulverizadas a las hortalizas a una concentración de 1 x 107 conidios/mL-1.
A continuación, la primera pulverización foliar de los tratamientos se realizó a los 30 días del transplante de las plántulas de hortalizas a las camas de cultivo. Después de 15 días de la primera pulverización y 8 días de la segunda pulverización, se contabilizaron los insectos adultos afectados y momificados en cada planta y tratamientos.
Diseño de la investigación
Se utilizó un Diseño Completamente Al Azar (DCA), con cuatro tratamientos, tres repeticiones y los promedios fueron comparados por la prueba de Tukey a 5 % de probabilidad, siendo los resultados obtenidos para las dos especies de hongos analizados independientemente, utilizándose para esto el programa estadístico SAS® (Statistical Analysis System) versión 8.1.
Resultados y discusión
Durante los monitoreos, se identificaron los siguientes insectos plagas adultos: Brevicoryne brassicae Linneus (pulgón) y Bemisia tabaci (mosca blanca).
Los resultados obtenidos no presentaron diferencias significativas entre los tratamientos y el testigo, observándose en el envés de las hojas de lechuga 58, 66 y 73% de mortalidad en B. tabaci respectivamente durante 30 días, diferente del testigo donde no hubo mortalidad (Tabla 1).
En otras investigaciones, Ríos-Velasco et al. (2014) verificaron la patogenicidad de B. bassiana y M. anisopliae con distintas concentraciones de conidios para el control de ninfas de B. tabaci en Solanum lycopersicum bajo condiciones de laboratorio. B. bassiana provocó mayor mortalidad en B. tabaci a una concentración de 6.1 x 107 conidios/mL (100 %) y M. anisopliae con una concentración de 9,5 x 107 conidios/mL (87,9 %) durante 8 días.
Diferente a nuestros experimentos, fue evaluada la eficiencia de marcas de bioformulaciones comerciales de B. bassiana y M. anisopliae para reducir la población de plagas con tres aplicaciones durante 36 días, observándose pocas variaciones en la tasa de mortalidad de B. tabaci adultos producida por B. bassiana (91,90%) y M. anisopliae (92,67%) a diferentes concentraciones (2 x 108 ufc/L y 5 x 108 ufc/L) respectivamente (Sharma et al., 2015).
Sin embargo, Garrido-Jurado et al. (2016), encontraron que una concentración de 1,0 x 108 conidios/mL-1 de B. bassiana y M. brunneum fue necesaria para eliminar el 94% y 60% de ninfas de B. tabaci biotipo Q respectivamente en 96 horas.
Zafar et al. (2016), realizaron trabajos con aislamientos de B. bassiana en Capsicum annum y Solanum melongena, cuya concentración de 2 x 108 conidios/mL promovió mayor número de muertes (75,90%) y (76,91%) en ninfas de mosca blanca de cada planta hospedera a lo largo de 7 días de tratamiento.
Mientras que Jabert et al. (2017), en los tratamientos que realizaron entre 20 a 25 días con dos aplicaciones de 1x107 conidios/mL obtuvieron baja virulencia de B. bassiana (34,8%) y M. anisopliae (18,2%) contra adultos de B. tabaci.
También se probó la eficacia de marcas de bioplaguicidas B. bassiana (BotaniGard®), Isaria fumosorosea (Preferal®), Natur'l Oil™ y (Publix®), a través de tratamientos por inmersión previos al envío de Mentha sp para atenuar el transporte transfronterizo de B. tabaci, reportando una reducción (81%) de la población adulta en 14 días, cuando testados solamente con concentración 2 x 103 conidios/lb de B. bassiana BotaniGard®) (Aristizábal et al., 2018).
Al contrario, Somoza (2018), evaluando la asociación de B. bassiana y Bacillus thuringiensis para el control de ninfas de B. tabaci en cultivo de fresas en laboratorio e invernadero, encontró que B. bassiana a una concentración de 1 x 106 conidia/mL ocasionó una mortalidad 61,67 % durante 7 días de tratamiento.
Por otra parte, en bioensayos fueron aisladas bacterias y hongos potenciales del suelo y estiércol de vaca con el objetivo de probar su patogenicidad en moscas blancas adultas de la yuca (B. tabaci), donde se observaron que 1 x 106 conidios/mL de los entomopatógenos B. bassiana y M. anisopliae ocasionaron la muerte de 70,8% y 67,5% de moscas correspondientemente en solo 5 días después del tratamiento (Harish et al., 2019).
De acuerdo con Niu et al. (2019), estudiando la biodiversidad de hongos entomopatógenos aislados de los suelos del sur de China, ejecutaron experimentos en laboratorio para informar sus actividades entomopatógenas contra B. tabaci y estimar las mortalidades generadas a una concentración de 1x108 conidios/mL en 10 días, constatando que al utilizar aislados de hongos entomopatógenos para el manejo de ninfas de B. tabaci se pueden obtener niveles de control que oscilan de 55,56% y 61,02%.
Asimismo, nuevos trabajos fueron efectuados para examinar la compatibilidad en condiciones de laboratorio de hongos entomopatógenos con insecticidas y su eficacia para el manejo de ninfas de B. tabaci en cultivos de algodón. Los resultados demostraron que el porcentaje de muertes de 95,1% y 86,7% en 7 días de tratamiento, fue acarreado por una concentración de 1 x 106 conidios/mL originado individualmente tanto de B. bassiana como de M. anisopliae (Sain et al., 2019).
De forma similar Singh y Joshi (2020), evaluaron diferentes formulaciones de entomopatógenos, junto con Azadirachtin 1% para el manejo del pulgón y la mosca blanca en el pimiento bajo condiciones protegidas, durante los tratamientos 3 pulverizaciones foliares de 1,2 x 1010 ufc/L fueron aplicadas a intervalos de 3, 7 y 10 días. Concluyeron que la cepa nativa de B. bassiana -B1 y las formulaciones comerciales de B. bassiana y de M. anisopliae durante 30 días, consiguieron reducir el 46,5%, 52% y 48,7% de la población adulta de B. tabaci.
Finalmente, tres métodos de inoculación: pulverización foliar, desinfección de semillas e irrigación de raíces, fueron aplicados con la finalidad de determinar la eficiencia de la colonización de la cepa B. bassiana Bb252 de plantas de tomate en la eliminación de insectos de B. tabaci biotipo MED, cuyos ensayos evidenciaron la eficiencia del 100% de colonización utilizando 1 x 108 conidios/mL de B. bassiana por el método de pulverización foliar alcanzados a los 14 días de tratamiento (Wei et al., 2020).
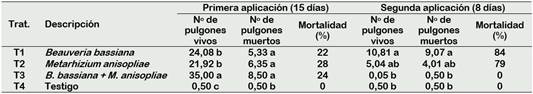
Se observa que, en los tratamientos testados, así como en el testigo, el número de pul gones muertos en el haz de las hojas de col no mostraron diferencia estadística tanto en la primera y segunda aplicación, con excepción del tratamiento 3. No obstante, en la segunda aplicación a los 23 días, las concentraciones de B. bassiana y M. anisopliae exhibieron mayores porcentajes de mortalidad (84%) y (79 %) cuando comparados a la primera aplicación durante 15 días (Tabla 2).
Diferentes ensayos fueron practicados por García-Gutiérrez y Gonzales-Maldonado (2010), al aplicar bioinsecticidas a base de B. bassiana, M. anisopliae y Paecilomyces fumosoroseus, los cuales lograron controlar a Pieris rapae, Pluxtella xylostella, Trichoplusia ni, Brevycorine brassicae, Trips spp., Phthorimaea operculella, Empoasca fabae, Liriomyza trifolii y B. tabaci en cultivos de hortalizas con concentraciones de 1,2 x 1012 conidos/ml que manifestaron mortalidades superiores al 80% a las 72 h después del procedimiento.
Similar a nuestros resultados, se desarrollaron experimentos con insecticidas químicos y micoinsecticidas mezclados con surfactante no iónico (0,125%) para la eliminación de Frankliniella occidentalis, B. brassicae, Myzus persicae en hojas de lechuga y brócoli, en los cuales se comprobaron que B. bassiana GHA fue más eficaz contra M. persicae (40%) en comparación de B. brassicae con solo una reducción del 19% y 14% después del tercer y décimo tercero día de la primera pulverización y a concentraciones de 4,4 x 1010 conidios/g (Dara et al., 2017).
Por tanto, vale resaltar que cada vez se presenta mayor resistencia a productos agro químicos por parte de las plagas y sumado a esto, los países a los cuales se exportan los productos aumentan las restricciones en el uso de numerosos plaguicidas, por cuanto demandan productos naturales u orgánicos, con certificación (Chiriboga et al., 2015).
En la Tabla 3, con respecto a la primera y segunda aplicación, así como en el número de pulgones muertos en el envés de las hojas de col, los resultados expresaron diferencias significativas en todos los tratamientos realizados y en el testigo.
El tratamiento con la combinación de B. bassiana + M. anisopliae, expuso mayor porcentaje de mortalidad (79%) en solo seis días de la primera aplicación, a pesar de esto, porcentajes de mortalidad de M. anisopliae (88%), B. bassiana (82%) y ausencia de mortalidad en el testigo durante 23 días de exposición después de su segunda aplicación, revelaron que la aplicación aislada fue más eficiente en el control de los insectos plaga de col al contrario de la aplicación combinada de ambos entomopatógenos.
Estos datos son semejantes con los hallazgos de las evaluaciones efectuadas por Ramanujam et al. (2017), quienes constataron que la pulverización de aislamientos de B. bassiana-5a y M. anisopliae Ma-4 en con centración de 1 x 108 ufc/mL lograron disminuir 87,1% y 83,9% en la población de B. brassicae en 10 días y bajo condiciones de campo.
Al mismo tiempo, la mortalidad más alta de pulgones (B. brassica L.) fue dada por B. bassiana y M. anisopliae 96% y 97% en condiciones de campo y 85% y 83% en laboratorio; durante 10 días y a bajas concentraciones de conidios (1 x 104 conidios/mL) (Al-Keridis, 2016).
Tabla 1 Control del número de Bemisia tabaci vivas y muertas, en el envés de las hojas de lechuga

Letras iguales no presentan diferencias significativas. Tukey p ≤ 0,05.
Tabla 2 Control del número de Brevicoryne brassicae L. vivos y muertos, en el haz de las hojas de col
Letras iguales no presentan diferencias significativas. Tukey p ≤ 0,05.
Tabla 3 Control del número de Brevicoryne brassicae L. vivos y muertos, en el envés de las hojas de col

Letras iguales no presentan diferencias significativas. Tukey p ≤ 0,05.
Ligeras variaciones fueron notadas en experimentos para el control de B. brassicae L. utilizando micoinsecticidas aislados, siendo que, 100% y 91,11% de la mortalidad de los pulgones de la col por B. bassiana y M. anisopliae acontecieron en 10 días de tratamiento (Embaby y Lofty, 2016).
Después del ajuste de B. bassiana a la concentración de 1 x 107 conidios/mL, los análisis elaborados por Akbari et al. (2014), registraron que B. bassiana es capaz de colonizar hasta el 83% de la población de B. brassicae en 14 días. Entretanto, Asi et al. (2009), seleccionaron dos cepas; M. anisopliae (L6) y M. anisopliae (M440) testando diluciones de 1 x 107 conidios/mL-1 durante 7 días para constar la destrucción del 73,11% y 81,11% de pulgones adultos de la col.
Además, Liu et al. (2009) confirmaron que B. brassicae fue eliminada (93,87%) con 1 x 108 conidios/mL de B. bassiana y a la vez Prince y Chandler (2020), lograron mortalidad de 86,6% a 639,6 ufc/mm2 de B. bassiana por 9 días de tratamiento.
Para todos los efectos los hongos entomopatógenos que fueron utilizados expresaron alto valor de patogenicidad debido a que provocaron mortalidad a concentraciones bajas. Es probable que el comportamiento de ambas especies de hongos evaluadas para el control de moscas blancas y pulgones estén concernientes con sus características genéticas y fisiológicas, lo que determinan los contrastes entre diversos géneros de hongos y su patogenicidad hacia un determinado insecto (Rojas-Gutiérrez et al., 2017).
Además de eso, micoplaguicidas relacionados con bioplaguicidas bacterianos y virales no necesitan ser ingeridos para realizar su acción biocontroladora, solo requieren humedad y temperatura para estimular el crecimiento de esporas del microrganismo al depositarse en la superficie del insecto, atravesar la cutícula del exoesqueleto con ayuda de reacciones enzimáticas, invadir el cuerpo, sistema circulatorio (hemolinfa) y provocar la muerte del insecto por inanición fisiológica en aproximadamente 3 a 7 días (Bautista et al., 2018).
Por otro lado, es importante realizar experimentos que permitan estudiar mecanismos de acción patógena, identificar taxonómicamente y caracterizar a microrganismos nativos con el propósito de seleccionar los más virulentos y establecer condiciones óptimas in vitro para su aplicación en el campo y en la industria agrícola (Pacheco et al., 2019).
En conclusión, con todo lo expuesto es necesario recalcar que los resultados conse guidos bajo ciertos parámetros controlados se tornan difíciles para ser discutidos con investigaciones semejantes debido a la insuficiente información sobre el biocontrol de plagas con hongos entomopatógenos de las especies en estudio y todavía, en sistemas acuapónicos.
No obstante, se ha verificado que existen experimentos bajo condiciones de laboratorio y/o de campo con diferentes especies vegetales y ordenes de insectos, lo cual ha permitido realizar una referencia comparativa para este trabajo.
Conclusiones
La combinación de B. bassiana y M. anisopliae fue eficaz para el control de mosca blanca en el envés de las hojas de lechuga; sin embargo, B. bassiana fue más satisfactorio en el control de los pulgones del haz y M. anisopliae en el envés de las hojas de col durante la segunda aplicación evidenciando compatibilidad con el sistema acuapónico debido a que no se alteraron componentes acuáticos y vegetales generando una producción libre de pesticidas.
Debido a la escasa información se sugiere realizar más experimentos sobre la interacción de B. bassiana y M. anisopliae asi como la aplicación de Verticillium leccanii para el cultivo de frutos u hortalizas en sistemas acuapónicos con el objetivo de ser transferidos a la práctica agrícola.