Introducción
La pitahaya (Hylocereus spp.) comúnmente conocida como “Fruta del Dragón” es una fruta exótica, cuya reputación se está extendiendo en todo el mundo. Su popularidad se debe a sus características fisicoquímicas, nutricionales y sus compuestos bioactivos considerándosele como un alimento funcional, siendo ampliamente utilizado por sus excelentes características organolépticas y por su valor comercial agregado.
Se produce en regiones subtropicales y tropicales de América Latina, en estado silvestre se puede encontrar en ciertos países como México, Venezuela, Colombia, Brasil, Costa Rica y Ecuador, especialmente en la provincia de Morona Santiago cantón Palora. Además de los países antes nombrados se puede encontrar especies cultivadas de Pitahaya en Bolivia, Panamá, Curazao, Uruguay, Perú y Vietnam (Santarrosa, 2013).
La pitahaya recibe diversos nombres, según el país donde se produce, entre los cuales se destacan: pitajaya (Colombia), Belle de nuit (Francia), flor de cáliz (Venezuela, Puerto Rico), Dragon fruit, Belle of the night (Paises anglohablantes), Distelbrin (Alemania), pitahaya o fruta de dragón (Perú), entre otros (Figueroa y Mollinedo, 2017).
Esta fruta es una rica fuente de colorante natural debido a su alto contenido de betacianinas, que le otorgan un intenso color en la piel y pulpa, los mismos que pueden ir desde tonos rojos a purpura. A la pitahaya se le atribuyen propiedades nutracéuticas, ya que, se ha evidenciado que además del propósito para colorear, también proporciona beneficios nutricionales adicionales a los consumidores (Tze et al., 2012). Proporciona un sabor dulce y es abundante en nutrientes y compuestos bioactivos (Tran et al., 2015). En su composición nutricional se destaca el contenido de glucosa, betalaínas, vitaminas, ácidos orgánicos, fibra soluble dietética, fitoalbúminas y minerales constituyentes. Ibrahim et al. (2018) se centró en las actividades farmacológicas y beneficios nutricionales de la fruta pitahaya.
El área de cultivo de pitahaya se está expandiendo rápidamente en muchos países de bido a su potencial económico y beneficio nutricional (Ortiz-Hernández y Carrillo-Salazar, 2012).
Sin embargo, en los últimos años, la especie ha sido cultivada en todo el mundo, y estudiada por muchos investigadores, aumentando considerablemente las publicaciones con fruta, razón por la cual es necesario recopilar esta información, organizarla y presentarla en un solo documento, con el fin de informar sobre las técnicas de cultivo, plagas (enfermedades de la planta), botánica, composición y bondades nutricionales de este popular fruto.
Origen e historia
La Pitahaya (hylocereus spp.) es originaria de México y cultivada en algunos países tropicales y subtropicales, como Taiwán, el sur de China, Israel, Tailandia, Australia, Estados Unidos de América y Malasia (Mizrahi y Nerd, 1999). La fruta se cultiva en gran medida en Vietnam, conocido localmente como “Thanh Long” o “el dragón verde”, una descripción asociada con el color verde de la fruta inmadura y la aparición de dragón de las escalas o los soportes de los frutos (Hoa et al., 2006).
Este fruto fue domesticado originalmente por las culturas pre-colombinas, quienes lo recolectaban silvestremente para su alimentación y medicina, pero aún era desco nocido para muchos. Fue hasta mediados de la década de 1990 que ésta súper fruta tomo realce (Le Bellec y Vaillant, 2011). Actualmente la pitahaya, es ahora un fruto exótico muy conocido, atractivo por su forma y color, además por sus novedosas propiedades nutricionales que capta la atención del sector alimentario y comercial. Adicionalmente es una planta ornamental de floración nocturna y como cultivo de frutas (Kumar et al, 2018). Su nombre significa "fruta escamosa" y se refiere tanto a la planta de pi tahaya como a su fruto (Zee et al., 2004).
La pitahaya es nativa de América Central y del Sur (Ortiz-Hernández y Carillo-Salazar, 2012) y se cultivan comercialmente en una amplia gama de países, incluidos México, Nicaragua, Guatemala, Estados Unidos, Taiwán, Vietnam, Filipinas e Israel. Por su parte, Medina (2015) menciona que la pitahaya amarilla es una epífita facultativa que evolucionó en el piedemonte andino amazónico en Perú, Ecuador y Colombia; lo que explica su comportamiento trepador y tallo segmentado con facilidad de emitir raíces secundarias. Manzanero et al. (2014) argumenta que la pitahaya es una especie de cultivo en dispersión en el trópico y subtrópico que presenta alto polimorfismo. La especie ha sufrido selección humana por acción de colecta de frutos, situación que promovió la diversidad de frutos en forma, tamaño, color y calidad organoléptica, por lo tanto, hoy en día se conocen más de una especie de pitahaya.
Caracterización Botánica
La pitahaya pertenece a la familia Cactaceae y prevalece en dos géneros separados, "Hylocereus" y "Selenicereus". Las variedades cultivadas comercialmente más comunes son del género Hylocereus que cubre alrededor de 16 especies diferentes (Bauer, 2003). Su taxonomía ha sido revisada y se presenta en la Tabla 1.
Tabla 1 Clasificación taxonómica de la Pitahaya (Hylocereus spp.)
| Nombre Científico | Hylocereus spp. |
| Reino | Plantae |
| División | Magnoliophita |
| Clase | Magnoliopsida |
| Orden | Caryophyllale |
| Familia | Cactaceae - cactácea |
| Tribu | Hylocereeae |
| Género | Hylocereus |
| Especie | H. extensus (Salm- Dyck ex De Candolle) H. setaceus (Salm-Dyck ex De Candolle) H. tricae (Hunt) H. minutiflorus Br. and R. H. megalanthus (Schum. ex Vaupel) H. stenopterus (Weber) Br. and R. H. calcaratus (Weber) Br. and R. H. undatus (Haw.) Br. and R. H. escuintlensis (Kimn.) H. ocamponis (Salm-Dyck) Br. and R. H. guatemalensis (Eich.) Br. and R. H. purpusii H. costaricensis (Weber) Br. and R. H. trigonus (Haw.) Safford H. triangularis (L.) Br. and R H. monacanthus |
Fuente: Esquivel y Araya. (2012); Bauer (2003).
La planta cactácea de la Pitahaya es perenne, epífita, trepadora con forma triangular, carnosa y de tallos verdes articulados. Sus tallos se componen de tres alas onduladas con márgenes festoneados córneos. Los segmentos del tallo pueden crecer hasta 6 m de largo. Cada canal de las alas festoneadas tiene de una a tres espinas cortas de 1,5 cm de espesor y algunas variedades son más espinosas que otras. Las raíces aéreas crecen desde la parte inferior de los tallos, proporcionando anclaje para que las plantas trepen paredes, rocas o árboles. La floración es nocturna, las flores tienen verde exterior y segmentos blancos interiores miden aproximadamente 30 cm de largo y 23 cm de ancho, su estigma es lobulado y de color verde. Tienen forma de campana y muy fragante; abren durante la madrugada noche y marchitez al amanecer (Zee et al., 2004) (Le Bellec y Vaillant, 2011). En su há bitat natural, las flores son polinizadas por murciélagos frutales o polillas de halcón (Valiente-Banuet et al., 2007).
La pitahaya se puede propagar a través de semillas o estructuras vegetativas. Las semillas son importantes para obtener información genética debido a su variabilidad; exhiben características deseables que pueden usarse para la selección del genotipo, como las asociadas con el rendimiento, la apariencia externa, el color de la pulpa y la adaptación a diferentes condiciones climáticas (Andrade et al., 2008; Silva et al., 2011). La forma característica de su fruto es elipsoidal (referencial a una baya), con un diámetro que se encuentra entre 10-12 cm, según su especie (Corzo-Rios et al., 2016). Es considerada fruto exótico debido a la apariencia de su cáscara y sabor caracte rístico agridulce de la pulpa. En la superficie de su cáscara se observan formaciones sobresalientes llamadas bractéolos que son como orejas o brácteas, de consistencias cerosa y carnosa que resaltan a la vista del consumidor (Ariffin et al., 2009). Su pulpa es jugosa y carnosa, compuesta por pequeñas semillas brillantes que se distribuyen uniformemente en grandes cantidades en toda la fruta y tienen un diámetro de aproximadamente 3 mm, un color negro oscuro y una forma obovada (Andrade et al., 2007).
Las especies más populares de pitahaya son:
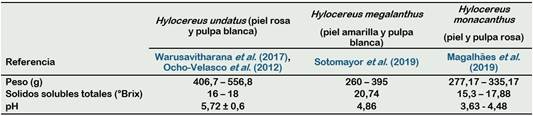
H. undatus (Haw.) Britton & Rose tiene flores largas de hasta 29 cm, de color verde o amarillo verdoso y el interior segmentos de perianto blanco puro. Su fruto es de piel rojo-rosa y pulpa blanca (Santarrosa, 2013), cubierto por bractéolos rojos y verdes en las puntas. La longitud y circunferencia promedio del fruto son de 11,3 a 14,2 y 25,5 a 29,1 cm, respectivamente (Warusavitharana et al., 2017).
La especie Hylocereus megalanthus (Figura 1) tiene flores blancas muy largas de 32 - 38 cm de largo (Le Bellec y Vaillant, 2011), medida superior al de otras especies. Su fruto se caracteriza por tener una corteza color amarillo con espinas y pulpa blanca jugosa (Delgado, 2015).
Hylocereus monacanthus posee flores de 25 a 30 cm de largo, con segmentos periantio rojizos externos, especialmente en las puntas y amarillentos lóbulos de estigma. Su fruto posee cascara roja con brácteolos sobresalientes verdes y pulpa roja brillante, con pequeñas semillas negras. Su fruto escarlata mide de 10 - 12 cm de diámetro (Le Bellec y Vaillant, 2011).
Plagas y enfermedades
El rendimiento del fruto de pitahaya se ve disminuido debido a microorganismos como hongos, virus y bacterias, así como a una cierta infestación de insectos durante el período posterior a la cosecha. Lo mencionado puede generar una pérdida económica hasta del 44% (Valencia-Botín et al., 2013) y para evitar estas pérdidas económicas, por lo general, se realiza un control de enfermedades y plagas mediante aplicación de fungicidas sintéticos como tiabendazol o imazalil (Vilaplana et al., 2017).
Actualmente se reconocen 17 géneros y 25 especies de fitopatógenos que infectan a la pitahaya. La mayor parte de estas origina enfermedades fúngicas en flores, tallo y frutas. Además, existen 2 enfermedades bacterianas, que afectan a este fruto, una nematoda y una viral. El chancro (Neoscytalidium dimidiatum), la enfermedad viral (virus de cactus X), la antracnosis (especies de Colletotrichum), y pudrición de frutos y tallos (B. cactivora), son las enfermedades más comúnmente reportadas (Balendres y Bengoa, 2019).
Una de las enfermedades que causa mayores pérdidas a este fruto es la podredumbre negra específicamente en la pitahaya amarilla que es causada por Alternaria alternata. Este género incluye plantas saprófitas y patógenas que afectan a plantas ornamentales, y causan el deterioro posterior y previo a la cosecha de los frutos (Njombolwana et al., 2013). Además, las cepas patogenas de A. alternata causan enfermedades en diversos frutos además de la pitahaya como, podredumbre negra en los tomates, el punto negro en los cereales, podredumbre negra y gris de los cítricos y la podredumbre negra en las zanahorias, los girasoles, los pimientos, los melones (Logrieco, et al., 2009). En el caso de la pitahaya, este hongo infecta lesiones de la fruta madura en el periodo posterior a la cosecha, presentando lesiones deprimidas empapadas en agua con manchas polvorientas que van de color oliva a negras y que coexisten con una podredumbre blanda (Wojciechowska et al., 2014). En un estudio realizado para minimizar las pérdidas por podredumbre negra en pitahaya amarilla causada por A. alternata, se demostró que la inmersión del fruto en agua a 50 °C por 2 minutos resultó un tratamiento efectivo para reducirla, además este tratamiento no causó un efecto negativo en la calidad fisicoquímica y sensorial del fruto (Vilaplana et al., 2017).
Asimismo, otra enfermedad postcosecha que sufre la pitahaya es la Antracnosis causada por Colletotrichum spp. esta enfermedad afecta a muchas frutas tropicales y subtropicales. El 50% de las pérdidas en verduras y frutas frescas en la postcosecha son ocasionadas por la antracnosis (Siddiqui y Ali, 2014). Una vez que la fruta se infecta por esta enfermedad, esta disminuye significativamente su valor comercial y calidad que afecta el margen de ganancias y la generación de ingresos de los exportadores y productores. Comúnmente para contrarrestar esta enfermedad se usa fungicidas sintéticos como el propiconazol o el procloraz, pero el impacto negativo de los fungicidas en la salud humana y el medio ambiente ha orientado a los investigadores a buscar nuevos enfoques para controlar esta enfermedad (Boonyapipat, 2013). Por eso en una investigación realizada en frutos de pitahaya, se planteó una alternativa para reemplazar los fungicidas por recubrimientos comestibles de extractos crudo de rizoma de cúrcuma, dukung anak (hierba medicinal) y jengibre para controlar la antracnosis. Se utilizaron pitahayas de la variedad Hylocereus costaricensis, los resultados mostraron que estos extractos poseían una actividad antifungica significativa contra antracnosis ya que inhibe la germinación conidial y crecimiento micelial además causan hinchazón, distorsión y contracción de las hifas fúngicas (Bordoh et al., 2020). Los extractos crudos de jengibre a 10,0 g L-1 evidenciaron el mejor efecto in vitro al suprimir el crecimiento la germinación conidial (87.50%) y micelial (88.48%) que resulto equiparable al fungicida comercial (Mancozeb) a 2.0 g L-1 (80.45%). El empleo de "dukung anak" a 5.0 g L-1 o 10.0 g L-1 controló significativamente la antracnosis y esto no fue distinto en las frutas tratadas con cúrcuma a 10.0 g L-1. En conclusión, el extracto crudo de cúrcuma o dunkung anak se puede usar como biofungicida para controlar la antracnosis en frutos de pitahaya a concentraciones de 10.0 g L-1 (Bordoh et al., 2020).
En los últimos años, se observó una enfermedad bacteriana grave en los frutos y tallo de pitahaya (H. monacanthus Britt. & Rose e Hylocereus undatus) causada por Aureobasidium pullulans en China, que ocasiona pérdidas económicas importantes en la producción comercial del fruto. Esta enfermedad se expandió rápidamente des pués de la llegada del tifón Ramasoon en la ciudad de Guangdon en el país asiático. La enfermedad se expandió de manera rápida afectando el 55% de plantas afectadas. Los síntomas en la fruta son piel suave con decoloración bronceada y más tarde la superficie de la piel agrietada. Además, aparecieron manchas irregulares, de color rojo ladrillo en los tallos infectados, ligeramente elevadas que se unieron en áreas más grandes y se cubrieron con la superficie del tallo y finalmente se despegaron (Wu et al., 2017).
En la última década, se detectó en muestras de pitahaya síntomas similares a virus (Cactus X) que consistían en manchas cloróticas irregulares, algunas con mosaicos verde amarillo pálido, márgenes rojo-marrón, necrosis y espinas deformadas. El virus de cactus X se ha detectado en la fruta del dragón en los EE. UU., Taiwán, Corea, Japón, China y se distribuye ampliamente en Malasia (Gazis et al., 2018; Kim et al., 2016; Peng et al., 2016; Masanto et al., 2018). Este virus afecta principalmente a las variedades H. megalanthus, H. monacanthus y H. undatus.
Se recomienda almacenar los frutos de pitahaya a temperaturas menores de 14 °C, para prolongar su corta vida útil, ya que este fruto cuando es almacenado a temperaturas superiores a 20 °C presenta pérdida de azúcar, perdida de acidez y un ablandamiento rápido (Obenland et al., 2016).
El principal método para evitar el deterioro de la pitahaya a fin de lograr conservar su valor nutricional es el almacenamiento en frio, sin embargo, este método causa altera ciones fisiológicas que se conoce como daños por frio (DF), esto conlleva un impacto negativo en la calidad de este fruto (Quiroz-González et al., 2017). Los signos comunes de DF abarcan cambios como áreas acuosas, hundimientos en la cáscara, cambios de color externo e interno, maduración heterogénea, desarrollo de condiciones que favorecen la incidencia acelerada de hongos y sabores extraños. Este desorden se estudia en especial en productos con valor económico, como mango cítricos y aguacate (Ramaswamy, 2015).
En una investigación para determinar las variables correlacionadas con el DF realizada en pitahayas con madurez comercial de la variedad Hylocereus undatus, cosechados en Santa Clara Huiziltepec, Puebla (México), se les aplico un tratamiento que consistió en almacenar las pitahayas 30 días a 2 ó 7 ± 1 °C HR de 90±6 %, y después se mantuvieron hasta 7 días a 22 ± 4 °C y HR 60±8 %. La evaluación visual de DF se realizó por medio de una escala hedónica de cinco puntos después del almacenamiento refrigerado y la transferencia de los frutos a 22 ± 4 °C. Los resultados indican que las variables que resultaron consistente y positivamente correlacionadas con DF fueron, acidez titulable, actividad de superóxido dismutasa, translucidez y contenido de etanol. Por eso, en temperatura más baja y período de almacenamiento más largo, se observó un cambio proporcionalmente mayor en estas variables (Quiroz-González et al., 2017).
Técnicas de cultivo
El interés sobre los frutales de pitahaya tiene un gran crecimiento durante el último periodo, y por esto existe la necesidad de programas de mejoramiento eficientes para posibilitar la extensión de las áreas de cultivo. El interés se ve reflejado en el registro de nuevos cultivares en la última década (Lobo et al., 2016).
En el sur de Taiwán, se considera a la pitahaya como un cultivo de día largo, la variedad de carne blanca tiene un estadio reproductivo desde el verano hasta el otoño, su primera floración se da a principios de mayo y la última a fines de septiembre (Chiu et al., 2015).
Una fundamental propiedad de la planta de pitahaya es su metabolismo del ácido crasu láceo (CAM), que promueve la expansión de las áreas bajo cultivo debido que otorga una tolerancia a la sequía extrema; por eso estas plantas tienen una eficiencia del empleo de agua entre cuatro a seis veces mayor que otros cultivos frutales bajo condiciones similares. Por lo tanto, esta especie de cactus es un valioso producto para los agricultores que cuentan con tierras secas, degradación de la tierra y escasez de agua (Li et al., 2018).
El cultivo de pitahaya puede propagarse de forma sexual o asexual. Por lo general, los productores utilizan la propagación asexual, por medio del corte, debido al manejo rápido y simple para la formación de plántulas (Le et al., 2011). La reproducción sexual (semife-rora) es un método menos usado, porque el inicio de la producción es posterior, la planta debe pasar por la etapa de juventud hasta poder alcanzar la madurez adecuada para empezar su periodo reproductivo que lleva de cuatro a seis años (Gunasena et al., 2007). Por lo tanto, la propagación a través de semi-bosque puede tornarse económicamente inviable (Silva, 2014). Pero este método cuenta con una ventaja, debido a que posibilita la investigación de los factores que alteran la biología de germinación (Suárez-Román et al., 2011).
La luz y temperatura son factores que tienen influencia en la germinación de las especies de pitahaya (Oliveira et al., 2015). Estos pueden manejarse para aumentar el porcentaje de velocidad, sincronización y germinación para acrecentar el número de plántulas vigorosas. Por lo tanto, es fundamental valorar temperaturas constantes y alternas además de la necesidad de brillo para encontrar las mejores condiciones para la germinación de semillas (Lone et al., 2014a, Lone et al., 2014b). Ruths et al. (2019) realizó un estudio con el objetivo de evaluar la influencia, en la germinación de semillas, de la luz y temperatura en tres especies de pitahaya (Hylocereus monacanthus, Hylocereus undatus y Hylocereus setaceus). Para determinar el efecto de la temperatura sobre la calidad fisiológica de las semillas, se sometieron a germinación en siete temperaturas (15, 20, 25, 30 y 35 °C, y temperaturas alternas: 15 - 25 °C y 20 - 30 °C, con un fotoperíodo de 12 horas). Para las tres especies el máximo rendimiento fisiológico de las semillas se obtuvo en las temperaturas de 25°C y 20-30 °C, la temperatura más desfavorable fue de 35°C y la especie H. setaceus presentó un mayor porcentaje de vigor y germinación en todas las temperaturas evaluadas (Ruths et al., 2019).
La técnica de cultivo a base de sustratos comenzó en el año 1930, sin embargo, este interés ha crecido durante el último periodo (Pissinati et al., 2018). Esta técnica posibilita una mejoría en la utilización de nutrientes, mejor calidad de las plántulas y mayor índice de pegamento (Fratoni et al., 2019). En una de las escasas investigaciones sobre esta técnica, se evaluó el efecto de una formulación de fertilizante NPK (N-P2 O5 -K2 O: 8-20-20), que fue agregado en distintas dosis (0; 200; 250; 300; 350 y 400 g por maceta) a un sustrato que contiene compost orgánico y arena en relación (2:3; v:v), en el estado nutricional de la planta y crecimiento de los cladodios en pitahaya amarilla. Los parámetros evaluados fueron la altura, el diámetro, la velocidad de enraizamiento, el peso seco (DW), el contenido de nutrientes en los cladodios y el peso fresco (FW). Se determinó que la adición de la formulación NPK no afectó el diámetro, el índice de pegamento de los cladodios y la altura en pitahaya amarilla; y el uso del compost orgánico y la arena en proporción (2:3; v:v) fue autosuficiente para el incremento del peso seco y peso fresco de las plantas de pitahaya amarilla (Fratoni et al., 2019).
Una tendencia para el cultivo de pitahaya es el empleo de casas de red, sin embargo, esta depende del clima y las variedades (Yen-Chieh y Chang, 2019). En Israel (recibe 50 mol/m2 por día de luz integral en el verano), se utiliza pantallas de sombra (sombreado entre 30 al 60%) en las casas de red para minimizar las quemaduras solares y maximizar la calidad de la fruta y su rendimiento durante el periodo reproductivo (Mupambi et al., 2018). Esta técnica también es capaz de realizar el bloqueo de plagas como los insectos, los escarabajos y las moscas; por lo tanto, tiene un considerable potencial para la producción de pitahaya (Yen-Chieh y Chang et al., 2019).
Debido a que la pitahaya se cultiva en extensas regiones tropicales y subtropicales (Fan et al., 2018; Xu et al., 2018), estos climas húmedos y cálidos son un entorno favorable para el crecimiento vigoroso y continuo de malezas, por esto, el control de malezas es un componente fundamental en el manejo de pitahaya (Jhala et al., 2013; Liu et al., 2019). En el manejo de malezas el método más efectivo es el control químico. Un herbicida es el indaziflam, utilizado para el control de malezas anuales de hoja ancha y de hierba, que logra inhibir la biosíntesis de celulosa después de la germinación de las especies de malezas (Trigo et al., 2014; Gonzalez-Delgado et al., 2017). El indaziflam puede controlar pastos anuales como el pasto azul anual, el pasto de ganso y el cangrejo de los pastos (Alonso et al., 2011; Liu et al., 2019); y tiene tasas más bajas (10 a 15 veces) de uso que la mayoría de herbicidas (Reed et al., 2013).
Composición
La pitahaya está compuesta de pulpa y cascara, su pulpa es consistente y espumosa, presenta coloración blanca (variedad amarilla) y blanca rojiza (variedad roja), con pequeñas y suaves pepas comestibles, cubiertas de escamas rojas y amarillas según la especie (Santarrosa, 2013).
La pulpa de la Pitahaya (Hylocereus) representa entre el 60-80 % de su peso total, el cual varía en promedio de 200-570 g, según su especie (Corzo-Rios et al., 2016). Sin embargo, es considerado que la Pitahaya sufre cambios físicos durante su maduración. En una evaluación a H. Megalanthus (Pitahaya amarilla) se obtuvo, que el porcentaje de cascara disminuyo de 55.93 a 33.40 %; mientras que el de pulpa aumento de 44.04 a 66.60 % entre el estado de madurez de 0 a 6, respectivamente (Sotomayor et al., 2019).
La Pitahaya es un fruto de bajo valor calórico, ya que cuenta con pequeñas canti dades de hidratos de carbono (9,20 g por cada 100 g de pulpa comestible) (Rodríguez et al., 2005). En su composición destaca el contenido de vitamina C, vitamina que interviene en la formación de colágeno, glóbulos rojos, huesos y dientes, además, favorece en la resistencia a las infecciones, absorción del hierro de los alimentos y tiene acción antioxidante. En la Tabla 2, se observa la composición nutricional de dos especies de pitahaya, donde la variedad roja (Hylocereus undatus) resalta en su composición de vitamina C desde el punto de vista funcional con relación a la variedad de color amarilla (Hylocereus megalanthus).
Además, el sabor de este fruto depende de la madurez durante su cosecha, factor importante para que la concentración de azucares sea mayor y de esta manera aumente los sólidos solubles totales (SST) expresados en grados Brix. Los SST que predominan en la Pitahaya son la glucosa y fructosa (Ochoa-Velasco et al, 2012). Azucares que por su concentración identifican a cada una de las variedades de Pitahaya.
Para H. undatus y H. monacanthus se reportó SST de 12 y 15 °Brix respectivamente, presentando valores de glucosa (353 - 451 g/100 g), fructosa (238 - 158 g/100 g) y oligosacáridos (86 - 90 g/100 g) (Wichienchot et al., 2010). Además, en la Tabla 3 se presentan la comparación de tres variedades de pitahaya, donde Hylocereus megalanthus resalta como la variedad más dulce de estas especies con SST de 20,74 °Brix (Sotomayor et al., 2019).
El contenido de SST en la Pitahaya es variable (12-14 °Brix) y baja acidez (0,2 - 0,35 mg de ácido málico por 100 g de peso fresco) (Mercado-Silva, 2018). El sabor presente en la pulpa tiene relación con el valor del pH que va de 4,3 a 4,7 y con acidez titulable entre 2,4 a 3,0 en variedades agridulces y de 0,62 a 0,5 (% de ácido málico) en variedades dulces (Mercado-Silva, 2018).
Una investigación que uso tres variedades reportó que la pitahaya de pulpa roja presentó la acidez más baja, con relación a la pulpa rosa y blanca con valores de 0,3; 0,6 y 0,7%, respectivamente; siendo el ácido málico el principal ácido orgánico con concentraciones que van desde 6,08 a 8,20 g/L en los genotipos de pitahaya de Costa Rica (Esquivel et al., 2007).
En la especie Hylocereus undatus, se ha encontrado contenidos de: 14,84 gramos de proteína cruda, 21,50 gramos de fibra cruda y 39,94 gramos de minerales esenciales.
En el campo de la gastronomía los tallos de la Pitahaya son utilizados por su característica consistencia suave y su contenido nutrimental. En un estudio de su composición se observó contenido de proteína cruda de 11,8-24,49 g y de fibra cruda de 7,86-14,79 g con contenido de cenizas entre 10,80 a 14,90 g y extracto etéreo 0,64 a 1,46 g, obtenidos mediante un análisis proximal y expresado en base seca (g/100 g de materia seca). Además, la variedad de pitahaya Hylocereus undatus tiene importantes contenidos de Zn (34,02 mg kg-1) y K (4,82 mg kg-1) (Montesinos et al., 2015).
En la especie Hylocereus megalanthus (Pitahaya amarilla), se ha encontrado que el aceite de su semilla presenta alto contenido de ácidos linoleicos grasos poliinsaturados. Los cinco principales ácidos grasos encontrados fueron: ácido palmítico (11,52%), ácido esteárico (4,29%), ácido oleico (11,09%), ácido vaccénico (3,08%), y ácido linoleico (69,98%) (Altuna et al., 2018).
Por su composición de ácidos grasos, las semillas de pitahaya amarillo pueden ser considerados como alimentos sanos y pueden ser utilizados en la industria de alimentos para diferentes propósitos. El consumo regular de pitahaya amarilla puede mejorar la salud humana (Altuna et al., 2018).
Tabla 2 Composición nutricional de 100 g de pulpa de dos especies de pitahaya
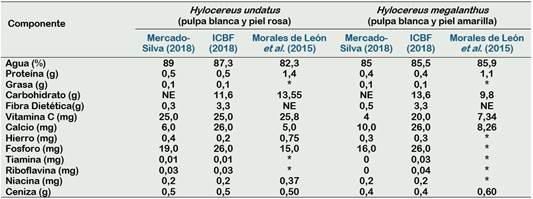
* valor no encontrado; N: Valor no evaluado.
Componentes bioactivos
Betalainas
Los colores son importantes indicadores de calidad, determinan la aceptación de los alimentos por parte del consumidor. En los últimos años, el mercado de colorantes sintéticos ha presentado una disminución debido a su naturaleza tóxica (Chandrasekara et al., 2012). Por lo tanto, en la actualidad la fuerte demanda de los consumidores por un producto más natural y beneficioso para la salud ha ido en aumento, con la tendencia al reemplazo del colorante sintético, aun si el colorante natural tenga mayor costo.
Las betalaínas se pueden usar como aditivos alimentarios para enriquecerlos o evitar su decoloración. El uso de betalainas como colorante de alimentos está aprobado por la Unión Europea y las betalainas están etiquetadas como E-162 (aditivo alimentario) (Thirugnanasambandham et al., 2014d).
Este compuesto bioactivo tiene efecto positivo contra los trastornos relacionados con el estrés en los seres humanos, lo cual se debe a su potencial para inhibir la oxidación y la peroxidación lipídica (Kanner et al., 2001).
Thirugnanasambandham et al. (2015) encontraron que las condiciones óptimas para el proceso de extracción por microondas asistida eran la temperatura de 35 °C, la masa de la muestra de 20 g de polvo de Pitahaya y el tiempo de tratamiento de 8 minutos. En estas condiciones, se extrajeron 9 mg/L de contenido de betalaina en la Pitahaya.
Betacianinas
Las betacianinas poseen actividades de eliminación de radicales libres y antioxidantes, lo que sugiere sus posibles efectos beneficiosos sobre las enfermedades metabólicas (Song et al., 2015).
La Pitahaya roja (Hylocereus monacanthus) es una rica fuente natural de betacianinas, lo cual fue demostrado en un estudio sobre la anti-obesidad y los efectos anti-hiperglucémicos de la betacianina en 6 ratones obesos que llevaban una alimentación alta en grasas (HFD). Los resultados indicaron que las betacianinas de la Pitahaya disminuyeron significativamente la ganancia de peso y mejoraron el perfil lipídico, la resistencia a la insulina y la hepatosteatosis en el tratamiento de 14 semanas (Song et al., 2015).
También se reportó el efecto antidiabético de pitahaya roja, la cual en fresco atenúa significativamente la resistencia a la insulina en ratas y 600 g de consumo de fruta de pitahaya roja tiene un gran potencial en el control del nivel de glucosa en sangre en diabéticos tipo II (Song et al., 2015).
En la industria alimentaria, las betacianinas de pitahaya roja pueden utilizarse como colorante natural ya que presentan una estabilidad térmica similar o mejor en comparación con el rojo de remolacha, dependiendo del tratamiento de temperatura. En la leche se realizó un análisis sensorial comparando leche que contenía betacianinas de Pitahaya roja con leche que contenía el rojo de remolacha, resultando que el primer tratamiento tuvo una mejor aceptación de color. Además, el uso de este aditivo en la leche retrasó el inicio microbiano (Gengatharan et al., 2015).
El papel de la cáscara de la pitahaya
La cáscara de pitahaya ha demostrado propiedades nutraceúticas importantes, para conocer sus propiedades se han realizado estudios del polvo de esta cáscara.
En una investigación se concluyó que el polvo de cáscara de la fruta de Pitahaya roja tiene potencial para reducir el colesterol total, triglicéridos y lipoproteínas de baja densidad (LDL-c) en la sangre de los ratones Balbc macho con hiperlipidemia y aumentar los niveles de lipoproteínas de alta densidad (HDL-c) (Hernawati et al., 2018). Los polvos de cascara de Pitahaya roja se pueden consumir como un suplemento en los alimentos que se espera que mantengan un cuerpo sano y prevengan la hiperlipidemia. En este estudio las muestras fueron 24 ratones macho que se dividieron en seis grupos, es decir, controles positivos y negativos, dosis de 50; 100; 150 y 200 mg / kgBW /días de piel de fruta de dragón rojo en polvo. Antes de recibir tratamiento, a los ratones se les administró alimento con alto contenido de grasa durante 20 días hasta que experimentaron condiciones de hiperlipidemia. El polvo de cáscara de Pitahaya roja se administró por vía oral con una sonda usada durante 30 días (Hernawati et al., 2018).
Polímeros
Polisacáridos solubles en agua
Otro grupo importante de los compuestos químicos bioactivos son los polisacáridos solubles en agua, los cuales están involucrados en los efectos beneficiosos para la salud. La microbiota intestinal puede ser mejorada por polisacáridos debido al comportamiento directa e indirecta con microbios (Yoo et al., 2012).
Mediante una investigación los polisacáridos solubles en agua de la pitahaya se iden tificaron mediante la técnica de extracción con agua caliente (Souza et al., 2015), además se utilizó la liofilización para los gránulos de polisacáridos para finalmente purificarlos. A partir de la pitahaya se purificó un polisacárido aniónico DSPP. La co lumna vertebral era construida por →4-β-D-GlcpA-1→, →6-β-D-Galp-1→ y →4-α-L-Rhap-1→. Solo una rama se revelo como α-L-Araf-1→5-α-L-Araf-1→. El peso molecular era 2.2×103 kDa. Este polisacárido eso uno de los componentes principales de la pitahaya (Hylocereus), al cual se le deben contribuir beneficios para la salud de esta fruta (Xu et al., 2016).
Oligosacáridos, aliado contra el cáncer de colon
La pitahaya es cada vez más popular debido a sus beneficios nutricionales. En informes recientes se ha reportado como una posible fuente de prebiótico natural, ya que contiene oligosacáridos.
Los prebióticos son considerados componentes importantes en los alimentos funcio nales y se ha informado que tienen efectos positivos en la modulación de bacterias intestinales beneficiosas, lo que refuerza el sistema inmunológico (Rolim, 2015; Kazemi et al., 2019) al tiempo que reduce el riesgo de síndrome metabólico o enfermedades neurodegenerativas.
Los prebióticos son carbohidratos no digeribles, oligosacáridos y fibras dietéticas, que sirven como fuentes de alimento para las bacterias en el sistema intestinal. Promueven el crecimiento y la actividad de las bacterias benéficas (probióticos) al tiempo que regulan el crecimiento de bacterias dañinas (Gibson et al., 2010; Zhang et al., 2018).
Los oligosacáridos encontrados en la Pitahaya son oligosacáridos no digeribles ya que resistieron la hidrólisis por la α-amilasa humana con sacarosa, α-amilasa humana en la boca y el jugo gástrico humano artificial en el estómago, dando la máxima hidrólisis del 4,81; 6,7 y 0,6 %, respectivamente. La fermentación fecal de los oligosacáridos mostró aumento en las poblaciones de bifidobacterias, lactobacilos y la disminución de las poblaciones de Bacteroides y Clostridium. Además, la fermentación fecal de los oligosacáridos tuvo un efecto prebiótico positivo con índice prebiótico (PI) de 0,41, mientras que el ácido acético, ácido láctico, ácido propiónico y butírico se producen a concentraciones de 860; 265; 15,95 y 29,63 mM, respectivamente. La mezcla de estos ácidos grasos de cadena corta tiene la propensión para inhibir células Caco-2 que tiene potencial para la reducción del riesgo en el cáncer de colon (Dasaesamoh et al., 2016).
El oligosacárido de la Pitahaya tiene una propiedad prebiótica que mejora la salud intestinal al estimular selectivamente la microbiota colónica. La alteración de la composición de la microbiota puede afectar la motilidad intestinal. Un estudio reciente evaluó los efectos de los oligosacáridos de este fruto en las funciones del motor intestinal en el colon de ratones ICR machos en comparación con el fructooligosacárido (FOS) prebiótico y las bifidobacterias probióticas. Los ratones fueron suplementados con oligosacáridos de Pitahaya por 1 y 2 semanas.
La investigación concluyó que los oligosacáridos de este fruto aumentan las contrac ciones del musculo blando colónico sin cambio morfológico y actúan como un laxante formador de masa y estimulante para aumentar la producción fecal y la motilidad intestinal. Así, los oligosacáridos de la Pitahaya como suplemento en la dieta pueden promover la salud intestinal y corregir trastornos de la motilidad gastrointestinal, como estreñimiento y diarrea (Khuituan et al., 2019).
Capacidad antioxidante
La capacidad antioxidante de fuentes como frutas y plantas, son esenciales para prevenir el daño oxidativo en el cuerpo humano. La Pitahaya es un fruto con alta capacidad antioxidante (160,84 mg de Trolox/100 mL de jugo) (Pitahaya de pulpa roja), incluso superior a la de otras cactáceas rojas como la tuna (Ochoa-Velasco et al., 2012).
Varios estudios han demostrado que la Pitahaya (Hylocereus undatus (Haw.)) tiene compuestos bioactivos que son beneficiosos para la salud, por ejemplo, polifenoles, flavonoides y vitamina C, que están relacionados con su actividad antioxidante en los trastornos metabólicos relacionados con la obesidad (Luo et al., 2014; Song et al., 2016).
Después de una prolongada exposición a oxidantes o a la disminución de la capacidad antioxidante del sistema, surge el fenómeno llamado estrés oxidativo. Este fenómeno también es generado por un desequilibrio entre prooxidantes y antioxidantes en el organismo, el cual está implicado en el desarrollo de enfermedades crónicas tales como cáncer, artritis reumatoidea, arteriosclerosis, algunas formas de diabetes, anemia, entre otras (Tapia et al., 2004).
La pitahaya posee propiedades medicinales y nutricionales altamente beneficiosas para el organismo como fósforo, calcio, vitamina C y fibra, fortalece los huesos y dientes por lo que se sugiere su consumo en niños y jóvenes. Su alto contenido de vitamina C refuerza el sistema inmunológico, su capacidad antioxidante evita el envejecimiento prematuro y promueve la generación de colágeno, teniendo así una amplia gama de aplicaciones como aliviar problemas estomacales e intestinales, ayudar en la reducción de los niveles de presión arterial e incluso ha sido recomendada para la diabetes y para contrarrestar enfermedades como el cáncer (Zorrilla et al., 2004).
Los trabajos actuales explicaron la actividad fitoquímica, antioxidante de la pitahaya (Hylocereus undatus), el estudio de su bioactividad frente a las bacterias patógenas y el estudio del efecto de la toxicidad en ratones. Los resultados mostraron que este fruto es una buena fuente de capacidad antioxidante observada por el método químico DPPH (Determinación cuantitativa del ensayo de actividad de captación de radicales libres). La Pitahaya es rico en compuestos fenólicos, antioxidantes, ácidos grasos insaturados, terpenos, muchos de los oligoelementos y otros.
Del mismo modo, el extracto muestra un agente eficaz contra las bacterias gramnegativas y grampositivas. El estudio quirúrgico e histológico muestra que el extracto de esta fruta tiene un efecto tóxico muy pequeño. El resultado final pareció que el extracto tenía buenos compuestos bioactivos y capacidad antioxidante, con un papel aceptable en la curación de heridas, que puede aplicarse para muchas aplicaciones antibacterianas, antiinflamatorio y podría ser útil en la preparación de fármacos farmacológicos (Montadher et al., 2018).
Asimismo, en la última década se estudió la actividad antioxidante del jugo fermentado de pitahaya. Muhialdin et al. (2020) determinó para jugo de pitahaya no fermentada (N-FPJ) y jugo de pitahaya fermentada (FPJ) utilizando el ensayo de la actividad de eliminación de radicales (DPPH). El valor para FPJ era 13.720 mg / ml y 15,052 mg / ml para NFPJ.
Contenido de compuestos fenólicos
Los compuestos fenólicos son una clase grande de metabolitos secundarios de plantas que consisten en una gran cantidad de compuestos que van desde los compuestos de estructura simple como los ácidos fenólicos hasta los polifenoles más complejos como los flavonoides. Los compuestos fenólicos son ampliamente conocidos por sus efectos beneficiosos, tales como la prevención de cánceres relacionados con las hormonas, potente actividad antioxidante y propiedades antibacterianas (Sidhu et al., 2007).
La pitahaya tiene un alto contenido de compuestos fenólicos (45,31 mg de ácido gálico/100 ml de jugo) (Ochoa-Velasco et al., 2012).
En una investigación donde se produjo polvo de pitahaya roja fresca, se encontraron altos contenidos de compuestos bioactivos, incluyendo ácido fenólico, flavonoides y antocianinas. Los resultados mostraron un contenido fenólico total de 386,09 ± 1,52 mg en 100 g de pitahaya (Hylocereus monacanthus seco). Esta cantidad excede las cantidades de frutas como plátano, piña, papaya y tomate, lo que indica que el polvo de pitahaya roja es una buena fuente de polifenoles que pueden integrarse en la dieta humana (Tonny et al., 2017).
Metabolitos primarios y secundarios
La pitahaya es un fruto muy versátil y funcional, Muhialdin et al. (2020) sometió el zumo de pitahaya a lacto-fermentación durante 48 horas a 37 ° C usando Lactobacillus plantarum FBS05. Se realizó 1 análisis H-RMN (Espectroscopia de resonancia magnética nuclear) con multivariante y se logró identificar la presencia de 21 y 12 metabolitos en el zumo de pitahaya fermentada y no fermentada. Los principales compuestos que contribuyeron a la diferencia eran ácido acético, ácido succínico, ácido láctico, lisina, alanina, glucosa, iso-butirato y betaína (Muhialdin et al., 2020).
Además, en otro estudio, basado en el análisis fitoquímico del extracto hidroalcohólico del fruto Hylocereus undatus (Haw) Briton & Rose “pitahaya roja”, se logró identificar cualitativamente la presencia de los compuestos fenólicos, azúcares, saponinas, flavonoides, alcaloides, quinonas y compuestos grasos (Berrospi y Sanchez, 2018). Por otro lado, en la marcha fitoquímica de los tallos y semillas de la pitahaya amarilla se encontró metabolitos como alcaloides, cumarinas, compuestos grasos, catequinas, saponina, azúcares reductores, entre otros (Parra, 2010).
Pectina
La pectina ha adquirido cada vez más importancia, ya que se emplea ampliamente en numerosas aplicaciones industriales debido a su capacidad de gelificación. La literatura existente y los estudios han demostrado que la cáscara de la fruta del dragón es una fuente ideal de pectina (Chua et al., 2018).
El consumo regular de pectina otorga un efecto benéfico a la salud ya que disminuye los niveles séricos de lípidos y glucosa, ayudando a prevenir enfermedades como diabetes y dislipidemias. Estas propiedades hacen a la pectina idónea para enriquecer en fibra soluble a alimentos de alto consumo (Ortiz y Anzola, 2018).
Según estudios, la Pectina en la fruta del dragón tiene condiciones óptimas de extracción (temperatura: 73 °C; tiempo: 67 min; pH 2,03). Se extrajo pectina de diferentes secciones de piel de fruta de dragón (Hylocereus monacanthus) usando ácido cítrico al 1%. Se logró extraer el mayor rendimiento de pectina (26,38% en peso seco), de la capa interior fresca de la cascara. Además, la pectina extraída tenía un alto contenido de metóxilo y demostró el mayor grado de esterificación (63,74%) cuando se compara con la pectina de otras secciones de la cascara de fruta de dragón (Muhammad et al., 2014).
En trabajos posteriores, la cromatografía líquida de alta resolución reveló que la pec tina de la fruta de dragón está constituida predominantemente por ácido galacturónico (39,11%), seguido por concentraciones moderadas de manosa, ramnosa, galactosa, glucosa y cantidades menores de xilosa y arabinosa (Muhammad et al., 2014).
Mientras que en un estudio (Rahmati et al., 2015) se demostró que aplicando la extracción asistida por microondas se puede dar lugar a una pectina de cáscara de Pitahaya de alta calidad con un rendimiento máximo del 18,53 %. La pectina extraída exhibió una alta cantidad de propiedades, incluyendo el 67,5% de ácido galaturónico contenido (GA) y 49,84% de grado de esterificación (DE), que fueron comparables a la pectina cítrica (53,62% DE).
Además, otra investigación demostró que el rendimiento de la pectina de las cáscaras de Pitahaya fue de 11-13% que era equivalente a pulpa de manzana (Tang et al., 2011).
Apreciación crítica
El presente trabajo aborda información acerca de los beneficios que aporta la pi tahaya o comúnmente llamado fruta del dragón, donde se ha podido evidenciar en diferentes investigaciones las propiedades funcionales de este fruto afrodisiaco. Estos estudios están dirigidos hacia la investigación de nuevos tratamientos, usando la pitahaya como aliado para reducir enfermedades degenerativas, como la diabetes, cáncer al colon, enfermedades del corazón. Además, ayuda a aliviar el sistema digestivo, a controlar el nivel de colesterol y la presión arterial.
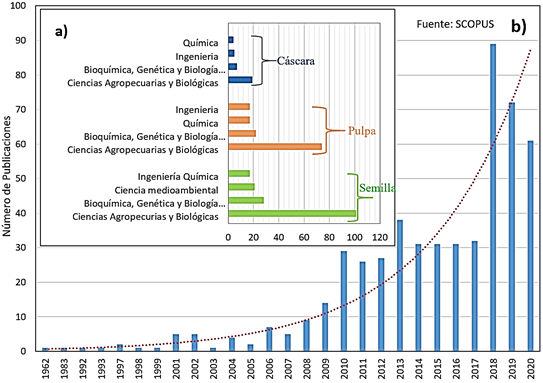
Figura 2 Número de publicaciones de artículos científicos sobre Pitahaya. (a) Información obtenida de la base de datos Scopus (criterios de búsqueda: ARTICLE TITLE, ABSTRACT, KEYWORDS: '' Dragon fruit '' y ARTICLE TITLE, ABSTRACT, KEYWORDS: “each group of application”). (b) Información obtenida de la base de datos Scopus (criterios de búsqueda: ARTICLE TITLE, ABSTRACT, KEYWORDS: '' Dragon fruit '' y tipo de DOCUMENT TYPE: ''ALL'').
Un fruto con tantos beneficios como la pitahaya ha sido explorado e investigado en todos sus componentes y áreas (Figura 2a), por lo que requiere de un mayor interés científico sobre sus propiedades funcionales, abarcando no solo la pulpa, sino todos sus componentes como la cáscara y las semillas. Asimismo, la tendencia de las investigaciones acerca de pitahaya ha ido en aumento en estos últimos años (Figura 2b) y es que al pasar de los años los investigadores de los diversos campos de estudio se están interesando por el estudio de las bondades de esta fruta.
La pulpa de pitahaya tiene propiedades nutraceúticas importantes, es muy versátil, su extracto se puede usar en la elaboración de bebidas fermentadas (donde la fermentación aumenta los compuestos fenólicos, pero disminuye la actividad antioxidante y la carga microbiana) y la harina de pitahaya para nuevos productos de panificación. Sin embargo, en las distintas áreas se presenten inconvenientes que requieren de futuras investigaciones.
Asimismo, las semillas presentan alto contenido de ácidos grasos insaturados, fuente potencial de aceite para uso alimentario, cosmético o farmacéutico, y se ha encontrado alto contenido de proteína. Mientras que su cáscara presenta alto contenido de pectina, que aumenta la capacidad de gelificación y con ello la importancia en la industria alimentaria. Este tipo de investigaciones pueden ayudar a complementar los estudios ya existentes y dar a conocer otros nuevos beneficios de la pitahaya, de esta manera se podrá conocer y aprovechar al máximo esta fruta.
Conclusiones
En este artículo se ha definido a la pitahaya como un fruto de bajo valor calórico, donde destaca su contenido de vitamina C en la variedad roja. Además, gracias a la presencia de betalainas, es considerado un colorante alimentario natural prometedor; ya que su poder colorante es comparable a los colorantes sintético. Otros de sus beneficios es su poder antioxidante, que favorece a la generación de colágeno, lo cual retarda el envejecimiento.
Estudios experimentales han demostrado que el consumo de pitahaya ayuda en la reducción de niveles de presión arterial, y por su contenido en pectina; al alivio de problemas estomacales. Asimismo, investigaciones han demostrado el uso de la pitahaya para contrarrestar la obesidad, y enfermedades como la diabetes y cáncer al colon.
Las propiedades que posee la pitahaya, un fruto de apariencia novedosa para la población, son de alto valor benéfico y nutricional, lo cual con adecuada información fomentará el consumo.
Finalmente, a pesar de que se ha demostrado que la cáscara de pitahaya tiene propiedades nutraceúticas importantes, existen pocos estudios y todavía no se le investigado como debe ser. Se deben profundizar más estudios en la cáscara, así como investigar posibles usos alternativos, como el desarrollo de películas o bio-envases a partir de este residuo.