Introducción
La presencia de Phytophthora en países tropicales corresponde en su mayoría a especies de: P. capsici, P. citrophthora, P. megakarya, P. hevea, y P. palmivora donde esta última es la más frecuente y agresiva (Bahia et al., 2015). La similitud de las enfermedades, hace que su identificación a nivel patológico se ha poco confiable por las diversas especies, siendo importante la identificación correcta para el monitoreo y manejo del patógeno (dos Santos et al., 2016). La técnica de PCR, ha permitido su identificación a nivel de especies por aplicación de cebadores específicos para definir (género y especie) por secuenciación al ADN/ARN (Ali et al., 2016).
Al control de Phytophthora se emplean fungicidas a base de cobre (Liu et al., 2020). Este fungicida aumenta el costo de producción a los ingresos por venta de cacao (Efombagn et al., 2007). Aplicaciones continuas de fungicidas a base de sulfato de cobre contribuyen a la contaminación ambiental de (suelo y agua) (Cornu et al., 2017). Además, incrementa el grado de tolerancia y su efectividad es variable durante la alta presión de la enfermedad en estación húmeda (Guest, 2006).
Alternativas naturales al control de Phytophthora se ha empleado extractos naturales de hojas de Rosmarinus officinalis (romero) y Lavandula (lavanda), que reducen la germinación de las zoospporas de P. palmivora y P. megakarya (Widmer y Laurent, 2006). La aplicación de hongos endófitos de Aspergillus flavipes disminuye la incidencia de enfermedad por Phytophthora (El-Sayed y Ali, 2020). Ensayos in vitro con Trichoderma se ha verificado la presencia de compuestos orgánicos volátiles que inhiben el desarrollo micelial de P. infestans (Elsherbiny et al., 2020). Estudios de aplicación en campo de T. asperellum PR11 determinaron las incidencias de P. megakarya del (47,1%), siendo necesario integrar otros métodos de control (Deberdt et al., 2008).
Los suelos agrícolas disponen de alta diversidad microbiana y asociadas a su sistema radicular promueven un mecanismo en defensa a las plantas, destacándose la presencia de Rizobacterias Promotoras del Crecimiento en Plantas (PGPR). Las rizobacterias secretan de compuestos volátiles como: cianuro de hidrogeno (HCN), proteasa (PR), antibióticos pirrolnitrina (Prn) y ácido fenazina-1-carboxilico (PCA), que protegen las especies vegetales de problemas fúngicos (Keswani et al., 2020). El empleo de Pseudomonas putida R32 y Pseudomonas chlororaphis R47 productoras de HCN tienen actividad antagónica in vitro a P. infestan (Anand et al., 2020). Ensayos de aplicación de Streptomyces cameroonensis en cacao promueve el desarrollo de la planta y protegen a P. megakarya (Boudjeko et al., 2017). Las PGPR en especies vegetales promueven la resistencia sistémica inducida (ISR) (Bukhat et al., 2020). Se ha demostrado que ISR mediada por PGPR, suprime eficazmente varios patógenos fúngicos, por una activación rápida y coordinada de genes en defensa en plantas que normalmente expresan susceptibilidad al patógeno (Goswami et al., 2016).
El trabajo se enmarca a la búsqueda de nuevas alternativas al control de problemas fitosanitarios del cacao bajo la aplicación de PGPR. Donde el inadecuado y excesivas aplicaciones de fungicidas al control de enfermedades en este cultivo, ha originado el incremento al desarrollo de tolerancia de los fitopatógenos y cambios de la biodiversidad de Phytophthora spp. de zonas productoras del Ecuador. El objetivo se basó en caracterizar la biodiversidad de Phytophthora spp. y rizobacterias con potencial al biocontrol en la enfermedad de la mazorca negra en CCN-51.
Materiales y métodos
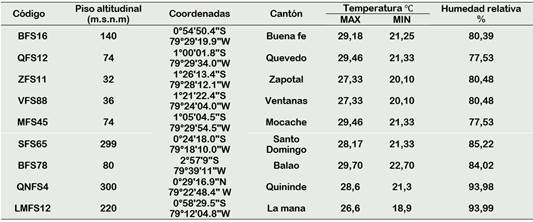
La investigación se ejecutó en el Laboratorio de Microbiología y Biología Molecular de la Universidad Técnica Estatal de Quevedo (UTEQ), localizado en el Campus Universitario “Manuel Haz Álvarez” ubicado en el km 1,5 vía Quevedo - Santo Domingo. Sus coordenadas geográficas 01° 01” de latitud Sur y 79° 47” de longitud Occidental a 73 m.s.n.m.
Muestreo y aislamiento de Phytophthora spp.
De plantaciones de cacao CNN51, se recolectaron mazorcas con síntomas a la enfermedad de Phytophthora spp., plantaciones de distintos pisos altitudinales. Se georreferenciado y codificaron de acuerdo con su procedencia (Tabla 1).
Al aislamiento de Phytophthora spp., se ajustó al protocoló descrito por Evans et al. (2013) con modificaciones. Las mazorcas con presencia de síntomas se sometieron a triples lavados con H2O estéril y alcohol 70%, recuperando de su epidermis segmentos de corcho de (0,2 cm2). Las muestras de tejido se inocularon en cajas Petri con agar V8, empleando la metodología establecida por Matos et al. (2011), e incubadas a 28 °C / 5 días, material biológico se codifico y adjuntó al Banco de Cepas del Laboratorio de Microbiología Molecular. El hongo se reactivó en medio agar V8 por un fotoperiodo de (12 h luz / 12 h oscuridad) / 5 días, para proceder a evaluar las variables: borde, forma, elevación y presencia de disco concéntrico, de la colonia.
Determinación del tamaño de esporangios
El hongo se incubó en placas con agar V8 por un fotoperiodo de (12 h luz / 12 h oscuridad) / 3 días. Se extrajo 1 cm2 del micelio y transferido a tubos (Eppendorf), para ser vortexeado con 1 mL H2O y 20 µL de azul de tripan. Recuperando 20 µL y ubicado en porta objeto para su visualización por el microscopio OLYMPUS (ocular 10X y objetivo 40X), registrando longitud del esporangio al punto de inserción del pedicelo hasta su papila en (µm) por el software IScapture.
Concentración de zoosporas
El hongo incubado en agar V8 se sometió al fotoperiodo antes mencionado, posteriormente se adicionó 10 mL de H2O a 4 °C / 10 min. Este material fue sometido a ondas de choque por ultrasonido (Diamond Back 3Q) / 10 min, para la liberación de zoosporas. Se extrajo 1 mL de la suspensión y ubicado en tubos (Eppendorf) con 20 µL de azul de tripan para su inmovilización. Obteniendo 10 µL de la solución para su visualización en cámara de Neubauer, para el conteo en cinco de los cuadrantes de 0,20 mm2, para determinar la concentración de zoosporas= (número de células x 10.000) / (número de cuadros).
Prueba de infectividad de Phytophthora spp.
De mazorcas sanas de CCN-51 con 18 semanas de edad, se lavaron con H2O destilada y jabón. Siendo sumergidas en NaClO al 10% / 10 s. Este material se llevó a bolsas de polipropileno más papel absorbente con 10 mL de H2O para generar cámara húmeda. Se recuperó discos miceliales de (1cm Ø), con un promedio de (10.000 U) de esporangios. Los discos miceliales del hongo se ubicaron en los extremos de la mazorca y almacenadas a temperatura ambiente por un fotoperiodo de (12 h luz / 12 h oscuridad) / 3 días, para registrar el avance de infección a 4, 5 y 6 días postincubación (dpi), con un calibrador de Vernier y fotografía.
Los experimentos contenían cinco replicas y cada una con tres unidades experimentales. Los valores a cada condición están representados con la desviación estándar promedio individual (±), los tratamientos fueron sujetos al análisis de varianza por ANOVA, y separados por procedimiento de comparación múltiple de Tukey SD, al nivel de significancia de (p ≤ 0,05), empleando Statgraphics.
Caracterización molecular
Las cepas de Phytophthora spp. se cultivaron en medio V8 y se recuperó 1 g de tejido micelial para su pulverización con N2 líquido, obteniendo entre 400 mg. Iniciando con la extracción de ADNg, siguiendo las intrusiones del fabricante por DNeasy Plant Mini Kit de (QIAGEN-Start EE.UU.), la muestra se diluyó en 50 µL del tampón TE (Ácido trisetilendiaminotetraacético 10 mM y EDTA pH 8.2). El ADNg se visualizó en geles de agarosa al 0,9% teñidos en bromuro de etidio. La identificación por PCR para las especies de Phytophthora, se empleó los oligonucleótidos específicos reportados por Ali et al. (2016) (Tabla 2). Que amplifica la secuencia específica a la región ITS al gen del ARNr. La reacción de la PCR se realizó en 20 µL que contenía 4 µL Buffer (1X): 1,2 µL de MgCl2 (6 mM); 1 µL de DNTP`s (0,2 mM); 1 µL / cada primer (0,2 mM); 0,2 µL de Taq pol (Promega®); 1 µL de ADN (60 ng/mL); 10,6 µL de H2O. Se empleó un termociclador (TECHME®) ajustando su perfil térmico a: 94 °C por 5 min; 35 ciclos a 94 °C por 1 min; 57 °C por 60 s; 72 °C por 1 min; extensión final de 72 °C por 10 min.
Tabla 2 Cebadores específicos para la identificación de Phytophthora spp.
| Primer | Forward | Reverse | Tamaño del fragmento (bp) | Especie |
| PmegITS_F/R | TGCTCGAAAAGTAAAGCTTGC | AGGAAAAACGCCCAATAAGC | 147 | P. megakarya |
| PpalITS_F/R | AAAAGCGTGGCGTTGCT | AATCATACCACCACAGCTGAA | 159 | P. palmivora |
| Pcap/citITS_F/R | TCGAAAAGCGTGGTGTTG | GCCACAGCAGGAAAAGCATA | 157 | P. capsici y P. citrophthora |
| PcitITS_F/R | GGGTGTTGCTTGGCATTTT | CACAAAAACCGCAAGACACTT | 380 | P. citrophthora |
Los productos de amplificación se verificaron por electroforesis en gel de agarosa al 2% y teñidos en bromuro de etidio. Los fragmentos se determinaron por comparación con el marcador de peso molecular 100 bp (Invitrogen®)
Actividad antagónica del enfrentamiento bacteria-patógeno
Del Banco de Germoplasma del Laboratorio de Microbiología de la UTEQ, se seleccionaron cuatro rizobacterias (Tabla 3). Las rizobacterias se incubaron a 120 r.p.m / 24 h a 27 °C en un agitador (Benchmark, IncuShaker), en 10 mL del medio liquido King B ((g/L): 20.0, peptona; 15 mL, glicerol; 1,5, K2HPO4; 1,5, MgSO4 x 7H2O; 15, agar; agua destilada (pH 7.2))suplementado con chloramphenicol (13 µg/mL), ampicillina (40 µg/mL) (King et al., 1954). Del cultivo bacteriano se recuperó 1 mL y ubicados en tubos (Eppendorf) para su centrifugación a 6000 r.p.m. / 5 min. Se descartó el sobrenadante para recuperar las bacterianas y resuspenderlas en un mismo volumen de H2O. Al enfrentamiento antagónico se seleccionó la Phytophthora de mayor agresividad con discos miceliales de (1 cm Ø) y ubicados al centro de la placa Petri con PDA (papa dextrosa agar). Simultáneamente se inoculó 5 μl de la bacteria en los 4 extremos de la caja con el patógeno a 28 °C para su evaluación.
Actividad antagónica del enfrentamiento extractos celulares-patógeno
Las rizobacterias incubadas King B líquido con 50 mL a 120 r.p.m / 48 h a 27 °C, se recuperó 15 mL del cultivo bacteriano y centrifugado a 6000 r.p.m / 5 min (Centrifuge 800-B), proceso se realizó en triplicado para recuperar el sobrenadante. Los extractos se filtraron en Nalgene Syringe de 0,2 µm, sometidos a 15 min / 90 °C en (Memmert WNB 22) y 15 min / - 40 °C en el congelador (Eppendorf-Innova U725), para ser almacenados a 4 °C. Para los ensayos antagónicos se añadieron 0,2 mL de los extractos en placas con PDA y posteriormente se ubicó un disco micelial de (1 cm Ø) al centro de la misma a 28 °C para su evaluación.
Se evaluó el porcentaje de antagónico a inhibición micelial por bacterias y los extractos al séptimo dpi, desde el borde del disco micelial hasta el crecimiento del hongo empleando la fórmula: % inhibición = (crecimiento del control - crecimiento del tratamiento / crecimiento del control) x 100. Se realizó seis replicas y cada una con cuatro unidades experimentales. Los valores a cada condición están representados con la desviación estándar promedio individual (±), los tratamientos fueron sujetos al análisis de varianza por ANOVA, y separados por procedimiento de comparación múltiple de Tukey SD, al nivel de significancia de (p ≤ 0,05), empleando Statgraphics.
Inoculación y protección de PGPR a plántulas de cacao CCN-51 en presencia de Phytophthora spp.
Las semillas de cacao CCN-51 se desinfectaron con NaClO al 5% por 3 min y sumergidas en H2O estéril para su escarificación. Se ubicaron en contenedores plásticos con papel absorbente con 5 mL de H2O destilada estéril a 28 °C / 96 h para su germinación. Las bacterias se incubaron en 50 mL de King B líquido a 120 r.p.m a 27 °C / 24 h, hasta alcanzar la concentración de 1x109 (UFC x mL) y centrifugadas a 6.000 r.p.m / 5 min, para la recuperación de células y resuspendidas en un mismo volumen de H2O. Con 10 µL de la suspensión celular se inoculó en la base del hipocótilo de cada semilla pregerminada y ubicadas en contenedores plásticos con 140 g del sustrato con (50 / 50%) de suelo franco limoso y turba (Novarbo seedling, black C1B), esterilizado por autoclave a 121 °C / 20 min. Se realizaron aplicaciones de 1 mL de suspensión celular individual de (R4, PM3-8, BMR2-12 y CHA0) al suelo por (15, 30 y 45 días). Se mantuvieron en invernadero con humedad relativa al 75% a 28 ± 2 °C, por un fotoperiodo de (12 h luz / 12 h oscuridad) y plántulas control sin inoculante bacteriano. A los 46 dpi se añadió 20 µL de zoosporas a una concentración de (2,00E+05) al ápice de las plántulas de CCN-51, de la Phytophthora spp. de mayor agresividad. Las plántulas se trasladaron a cámara húmeda para asegurar la supervivencia de las zoosporas. A los 65 dpi se evaluó su patogenicidad, donde se determinó peso fresco de (hojas y raíz), peso del brote se realizó un corte por debajo de la inserción de los cotiledones a (10 cm) y retirando la masa foliar.
Productoras de metabolitos secundarios: PR-Proteasa, HCN-cianuro de hidrogeno, Prn-pirrolnitrina, 2,4-DAPG diacetilfloroglucinol, sideróforos, AIA-ácido indol-3-acetico (Chávez et al., 2018).
El Ø del hipocótilo se evaluó por debajo de la inserción de los cotiledones y el número de hojas funcionales. Los tratamientos contenían cinco replicas y cada una con cuatro unidades experimentales. Los valores a cada condición están representados con la desviación estándar promedio individual (±), los tratamientos fueron sujetos al análisis de varianza por ANOVA, y separados por procedimiento de comparación múltiple de Tukey SD, al nivel de significancia de (p ≤ 0,05), empleando Statgraphics.
Resultados y discusión
Caracterización morfológica de Phytophthora spp.
La caracterización morfológica reveló considerables variaciones en todos los parámetros analizados, al género Phytophthora spp. se pueden dilucidar distintos morfotipos de colonia del hongo cultivados en agar V8, que se clasifican en cuatro grupos morfológicos (1 y 3) (Figura 1a). Esto concuerda con Appiah et al. (2003), la presencia de patrones de colonias algodonosos, borde regular y estrellado característico para Phytophthora spp. Las variaciones morfológicas están influenciadas a su mecanismo de patogenicidad para sus pisos altitudinales, donde se cultiva el cacao en Ecuador. Esto coincide con Maora et al. (2016), que verifican variaciones morfológicas de Phytophthora spp. en una misma plantación de cacao. Estas diferencias en colonias de Phytophthora spp., están reguladas a las variantes del fenotipo del hongo por su capacidad de adaptación y coevolución con el cultivo del cacao.
Al visualizar los esporangios de Phytophthora spp., no hay variaciones en las papilas y con ausencia de pedicelo. La forma de los esporangios reúne dos grandes características: grupo 1 elipsoide y grupo 2 ovoide (Figura 1b). En longitud de esporangios se evidencia variaciones entre los nueve ecotipos, con rangos de 27,54 y 52,74 µm (Figura 2). Estas variaciones en dimensiones de los esporangios se ha reportado dentro de una misma localidad o región, sugiriendo una población continua que afecta el cultivo de cacao (Maora et al., 2016).
Las concentraciones de zoosporas varían entre las cepas de Phytophthora spp., observando el mayor contenido de 1918750 zoosporas/mL para la cepa BL15. Los altos contenidos de zoosporas demuestran su alto mecanismo de infección a tejidos vegetales y su desimanación en plantaciones de cacao (Figura 2). Estos ecotipos de Phytophthora spp., no guardan relación entre mayor longitud del esporangio el aumento de concentración de zoosporas cepa BF05 (esporangios de 52,74 µm - 1337500 /mL zoosporas), con la cepa BL15 (esporangios de 47,67 µm - 1918750 /mL zoosporas). Sus zoosporas se movilizan por el agua en busca de tejidos (semillas, raíces, tallos u hojas), donde se asientan y enquistan (Hon, 2018; West et al., 2003).
Progresión de virulencia por Phytophthora spp. en mazorcas de CCN-51
El grado de infección por Phytophthora spp. en mazorcas de CCN-51 mostraron ser virulentas con índices de necrosis entre 136 y 195 (mm) a 4 dpi. Los ecotipos recolectados son de alta virulencia con necrosis en mazorcas entre 406 y 497 (mm) a los 6 dpi (Figura 3a). Las condiciones de infección en mazorcas se ejecutaron en condiciones con alta humedad, esto facilitó el avance de la enfermedad para cubrir la totalidad de la mazorca en 10 días. Donde el borde de sus lesiones avanzó con un promedio 12 mm por cada 24 horas. Las especies de Phytophthora se consideran hemibiotrófico en su primera etapa de infección (Ali et al., 2017), siendo esto oportuno para este patógeno donde cambia a necrotrófico una vez establecida.
Las cepas de Phytophthora spp. poseen un alto índice en producción de zoosporas infectivas entre 1918750 y 737500, que favorecen al desarrollo de la necrosis (Figura 3b). La infección por Phytophthora spp., está regulado a la formación rápida del tubo germinal de las zoosporas, que penetra al huésped directamente a través de su apresorio causando la diseminación de la enfermedad (Ali et al., 2016). En estos ensayos de agresividad en mazorcas de cacao CCN-51 no se ejecutaron heridas para facilitar la infección por el patógeno, deduciendo que la formación del apresorio estableció una interacción exitosa con el huésped (Hardham, 2001).

Figura 1 Diferencias morfológicas a micelio y esporangios de Phytophthora spp. (a) Desarrollo micelial del hongo en agar V8 por cinco dpi, grupo 1 (forma estrellada, sin elevación, borde regular, algodonoso y disco concéntrico), grupo 2 (forma estrellada, sin elevación, borde irregular, algodonoso y sin disco concéntrico), grupo 3 (forma aracnoides, bordes regulares, algodonoso, sin elevación, no presentan disco concéntrico), grupo 4 (forma estrellada, borde regular, sin elevación y sin disco concéntrico). (b) Visualización morfológica de los esporangios cultivado en agar V8 por tres dpi.
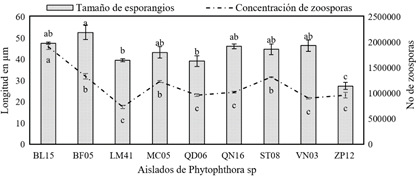
Figura 2 Diferencias en longitud de esporangios y concentración de zoosporas entre Phytophthora spp. Los valores con letras similares no presentan diferencias estadísticas significativas al nivel de (p ≤ 0,05), por el procedimiento de comparación múltiple de Tukey. Las barras indican la DE individual para tratamiento (±).
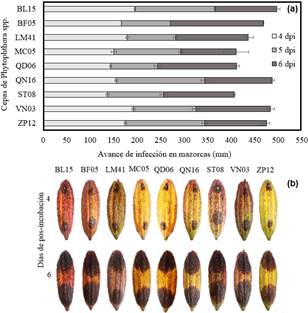
Figura 3 Avance de infección de ecotipos de Phytophthora spp. en mazorcas de cacao CCN-51. (a) Respuesta diferencial de necrosis de las nueve cepas de Phytophthora spp. a 4, 5 y 6 dpi. Las barras indican el DE individual para tratamiento (±). Con diferencias significativas al nivel de (p ≤ 0,05), por el procedimiento de comparación múltiple de Tukey. (b) Avance de infección con la formación de necrosis a 4 y 6 dpi por inoculación de discos miceliales de Phytophthora spp., a los extremos de la mazorca.
Identificación de especies de Phytophthora spp. especifica por PCR
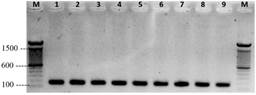
Los perfiles de electroforesis revelaron un amplicón único de 159 pb que concierne a P. palmivora, para las nueve cepas de los cultivares de cacao en Ecuador (Figura 4), pero con diferencias en sus comportamientos fisiológicos y morfológicos. Corroborando con Ali et al. (2016), donde el amplicón de 159 para P. palmivora. Además, se realizó la reacción de PCR, con los partidores (PmegITS_F/R; Pcap/citITS_F/R; PcitITS F/R), donde no generó los productos de amplificación para: P. megakarya, P. capsici y P. citropthora. En este trabajo no se descarta la presencia de otras especies de Phytophthora spp., al poder parasitar distintas partes del tejido: foliar y radicular. De forma especial P. palmivora y P. megakarya son capaces de poder parasitar el mismo huésped en toda la planta, por su trayectoria evolutiva (Ali et al., 2017).
Las PGPR en inhibición al desarrollo micelial de P. palmivora in vitro
Los ensayos in vitro (bacteria-hongo) en inhibición al desarrollo micelial de P. palmivora, se verificó niveles de antagonismo entre (78 y 60%) por: R4, BMR2-12, PM3-8 y CHA0 (Figura 4a). La búsqueda de bacterias antagónicas inicia con pruebas in vitro, donde Pseudomonas chlororaphis CP07 capaz de sintetizar: (HCN, proteasa, fenazina), inhibe el desarrollo micelial in vitro del 50% a P. palmivora (Acebo et al., 2015). Donde el efecto inhibitorio in vitro por las PGPR a P. palmivora está conferido por la producción de metabolitos antagónicos antes descrito (Tabla 3). La producción de enzimas como: (proteasa y quitinasa) por rizobacterias no tiene efecto alguno sobre P. palmivora, donde la pared celular de los oo micetos está compuesto por celulosa (β-1,4-glucanos) y los ascomicetos contienen quitina (West et al., 2003).
Los ensayos in vitro del (sobrenadantehongo) de R4, BMR2-12, PM3-8 y CHA0, inhibieron el desarrollo micelial entre (46 al 51%) a P. palmivora (Figura 4a). Resultados de sobrenadantes obtenidos de Pseudomonas chlororaphis R47 detienen el desarrollo micelial de P. infestans y al ser transferidas a placas frescas no permite que el oomiceto reanude su crecimiento (Hunziker et al., 2015). P. protegens CHA0 se caracterizan por ser cianogénicas, donde la funcionalidad del HCN tiene una toxicidad de amplio espectro para hongos, causando la sensibilidad en las hemoproteínas en células eucariotas (Zdor, 2014). Curiosamente P. veronii R4 incapaz de producir HCN, sugiriendo la presencia de otros componentes bioactivos volátiles. Donde la biosíntesis del antibiótico Prn por las cepas BMR2-12, CHA0 y R4, se considera como otro factor de inhibición micelial. Este antibiótico Prn se dirige a las mitocondrias siendo el objetivo para este biopesticida (Anderson y Kim, 2018). Además, Prn participa en alterar la señalización al estrés osmótico en hongos (Okada et al., 2005).
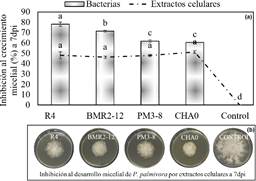
Figura 5 Ensayos antagonistas de PGPR a P. palmivora. (a) Inhibición al desarrollo micelial del hongo por bacteria y extractos celulares a 7 dpi. Los valores con letras similares no presentan diferencias estadísticas significativas al nivel de (p ≤ 0,05), por el procedimiento de comparación múltiple de Tukey. Las barras indican el DE individual para tratamiento (±). (b) Inhibición antagónica por los extractos celulares en reducción del crecimiento micelial de la colonia.
El extracto celular de P. protegens CHA0 desplegó el 51% de inhibición a P. palmivora por la producción del 2,4-DAPG (Figura 4a). Este antibiótico desorganiza las hifas de Pythium ultimum, alterando la membrana plasmática y desintegración del contenido celular (Souza et al., 2003). El HCN y 2,4-DAPG contribuyen a un mayor efecto antagónico por CHA0, esto se corrobora por Paulin et al. (2019), donde estos dos metabolitos presentes en P. brassicacearum LBUM300 reduce significativamente a Clavibacter michiganensis. Sugieren que los extractos celulares de R4, BMR2-12, PM3-8 y CHA0 contienen una diversidad de metabolitos antagónicos que reducen el desarrollo micelial de P. palmivora in vitro.
Las PGPR promueven el desarrollo y protección a plántulas de CNN-51 en presencia de P. palmivora.
Las aplicaciones individuales de: (R4, BMR2-12, PM3-8 Y CHA0) contribuyeron al incremento en peso fresco del brote, foliar y radicular. A diferencia de las plantas no tratadas se verifica la disminución del peso fresco de los tejidos evaluados en CCN-51 a 19 dpi en presencia de P. palmivora cepa (BL15) (Figura 6a). La protección e incremento del tejido vegetal en CCN-51 por aplicación de las PGPR, se relacionó a su capacidad simbiótica bacteria-planta. Las bacterias colonizan el tejido radicular captando las pequeñas cantidades de Trp presente en las raicillas e incrementando la biosíntesis de AIA (Kravchenko et al., 2004). Donde aplicaciones in vitro de Burkholderia phytofirmans PsJN en Vitis vinífera L.cv. Chardonnay, incrementaron el tejido radicular por su colonización endofítica (Barka et al., 2006).
Las rizobacterias en CCN51 promovieron el desarrollo de (8 a 9 hojas) funcionales, con incremento al Ø del hipocótilo entre (0,41 a 0,44 mm), inhibiendo la marchitez por P. palmivora a 19 dpi (Figura 6b). Las plantas no tratadas con PGPR se evidencian el grado de infección en el tejido foliar a 10 y 15 dpi por P. palmivora cepa (BL15) (Figura 6c). Las PGPR ejercen un incremento de la masa radicular y foliar por aplicaciones edáficas de P. brassicacearum LBUM en tomate, y reduciendo la marchitez por Clavibacter michiganensis (Paulin et al., 2019). Sugiriendo que las rizobacterias en CCN-51, se fusionó la capacidad promotora en plantas y la supresión de P. palmivora (Figura 6d y e). En aplicaciones foliares de P. protegnes 44R-P8 en papa hacen posible reducir la incidencia de P. infestans por biosíntesis del 2,4-DAPG (Caulier et al., 2018). Las bacterias ejercieron cambios positivos morfológicos y fisiológicos en CCN-51, estas habilidades de las PGPR están regulados por la producción de: ácido indolacético, citoquininas y activación de mecanismo en defensa (Singh et al., 2017).
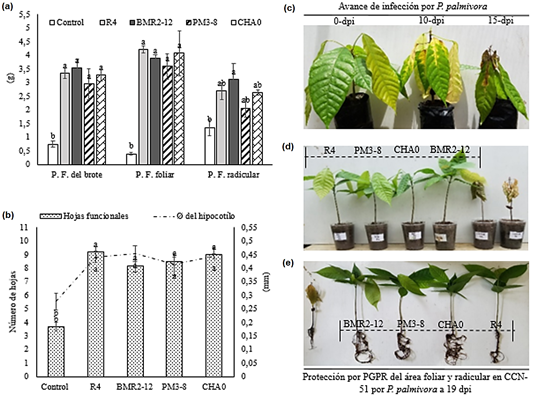
Figura 6 Influencia del tratamiento edáfico en CCN-51 con PGPR al biocontrol de P. palmivora. a) Incremento en peso fresco de la planta. b) Número de hojas funcionales y Ø del hipocótilo. c) Avance de la enfermedad en plantas sin inoculo bacteriano a los 15 dpi., con P. palmivora. Los valores con letras similares no presentan diferencias estadísticas significativas al nivel de (p ≤ 0,05), por el procedimiento de comparación múltiple de Tukey. Las barras indican el ES individual para tratamiento (±). d y e) Protección del tejido foliar y radicular al hongo por aplicación de PGPR e inducción al desarrollo en plantas 19 dpi.
En este trabajo, no se estableció un contacto directo bacteria-patógeno, por lo tanto, el efecto protector a CCN-51 está mediado por la capacidad endofítica de las PGPR y activación de genes de resistencia por ISR, impidiendo el avance de la enfermedad. Esto se corrobora con Miguelez et al. (2019), por aplicaciones edáficas de P. chlororaphis cepa CP07 en cacao reduce la incidencia de P. palmivora. Esto guarda relación con aplicaciones edáficas en T. cacao con Pseudomonas chlororaphis CP24 productora de Prn, reduce la incidencia de P. palmivora (Acebo et al., 2015).
Las PGPR en este trabajo tienen la capacidad de producir sideróforos, estos están asociados en activar el mecanismo en defensa para ISR y promover el desarrollo en plantas (Verbon et al., 2017). Los sideróforos de P. putida WCS358 activan ISR en tomate a la infección por Botrytis cinérea (Meziane et al., 2005). Los metabolitos bacterianos se consideran inductores de ISR en plantas y pueden conferir un efecto protector contra un amplio espectro de enfermedades (Meena, 2014). Las bacterias activarían el mecanismo en defensa por ISR en CCN-51 al colonizar el sistema radicular. Esto sensibilizan a nivel sistémico las partes distales de la planta, a través de un mecanismo de defensa dependiente al ácido jasmónico (JA) y etileno (ET) (Ton et al., 2002). Esto proporciona una capacidad rápida y eficiente a una infección, que solo se activaría en presencia del patógeno (Verhagen et al., 2004).
Las bacterias Acinetobacter calcoaceticus BMR2-12 y Serratia marcescens PM 3-8 provenientes de la rizósfera de cultivares endémicas de Musáceas del Ecuador y P. protegens CHA0 y P. veronii R4 impidieron el avance de la enfermedad por infección de P. palmivora en cacao CCN-51, clon de origen ecuatoriano que se destaca por ser un cultivar precoz y alta productividad. Donde la capacidad endofítica de las rizobacterias hace posible mejorar la potencialidad del CCN-51, favoreciendo la arquitectura morfológica y activación al mecanismo en defensa a P. palmivora. La adaptabilidad de las bacterias lo faculta para su potencial empleo como agente biocontrolador a la podredumbre de la mazorca negra al sector cacaotero y mejorando la sostenibilidad en la producción del cacao.
Conclusiones
P. palmivora está presente en plantaciones de CCN-51 con una gran diversidad dependiendo a sus pisos altitudinales donde se viene cultivando en Ecuador, observando cambios en el patógeno en su morfología y patogenicidad que han permitido desarrollarse de las nueve zonas evaluadas. El proceso de inhibición antagónica in vitro por A. calcoaceticus BMR2-12, S. marcescens PM 3-8, P. protegens CHA0 y P. veronii R4 alcanzaron promedios superiores al 70% destacándose su actividad antifúngica. El proceso de interacción bacteria-plantapatógeno hace posible la inhibición de la enfermedad por la capacidad endofítica de las rizobacterias mejorando la potencialidad del CCN-51, estas rizobacterias se proyectan a su aplicación individual o en consorcios para determinar su actividad biocontroladora en campo.