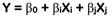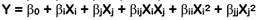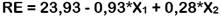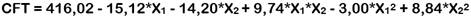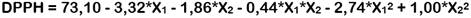Introducción
Los antioxidantes provenientes de las plantas son cada vez de mayor interés por sus múltiples beneficios para la salud debido a sus propiedades antialérgicas, antimicrobiales, antiinflamatorias y antimutagénicas que le confieren un efecto protector frente al estrés oxidativo (Tungmunnithum et al., 2018) evitando que se generen radicales libres y disminuyendo así el riesgo de enfermedades cardiovasculares, neurodegenerativas, inmunológicas, cáncer y envejecimiento (Szymanska et al., 2018). Debido a sus propiedades bioactivas, los antioxidantes pueden ser usados como aditivos naturales, en reemplazo de los antioxidantes sintéticos, por ser más seguros, generar beneficios a la salud de los consumidores y extender la vida útil de los productos (Ordoñez-Gómez et al., 2018; Kebede y Admassu, 2019).
Debido a que la mayoría de los antioxidantes se encuentran unidos covalentemente a polímeros insolubles, es necesario establecer un método eficaz para la liberación de estos componentes (Sánchez-Molina et al., 2018). La extracción asistida por ultrasonido (EAU) es una técnica que permite liberar compuestos antioxidantes en corto tiempo, tiene un funcionamiento sencillo, un bajo consumo de solvente, ahorra energía y contribuye a aumentar el rendimiento (Sharayei et al., 2019). Además, si esta técnica es optimizada, se logra extraer la mayor cantidad posible de compuestos. Esto se da gracias a herramientas estadísticas como la metodología de superficie de respuesta (MSR) que establece las condiciones óptimas que permiten mejorar un proceso (Kumar y Sharma, 2016).
Sin embargo, los antioxidantes son inestables en el tracto gastrointestinal; asimismo, las condiciones de procesamiento y almacenamiento de alimentos, como altas temperaturas, congelación, humedad relativa, pH, luz, presencia de enzimas oxidativas, oxígeno y metales también pueden contribuir a la pérdida de estos compuestos (Kuck y Noreña, 2019). La microencapsulación permite proteger estos antioxidantes utilizando un polímero para encapsularlos. Entre los diferentes métodos de microencapsulación, el secado por aspersión es el método más antiguo y utilizado en la industria de alimentos y bebidas debido a su amplia disponibilidad y bajo costo (Nurhadi et al., 2020; Peanparkdee et al., 2016).
Por otro lado, las semillas, cáscaras, tallos y hojas de plantas contienen una gran cantidad de compuestos fenólicos, muchas veces, en cantidades mayores que las partes comestibles (Soong y Barlow, 2004; Orak et al., 2019). Estos compuestos fenólicos son los principales responsables de la capacidad antioxidante (Dai y Mumper, 2010). Entre las palmeras endémicas de la región amazónica que presentan amplio potencial para ser aprovechadas, se destaca el Oenocarpus bataua Mart (Darnet et al., 2011), conocido como ungurahui o patawa. La semilla del ungurahui es un residuo del fruto que no es aprovechado, del cual existe muy poca, pero relevante información bibliográfica que demuestra su elevado contenido de fenoles totales y mayor capacidad antioxidante que la pulpa del mismo fruto (Hidalgo et al., 2016) y que el açai (fruto ampliamente estudiado por su alto potencial antioxidante), con presencia de antocianinas, taninos condensados, estilbenos y ácidos fenólicos (Rezaire et al., 2014), que lo convierten en una fuente importante de antioxidantes naturales que pueden ser aprovechados.
Por lo tanto, el objetivo de este estudio fue extraer y microencapsular los compuestos antioxidantes presentes en la semilla de ungurahui.
Materiales y métodos
Reactivos
Los productos químicos utilizados en el estudio fueron de grado analítico de las marcas Fisher Scientific (Etanol grado HPLC), Sigma-Aldrich (2,2-difenil-1-picril-hidrazilo (DPPH)), Merck (reactivo Folin-Ciocalteu 2N, hidróxido de sodio, carbonato de sodio y molibdato de amonio), J.T. Baker (ácido sulfúrico), Fermont (ácido gálico), Riedelde-Haën (fosfato de sodio dodecahidratado) y Scharlau (ácido ascórbico).
Acondicionamiento de la materia prima
Se utilizaron frutos maduros de ungurahui (Oenocarpus bataua Mart.) que fueron recolectados en Pucallpa-Ucayali (Perú). Los frutos fueron lavados y desinfectados en una solución de hipoclorito de sodio a 50 ppm por 10 min. Las semillas fueron separadas de los frutos manualmente, secadas en un horno (Zenith Lab, ODHG- 9053A) a 40 °C por 48 h, molidas con un molino de martillos (Pulvex, MM200) y secadas nuevamente (40 °C) hasta peso constante. Finalmente, fueron pulverizadas en una licuadora (Oster, BLSTMG-B00-051) y tamizadas (W.S. Tyler, malla #80) hasta obtener un polvo fino que se colocó dentro de una bolsa trilaminada y fue llevado a congelación (-20 °C) para posteriores evaluaciones.
Optimización de la extracción de compuestos antioxidantes
Extracción de compuestos antioxidantes
Se siguió la metodología descrita por Lan et al. (2014) con ligeras modificaciones. Se combinó el polvo fino de semilla (soluto) con una solución hidroetanólica (solvente) en una relación de 1:30 (p/v) en un baño ultrasónico (Branson, B1510MTH) a temperatura ambiente (25 ± 1 °C), a diferentes concentraciones de etanol y tiempo de extracción. Las mezclas fueron centrifugadas a 4000 rpm por 15 min (GREETMED, GT119-100T) y fueron filtradas con papel Whatman n° 2. Los sobrenadantes fueron concentrados a 40 °C en agitación constante dentro de un sistema a vacío. Luego de evaporar la mayor parte del solvente, los extractos fueron secados a 40 °C en un horno hasta peso constante, recolectados y designados como “extractos de ungurahui” (EU). Seguidamente, se determinó el rendimiento (RE) como la relación entre el peso de cada EU (g) y el peso del polvo fino (g). Los EU fueron almacenados a -20 °C hasta realizar los análisis de contenido fenólico total (CFT) y capacidad antioxidante por los métodos de Capacidad Antioxidante Total (CAT) y capacidad captadora del radical libre DPPH.
Diseño experimental
Se utilizó el diseño central compuesto ortogonal (DCCO) de la metodología de superficie de respuesta (MSR) para determinar las condiciones óptimas de los factores: concentración de etanol (X1) y tiempo de extracción (X2), cada uno con cinco niveles (-1,07809; -1; 0; +1; +1,07809) que maximizan las variables de respuesta: RE (Y1), CFT (Y2), CAT (Y3) y DPPH (Y4). Los datos experimentales se ajustaron a modelos polinomiales (lineal (Ec. 1) o cuadrático (Ec. 2)) para predecir el comportamiento y el valor máximo de cada respuesta, los cuales son expresados mediante las siguientes ecuaciones:
donde, Y es la variable de respuesta pronosticada, β0 es el intercepto, βi y βj son los efectos lineales, βij es el efecto de interacción, βii y βjj son los efectos cuadráticos, Xi y Xj son los niveles de los factores y XiXj es la interacción lineal entre los niveles de los factores (Saikia et al., 2015).
La idoneidad de cada modelo se determinó a través de un análisis de regresión múltiple (ANOVA), y para su validación, se realizó un experimento con las condiciones óptimas de concentración de etanol y tiempo de extracción que maximizaban las respuestas en simultáneo. El extracto obtenido fue designado como “extracto de semilla de ungurahui libre” (EUL).
Determinación del contenido fenólico total y capacidad antioxidante del EU y EUL
Para la preparación de las muestras, se disolvió 25 mg de cada extracto en un solvente hidroetanólico (1:1 v/v) y se hicieron diluciones con el mismo solvente hasta 100 ppm para determinar el CFT usando el reactivo de Folin-Ciocalteu, y hasta 10 ppm para determinar la capacidad antioxidante por DPPH y CAT. Los análisis de CFT, CAT y DPPH se realizaron según la metodología descrita por Elkhamlichi et al. (2017) con ligeras modificaciones.
Microencapsulación de compuestos antioxidantes
Se siguió lo descrito por Saikia et al. (2015) con ligeras modificaciones. Una solución acuosa de maltodextrina MD (10 - 12 equivalentes de dextrosa) fue añadida a una solución hidroetanólica de EUL hasta alcanzar 20% (p/p) de sólidos en suspensión, la mezcla fue homogenizada usando un Ultra Turrax (IKA, T25 Basic) a 10000 rpm por 10 min y encapsulada mediante secado por aspersión en flujo co-corriente (TOPTION, TP-S15) bajo las siguientes condiciones: 150 °C de temperatura de entrada, 90% de velocidad del aire y 18% de velocidad de alimentación. El EUL microencapsulado fue designado como “extracto de semilla de ungurahui microencapsulado” (EUM) y almacenado en bolsa trilaminada.
Análisis de morfología y tamaño de partícula
El EUL y EUM fueron introducidos en un microscopio electrónico de barrido (ZEISS, EVO 10) de 4x10-6 mbar y 20 kV, anexado al software SmartSEM V05.06. El diámetro promedio de las partículas de EUM se obtuvo por medio de los programas ImageJ (Software Fiji, USA) y Origin 9.0 (Electronic Arts, USA).
Determinación del contenido fenólico total y capacidad antioxidante del EUM
Se preparó una muestra de EUM que teóricamente contuvo la misma concentración de EUL. Se pesó 20 mg de EUM, se disolvió en una solución hidroetanólica y se hicieron diluciones con el mismo solvente hasta 400 ppm para determinar el CFT, y hasta 40 ppm para determinar la capacidad antioxidante por DPPH. Los análisis de CFT y DPPH se realizaron según la metodología de la sección 2.3.3.
Análisis de estabilidad fenólica de los extractos durante el almacenamiento
El EUL y EUM fueron almacenados en viales de vidrio de color ámbar a temperatura ambiente (25 ± 1 °C) por 180 días. El CFT se analizó cada 45 días, según la metodología de la sección 2.3.3.
Análisis estadístico
Para los análisis estadísticos y la MSR se usó Design Expert v. 10.0 (Stat-Ease Inc.). Todos los análisis se realizaron por triplicado y se reportaron como promedio. La diferencia significativa entre las medias de cada tratamiento fue comparada mediante la prueba de Tukey con un nivel de significancia de 5%.
Resultados y discusión
Optimización de la extracción de compuestos antioxidantes
Diseño experimental
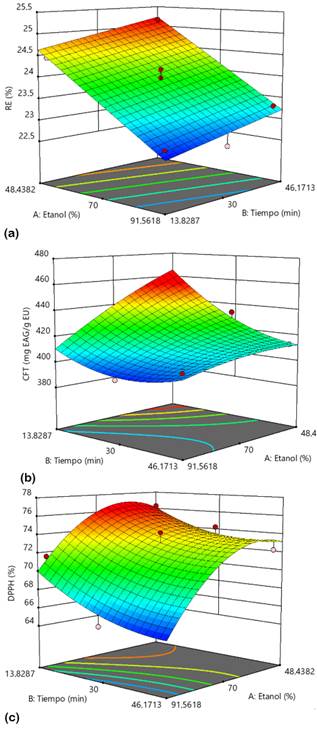
La Tabla 1 muestra los resultados del análisis de cada EU obtenido a diferentes condiciones de extracción, según el DCCO. Cada respuesta se ajustó a diferentes modelos polinomiales y para elegir el mejor modelo se llevó a cabo un ANOVA, en donde el valor del coeficiente de determinación (R2) debe ser al menos 0,8 (Saikia et al., 2015) y el valor p de la prueba de falta de ajuste (FA) debe ser no significativa (p > 0,05) (Morales et al., 2017). En base a ello, se seleccionó un modelo lineal para RE y un modelo cuadrático para CFT y DPPH (Tabla 2). La capacidad antioxidante por el método CAT no fue modelizada ya que presentó una evidente falta de ajuste para cualquier modelo seleccionado (valor p de FA < 0,05).
A continuación, se muestran las ecuaciones de los modelos polinomiales seleccionados para cada una de las respuestas:
Extracción de compuestos antioxidantes
En la Figura 1 se muestran las gráficas de superficie de respuesta de cada modelo generado. Los valores máximos y mínimos de cada respuesta se ubican en las regiones de color rojo y azul, respectivamente. En general, se observa que a medida que aumenta la concentración de etanol, disminuyen las respuestas. Se cumple así la regla clásica de "lo similar disuelve lo similar" basada en la solubilidad solvente-soluto. Según esta regla, los solventes más polares tienden a disolver solutos polares, mientras que los solventes no polares tienden a disolver solutos menos polares o no polares debido a la similitud entre sus estructuras químicas (Nutrizio et al., 2020; Haslina y Eva, 2017).
La tendencia cuadrática del DPPH se relaciona con su selectividad hacia compuestos poco polares (Rivas et al., 2017), aun así, concentraciones muy altas de etanol pueden causar que una parte del DPPH coagule y que no reaccione fácilmente con antioxidantes (Karadag et al., 2009). En este caso, se asume que la mayoría de los compuestos antioxidantes extraídos son polares debido a que son más afines a un solvente que contenga 48,44% de etanol.
Con respecto al tiempo de extracción, su efecto positivo sobre el RE se debe a que las ondas del ultrasonido inducen la ruptura de la pared celular del soluto y la transferencia de masa hacia el solvente (Annegowda et al., 2011). Por ello, tiempos prolongados de sonicación inducen mayor liberación de componentes de la matriz, pero no necesariamente de antioxidantes, ya que, el CFT y DPPH disminuyeron a medida que el tiempo aumentaba. Esto puede deberse a la generación de radicales libres altamente reactivos que pueden oxidar y degradar los antioxidantes antes de que sean cuantificados (Annegowda et al., 2011; Chew et al., 2011), o a la polimerización de los mismos (Spigno et al., 2007). Se estima que dentro de los primeros 10 min de sonicación se extrae hasta más del 90% de compuestos antioxidantes (Tao et al., 2014). En este caso, una extracción corta, de 13,83 min, permitió extraer la mayor cantidad de ellos.
Tabla 1 Rendimiento, contenido fenólico total y capacidad antioxidante de los EU
| Etanol (%) | Tiempo (min) | RE (%) | CFT (mg EAG/g EU) | CAT (mg EAG/g EU) | DPPH (%) |
| 48,4382 | 30 | 24,82 ± 0,05 AB | 433,22 ± 25,17 AB | 1807,21 ± 135,54 AB | 74,23 ± 1,10 AB |
| 50 | 15 | 24,45 ± 0,41 ABC | 456,25 ± 1,53 A | 1947,83 ± 101,69 A | 76,35 ± 2,83 A |
| 50 | 45 | 25,17 ± 0,45 A | 412,88 ± 8,36 BC | 1692,75 ± 129,73 BC | 72,25 ± 0,07 BC |
| 70 | 13,8287 | 23,76 ± 0,21 CD | 446,82 ± 5,36 A | 1847,09 ± 126,14 AB | 74,85 ± 1,27 AB |
| 70 | 30 | 23,98 ± 0,55 CD | 415,92 ± 0,84 BC | 1737,76 ± 36,99 BC | 74,18 ± 0,25 AB |
| 70 | 30 | 24,17 ± 0,44 BC | 414,35 ± 0,00 BC | 1737,65 ± 57,90 BC | 72,43 ± 1,11 BC |
| 70 | 46,1713 | 24,22 ± 0,48 BC | 407,85 ± 2,19 C | 1457,94 ± 90,25 DE | 73,19 ± 0,48 BC |
| 90 | 15 | 22,78 ± 0,21 E | 410,12 ± 15,29 C | 1594,20 ± 99,56 CD | 71,64 ± 2,17 C |
| 90 | 45 | 23,31 ± 0,53 DE | 405,71 ± 2,08 C | 1401,64 ± 48,67 E | 65,77 ± 1,21 D |
| 91,5618 | 30 | 22,63 ± 0,69 E | 393,94 ± 2,08 C | 1378,26 ± 92,23 E | 65,13 ± 0,34 D |
Los valores están expresados como media ± desviación estándar (n = 3). Las medias que no comparten una misma letra dentro de cada columna son significativamente diferentes (p < 0,05). Los valores son expresados en base seca. RE: rendimiento, CFT: contenido fenólico total, CAT: capacidad antioxidante total, DPPH: capacidad captadora del radical libre DPPH, mg EAG/g EU: mg equivalente de ácido gálico por g de extracto de ungurahui, mg EAA/g EU: mg equivalente de ácido ascórbico por g de extracto de ungurahui.
Tabla 2 Coeficiente de determinación y falta de ajuste de los modelos polinomiales
| RE (%) | CFT (mg EAG/g EU) | DPPH (%) | |
| Coeficiente de determinación (R2) | 0,9677 | 0,9712 | 0,9256 |
| Falta de ajuste (valor p) | 0,5438 | 0,1423 | 0,5033 |
Validación de los modelos optimizados
De acuerdo con las gráficas de superficie de respuesta, los valores máximos pronosticados para RE, CFT y DPPH se obtuvieron a las condiciones óptimas de extracción de 48,44% de etanol y 13,83 min. Los resultados fueron validados experimentalmente obteniéndose porcentajes de error menores al 5% (Tabla 3), lo que comprueba que los modelos polinomiales propuestos en este estudio pueden predecir la máxima extracción de compuestos antioxidantes del EUL.
Tabla 3 Validación de los modelos polinomiales de superficie de respuesta
| Respuestas | Valores pronosticados | Valores experimentales | Error (%) |
| RE (%) | 24,64 | 24,37 ± 0,25 | 1,08 |
| CFT (mg EAG/g EUL) | 465,72 | 452,76 ± 0,00 | 2,78 |
| DPPH (%) | 76,15 | 74,26 ± 0,09 | 2,48 |
Los valores experimentales están expresados como media ± desviación estándar (n = 3) y son expresados en base seca. mg EAG/g EUL: mg equivalente de ácido gálico por g de extracto de semilla de ungurahui libre.
La extracción de compuestos antioxidantes de fuentes vegetales ha sido motivo de numerosos estudios, así que, a modo de recopilación, en la Tabla 4 se comparan nuestros resultados del proceso de optimización con otros trabajos similares de extracción de compuestos antioxidantes.
Microencapsulación
Análisis de morfología y tamaño de las partículas de EUL y EUM
Mientras que el EUL presentó morfología irregular (Figura 2.a), las partículas del EUM fueron más pequeñas y de tamaño homogéneo (5,05 ± 2,62 µm) (Figura 2.b), tal como se esperaba, ya que, las microcápsulas generalmente miden menos de 10 μm (Saleem et al., 2017) y su tamaño puede proporcionar un sabor homogéneo (Teixeira et al., 2004). No se evidenció grietas ni fisuras en las microcápsulas, lo que implica la preservación de la capacidad antioxidante del EUM, pero la mayoría presentó abolladuras superficiales (Figura 2.c). Morfologías similares de microcápsulas fueron reportadas en otros estudios de secado por aspersión con MD (Cai y Corke, 2000; Díaz et al., 2006).
Tabla 4 Recopilación de trabajos relacionados con la extracción de compuestos antioxidantes de fuentes vegetales
| Fuente vegetal | RE a | CFT b | DPPH c | Referencia bibliográfica |
| Semilla de ungurahui | 24,37 | 452,76 | 74,26 | Elaboración propia |
| Pulpa de ungurahui | 10,50 | 306,60 | - | Rezaire et al., 2014 |
| Pulpa de açai | 10,50 | 368,30 | - | Rezaire et al., 2014 |
| Cáscara de guayaba | 9,88 | - | 70,95 | Khalifa et al., 2016 |
| Semilla de guayaba | 4,54 | - | 62,75 | Khalifa et al., 2016 |
| Hojas de olivo | 2,80 | - | 97,26 | Khalifa et al., 2016 |
| Orujo de uva | 7,92 | 768,56 | - | Braga et al., 2016 |
| Bagazo de mango | 31,07 | 160,25 | - | Braga et al., 2016 |
| Cáscara de granada | - | 40,69 | 86,01 | Sharayei et al., 2019 |
| Cáscara de granada | - | 78,23 | 78,90 | Azarpazhooh et al., 2019 |
| Cáscara de uva | - | 971,85 | - | Kuck y Noreña, 2019 |
| Té negro usado | - | 127,15 | - | Rajapaksha y Shimizu, 2020 |
Resultados expresados como: a g de extracto seco por cada 100 g de polvo de fuente vegetal, b mg equivalente de ácido gálico por g de extracto seco, c porcentaje de capacidad captadora del radical libre DPPH de los extractos.

Figura 2 Morfología de los extractos a diferentes ampliaciones: a) EUL a 500x, b) EUM a 500x, c) EUM a 5000x.
La formación de abolladuras superficiales se atribuye a la pérdida de humedad y consecuente contracción de las partículas durante el secado y enfriamiento (Kusmayadi et al., 2019; Singh y Hathan, 2017) y al uso de polisacáridos como encapsulantes (Mujica-Álvarez et al., 2020), en este caso, la MD.
Determinación del contenido fenólico total y capacidad antioxidante del EUM
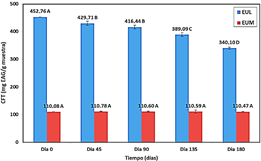
El CFT para el EUM (110,08 mg EAG/g EUM) fue aproximadamente la cuarta parte del EUL (452,76 mg EAG/g EUL ≈ 113,19 mg EAG/0,25 g EUL) debido al efecto de dilución de la MD sobre el contenido fenólico (1 g EUM ≈ 0,25 g EUL + 0,75 g MD), tal como indican Pérez-Serradilla y Luque de Castro (2011), la adición de excipientes produce la dilución del principio activo. Tras la encapsulación, se retuvo 97,25% del CFT y no se observó disminución significativa (p < 0,05) de los antioxidantes por el método DPPH (EUM = 74,59%). Robert et al. (2010) y Kuck y Noreña (2016) también recuperaron más del 90% de compuestos fenólicos al usar MD como encapsulante, ya que, este polímero forma una barrera protectora que retiene a los antioxidantes durante el secado por aspersión (Diaz et al., 2017). Además, se da una rápida evaporación del agua y la formación de una costra que seca las partículas en segundos permitiendo un menor contacto con la temperatura, y evitando así la degradación térmica (Mohammed et al., 2020; Santos et al., 2018).
Estabilidad fenólica del EUL y EUM durante el almacenamiento
La degradación del CFT del EUM tras 180 días de almacenamiento fue no significativa (p > 0,05); mientras que el EUL tuvo una pérdida fenólica de 24,88% (Figura 3). Esto sugiere que los compuestos fenólicos de un extracto no encapsulado en almacenamiento están expuestos a reacciones de autooxidación e hidrólisis que contribuyen con su degradación (Laine et al., 2008). En otros estudios similares encontraron que los extractos encapsulados de los residuos de zarzamora (Laine et al., 2008) y uva (Aizpurua-Olaizola et al., 2016) fueron más estables que los extractos libres después de 6 meses y 64 días de almacenamiento, respectivamente. Por lo tanto, la microencapsulación permitió preservar los compuestos antioxidantes del EUM de las condiciones ambientales adversas durante el almacenamiento.
Conclusiones
La metodología de superficie de respuesta determinó las condiciones óptimas de concentración de etanol (48,44%) y tiempo de extracción (13,83 min) que maximizaron la extracción de compuestos antioxidantes de la semilla de ungurahui. Tras la microencapsulación del extracto óptimo, las microcápsulas presentaron tamaño uniforme, estructura íntegra y conservaron su capacidad antioxidante debido al efecto protector de la maltodextrina, y demostraron tener mayor resistencia fenólica frente a las condiciones ambientales durante 180 días de almacenamiento. Por lo tanto, este estudio ofrece una opción tecnológica para el aprovechamiento de residuos de frutos que contienen sustancias funcionales, como la semilla de ungurahui, cuyo extracto microencapsulado, puede ser aplicado como antioxidante natural en productos alimentarios. Recomendamos evaluar el comportamiento de este producto en matrices alimentarias para incentivar su consumo por las propiedades antioxidantes que lo caracterizan.