Introducción
La ganadería altoandina es una actividad económica muy importante en el Perú, se estima que el 87% de los 824 mil productores agropecuarios se centran en la sierra (MINAGRI, 2017), donde el ganado constituye una fuente de trabajo para el poblador andino; además de proporcionar carne, leche y tracción para el arado, es en muchos casos, el único sustento de la familia debido a que las condiciones ambientales no permiten desarrollar muchos cultivos de pan llevar (Rivas et al., 2007).
La actividad ganadera altoandina se basa en el aprovechamiento de los pastos naturales, cuya disponibilidad varía de acuerdo a la época del año (Delgado et al., 2019). El aumento de las precipitaciones en la época lluviosa da como resultado una mayor disponibilidad de recursos vegetales y agua que son los principales impulsores del éxito reproductivo (Mastromonaco y Gonzalez, 2020); y en la época seca hay una marcada disminución de estos recursos, a los que se suma la disminución de la temperatura, que se sabe, influye de manera similar a la lluvia (Caro et al., 2013).
El ganado que se ha adaptado a estas condiciones a lo largo de los años por selección natural, se denominan vacunos “criollos”, éstos son animales que se han vuelto extremadamente resistentes al clima seco, bajas temperaturas, pastos de baja calidad y enfermedades en general (Zárate et al., 2010). Debido a dichas características, el ganado criollo ha atraído el interés de algunos investigadores como recurso potencial para mejorar la productividad en la zona altoandina; sin embargo, no se cuenta con información necesaria para su mejoramiento, manejo e inserción a la ganadería productiva del país, y por considerarlas poco productivas, los animales criollos están siendo poco a poco sustituidos o absorbidos por otras razas (Hidalgo et al., 2015).
El uso de biotecnologías reproductivas puede contribuir en gran medida a la preservación, uso y difusión de grupos de animales en riesgo como el ganado criollo, por lo que estudios de los procesos fisiológicos que rigen su ciclo reproductivo (ciclo estral) son fundamentales (Mastromonaco y Gonzalez, 2020).
El ciclo estral del ganado vacuno ha sido ampliamente descrito y, en los últimos años, el estudio de la dinámica folicular ha contribuido grandemente a su entendimiento (Komatsu y Masubuchi, 2017). La comprensión actual de la dinámica folicular es la suma de estudios endocrinológicos e histológicos que se apoyan siempre con técnicas ecográficas (Abdelnaby et al., 2020), las variaciones en la dinámica folicular se pueden deber a factores externos como la estación, la alimentación o el manejo, pero también pueden variar por factores internos como la raza (Kojima, 2003).
El entendimiento de estas diferencias resultan de importancia para la aplicación práctica de las biotecnologías reproductivas (Dorneles et al., 2017), sobre todo porque actualmente son escasos los reportes de dinámica folicular de vacas criollas en la zona altoandina del Perú. Por lo tanto, el objetivo fue estudiar la dinámica folicular de vacas criollas bajo condiciones de pastoreo en la época de lluvias y seca.
Materiales y métodos
Lugar de estudio
El trabajo se realizó en el distrito de Carapo, provincia de Huancasancos, departamento de Ayacucho, Perú; a una altitud de 3 320 a 3850 msnm., Latitud:13°83’89’’; Longitud: 74° 31’19’’; temperatura media anual de 11,4 °C y precipitación media anual de 702 mm (SENAMHI, 2017).
Animales
Se utilizaron 15 vacas criollas de entre 4 a 6 años de edad, con una condición corporal de 2,5 a 3 en la escala de 1 a 5, vacías y con ciclo regular previa evaluación ginecológica. No se realizó ningún tipo de sincronización debido a que el objetivo fue estudiar la dinámica folicular de los ciclos estrales espontáneos que el animal presentaba naturalmente en un ambiente altoandino, tanto en la estación lluviosa (enero- marzo) como en la estación seca (julio - setiembre).
Composición del pasto
Se obtuvieron muestras de pasto natural que era consumido por los animales, tanto en la época de lluvias como en la época seca. Las muestras fueron tomadas al azar, por método directo, siguiendo el desplazamiento del animal y simulando el movimiento que éstos realizan al alimentarse (Herrera, 2007).
Tabla 1 Resultados del análisis proximal del pasto natural en la estación lluviosa y seca
| Contenido (%) | Estación lluviosa | Estación seca |
| Humedad | 25,78 | 0,00 |
| Proteína | 14,37 | 11,69 |
| Ext. etéreo | 3,04 | 1,65 |
| Fibra cruda | 24,55 | 40,50 |
| Cenizas | 8,52 | 7,24 |
| Extracto No Nitrogenado | 49,52 | 38,92 |
Las muestras fueron llevadas al el Laboratorio de Bioquímica, Nutrición y Alimentación Animal de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, donde se realizó el análisis proximal para determinar el contenido de humedad, proteína cruda (nitrógeno total), fibra cruda, lípidos, ceniza y extracto libre de nitrógeno (Tabla 1).
Seguimiento ecográfico
Las vacas fueron evaluadas por ecografía transrectal cada 48 horas durante al menos dos ciclos consecutivos por época del año (lluviosa y seca), utilizando un ecógrafo portátil Esaote Tringa Linear Vet ®, con un transductor lineal de 7,5 MHz.
Para realizar la ecografía transrectal se inmovilizó al animal en un brete de manejo, se realizó el lavado de los genitales externos, se procedió a lubricar e insertar la mano enguantada con el transductor. Los ovarios fueron observados minuciosamente en dos planos (latero medial y dorsoventral) tratando de abarcar toda su superficie, de esta manera se obtuvieron al menos 4 imágenes por ovario.
Se registraron las variaciones en el tamaño del cuerpo lúteo y el folículo para cada observación, lo que permitió determinar la tasa de crecimiento restando el tamaño máximo alcanzado menos el tamaño inicial dividido entre los días de persistencia. El perfil de la dinámica folicular de cada animal se determinó recapitulando todos los datos obtenidos en la ecografía de cada folículo observado a partir de 4 mm.
Actividad del cuerpo lúteo
La actividad lútea se evaluó mediante la medición de los niveles de progesterona plasmática para lo cual se tomaron muestras de sangre semanalmente que se obtuvieron por punción en la vena coccígea usando agujas Nº 18 G x 1” en tubos vacutainer sin anticoagulante. Las muestras se mantuvieron refrigeradas, se separó el suero por centrifugación dentro de las 2 horas y se conservaron a -20 ºC hasta su procesamiento.
Las muestras fueron analizadas en el Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, los análisis para la determinación de progesterona plasmática se realizaron mediante la técnica de radioinmunoanálisis (RIA) en fase sólida, usando un antiP4 monoclonal y 125I progesterona como trazador, validados para plasma bovino (Ramirez, 2001).
Se ordenó el ciclo estral de acuerdo a la concentración de P4, las imágenes ultrasonográficas o la observación visual de celo, asumiendo como día 0 de cada ciclo la presentación de celo, el nivel basal de P4 o el día previo a la imagen de ovulación.
Análisis estadístico
Los datos fueron analizados en un diseño completamente al azar (DCA), las diferencias en las variables de respuesta por época fueron evaluadas mediante análisis de varianza (ANOVA) desbalanceado con un nivel de significancia de α = 0,05. Los valores se expresan como media ± desviación estándar (DS) del conjunto de observaciones. Las figuras fueron generadas con el paquete “ggplot2” del programa estadístico R.
Resultados y discusión
Duración del ciclo estral
En la época de lluvias, 2 de 15 vacas fueron evaluadas en 3 ciclos estrales, 7 en 2 ciclos estrales y los 6 restantes fueron evaluadas en un solo ciclo estral completo, haciendo un total de 26 ciclos estrales observados con un promedio de duración de 21,39 ± 1,17 días. En la época seca, 8 de las 15 vacas fueron evaluadas en 2 ciclos estrales y los 7 restantes en un ciclo estral completo, haciendo un total de 23 ciclos estrales observados con un promedio de duración de 22,07 ± 1,04 días (Tabla 2). No hubo diferencia estadística entre épocas del año.
Tabla 2 Duración del ciclo estral y características de la dinámica folicular de vacas criollas al pastoreo en la época de luvias y seca
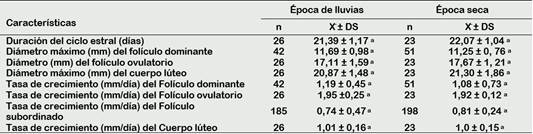
ab Valores con letra diferente en la misma fila difieren significativamente (p < 0,05).
La duración del ciclo estral en ambas épocas se encuentra dentro del rango reportado para la especie, pues la mayoría de los estudios muestran que el 60% a 70% de los Bos taurus presentan un ciclo estral que oscila entre 19 y 23 días (Adams et al., 2008), esto depende de la duración de las ondas y la influencia del cuerpo lúteo; por lo tanto, el proverbial ciclo estral de 21 días del ganado vacuno existe solo como un promedio (Adams y Singh, 2014).
Se han realizado estudios de dinámica folicular en ganado Brown Swiss en condiciones de altura en Perú como el de Quispe et al. (2013), que reporta un promedio de 20,5 ± 2,3 días. Por otro lado, Satheshkumar et al. (2015) realizó estudios sobre la influencia de la estación en vacunos mestizos de Jersey en la India, reportando que la duración del ciclo estral fue mayor en la época calurosa (22,2 ± 0,9 días) que en la fría (20,7 ± 0,4 días).
Desarrollo folicular y de cuerpo lúteo
El diámetro máximo del folículo dominante y el tamaño del folículo ovulatorio no muestran diferencias significativas por época del año (Tabla 2).
El folículo dominante puede llegar a medir de entre 11,2 a 22,2 mm, hasta que una nueva onda se imponga o se den las condiciones para su desarrollo y posterior ovulación (Satheshkumar et al., 2015); sin embargo, también se han reportado diámetros menores los cuales podrían estar asociados a una meseta más corta, lo que contribuiría a aumentar el número de ondas, descrito a profundidad en ganado Bos indicus (Ginther y Hoffman, 2014).
El tamaño del folículo ovulatorio en ambas épocas fue menor al reportado para la especie, que va desde los 18 a 20 mm (Ginther et al., 2016; Adams y Singh, 2014). Las diferencias podrían atribuirse a las características fenotípicas de tamaño y conformación propias del grupo estudiado, pues More (2016) evaluó vacunos criollos de la misma zona, llegando a la conclusión que este grupo de animales presentaba menor altura a la cruz (113,53 ± 1,15 cm), perímetro torácico (157,09 ± 1,03 cm) y longitud corporal (127,56 ± 1,51 cm). Por otro lado, García et al. (2017) asoció las diferencias de tamaño al genotipo bovino en su investigación sobre perfiles de crecimiento folicular en vacas portadoras y no portadoras del gen “Trio”, reportando 14,9 ± 0,4 mm como diámetro mínimo encontrado en un folículo peri ovulatorio en animales que no portaban el gen.
De los 49 folículos ovulatorios observados, 27 (55%) correspondieron al ovario derecho y 22 (45%) al ovario izquierdo. La asimetría en la dinámica del folículo en los ovarios izquierdo y derecho se ha utilizado para dilucidar los mecanismos locales de control de la función ovárica frente a los sistémicos. Algunos autores han informado una mayor actividad folicular y proporción de ovulaciones en el ovario derecho (> 60%), mientras que otros no reportan tales diferencias (Adams y Singh, 2014).
En cuanto al diámetro máximo alcanzado del cuerpo lúteo en ambas épocas (Tabla 2), fueron menores a los reportados por Quispe et al. (2013) de 26,8 mm en los días 10,8 ± 3,7. Por otro lado, nuestros resultados fueron más cercanos al estudio de Satheshkumar et al. (2015) quien hizo estudios de la influencia de la estación natural en la dinámica ovárica de vacas mestizas de la India, reportando diámetros de 22,1 ± 0,4 mm para la época calurosa y 22,6 ± 0,8 mm para la época fría no habiendo diferencia entre épocas.
Tasa de crecimiento folicular y del cuerpo lúteo
La tasa de crecimiento del folículo dominante en ambas épocas (Tabla 2), es muy cercana al reportada por Ginther (2018) de 1,5 ± 0,1 a 1,8 ± 0,1 mm / día, clasificándola como un crecimiento común. Por otro lado, Pérez et al. (2019) estudió tasas de crecimiento del folículo dominante por etapa de lactación en ganado sometido a sincronización de celo en el altiplano peruano, reportando valores que van desde 2,3 ± 1,5 a 2,4 ± 1,8 mm/día.
Gran parte de las variaciones en el crecimiento folicular se deben a factores nutricionales pues existe estrecha relación entre el balance energético y fertilidad (Martins et al., 2019). Aunque los mecanismos bioquímicos son complejos y numerosos, se ha demostrado que el desarrollo de los folículos depende de los factores de crecimiento en una etapa temprana y de su capacidad de respuesta gonadotrópica, esteroidogénica para la proliferación celular en una etapa tardía (Luo et al., 2020). Por lo tanto, los cambios nutricionales actúan directamente sobre el ovario para provocar cambios en los patrones de crecimiento folicular (Armstrong et al., 2001). Sin embargo, al no encontrarse diferencias en la tasa de crecimiento entre épocas, resulta interesante debido a que si existe variación del porcentaje de nutrientes disponibles en el pasto natural que las vacas criollas consumen a lo largo del año (Tabla 1). Un adecuado aporte de nutrientes, sobre todo energéticos, promueven cambios metabólicos plasmáticos como la glucosa y el colesterol (Martins et al., 2019), teniendo en cuenta que los receptores de insulina, factores de crecimiento y precursores esteroideos están ampliamente distribuidos por todo el ovario (Shimizu, 2016), debe haber un delicado equilibrio de contenido en la dieta. En este caso, podríamos suponer que la vaca criolla posee mecanismos aún desconocidos para mantener sus procesos reproductivos regulares, aún en condiciones precarias de alimentación.
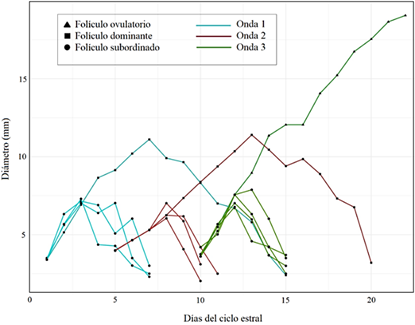
Ondas de crecimiento folicular
Se pudieron observar ciclos con 2 (16%), 3 (78%) y hasta 4 (6%) ondas de crecimiento folicular, presentándose en mayor porcentaje los ciclos con tres ondas foliculares (Figura 1); a diferencia de Quispe et al. (2013), quién reportó ciclos con dos (83,3%), tres (11,1%) y cuatro (5,5%) ondas foliculares.
La mayoría de los ciclos estrales bovinos Bos taurus (> 95%) están compuestos por dos o tres ondas de crecimiento folicular, siendo la presentación de 4 ondas de crecimiento folicular muy reducida (Ginther et al., 2015; Adams y Singh, 2014).
Un aumento en el número de ondas de crecimiento folicular se ha asociado con factores raciales (Moreira et al., 2000), de manejo y nutrición (Zárate et al., 2010). Resaltando con este último, debido a que bajos niveles nutricionales en el alimento conducen a bajas concentraciones del factor de crecimiento insulínico tipo 1 (IGF-I), traduciéndose en una reducción del diámetro y persistencia del folículo dominante de todas las ondas; por lo tanto, los folículos no llegan a diámetros pre ovulatorios y el ciclo se alarga (Aerts y Bols, 2010).
Gomez et al. (2019) y Satheshkumar et al. (2015) manifiestan que existe gran influencia de los diferentes mecanismos hormonales, sobre todo la actividad endocrina lútea, que impulsa el crecimiento y desviación de folículos. Por otro lado, Jaiswal et al. (2009) asoció el dominio de la primera onda con un retraso posterior en el logro del diámetro máximo del folículo dominante de la segunda onda, así como con el inicio temprano de la luteólisis; llegando a la conclusión que los factores que influyen en el desarrollo del folículo dominante de la primera onda son los responsables de regular el patrón de ondas.
Por lo tanto, un estudio minucioso de la interacción de los folículos de una misma onda podría dar mejores luces para aclarar este mecanismo.
Número de folículos observados por onda de crecimiento folicular
El número de folículos observados por onda de crecimiento folicular (Tabla 3) se encuentra dentro del rango reportado por Komatsu y Masubuchi (2017) que es de 5 a 10 para la especie. Sin embargo, en los estudios de Satheshkumar et al. (2015) indica un promedio de 3,9 ± 0,4 folículos en la estación calurosa y 7,0 ± 0,3 para la estación fría. Es necesario tener en cuenta que la observación de folículos puede verse afectada por la técnica de exploración, experticia o calidad del equipo ecográfico que se use.
Tabla 3 Características de la dinámica folicular de vacas criollas al pastoreo por ondas de crecimiento folicular
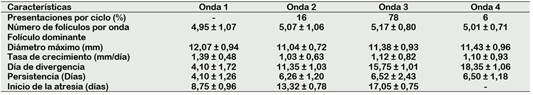
Características del folículo dominante por onda de crecimiento folicular
El diámetro máximo y tasa de crecimiento del folículo dominante de la primera onda es superior a las demás ondas, esto puede estar asociado a su entorno endocrino; pues Miura et al. (2014) sustenta que la menor concentración de progesterona inicial, la concentración de estrógenos en el líquido folicular y el aumento del flujo sanguíneo, contribuyen a una mayor actividad metabólica del mismo. Por otro lado, Ginther et al. (2015) explica que la oleada preovulatoria de la hormona folículo estimulante (FSH) también podría inducir el crecimiento folicular de la onda folicular emergente y disminuir la tasa de crecimiento del siguiente folículo dominante.
En cuanto al día de divergencia, se presentó días después al reportado por Dorneles et al. (2017) que fue de 2,9 días para la primera onda folicular y García et al. (2017) de 3,3 ±0,6 días para la segunda onda folicular.
Las variaciones en el inicio de la divergencia están asociadas a los niveles de estradiol (E2) y la hormona folículo estimulante (FSH), pues la secreción de E2 acelera la divergencia, mientras que un patrón de secreción de FSH con aumentos bruscos de concentración alargan la misma (Gomez et al., 2019). Para efectos de estudios posteriores, es recomendable la medición de las concentraciones de gonadotropinas circulantes, pues la FSH circulante y la divergencia han sido una asociación constante en las especies monovulares.
Actividad del cuerpo lúteo
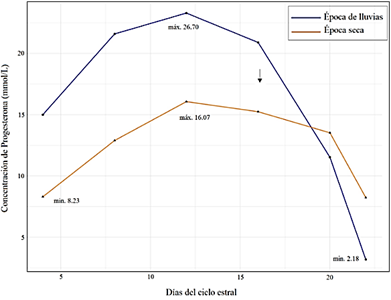
Además del estudio ecográfico, fue necesario medir las concentraciones de progesterona pues los parámetros ecográficos para distinguir un cuerpo lúteo (CL) recién formado de uno ya establecido no son precisos (Perry y Cushman, 2016). El dosaje semanal de progesterona plasmática sirvió como indicador para poder relacionar el crecimiento del cuerpo lúteo con el final del ciclo estral.
En la Figura 2 se observa que la concentración máxima de progesterona en ambas épocas del año se dio entre los días 13 a 16 del ciclo estral y declinó a partir del día 17. También, que los niveles de progesterona plasmática en la época de lluvias son mayores a los de la época seca; sin embargo, ambas siguen un mismo patrón.
En el estudio de Satheshkumar et al. (2015), la concentración de progesterona fue significativamente mayor (17,81 nmol /L) durante la temporada de calor que durante la temporada de frío (13,36 nmol /L), la cual asocia a la presentación de mayor número de ondas debido a que la alta concentración de progesterona durante el ciclo medio del cuerpo lúteo.
Recientemente, Gomez et al. (2020) demostró que elevados niveles de progesterona conducen a una inhibición más temprana del crecimiento del folículo subordinado y aumenta la frecuencia de desviación temprana; sin embargo, la desviación temprana aun no es explicada porque, según este estudio, puede suceder en presencia de concentraciones de FSH y LH elevadas o reducidas. Por su parte, Narváez et al. (2019) precisa que el cuerpo lúteo no tiene influen cia en el número de folículos ni en la calidad de ovocitos, por lo que estudios más precisos de la actividad luteal son necesarios.
Conclusiones
Los animales evaluados, en general, han mostrado que las características de su dinámica folicular están dentro de los parámetros biológicos para la especie, sólo algunas características fueron diferentes. Es necesario resaltar que en dichas características no hubo diferencia entre épocas del año, a pesar de que en la estación seca los nutrientes disponibles en el pasto natural son menores a los de la época lluviosa. Esto supone que el animal criollo tiene potencialidad para un adecuado desempeño reproductivo en ambientes extremos; sin embargo, para entender con mayor profundidad los mecanismos que regulan la dinámica folicular y estacionalidad propiamente dicha, también se debe contemplar estudios de concentraciones de gonadotropinas, del eje hipotalámico-pituitario-gonadal y mejorar los métodos actuales para observar el desarrollo folicular en el ovario.