1. Introducción
Los granos de cacao son fuente de materia prima para la elaboración del chocolate, uno de los commodities agrícola con mayor incremento en consumo de los últimos años. La demanda en cantidad y calidad ha sostenido un aumento en el precio de la almendra fermentada y seca (Intriago et al., 2019; Lara et al., 2016), sin embargo, los requerimientos de calidad son muy altos y demandantes. Uno de los parámetros más importantes de calidad es la concentración de contaminantes y metales pesados, particularmente el cadmio (Cd), que en el caso del cacao parecen ser por naturaleza más altos que con otros cultivos (Llatance et al., 2018; Lara et al., 2016). La Unión Europea, principal destino de las exportaciones de cacao en grano del Perú, ha fijado los límites máximos de Cd en cacao y chocolate en un rango de 0,10 a 0,80 µg g-1 (Meter et al., 2019). El Cd es el metal pesado con más atención porque se transfiere y se acumula en el cuerpo afectando nuestra salud, además de su extremado bajo valor tolerable, que está en el rango de 0,2 - 0,5 ppm para los alimentos terminados, como el caso de granos de cacao (Meter et al., 2019; Arévalo-Gardini et al., 2017; Lara et al., 2016). Arévalo-Gardini et al. (2017) reportó que árboles de cacao en Perú muestran acumulación de Cd tanto en hojas como en granos y representa un problema para las exportaciones de granos de cacao y la industria chocolatera (Assa et al., 2018; Arévalo-Gardini et al., 2017). La presencia de altos niveles de Cd en el cacao cultivado principalmente en las regiones de Amazonas, Piura y Tumbes es una preocupación para los cacaoteros (Arévalo-Gardini et al., 2017). El incumplimiento del reglamento de la Unión Europea está generando consecuencias económicas y sociales importantes para los productores cacaoteros de Perú y países vecinos.
Los microrganismos del suelo constituyen una alternativa amigable para minimizar la absorción de Cd por la planta de cacao desde el suelo. Hongos, bacterias y levaduras habitantes del suelo pueden absorber los metales pesados, ellos utilizan los contaminantes como fuente de nutrientes y energía, convirtiendo en sustancias solubles (Qiu-Yun et al., 2016; Svecova et al., 2006; Xiezhi et al., 2005). Los microrganismos inmovilizan iones metálicos mediante su unión con sus paredes celulares (Vankar et al., 2008; Akhtar et al., 1996), como el caso del hongo Trichoderma que puede absorber Cd (Qiu-Yun et al., 2016; Dugal & Gangawane, 2012). Las especies de Trichoderma se encuentran comúnmente en todos los tipos de suelos y son ampliamente estudiados como agentes antagónicos de fitopatógenos, sin embargo, solo Trichoderma virens, T. asperellum, T. harzianum
y T.simmonsii, han sido reportados con capacidad de absorción de iones de Cd con las paredes celulares del hongo y colonizando dominios que contienen metales tóxicos (Yaghoubian et al., 2019; Hoseinzadeh et al., 2017; Mohsenzadeh & Shahrokhi, 2014; Dixit et al., 2011; Fomina et al., 2003). Las especies mencionadas de Trichoderma y otras pueden explotarse como agentes de biorremediación de campos agrícolas contaminados con Cd, bajo diversas condiciones de pH (Nongmaithem et al., 2016; Vankar & Bajpai, 2008; Fomina et al., 2003). Los estudios son limitados sobre el uso de Trichoderma spp. nativas como agentes biológicos para el manejo de Cd en plantaciones de cacao.
En este contexto, el objetivo del presente estudio fue analizar las especies de Trichoderma nativas del suelo rizosférico de árboles de cacao, con capacidad de remoción y tolerancia a Cd y su potencial uso como agentes de biorremediación.
2. Materiales y métodos
Este estudio fue realizado en el Laboratorio de Fitopatología del Instituto de Investigaciones de la Amazonia Peruana, en Perú (6° 35′ 28″ S, 76° 18′ 47″ W; altitud 330 msnm). Para aislar Trichoderma spp. nativas se colectó suelo rizosférico de árboles de cacao, en parcelas de diez provincias de la región San Martin, Perú (Tabla 1). Las muestras fueron tomadas al azar, haciendo un recorrido en zigzag. De cada muestra se tomó 5 g de suelo y se colocaron en matraces estériles con 95 ml de agua destilada estéril. Se agitaron los matraces con las muestras a 120 rpm durante 30 min y de cada matraz con la muestra se procedió a realizar diluciones seriadas. De la dilución 10-5 se extrajo 1 ml y se inoculó en placas de Petri con medio de cultivo papa dextrosa agar (PDA) + 0,5 g de oxitetraciclina L-1. Las placas fueron incubadas a 25 °C en oscuridad hasta observar el crecimiento de las colonias de Trichoderma (48 -72 horas), posteriormente se sometió a luz artificial para estimular la esporulación de los hongos. Las colonias emergentes se subcultivaron y purificaron individualmente. Los aislamientos de Trichoderma spp. se cultivaron en placas de Petri con medio de cultivo PDA DifcoTM, a 25 ºC durante 5 días (Márquez-Dávila et al., 2020). Se logró aislar un total de 56 cepas de Trichoderma spp., de estas se eligió diez cepas (una cepa representante por provincia) para el estudio de tolerancia y remoción de Cd (Figura 1).
La tolerancia a Cd y capacidad de remoción de 10 cepas de Trichoderma, fue estudiada mediante el ritmo de crecimiento (RC) de las colonias y su efecto de remoción, en condiciones in vitro en medio de cultivo contaminado con Cd.
Para evaluar el RC de las cepas de Trichoderma spp., se preparó PDA DifcoTM con tres concentraciones de Cd (25 ppm, 100 ppm y 250 ppm), a partir de una solución concentrada de 5000 ppm de Cd (Mohsenzadeh & Shahrokhi, 2014). El medio de cultivo PDA + Cd fue ajustado a pH neutro y agitado para homogenizar al contaminante. Posteriormente fue esterilizado en autoclave vertical durante 25 minutos a 121 °C y 15 libras de presión. El medio de cultivo contaminado estéril fue distribuido a placas de Petri de 80 x 15 mm en condiciones asépticas dentro de la cabina de flujo laminar. Se consideró cinco placas por cepa del hongo para cada concentración de Cd y como testigo PDA sin Cd. La siembra de Trichoderma spp., fue mediante un disco de 5 mm de PDA con micelio del hongo. Después de 48 h de incubación en oscuridad a 25 °C, se registró la medida del diámetro de la colonia y con ese dato se calculó el RC, dividiendo el diámetro total de la colonia con el tiempo (Nongmaithem et al., 2016; French & Hebert, 1980). El ensayo in vitro para medir el RC fue repetida dos veces.
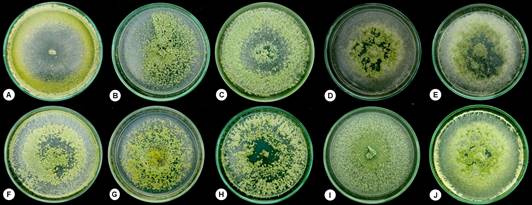
Figura 1 Colonias de las especies de Trichoderma nativas en medio de cultivo PDA a los 8 días de incubación. A) T. harzianum M1P, B) T. koningiopsis M3B, C) T. harzianum M17MC, D) T. spirale M19T, E) T. spirale M25AM, F) T. koningiopsis M33L, G) T. virens M40H, H) T. brevicompactum M43D, I) Trichoderma sp. M52BR y J) T. spirale M55SM.
La remoción de Cd por Trichoderma spp., fue evaluada siguiendo la metodología adaptada de Mohsenzadeh & Shahrokhi (2014) y Hoseinzadeh et al. (2017). Se preparó el medio de cultivo liquido papa dextrosa (PD); 250 g de papa cocida en un recipiente con 1 L de agua destilada durante 20 min, el caldo fue colado en un frasco de vidrio graduado, al caldo se agregó 20 g de dextrosa agitando constantemente. El medio PD fue distribuido a 33 matraces (200 ml por matraz), cada matraz fue contaminado con 5 ppm de Cd. Los matraces con medio contaminado fueron esterilizados en autoclave vertical durante 20 minutos a 121 °C y 15 libras de presión. Cada matraz fue inoculado con cuatro discos de 5 mm de agar con el micelio de Trichoderma spp (tres matraces por cepa) más tres matraces control sin Trichoderma, posteriormente se sometió a incubación en agitación a 150 rpm durante 15 días y a temperatura ambiente del laboratorio 25 °C (±2). Después de la incubación, el micelio fue separado del medio de cultivo por filtrado en algodón estéril dentro de la cabina flujo laminar. Los filtrados fueron sometidos a digestión húmeda en ácido nítrico a 130 °C por 5 h (Güldaş, 2008), la solución digerida se filtró a través de un papel filtro Whatman N° 42 y se diluyó antes del análisis. La concentración final de Cd en el filtrado se determinó usando un espectrofotómetro de absorción atómica (SAA; modelo Varian "Spectra 55B" Hecho en Australia). Para lograr la calidad analítica, se llevaron a cabo tres repeticiones para cada muestra (Arévalo-Gardini et al., 2017). Con la concentración inicial en PD y concentración final de Cd en el filtrado, se calculó el porcentaje de remoción (RCd) por las cepas de Trichoderma spp. (Hoseinzadeh et al., 2017; Mohsenzadeh & Shahrokhi, 2014), según la formula siguiente: R = [(Po - Pe)/Po]*100; dónde R = porcentaje de Cd removido por Trichoderma; Po = concentración inicial de Cd en medio de cultivo (ppm) y Pe = concentración final del Cd en medio de cultivo (ppm).
Todos los datos se registraron en una base de Excel. Antes del análisis de varianza, se realizó la prueba de Shapiro-Wilk (a 0,05) para confirmar la normalidad de los datos. Los datos de RC fueron normales y en el caso de los datos porcentuales, los datos originales se transformaron a log (x + 2) según lo recomendado por Sheskin (2011). Las medias se compararon con la prueba de Scott-knott a un nivel de significancia de 0,05 utilizando el software estadístico R estudio, versión 2015 (R Core Team, 2015).
Tabla 1 Procedencia de las especies de Trichoderma nativas evaluadas
| Trichoderma spp. | Cepa | Procedencia |
| T. harzianum | M1P | Picota, San Martín - Perú |
| T. koningiopsis | M3B | Bellavista, San Martín - Perú |
| T. harzianum | M17MC | Mariscal Cáceres, San Martín - Perú |
| T. spirale | M19T | Tocache, San Martín - Perú |
| T. spirale | M25AM | Moyobamba, San Martín - Perú |
| T. koningiopsis | M33L | Lamas, San Martín - Perú |
| T. virens | M40H | Huallaga, San Martín - Perú |
| T. brevicompactum | M43D | El Dorado, San Martín - Perú |
| Trichoderma sp. | M52BR | Rioja, San Martín - Perú |
| T. spirale | M55SM | San Martín, San Martín - Perú |
3. Resultados y discusión
Las cepas de Trichoderma estudiadas, fueron previamente identificadas mediante marcadores moleculares, según el análisis de secuencias nucleotídicas de las regiones 1 y 2 del espaciador transcrito interno ITS del ADN ribosómico. La secuencia de cada cepa tuvo 99% de similitud, comparada con secuencias depositadas en la base de datos del Genbak (NCBI) (Druzhinina et al., 2005). Los resultados in vitro del efecto de tres concentraciones de Cd (25 ppm, 100 ppm y 250 ppm), sobre el RC como parámetro de tolerancia, muestran sensibilidad de Trichoderma spp. a la presencia de Cd (Figura 2). El incremento de concentración de Cd en placas Petri con PDA reduce significativamente el RC de Trichoderma spp. (25 ppm = 17 , 100 ppm = 42% y 250 ppm = 61%), comprado con el control sin Cd.
La tolerancia de Trichoderma spp. a la presencia a Cd disminuye con el incremento de la concentración (hasta 61% a 250 ppm). Hoseinzadeh et al. (2017) reporta que Trichoderma es sensible a la presencia de Cd, puede tolerar y sobrevivir a una concentración máxima, y dos especies lograron sobrevivir a 200 mg/L de Cd. La tolerancia de cepas de Trichoderma spp. a la presencia de Cd, es un indicador de la influencia sobre la absorción del metal desde el suelo por las plantas de cacao (Meter et al., 2019) y puede desarrollarse como agentes tolerantes al estrés por Cd (Mohsenzadeh & Shahrokhi, 2014). La tolerancia de Trichoderma a un rango de concentraciones de metales pesados fueron estudiadas mediante pruebas in vitro, demostrando que cepas nativas o mutantes de Trichoderma tienen el potencial de tolerar el estrés por metales pesados (Kredics et al., 2001a,2001b). Otro estudio observó menor concentración de Cd, mayor biomasa vegetal y un aumento significativo en la clorofila en plantas de arroz tratada con Trichoderma sp. cepa MT-4 (Nongmaithem et al., 2017).
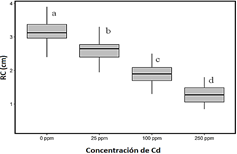
Figura 2 Efecto de concentraciones de cadmio (0, 25, 100 y 250 ppm) sobre el ritmo de crecimiento de Trichoderma spp. en medio de cultivo PDA. Las cajas con letras distintas indican diferencias significativas (p < 0,05).
Se observaron los efectos significativos de las concentraciones de Cd sobre la tolerancia por las especies de Trichoderma (Figura 3). En ausencia de Cd, observamos dos grupos y una cepa diferente según el RC. Primer grupo de crecimiento rápido formados por T. harzianum M1P, T. koningiopsis M3B y Trichoderma sp M52BR. Segundo grupo de crecimiento intermedio formados por T. harzianum M17MC, T. koningiopsis M33L, T. virens M40H y T. spirale cepas M19T, M25AM y M55SM, y de crecimiento lento solo T. brevicompactum M43D.
La tolerancia a Cd por las especies de Trichoderma mostró variabilidad con el incremento de la concentración. Con 25 ppm de Cd, observamos dos grupos, el primero de mayor tolerancia (T. harzianum M17MC, T. spirale M19T y T. koningiopsis M33L) y el segundo por cepas de menor tolerancia. Con 100 ppm de Cd, observamos tres grupos, el primero por cepas de tolerancia alta (T. harzianum M1P, T. koningiopsis M3B, T. harzianum M17MC, T. spirale M25AM, T. koningiopsis M33L y Trichoderma sp. M52BR), segundo de tolerancia media (T. virens M40H y T. spirale cepas M19T y M55SM); y tercero de tolerancia baja (T. brevicompactum M43D). Mientras con 250 ppm de Cd, las cepas de tolerancia alta fueron T. harzianum M1P, T. koningiopsis M3B, T. koningiopsis M33L y Trichoderma sp. M52BR; de tolerancia media T. spirale (M19T y M25AM), y T. virens M40H; y de tolerancia baja T. harzianum M17MC, T. brevicompactum M43D y T. spirale M55SM.
En general T. harzianum M1P y T. koningiopsis M3B tuvieron alta tolerancia a Cd (RC = 2,54 cm y 2,45 cm, respectivamente). Mientras con tolerancia media fueron T. harzianum M17MC, T. koningiopsis M33L y Trichoderma sp. M52BR (RC entre 2,39 cm y 2,33 cm); y de tolerancia baja T. virens M40H, T. spirale cepas M19T, M25AM y M55SM (RC entre 2,25 cm y 2,03 cm); sin embargo, observamos tolerancia muy baja de T. brevicompactum M43D (Figura 4).
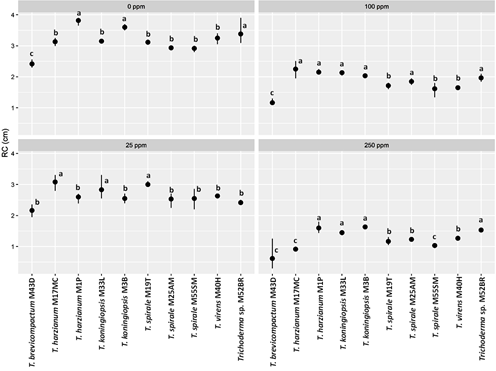
Figura 3 Efecto de concentraciones de Cd en la tolerancia de cepas de Trichoderma spp. Los puntos en las líneas con letras distintas indican diferencias significativas (p < 0,05) entre las cepas de Trichoderma spp.
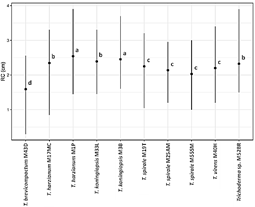
Figura 4 Tolerancia de Trichoderma spp a cadmio. Los puntos en las líneas con letras distintas indican diferencias significativas (p < 0,05).
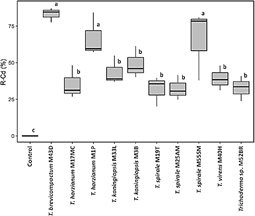
Los resultados muestran una notable capacidad de remoción de Cd por las cepas Trichoderma spp. alcanzando valores de 31,8% a 83,1% comparado con el control medio PD contaminado con Cd sin Trichoderma (Figura 5). Observamos dos grupos cepas de Trichoderma spp según la capacidad de remoción de Cd del medio PD. El primer grupo identificado, corresponde a cepas con porcentajes más altos de remoción de Cd in vitro; T. brevicompactum M43D (83,1%), T. harzianum M1P (67,0%) y T. spirale M55SM (65,8%), estas cepas se constituyen en potenciales candidatos para remoción de Cd. El segundo grupo corresponden a cepas con menores porcentajes de remoción de Cd; T. koningiopsis M3B (49,1%), T. koningiopsis M33L (43,6%), T. virens M40H (39,2%), T. harzianum M17MC (35,4%), Trichoderma sp M52BR (32,7%), T. spirale M25AM (32,3%) y T. spirale M19T (31,8%). Los resultados obtenidos revelan a tres especies de Trichoderma (T. brevicompactum, T. harzianum y T. spirale), como potenciales agentes de biorremediación de Cd y sería el primer reporte para T. brevicompactum M43-D y T. spirale M55-SM con capacidad de remoción Cd.
En este estudio T. brevicompactum M43D alcanzó hasta 83,1% de capacidad de remoción de Cd de medio contaminado, superando a T. asperellum reportados por Mohsenzadeh & Shahrokhi (2014) y Hoseinzadeh et al. (2017) que, bajo condiciones similares de estudio logró absorber Cd hasta 76,17%. Otro estudio reporta a T. brevicompactum QYCD-6 como un hongo intestinal de lombrices de tierra con capacidad de eliminar metales pesados de lugares contaminados, el mecanismo como elimina el metal aún se desconoce (Zhang et al., 2020). T. spirale M55SM con 65,8% de remoción de Cd del medio contaminado, este sería, también el primer reporte para la especie. T. spirale es un hongo con actividad de biocontrol en lechuga contra Corynespora cassiicola yCurvularia aeria causantes de manchas foliares (Baiyee et al., 2019). También observamos que T. harzianum M1P removió el Cd hasta 67,0%, al respecto Hoseinzadeh et al. (2017) concluyeron que T. harzianum pueden sobrevivir a concentraciones máximas de Cd (200 mg/L) y eliminarlo absorbiendo Cd del medio de cultivo con las paredes celulares del hongo durante el período de crecimiento. El análisis del transcriptoma de T. harzianum en presencia de Cd realizado por Oshiquiri et al. (2020), revelan varios genes que codifican NmrA y su papel en la respuesta de cadmio; represión del metabolismo de carbohidratos, especialmente los genes relacionados con el micoparasitismo; y sugieren que la capacidad micoparasitaria de T. harzianum podría verse afectada durante la exposición al Cd.
Este estudio también revela que T. koningiopsis, T. virens y Trichoderma sp con potencial de remoción de Cd, pero en menor proporción. Un estudio relaciona a T. koningiopsis con solubilización de fosforo mediante el empleo diferentes mecanismos en condiciones in vitro (Tandon et al., 2020). Otro estudio relaciona con la resistencia sistémica inducida (ISR) y promoción de crecimiento de plantas de tomate (Simbaqueba et al., 2011). Para el caso de T. virens los estudios lo relacionan con el control biológico de enfermedades de plantas, sin embargo, Frank & Támová (1993) observó que Cd induce mutación sobre el crecimiento y la morfología, cuando dejó crecer al hongo en medio de cultivo contaminado con 10 mM de Cd++, resultando dos mutantes blancos (no formaron conidióforos) y un mutante amarillo (conidios de diferentes colores y tasa de crecimiento más lenta). Dixit et al. (2011) concluye que plantas de tabaco transgénicas que expresan un GST de T. virens son más tolerantes al Cd, sin aumentar su acumulación en la biomasa vegetal. Esta es otra evidencia que T. virens involucra procesos de mutación.
4. Conclusiones
Las especies de Trichoderma evaluadas fueron sensibles a la presencia de Cd, dependientes de la concentración y capaces de remover Cd. Los resultados obtenidos in vitro revelan a T. brevicompactum M43D (83,1 %), T. harzianum M1P (67,0%) y T. spirale M55SM (65,8%), con alta capacidad de remoción de Cd. Mientras a T. harzianum M1P y T. koningiopsis M3B como los más tolerantes. T. brevicompactum M43D y T. spirale M55SM se suman a la lista de especies de Trichoderma como nuevos agentes potenciales de biorremediación de Cd que pueden ser explorados, en nuevos estudios.