1. Introducción
La maca (Lepidium meyeniiWalp.) es un cultivo endémico de los Andes centrales que se cultiva desde el centro de Perú hasta el noroeste de Argentina (Wang, Wang, McNeil, & Harvey, 2007). La alta demanda de alimentos a nivel mundial, especialmente del mercado asiático en el 2012, impulsó en zonas altoandinas de Perú la ampliación de la frontera agrícola hacia zonas de aptitud ganadera (Beharry & Heinrich, 2018). Grandes extensiones de los pastizales altoandinos fueron reemplazadas por monocultivos de gran demanda nutricional y funcional como la maca. Este comportamiento del mercado internacional ha conllevado que los agricultores reduzcan drásticamente los periodos de descanso de los suelos de cultivo de siete o más años a sólo un año o cero años de descanso.
El cambio e intensificación de uso del suelo ha dado lugar al empobrecimiento de los suelos con pérdida significativa de nutrientes (Yitbarek, 2013), afectación de los microorganismos del suelo (Khodadad, Zimmerman, Green, Uthandi, & Foster, 2011) y la actividad en la que participan, como los procesos del ciclo de nutrientes, el secuestro de carbono, la descomposición de la materia orgánica y la estabilidad de los suelos (Hernández-León, Velázquez-Sepúlveda, Orozco-Mosqueda, & Santoyo, 2010; Varma & Gaur, 2007; Amundson et al., 2015).
Las comunidades microbianas del suelo en mesetas altoandinas son tan diversas como las que se encuentran en otros biomas terrestres a pesar de las duras condiciones ambientales. Es probable que la diversidad microbiana del suelo en las mesetas altoandinas esté impulsada principalmente por la disponibilidad de N en sus variadas formas (Shen, Ni, Liang, Wang, & Chu, 2015) y ser determinante en el ciclo del N. La diversidad microbiana puede aumentar la eficiencia del reciclaje de nutrientes a través de una mayor intensidad en la explotación de compuestos orgánicos. Koyama, Wallenstein, Simpson, & Moore (2014) refieren que la disponibilidad de N influye en la estructura de la comunidad microbiana. Los niveles de N fácilmente disponible (NH4 +, NO3 -, urea) aumentados a través de la fertilización pueden favorecer la dominancia de unos taxones sobre otros, lo que resulta en una composición comunitaria menos uniforme (Lanzen et al., 2016).
Estudios previos sobre los cambios en las propiedades físicas, químicas y biológicas del suelo por el cambio de uso de suelo y la intensificación de uso revelan el deterioro de la materia orgánica y la reducción de la capacidad de intercambio catiónico (Sánchez-Marañón et al., 2017; Ramírez, Fuentes-Alburquenque, Díez, Vargas, & Bonilla, 2020). Estos efectos reducen el estado de fertilidad de los suelos e influyen en la estructura bacteriana. Hasta la fecha, los estudios sobre las bacterias del suelo se han centrado en ecosistemas agrícolas de cultivos diferentes a este estudio y en sistemas de cultivo continuo de maca en regiones de China situados a 3000 m de altitud (Wang, Dong, Luo, Jia, & Qu, 2020). Sin embargo, en los Andes Centrales de Perú hay una falta de conocimiento sobre las bacterias dominantes y ubicuas en suelos de cultivo de maca bajo diferente gradiente de uso a más 4000 m de altitud. Esta incertidumbre a dado lugar a datos limitados sobre este tipo de ecosistema agrícola. Por lo tanto, es fundamental identificar los filotipos bacterianos dominantes en suelos bajo presión de uso de cultivo de maca en esta región altoandina para aumentar la comprensión del comportamiento de las comunidades bacterianas. El objetivo del estudio fue analizar la composición bacteriana de suelos de cultivo de maca (Lepidium meyenii Walp) en los Andes centrales del Perú.
2. Materiales y métodos
2.1 Descripción del área de estudio
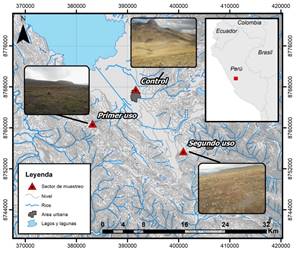
El área de estudio se localiza en la meseta de Bombón en los Andes Centrales del Perú, en límites circundantes a la Reserva Nacional de Junín, entre las latitudes: 10° 34̍ S - 13° 35̍ S y longitudes: 73° 55̍ W - 76° 40̍ W, a una altitud de 4080 y 4125 m.s.n.m. Se caracteriza por presentar temperaturas que oscilan entre los 3 y 7 °C en los meses de mayo a setiembre (época de estiaje) y aumentando en los meses noviembre a marzo con una precipitación anual de 940 mm (época lluviosa). Este lugar corresponde a la zona de vida páramo andino muy húmedo subalpino tropical (Caro, Sánchez, Quinteros, & Castañeda, 2014).
La definición de los sectores de muestreo se realizó en base a los factores de presión de uso del suelo (Figura 1). La presión de uso del suelo se refiere al número de veces que fueron usados los suelos para el cultivo de maca. La presión de uso estuvo conformada por los niveles suelo control (suelo natural), suelos con primer uso y segundo uso para el cultivo de maca (391597E, 8767516S; 383174E, 8760821S y 400918E, 8755400S, respectivamente).
2.2 Recolección y almacenamiento de muestras de suelo
La recolección de las muestras de suelo se realizó en tres sectores de muestreo. En cada sector se establecieron tres sitios de muestreo y de cada uno de estos sitios se colectaron cinco muestras de suelo de aproximadamente 250 g mediante un muestreador tipo taladro de los 20 cm de profundidad (Dungait et al., 2013).
Las muestras obtenidas de cada sitio de muestreo se homogeneizaron para conformar una muestra compuesta de 500 g de suelo. Finalmente, las muestras compuestas fueron transportadas en un cooler en refrigeración y posteriormente almacenadas en una congeladora de -50 °C.
2.3 Determinación de los indicadores fisicoquímicos del suelo
La materia orgánica del suelo se determinó a partir del carbono orgánico mediante el método analítico de Walkley-Black (Yaranga-Cano & Custodio, 2013), que consistió en la oxidación húmeda del carbono por medio del dicromato de potasio en presencia de ácido sulfúrico concentrado. El pH del suelo se determinó en un extracto acuoso de suelo: agua, en proporción de 1:5 (v/v). El nitrógeno total del suelo se determinó mediante el método Kjeldahl (Bremner, 1960). El fósforo total del suelo se midió por colorimetría.
2.4 Extracción, amplificación y secuenciación del ADN bacteriano del suelo
El ADN fue extraído de 0,5 g de muestra de suelo por el método de CTAB (Doyle, 1997). Inmediatamente, a partir de 50 ng de ADN extraído se amplificó por duplicado apuntando a la región hipervariable V3-V4 del gen del ARNr 16S en bacterias (Bernhard, Colbert, McManus, & Field, 2005; Daniel, 2005; Janssen, 2006;Sun, Zhang, Guo, Wang, & Chu, 2015). La PCR se realizó con secuencias de cebadores de longitud completa, utilizando la nomenclatura de nucleótidos estándar de la IUPAC (Forward Primer: 5'‒ TCGTCGGCAGCGTCAGATGTGT ATAAGAGACAGCCTACGGGNGGCWGCAG ‒3';
Reverse Primer: 5'‒ GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACH VGGGTATCTAATCC ‒3'). La PCR se realizó considerando las siguientes condiciones: desnaturalización inicial a 95 ° C durante 5 min, seguida de 25 ciclos que consisten en desnaturalización (95 °C durante 40 s), hibridación (2 min) y extensión (72 °C durante 1 min) y un paso de extensión final a 72 °C durante 7 min. La temperatura de recocido para el par de cebadores se fijó en 55 °C. Los productos de PCR se purificaron con un kit de purificación de PCR QiaQuick (QIAGEN, Hilden, Alemania). La cantidad y calidad del ADN se analizaron por espectrofotometría a través de un espectrofotómetro ND-1000 (NanoDrop Technologies, Wilmington, DE) y por electroforesis en gel de agarosa. Los productos de la PCR se almacenaron a -20 °C para su secuenciación. La construcción y secuen-ciación de la biblioteca se realizó comercialmente (GenLab del Perú SAC Tecnología para la vida).
2.5 Análisis de datos
Las secuencias en bruto de todas las muestras de suelo se procesaron utilizando diversas herramientas informáticas en la plataforma Galaxy (Giardine et al., 2005; Wu et al., 2012; Suleiman, Manoeli, Boldo, Pereira, & Roesch, 2013). Las lecturas con más del 2% de ambigüedad y no alineadas no se consideraron en el análisis. Las lecturas pareadas fueron asignadas en base a sus códigos de barras únicos. Las secuencias fueron analizadas usando el paquete de software QIIME (Quantitative Insights Into Microbial Ecology, versión 1.8.0).
La prueba de Kruskal-Wallis fue aplicada para evaluar las diferencias de las características fisicoquímicas de los suelos de forma independiente en una única variable continua no distribuida normalmente (Kruskal & Wallis, 1952). El análisis de asociación entre las variables fisicoquímicas de los suelos se realizó a través de la correlación de rango de Spearman que varía de -1 a +1 (ausencia de asociación ρ = 0; relación monótona perfecta ρ = -1 o +1) (Schober & Schwarte, 2018). El análisis de componentes principales (PCA) de las características fisicoquímicas de los suelos se realizó para reducir el número de variables independientes y resolver los problemas de multicolinealidad. También se realizó una rotación VARIMAX para mejorar la interpretabilidad de los componentes no correlacionados (Gottfried, Harmon, De Lucia, & Miziolek, 2009). Todas las cargas significativas (es decir, cargas > 0,40) se incluyeron en la interpretación de los componentes principales (PC) (Govaerts, Sayre, Lichter, Dendooven, & Deckers, 2007).
El análisis de porcentajes de similitud (SIMPER) se realizó para determinar la contribución de las familias de bacterias del suelo a la disimilitud promedio (Clarke & Warwick, 1994; Gioria & Osborne, 2010). El porcentaje de similitud general entre los grupos varía entre 0 y 100, en donde 100 expresa la máxima similitud. El análisis de redundancia (RDA) se utilizó para dilucidar las relaciones entre las propiedades químicas básicas del suelo y las familias bacterianas (Liu et al., 2017) y fue calculado mediante el software Canoco versión 5.
3. Resultados y discusión
3.1 Caracterización fisicoquímica de suelos presionados por cultivos de Lepidium meyenii
La Tabla 1 muestra las concentraciones de los indicadores fisicoquímicos de calidad de suelo según presión de uso para el cultivo de maca (Lepidium meyenii Walp) en la meseta Bombón en los Andes centrales de Perú. Los contrastes se hicieron en relación a un sector control (sin perturbación antropogénica) y dos sectores con dos tipos de presión de uso. Un tipo de presión representado por suelos con un primer uso (siembra de maca, una vez) y el otro tipo de presión representado por suelos con segundo uso (siembra de maca, dos veces). En el sector control, el pH varió de 7,05 a 7,51, con una media de 7,28 y una desviación estándar (DE) de 0,23. Mientras que, en los sectores con presión de uso el pH disminuyó a valores de 4,53 revelando la acidificación de los suelos por efecto del cultivo. Este comportamiento se debería a una mayor absorción de los cationes por la planta (Berthrong, Jobbágy, & Jackson, 2009), intensificando la escasez de algunos elementos nutritivos esenciales para las plantas de la próxima siembra. El cambio en el pH del suelo puede alterar los procesos biogeoquímicos del suelo y producir efectos en cascada sobre la estructura y funcionamiento del ecosistema terrestre (Rivest, Lorente, Olivier, & Messier, 2013; Hong et al., 2018).
La conductividad eléctrica (CE) en el suelo control varió de 0,06 a 0,09 dS m‒1 con una media de 0,07 dS m‒1, mostrando menores concentraciones de sales solubles. Sin embargo, la concentración de sales aumenta a medida que aumenta la presión de uso del suelo por cultivo de maca, registrándose valores máximos de 0,43 y 0,47 en suelos de primer y segundo uso, respectivamente. El contenido más alto de materia orgánica (MO) se registraron en los suelos control (10,26 %) disminuyendo con la presión de uso del suelo (5,40 %, en el segundo uso del suelo). Estos resultados son respaldados por estudios que refieren que la intensificación de la agricultura y el cambio de uso del suelo natural a suelo de cultivo se ve agravado por prácticas agrícolas con bajo rendimiento de materia orgánica (Trivedi, Delgado-Baquerizo, Anderson, & Singh, 2016; Wang, Huang, Hu, & Zhang, 2020). Las concentraciones más bajas de fósforo y potasio (19,67 ppm y 130 ppm, respectivamente) se registraron en suelos de segundo uso. Similares comportamientos presentaron las concentraciones de nitrógeno (0,27 ppm) y calcio (6,14 ppm).
Los valores medios del pH revelan la tendencia a acidificar los suelos; tal como se observa en los suelos con presión de uso (Figura 2), y la prueba de Kruskal Wallis a un nivel de significancia de 0,05 corrobora los resultados obtenidos. La CE en los dos niveles de presión de uso muestra que estadísticamente son similares. Sin embargo, el sector control es estadísticamente diferente a ambos (p < 0,05). Además, la prueba de Kruskal Wallis indicó que los suelos control son significativamente superiores en concentración a los suelos con presión de uso, especialmente a los suelos con segundo uso (p < 0,05).
Respecto a los nutrientes esenciales como el P, K y N, sólo el primero tiende a disminuir significativamente sus concentraciones por efecto de la presión de uso para el cultivo de maca. Para el caso del K la prueba indica que los suelos control y con presión de uso son estadísticamente similares (p > 0,05). En el N la presión de uso influyó en los valores medios registrados con valores significativamente superiores en los sitios control y similares en los sitios con distinta presión de uso. El Ca mostró tendencia similar ya que a partir del cambio de uso de los suelos las concentraciones se mantienen estadísticamente iguales.
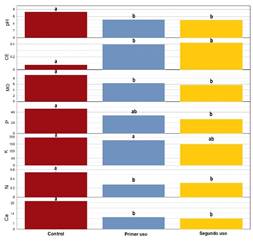
Figura 2 Prueba de Kruskal Wallis para los indicadores fisicoquímicos del suelo según el factor de presión de uso. Las etiquetas diferentes (a, b) son significativamente diferentes. La etiqueta ab denota que no hay diferencias significativas (p > 0,05).
La rho de Spearman para todos los indicadores fisicoquímicos del suelo muestra que, a un nivel de significancia de 0,05, el pH se correlaciona significativamente con CE, MO, P y K. La correlación negativa de CE con pH se debería a la saturación de sales y la correlación positiva con MO, P y K muestra una equivalencia a suelos saludables con valores neutros para el primero o mayores para los elementos esenciales. La CE como indicador de pobreza de suelo queda denotado en el análisis de correlación ya que su correspondencia negativa significativa (p < 0,05) indica que, a mayores valores de CE, las concentraciones de MO, P, K y Ca disminuyen. Además, la MO se correlaciona positiva y significativamente (p < 0,05) con el P, K y pH. El K mostró correlación positiva significativa con pH, MO y P, teniendo correlación negativa significativa con CE. Mientras que, el Ca se correlacionó negativa y significativamente con CE y positivamente con K y N (Tabla 2).
Tabla 1. Valores medios y desviación estándar de los indicadores fisicoquímicos de calidad de suelo según presión de uso para cultivo de Lepidium meyenii
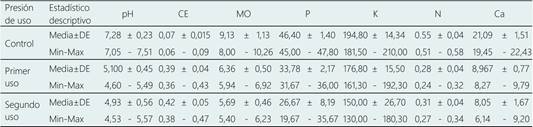
Tabla 2. Correlación de los indicadores de calidad del suelo. Estadísticas de la correlación de Spearman de las variables fisicoquímicas del suelo
| rho \ p value | pH | CE | MO | P | K | N | Ca |
| pH | 0,025 | 0 | 0,003 | 0,003 | 0,162 | 0,068 | |
| CE | -0,750 | 0,014 | 0,049 | 0,031 | 0,086 | 0,022 | |
| MO | 0,933 | -0,783 | 0,008 | 0,001 | 0,133 | 0,063 | |
| P | 0,867 | -0,683 | 0,817 | 0,006 | 0,336 | 0,077 | |
| K | 0,867 | -0,733 | 0,900 | 0,850 | 0,336 | 0,037 | |
| N | 0,517 | -0,600 | 0,550 | 0,367 | 0,367 | 0,024 | |
| Ca | 0,644 | -0,762 | 0,653 | 0,628 | 0,711 | 0,753 |
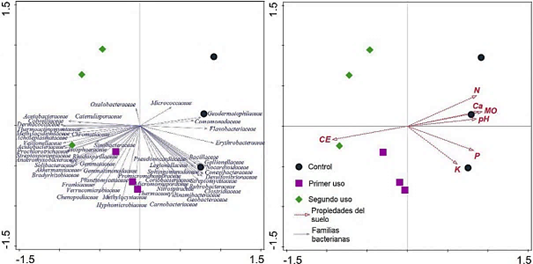
El ACP muestra la carga para la matriz de componentes rotados, los valores propios de cada componente, el porcentaje acumulado de la varianza explicada por cada componente y los puntajes para la distribución de las muestras por cada componente principal (Tabla 3). Los dos primeros componentes principales representaron el 97,1% de la varianza total en el conjunto de datos, representando el primer componente principal el 82,32% y el segundo el 13,87% de la varianza total. Dado que el valor propio del primer componente es significativamente superior a los demás, fue usado para evaluar el comportamiento de los indicadores fisicoquímicos del suelo por efecto del cambio de uso del suelo por cultivo de maca. Las cargas de las variables indicaron que los valores de pH y MO presentaron cargas positivas (0,40 a 0,70) y los valores de CE cargas negativas (-0,40 a -0,70) para el primer componente principal. En el segundo componente principal, el P y K mostraron una distribución positiva y el N una distribución negativa. Estas distribuciones revelan que las áreas con mayores puntuaciones positivas para el primer componente son las de los suelos control. Las cargas del primer componente en estos suelos muestran altos valores de pH y MO, y bajos valores de CE. Mientras que los suelos con primer y segundo uso para el cultivo de maca tienden a tener puntuaciones negativas, con altos valores de CE.
Tabla 3. Análisis de componentes principales (normalización Varimax) para determinar los indicadores fisicoquímicos de suelo de cultivo de maca bajo diferentes niveles de presión de uso
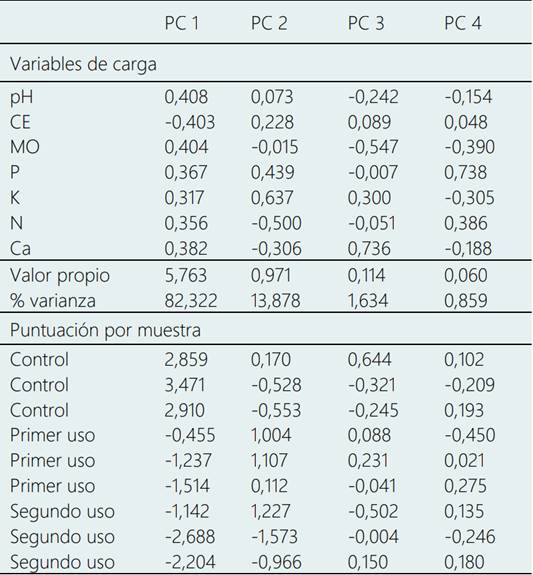
El segundo componente tiene valores propios bajos y un similar porcentaje de variación explicada, que denota las pequeñas diferencias con tendencia significativa. Estos resultados son respaldados por Wang et al. (2020) quienes encontraron que los contenidos de MO del suelo, N total, P total y K total disminuyeron significativamente con el aumento de los años de cultivo continuo de maca.
3.2 Composición bacteriana de suelos presionados por cultivos de Lepidium meyenii
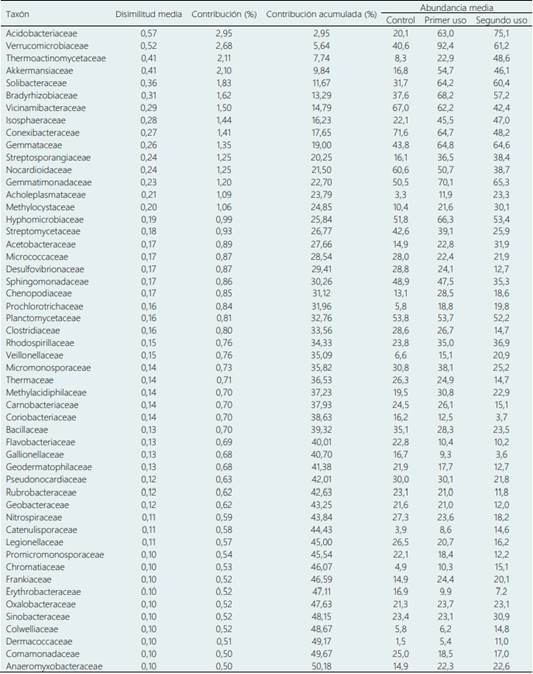
La Tabla 4 muestra el análisis del porcentaje de similitud (SIMPER) de las familias de bacterias encontradas en los suelos evaluados según la presión de uso por cultivos de maca. El análisis a un 50% de representatividad, a nivel de familia mostró que los mayores porcentajes de contribución lo realizaron las bacterias de las familias Acidobacteriaceae (2,95%), seguidas de las de Verrucomicrobiaceae (2,68%), Thermoactinomycetaceae (2,11%) y Akkermansiaceae (2,10%) contribuyendo con el 9,84%. En suelos control las familias más abundantes fueron Conexibacteraceae, Vicinamibacteraceae, Nocardioidaceae, Planctomycetaceae y Hyphomicrobiaceae. En suelos de primer uso predominaron las familias Verrucomicrobiaceae, Gemmatimonadaceae, Bradyrhizobiaceae, Hyphomicrobiaceae, Conexibacteraceae, Gemmataceae, Solibacteraceae y Acidobacteriaceae. En suelos de segundo uso las familias más representativas por su abundancia fueron Acidobacteriaceae, Gemmatimonadaceae, Gemmataceae, Verrucomicrobiaceae, Solibacteraceae y Bradyrhizobiaceae.
Las familias Verrucomicrobiaceae, Thermoactinomycetaceae y Akkermansiaceae presentaron porcentajes de contribución de 2,68, 2,11 y 2,10, respectivamente. Según las medias de abundancia estas familias bacterianas pueden ser usadas como indicadores de mala calidad fisicoquímica del suelo; ya que su abundancia aumenta a mayor número de uso del suelo. Mientras que las familias Conexibacteraceae, Vicinamibacteraceae y Nocardioidaceae tienden a ser indicadores de buena calidad de suelo ya que, a mayor presión de uso se reduce su abundancia. La posible explicación de la reducción de la población bacteriana de estas familias podría atribuirse al hecho de que no pudieron adaptarse a los cambios de pH del suelo (Wang et al., 2017). Otras familias importantes por su resiliencia a la presión de uso son Planctomycetaceae y Hyphomicrobiaceae. En términos generales, los grupos principales en las comunidades de los suelos estudiados fueron Acidobacterias, Actinobacterias, Proteobacterias, Bacteroidetes y Firmicutes que representaron más del 90% de las secuencias en los suelos estudiados.
Tabla 4 Media de abundancia y porcentaje de contribución de familias bacterianas en suelos de cultivos de maca, según el análisis SIMPER
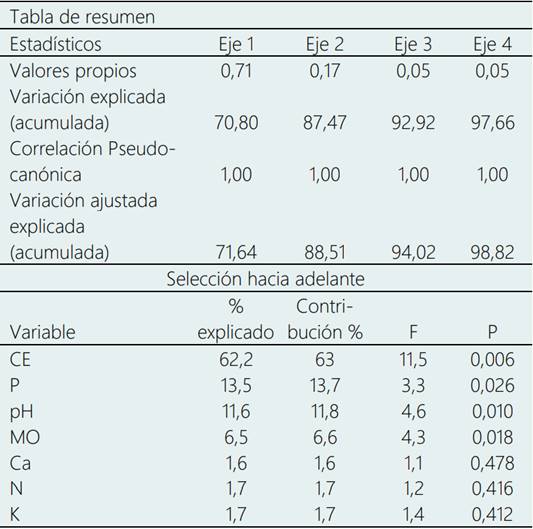
En el análisis de redundancia (RDA) entre los indicadores fisicoquímicos y las familias bacterianas del suelo se encontró que la similitud en la distribución de las muestras tenía una tendencia de ajuste de 90,6%, indicando una buena asociación entre ambas variables lo que podría explicar la distribución de las familias en función de los indicadores fisicoquímicos del suelo (Tabla 5). En la Figura 3, de ordenación del RDA, los ángulos entre las variables de respuesta de azul (familias bacterianas) y explicativas de rojo (indicadores fisicoquímicos del suelo). Los resultados revelan una correlación significativa entre la variable respuesta y las variables explicativas (CE, P, pH y MO), con una variación explicada ajustada de 71,64% para el primer y principal eje. Todas las familias bacterianas afines a los suelos perturbados tienen mayor afinidad a desarrollarse en suelos con mayores concentraciones de sales (correlación negativa). Mientras que las familias análogas a los suelos control tienden a desarrollarse mejor en suelos con mayores concentraciones de P, valores neutros de pH y alrededor del 10% en MO en zonas altoandinas, especialmente.
Tabla 5 Análisis de redundancia entre los indicadores fisicoquímicos y las familias bacterianas del suelo
Este estudio revela que suelos bajo presión de uso por cultivo de maca muestran cambios sustanciales en la composición química de los suelos con repercusión en la estructura de las comunidades bacterianas, revelando como mejores predictores a la CE, P, pH y MO. Estos resultados son respaldados por estudios que indican que la composición química de los suelos influye en la estructura de las comunidades microbianas (Landesman, Nelson, & Fitzpatrick, 2014; Pan et al., 2014; Wang et al., 2020). Así como, por estudios que refieren que la abundancia y composición de las comunidades bacterianas están fuertemente influenciadas por los cambios en el pH del suelo (Lauber, Hamady, Knight, & Fierer, 2009; Pan et al., 2014; Jia & Walhen, 2020). Esta influencia del pH del suelo en la composición de las comunidades bacterianas fue evidente a nivel de familias bacterianas en los suelos estudiados.
Las comunidades bacterianas de suelos de primer y segundo uso por el cultivo de maca experimentaron cambios consistentes al disminuir el pH y los nutrientes (por ejemplo, Acidobacteriaceae, Verrucomicrobiaceae, Thermoactinomycetaceae y Akkermansiaceae). Es importante indicar que, aunque los phyla bacterianas son filogenética diversas, esta diversidad estaría también influenciada por las diferencias metabólicas o por la plasticidad fisiológica entre los phyla que permiten el dominio de un phylum sobre otro (Fierer et al., 2012; Shade et al., 2012; Leff et al., 2015). Estas observaciones son consistentes y respaldadas por otros estudios que encontraron una disminución significativa de la biomasa microbiana (bacteriana y fúngica) en suelos ácidos (Nacke et al., 2011). Sin embargo, en contraste con los resultados encontrados en este estudio, Rousk et al. (2010) al relacionar el pH del suelo y la composición de la comunidad bacteriana encontraron que en suelos con pH alto la abundancia relativa de las Acidobacterias disminuye, pero, aumenta la abundancia de las Proteobacterias. La influencia del pH en la composición de la comunidad bacteriana encontrada en suelos de maca se debería a los estrechos rangos de pH para el crecimiento bacteriano óptimo. Además, las interacciones bacterianas con su entorno siguen siendo complejas.
4. Conclusiones
Este estudio se ha enfocado principalmente en los efectos de la presión de uso del suelo por el cultivo de maca en la composición de las comunidades bacterianas. El análisis metagenómico ha permitido identificar a familias bacterianas que pueden ser usadas como indicadores de calidad fisicoquímica del suelo según la presión de uso por cultivos de maca. Las familias Verrucomicrobiaceae, Thermoactinomycetaceae y Akkermansiaceae pueden ser usadas como indicadores de mala calidad fisicoquímica del suelo; ya que su abundancia aumenta a mayor número de uso del suelo. Mientras que las familias Conexibacteraceae, Vicinamibacteraceae y Nocardioidaceae tienden a ser indicadores de buena calidad de suelo ya que, a mayor presión de uso se reduce su abundancia. Otras familias importantes por su resiliencia a la presión de uso son Planctomycetaceae y Hyphomicrobiaceae. La CE, el P, pH y la MO del suelo fueron los mejores predictores de los cambios de la composición de las comunidades bacterianas. Por lo tanto, para mantener la calidad del suelo y las comunidades microbianas el cultivo de maca no debe exceder los dos años de cultivo continuo.