1. Introducción
Las películas comestibles son materiales que proporcio nan reemplazo y/o fortificación de las capas naturales del alimento para evitar pérdidas de humedad, permitiendo a su vez el intercambio controlado selectivo de los gases importantes, como el oxígeno y el dióxido de carbono. También pueden proporcionar la esterilidad de la super ficie y evitar la pérdida de componentes importantes (Pavlath & Orts, 2009) y se elaboran a partir de diversos polímeros presentes en la naturaleza como las proteínas, polisacáridos, lípidos, etc. La gelatina se obtiene a partir de la proteína fibrosa insoluble llamada colágeno consti tuyente de la piel, tendón y tejido conectivo. El colágeno está formado por tres cadenas polipeptídicas de igual ta maño cada una de las cuales es una hélice levógira, y las tres se enrollan para formar una triple hélice dextrógira con tres residuos de aminoácidos por vuelta (Teijón, 2017). El colágeno debe ser pre-tratado químicamente antes de que pueda ser convertido a una forma adecuada para la extracción, que se realiza por calentamiento en agua a temperaturas mayores de 45 °C, lo cual desestabilizará la hélice a espiral y conversión a gelatina soluble (Karim & Bhat, 2009). La gelatina tiene una amplia gama de funcio nalidades y aplicaciones, siendo una de ellas la capacidad de formación de películas lo cual permite su utilización como portadoras de una gama de aditivos alimentarios, incluidos agentes anti oscurecimiento y antimicrobianos, colorantes, sabores, nutrientes y especias (Pavlath & Orts, 2009). Las películas comestibles a partir de gelatina de piel de pescado se están estudiando ampliamente para su uti lización como materiales alternativos al plástico, pues la proteína colagénica tiene buena capacidad de formación de película (Nilsuwan, Benjakul, & Prodpran, 2016); tal como se ha demostrado en diversos estudios realizados por Fan, Dumont, & Simpson (2020).
Entre los años 2010 - 2014 la pesquería peruana de mahi-mahi ha representado el 50% de la captura total a nivel mundial (Amorós, Gozzer, Melgar, & Rovegno, 2017). El procesamiento primario de esta especie está en creci miento debido a una mayor demanda interna y externa, siendo la captura total de 47,711 t en el año 2018 y genera alrededor del 12% en pieles (Barriga et al., 2012), que no tienen una adecuada gestión debido a la ausencia de políticas ambientales causando daños a los ecosistemas terrestres y marinos.
La piel de mahi-mahi posee características de fuerza y resistencia, lo cual se relaciona con altos valores de fuerza de gel de la gelatina extraída bajo condiciones de optimización (Romero, 2016), lo cual lo convierte en una materia prima interesante para la obtención de películas comestibles con buenas propiedades fisicoquímicas, estructurales y de superficie. Por otro lado, muchos estudios han demostrado que las hierbas de la familia Lamiacea tienen potentes actividades antioxidantes y antimicrobianas, debido a la cantidad y calidad de compuestos fenólicos presentes en ellos (Kozlowska, Laudy, Przybył, Ziarno, & Majewska, 2015). El orégano es una hierba aromática perteneciente a esta familia y se ha demostrado que es una especie rica en constituyentes fenólicos (Teixeira et al., 2013). De acuerdo con Coccimiglio, Alipour, Jiang, Gottardo, & Suntres (2016) el extracto etanólico de Origanum vulgare posee actividad antimicrobiana, antioxidante y citotóxica. Diversos extractos de plantas se han incorporado a las formulaciones de películas de gelatina para incorporar sus propiedades antioxidantes y/o antimicrobianas como los extractos de murta en películas de gelatina de piel de atún (Gómez-Guillén, Ihl, Bifani, Silva, & Montero, 2007), extractos de orégano y romero en películas de gelatinas de piel de bovino y de piel de atún (Gómez-Estaca, Bravo, Gómez-Guillén, Alemán, & Montero, 2009), extractos de canela, clavo de olor y anís en películas de gelatina de piel de calamar (Hoque, Benjakul, & Prodpran, 2011).
La incorporación de aditivos de naturaleza apolar modifica las propiedades fisicoquímicas y estructurales de las películas, característica importante que influye en su funcionalidad como material de empaque (Syahida, Fitry, Zuriyatib, & Nur Hanani, 2020). Por ello, el objetivo del presente estudio fue evaluar los cambios en las propiedades fisicoquímicas, antimicrobianas, estructurales y de superficies de las películas elaboradas con gelatina de piel de mahi-mahi respecto a la incorporación de cuatro concentraciones de extracto de orégano.
2. Materiales y métodos
2.1. Formulación de las películas comestibles
Las películas comestibles fueron formuladas y preparadas por el método casting siguiendo la metodología de Gómez-Estaca et al. (2009) con algunas modificaciones. Las soluciones formadoras de película (SFP) se prepararon a partir de gelatina extraída de piel de mahi-mahi en polvo a una concentración de gelatina de 4% (p/v) obtenida bajo condiciones óptimas. La gelatina fue disuelta en agua destilada a 60 °C con agitación mecánica hasta su completa solubilización en un baño de agua (WNB29, Memmert, Schwabach, Germany). Las soluciones de gelatina fueron calentadas a temperaturas de proceso de 60 °C, luego se agregó el plastificante a una concentración de 0,134% p/p (basado en el peso de la gelatina) con agitación constante a 400 rpm (RT 10, IKA, Staufen, Germany) durante 20 min y a continuación se incorporaron los porcentajes de extracto de orégano (EO) al 2,5; 5; 7,5 y 10% (v/v) de SFP.
Las soluciones formadoras de película fueron colocadas en placas Petri para su secado en secador de aire forzado (Venticell 222, MMM Group, Planegg, Munich, Germany) a 50 °C durante 20 h. Después del secado, las películas fueron acondicionadas en desecadores con soluciones saturadas de bromuro de sodio bajo condiciones controladas de HR de 58% por 48 h.
2.2. Preparación del extracto de orégano
El extracto de orégano (EO) se obtuvo por maceración pasiva con etanol, de acuerdo a la metodología descrita por Hernández-Hernández, Ponce-Alquicira, Jaramillo-Flores, & Guerrero-Legarreta (2009) con algunas modificaciones. Las hojas de orégano fresco fueron adquiridas de un mercado local y lavadas 3 veces con abundante agua e hipoclorito de sodio y secadas a 20 °C durante 40 h. Las hojas secas fueron molidas y tamizadas con una malla de 0,25 mm hasta obtener un polvo fino el cual se mezcló con etanol al 85% (1/10 p/v). La mezcla se agitó a 70 rpm durante 16 h en oscuridad y se centrifugó a 3000 rpm durante 15 min. El sobrenadante se separó y el precipitado se mezcló nuevamente con etanol al 85% para una segunda extracción. Ambos sobrenadantes fueron mezclados y filtrados (papel whatman N° 1). El extracto obtenido se concentró por evaporación al vacío y se almacenó en refrigeración en un recipiente ámbar hasta su uso.
2.3. Caracterización de las películas con extracto de orégano
2.3.1. Humedad
El contenido de humedad se determinó usando el método gravimétrico de acuerdo a la metodología ASTM D644-99 (ASTM, 1999) con ligeras modificaciones. Las muestras de películas de 1 g fueron pesadas y secadas a 100 ± 2 °C por 24 h. Las mediciones fueron realizadas en triplicado.
2.3.2. Viscosidad
La viscosidad se midió directamente en cada solución formadora de película antes del secado siguiendo el método de Wang, Liu, Holmes, Kerry, & Kerry (2007) con algunas modificaciones. Las condiciones de análisis fueron: temperatura de 40 °C, velocidad de 70 rpm y spindle SC4-18, usando un viscosímetro (DV2TLV, Brookfield Engineering Laboratories, Inc. Middleboro, MA, USA). Los valores de viscosidad fueron obtenidos directamente en centipoises (cP). Las mediciones fueron realizadas en triplicado.
2.3.3. Opacidad
La opacidad de las películas se determinó a una longitud de onda de 600 nm con un espectrofotómetro UV-Visible (Lambda 950 UV/Vis, Perkin Elmer Inc., Waltham, MA, USA) siguiendo el método de Gómez-Estaca et al. (2009). El cálculo de la opacidad fue el resultado de la división de la absorbancia a 600 nm entre el espesor de la película (mm). Las mediciones fueron realizadas en triplicado.
2.3.4. Actividad antimicrobiana
La medición de la actividad antimicrobiana de las películas se realizó siguiendo la técnica de difusión en disco en agar Mueller Hinton, metodología utilizada por Teixeira et al. (2013) y Cruz-Tirado et al. (2020), con algunas modificaciones. Las cepas fueron aisladas totalmente de cada microorganismo en su respectivo medio tomando de 4 a 5 colonias que se sembraron en 5 ml de solución salina al 0,85 % p/v. Las concentraciones fueron ajustadas con el tubo patrón de McFarland No 0,5 (1,5 x 108 CFU/ml). La medición de la actividad antimicrobiana de las películas se realizó en discos circulares de 15 mm de diámetro cortados de cada película. Estos discos fueron puestos sobre la superficie de placas de agar inoculadas con 100 μl de cepas bacterianas. Luego fueron incubadas a temperatura de refrigeración (4 °C) durante 4 h hasta el visible crecimiento de cada bacteria. Posteriormente se incubaron las muestras a su temperatura óptima de crecimiento, 35 °C por 24 h. Las zonas de inhibición fueron medidas con un vernier digital (mm) y se restó del diámetro de película con la siguiente ecuación: Inhibición (mm) = diámetro total del halo - diámetro del disco de película. Las mediciones fueron realizadas en triplicado.
2.3.5. Espectroscopía Infrarroja Transformada De Fourier- FTIR
El registro del espectro infrarrojo entre 4000 y 650 cm-1 se realizó usando un Espectrómetro Infrarrojo (Perkin Elmer Spectrum 400 Inc, Waltham, MA, USA), equipado con un accesorio de prisma de vidrio ATR. Por cada espectro, se promedió 32 barridos de interferogramas y la resolución espectral fue de 4 cm-1. El espectro base se procesó usando el software Spectrum versión 6.3.2 (Perkin Elmer Inc.). Las medidas fueron realizadas a temperatura ambiente por disposición de la película sobre la superficie ATR y se presionaron con un émbolo de punta plana hasta que se obtuvieron espectros con picos estables y adecuados. Las mediciones fueron realizadas en triplicado.
2.3.6. Microscopía electrónica de barrido
Las muestras de película fueron previamente secadas a 30 °C por 24 h, luego se realizó el montaje de las mismas en cintas de carbono en plataformas de metal para su observación en el microscopio electrónico de barrido (Inspect-S50 FEI Technologies Inc. Oregon, USA) a bajo vacío, según la metodología propuesta por Lux. Se obtuvieron imágenes con aumentos de 1000x con aberturas de 4 - 5 a una distancia de 8 mm y con una intensidad de 2 - 3 kV.
2.3.7. Calorimetría de barrido diferencial
El análisis calorimétrico de las películas se realizó utilizando un calorímetro de barrido diferencial (TA-Q1000, TA Instruments, New Castle, DE, USA) calibrado mediante corrida con el elemento indio de alta pureza. Las muestras de películas de 10-15 mg ± 0,002 mg fueron pesadas y puestas en cápsulas herméticas de aluminio usando una cápsula vacía como referencia. Posteriormente se realizó el escaneo bajo purga de nitrógeno seco (50 ml/min) de 0 °C a 90 °C, a una tasa de calentamiento de 10 °C/min. Las temperaturas (Tpico, ºC) y las entalpías de los cambios conformacionales (ΔH) se midieron por duplicado. El software utilizado para el análisis de los datos fue el TA Instruments Universal Analysis 2000.
2.3.8. Análisis estadístico
El análisis estadístico de los datos se realizó utilizando la prueba de Tukey (α = 0,05) empleando el programa estadístico SPSS versión 19 (IBM SPSS Statistics 19).
3. Resultados y discusión
3.1. Propiedades fisicoquímicas
En la Tabla 1 se observa que la humedad de las películas control y con 7,5% de EO muestran diferencia significativa (p < 0,05). Todas las películas fueron secadas a 50 °C, sin embargo, la mayor incorporación de extracto, de natura leza lipídica, pudo causar un mayor atrapamiento de las moléculas acuosas dentro de la microestructura de la película de gelatina. Estos valores fueron similares a lo reportado por De Carvalho & Grosso (2004), quienes elaboraron películas de gelatina de bovino de tipo B con 12,18% de humedad. La composición de una película y la humedad influyen directamente sobre la temperatura de transición vítrea (T g) lo cual puede denotar la estabilidad de una película. Así mismo, la humedad también está relacionada con la concentración y tipo de plastificante e influye en sus propiedades mecánicas y de barrera. Al respecto, Bergo & Sobral (2007) determinaron que el glicerol presentó el mayor efecto higroscópico que otros plastificantes favoreciendo así la absorción de humedad por la película. El incremento del EO en las formulaciones de las películas se dio con una disminución del plastificante glicerol cuya variación no tuvo un efecto significativo sobre la humedad de las películas. Estos valores de humedad son menores a lo reportado por Hajivand, Aryanejad, Akbari, & Hemmati (2020) quienes obtuvieron películas de mucílago de semillas de psyllium con extractos de orégano entre 0,5% y 1,5% en su formulación con valores de humedad alrededor de 19%; mientras que Zhang et al. (2020) reportaron valores de humedad comprendidos entre 15,66% y 24,81% en películas elaboradas a partir de aislado proteico de soya y mucílago de semilla de psyllium en diferentes proporciones. La diferencia entre los grupos hidroxil de las estructuras poliméricas juega un rol importante en la hidrofilicidad y por ende en la humedad de las películas elaboradas. En general, las películas de polisacárido y proteína son buenas barreras de gas, pero pobres barreras frente a la humedad (Nussinovitch, 2013), sin embargo, para fines aplicativos se requieren películas con valores bajos de humedad.
Tabla 1 Propiedades fisicoquímicas de las películas con extracto de orégano
| Película con extracto de orégano (EO) | Humedad (%) | Opacidad | Viscosidad (cP) |
| EO 0 % | 11,42 ± 0,26a | 0,96 ± 0,09a | 4,59 ± 0,00a |
| EO 2,5 % | 11,06 ± 0,84a | 1,00 ± 0,06a,b | 4,27 ± 0,03a |
| EO 5,0 % | 12,05 ± 0,15a,b | 1,23 ± 0,13b,c | 3,81 ± 0,00b |
| EO 7,5 % | 12,94 ± 0,21b | 1,37 ± 0,13c | 3,86 ± 0,00b |
| EO 10,0 % | ND | 1,16 ± 0,04c | 1,68 ± 0,02c |
Los valores promedios con letras diferentes dentro de una columna muestran diferencia significativa (p < 0,05).
El extracto de orégano causó una variación significativa de la opacidad de las películas cuando se incorporó en un nivel de 5% en la formulación, lo cual está relacionado con una mayor distribución del extracto en la matriz de la película. Chentir et al. (2019) evaluaron la incorporación de extractos de ficocianina en concentraciones de 1,25% - 12,5% en la formulación de películas comestibles en el que la adición de las más altas concentraciones (6,25% y 12,5% (w/w)) causaron el incremento significativo de la opacidad de las mismas. La opacidad es una propiedad importante que puede prevenir la oxidación lipídica impidiendo la penetración de la luz UV, lo que resulta interesante en la aplicación potencial de estos materiales sobre algunos alimentos. Al respecto, Gómez-Estaca et al. (2009) y Govindaswamy, Shakila, Geevaretnam, & Pandurengan (2018) reportaron valores de opacidad de 0,4 y 1,9 en películas de gelatina de piel de atún y de vejiga natatoria de carpa, respectivamente, donde la adición de extractos naturales bioactivos en la formulación incrementó la opacidad de las películas resultantes en mayor medida que lo encontrado en el presente trabajo. Syahida et al. (2020) incorporaron cera de palma en concentraciones de 0% - 60% en películas de gelatina de piel de tilapia, obteniendo valores de opacidad comprendidos entre 1,28 - 3,27. Estas diferencias se deben a la naturaleza de los compuestos y a su concentración empleada en las formulaciones. La utilización de películas comestibles con valores muy altos de opacidad se limita a su aceptabilidad en función a los productos empacados.
La viscosidad de las películas disminuyó respecto al incremento del EO. Esto podría deberse a una disminución del contenido de gelatina en la SFP y a una pérdida del equilibrio entre los componentes de la película causada a su vez por el incremento del extracto en las soluciones formadoras de película. Esto se evidenció en la formación de un precipitado conformado por los polifenoles del extracto y las cadenas polipeptídicas de la gelatina.
3.2. Actividad antimicrobiana
La actividad antimicrobiana de las películas de gelatina de piel de mahi-mahi con extracto de orégano frente a cepas bacterianas gram (+) y gram (-) se observa en la Tabla 2. Los resultados muestran que las películas elaboradas con las cuatro concentraciones de extracto de orégano mostraron efecto inhibitorio sobre el crecimiento de las bacterias Proteus vulgaris (-) y Staphylococcus aureus (+) con similares tamaños de halos. Zam & Ali (2018) encontraron resultados similares cuando determinaron la capacidad antimicrobiaan de películas de diversas matrices con extracto hidroalcohólico de berris, frente a Staphylococcus aureus (+). Cabe señalar que Proteus vulgaris puede causar infecciones urinarias, septicemias y lesiones purulentas en diferentes órganos, siendo un riesgo para la salud, mientras que Staphylococcus aureus tiene la capacidad de producir en pocas horas enterotoxinas resistentes al calor, la cual la convierte en una bacteria causante de un gran número de intoxicaciones alimentarias. También se observa que el crecimiento de las bacterias Enterococcus faecalis y Salmonella entérica fue inhibido sólo por las películas con 7,5% y 10% de extracto de orégano. Así mismo, los mayores halos de inhibición frente a todas las bacterias evaluadas se observaron en las películas con 10% de EO, siendo los más grandes aquellos observados frente a las bacterias Proteus vulgaris y Staphylococcus aureus; mientras que los halos de menor tamaño fueron observados frente a Shewanella putrefaciens y Bacillus coagulans. Esto indica las diferencias en los niveles de sensibilidad de las bacterias frente a la acción del extracto de orégano. Los componentes principales del EO responsables de la actividad antimicrobiana son los compuestos fenólicos, como el ácido rosmarínico y derivados del ácido protocatéquico, los cuales actúan atacando la membrana celular fosfolipídica causando el aumento de la permeabilidad y fuga de citoplasma, o interactúan con las enzimas ubicadas en la pared celular (Wu et al., 2014). Por otro lado, se observa que las películas con EO ejercieron efecto antimicrobiano tanto sobre bacterias gram (+) como gram (-) evidenciándose de manera más clara en todas las películas con 10% de extracto de orégano lo cual podría deberse a la mayor concentración del extracto, que pudo haber atravesado la membrana externa adicional de las bacterias gram (-) logrando su disrupción para ejercer su efecto inhibitorio. De manera similar, Coccimiglio et al. (2016) determinaron que un extracto etanólico de la especie Origanum vulgare de la zona de Grecia mostró propiedades antimicrobianas frente a cepas de bacterias gram (+) y gram (-). Yeddes et al. (2020) reportaron que la adición de otros extractos con propiedades bioactivas, como el aceite esencial de romero, en la formulación de películas de gelatina con otros polímeros dio como resultado películas con actividad antimicrobiana frente a cepas de Bacillus subtilis, Staphylococcus aureus, Enterococcus aerogenes, Enterococcus faecalis y Escherichia coli con tamaños de halos de inhibición entre 9,66 y 16,33 mm.
3.3. Microestructura de las películas
Las microfotografías de las películas con extracto de orégano, EO, obtenidas por la microscopía electrónica de barrido de superficies, SEM, se muestran en la Figura 2. En general, se observan pequeños poros distribuidos en todas las estructuras poliméricas asociados al incremento del EO en las formulaciones. La imagen de la película control muestra una superficie lisa y uniforme, a diferencia de las películas con EO que muestran cambios estructurales sustanciales evidenciándose en estructuras más heterogéneas. Así, en la película con 2,5% de EO se observa unos pocos poros distribuidos en su estructura mientras que en la película con 5% de EO se observa una mayor cantidad. Esto puede deberse a una solubilización incompleta del EO en la estructura polimérica tal como lo sostienen Tongnuanchan, Benjakul, Prodpran & Nilsuwan (2015) lo cual está relacionado al incremento del EO, cuya naturaleza es parcialmente lipídica. La adición de mayores concentraciones de EO en las formulaciones se correlacionó con una mayor cantidad de gotas de aceite en las películas, las cuales se ubican en la superficie de la película y están atrapadas dentro de la matriz proteica de la película, pero debido a su naturaleza hidrofóbica se separan de la fase acuosa. La presencia de dos fases inmiscibles en la matriz polimérica debido a la presencia de gotitas de lípidos fue evaluada por Yeddes et al. (2020) en películas de gelatina con quitosano y pectina cuando incorporaron dos tipos de aceite esencial de romero en la formulación de las películas.
En la imagen de la película con 7,5% de EO se observan además de poros, la presencia de grietas y manchas blancas, con superficies rugosas en algunas zonas. Esto puede ser resultado de la precipitación de los polifenoles del EO con la gelatina. Al respecto, Wu et al. (2014) mencionan que aumento de la aspereza probablemente debido al estado líquido de los aceites que se extienden sobre la superficie de la matriz de gelatina reduciendo sus regularidades. Es posible que la adición del extracto haya influido en la interacción proteína-proteína de la estructura de la película, aumentando así la rugosidad de la microestructura lo cual se evidencia en mayor medida en la microestructura mostrada en la Figura 1d. A diferencia de las Figura 1b y 1c, en la Figura 1d se observa una microestructura con mayor rugosidad por zonas de manera discontinua, lo cual podría deberse a que la incorporación de 7,5% de EO en la formulación, causó la formación de un precipitado formado por los polifenoles del EO y la gelatina mediada por enlaces covalentes y no covalentes. Syahida et al. (2020) reportaron que la microestructura de películas comestibles de gelatina de piel de tilapia muestra la distribución de las partículas insolubles de cera de palma muestra agregados moleculares de cera incrustadas en la capa de gelatina debido a la temperatura de punto de fusión más alta de la cera de palma respecto a la temperatura de secado de la película.
3.4. Calorimetría de barrido diferencial - DSC
La calorimetría de barrido diferencial es un análisis térmico del cual se obtienen datos de entalpía y temperaturas de transición térmica, respecto a la temperatura de calentamiento del polímero. En la Figura 3 se muestra los termogramas correspondientes a la descomposición de la gelatina, polímero constituyente de las películas con extracto de orégano. En la Figura 3a se observa una curva que muestra inicialmente la transición de un estado vítreo a gomoso de la estructura polimérica, lo cual está relacionado a los dominios amorfos de la película. Este cambio estructural ocurre a una temperatura a la cual se le denomina temperatura de transición vítrea (T g). El valor de este parámetro fue de 43,48 °C y el valor de la entalpía de fusión fue de 4,501 J/g en la película sin EO.
Luego, se observan 2 picos correspondientes a eventos endotérmicos desarrollados a diferentes temperaturas a las cuales se les denomina, temperaturas de fusión (T f), correspondientes a los procesos de fusión de los dominios cristalinos del polímero (Tongnuanchan et al., 2015).
Tabla 2 Actividad antimicrobiana de las películas comestibles con extracto de orégano (EO)
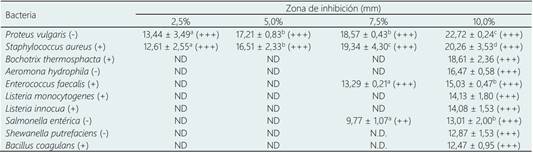
Zona de inhibición: +++: >10 mm, ++: ≥ 5 mm, +: 2,5-5 mm, ±: < 2,5 mm, - :1 mm.
Los valores promedios con letras diferentes dentro de una columna muestran diferencia significativa (p < 0,05).

Figura 2 Microfotografías de la superficie de la película sin extracto de orégano (EO) (a); superficie de la película con 2,5% de EO (b); superficie de la película con 5% de EO (c); superficie de la película con 7,5% de EO (d).
El valor de la T f asociada al primer evento endotérmico fue de 52,61 °C y el valor correspondiente al segundo evento endotérmico fue 78,43 °C correspondiente a la temperatura de fusión de sólidos. Estos picos endotérmicos pueden ser debido a otros cambios estructurales en las moléculas de proteínas antes de derretirse. Por otro lado, Mukherjee & Rosolen (2013) reportaron que la evaluación por DSC de la gelatina de piel de becerro mostró una curva similar a lo encontrado en el presente estudio, pero con valores de temperaturas más altas y el segundo pico lo nombraron temperatura de isomerización asociado a la isomerización de los enlaces peptídicos (cis-trans).
La variación en los termogramas causado por la incorporación del extracto de orégano en las formulaciones de las películas se observan en las Figura 2b,3ay3b. Un incremento del EO en las películas causó la disminución de las T g y las T f así como de sus respectivas energías de absorción. Entre los distintos factores que afectan la T g, la presencia del plastificante es uno de los más importantes y varía de forma inversa a la T g, ya que estos agentes incorporados se adaptan entre las moléculas vítreas y les proporcionan mayor movilidad. Nilsuwan et al. (2016) determinaron que el incremento del plastificante en la formulación de películas de gelatina de piel de tilapia causó la disminución de la temperatura de transición térmica. Estas películas mostraron valores de temperaturas de transición más altos que las películas de gelatina de mahi-mahi. Esto podría deberse a las diferencias en los contenidos de los iminoácidos prolina e hidroxiprolina entre ambas gelatinas, los cuales están asociados a la estabilidad térmica de la proteína. En el presente trabajo, el extracto de orégano también ejerció su efecto plastificante, por tal motivo, su incremento en la formulación de las películas probablemente causó la disminución de la T g. También se puede mencionar que el peso molecular de la gelatina varía en forma directamente proporcional a la T g ya que las cadenas cortas tienen más volumen libre y, por lo tanto, deben requerir menores valores de T g que las cadenas más largas. Al respecto, Rawdkuen, Sai-Ut & Benjakul (2010) mencionan que las películas compuestas de proteínas con bajo peso molecular y mayor contenido de péptidos de degradación, están asociadas con una interacción de red más débil, lo cual influye en la temperatura de transición. De acuerdo con Gómez-Guillén et al. (2007) el peso molecular de la gelatina depende de la materia prima y de las condiciones de extracción de la gelatina. Rawdkuen et al. (2010) reportaron un valor de T g alrededor de 60 °C en películas de gelatina de pez gato gigante mientras que De Carvalho & Grosso (2004) reportaron un valor de T f de 65,06 °C en películas de gelatina de bovino. Este valor está comprendido entre los valores de T f encontrados en las películas del presente trabajo.
3.5. Espectroscopía Infrarroja Transformada De Fourier (FTIR)
Los espectros FTIR de las películas de gelatina con extractos de orégano se muestran en la Figura 4. Todas las películas mostraron espectros que siguieron el mismo patrón de bandas correspondientes a los principales grupos funcionales con variaciones en las intensidades de absorción en función de la cantidad de EO incorporado en la formulación de las películas. Dentro de las principales bandas observadas se tienen las siguientes: banda amida A, la cual se encontró alrededor de un número de onda de 3298 cm-1 lo cual representa estiramientos -NH acoplados con enlaces de hidrógeno y la banda amida B que se encontró a un número de onda alrededor de 2926 cm-1, y que corresponde a estiramientos CH y NH3 +.
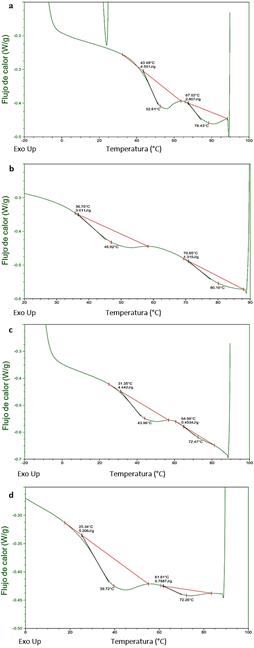
Figura 3 Curvas DSC de: (a) película de gelatina sin extracto de orégano; (b) película con 2,5% de extracto de orégano (c) película de gelatina con 5% de extracto de orégano; (d) película con 7,5% de extracto de orégano.
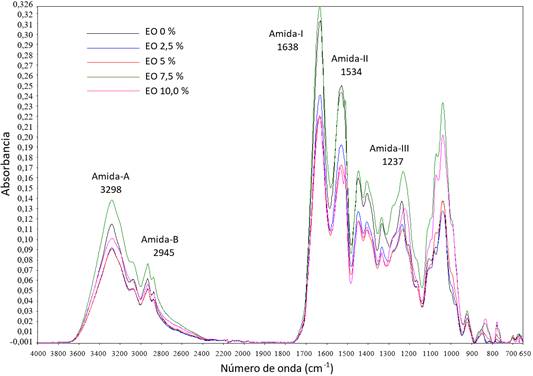
Figura 4 Espectro FTIR de películas comestibles incorporadas con diferentes porcentajes de extracto de orégano.
La incorporación de 2,5% y 5% de EO causó la disminución de intensidad de la banda amida A en igual medida, mientras que la inclusión de 10 % de EO causó una menor disminución de intensidad de banda. El extracto incorporado pudo haber interferido en los enlaces de los grupos -NH provenientes de los grupos amino acoplados a enlaces de hidrógeno en la gelatina.
Respecto a la banda amida B, se observó la disminución de la intensidad de absorción de los espectros correspondientes a las películas con 2,5%, 5%y 10% de EO observándose una menor disminución de la intensidad de banda en la película con 10% de EO. La incorporación de 7,5% de EO causó un aumento en la intensidad de esta banda. Esto indicaría que un mayor porcentaje de EO condujo a un mayor entrecruzamiento entre los grupos CH de los compuestos fenólicos del extracto incorporado y los grupos NH3 de la gelatina.
Muyonga, Cole, & Duodu (2004) y Fan et al. (2020) también reportaron espectros que mostraron bandas alrededor de un número de onda de 1638 cm-1 (amida-I) lo cual representa vibraciones de estiramiento C=O, la banda correspondiente a 1534 cm-1 (amida-II) que representa vibraciones de flexión de grupos N-H y vibraciones de estiramiento de grupos C-N y la banda a 1237 cm-1 (amida-III) que resulta de las vibraciones en el plano de grupos C-N y N-H del enlace amida o vibraciones de grupos CH2 de la glicina
Similares resultados fueron reportados por Govindaswamy et al. (2018) donde los picos de los enlaces amida-I, amida-II y amida-III correspondieron a números de onda de 1621, 1543 y 1237 cm-1, respectivamente.
Respecto a la banda amida I, se observó que la incorporación de 2,5%, 5% y 10% de EO causó una significativa disminución de la intensidad de banda, lo cual indica la interacción entre la fracción lipídica del EO con la gelatina mediante enlaces de hidrógeno lo cual disminuyó la interacción entre las cadenas polipeptídicas de la gelatina. Este comportamiento fue reportado por Fan et al. (2020) quienes estudiaron el efecto del incremento de la gelatina y del plastificante en películas de gelatina de piel de salmón.
También se observó que la incorporación de EO causó la disminución de intensidad de las bandas amida II correspondientes a las películas con 7,5%, 2,5%, 5% y 10% de EO, respectivamente. Al parecer, la unión del EO con la gelatina dio lugar a una menor disponibilidad de los grupos N-H y C-N de las cadenas polipeptídicas de la gelatina.
La incorporación de extracto de orégano en la formulación de las películas causó una notable disminución de la intensidad de las bandas amida III, siendo mayor en las películas con 5% y 10% respecto a la película con 2,5% de EO. Esto indicaría la interferencia del extracto de orégano incorporado en los enlaces amida de la gelatina, lo cual es más evidente cuando se aumentan las concentraciones del EO.
Además de las bandas de absorción asociadas a grupos funcionales conocidos, también se observa una banda situada alrededor de un número de onda de 1036 cm-1. Al respecto, Bergo & Sobral (2007) reportaron una banda con similar número de onda y sostienen que podría estar relacionada con las interacciones que surgen entre el plastificante (grupo OH) del glicerol y la estructura de la película. Bandas con números de onda similares también fueron reportada por Tongnuanchan et al. (2015).
4. Conclusiones
La incorporación de extractos de orégano en la formulación de películas comestibles elaboradas a partir de gelatina de piel de mahi-mahi modificó las propiedades fisicoquímicas, antimicrobianas, estructurales y de superficies. La humedad y la opacidad de las películas se incrementaron mientras que la viscosidad disminuyó. Los análisis de estructura y de superficies mostraron que las películas pueden ser utilizadas como agentes portadores para la incorporación de otros extractos naturales similares, por la capacidad que tiene la matriz proteica para establecer interacciones con los compuestos fenólicos. Así mismo, las películas comestibles con extracto de orégano podrían considerarse como una alternativa de empaque seguro de algunos alimentos en términos de criterios microbiológicos.
















