1. Introducción
El banano Musa spp. (Musaceae) es originario del Sudeste Asiático, es una fruta tropical que se cultiva desde hace 10 mil años (Maryani et al., 2019). Actualmente, se encuentra en estado silvestre en Filipinas, Papúa Nueva Guinea e Indonesia. Los cruces naturales han producido una importante diversidad genética y la aparición de variedades sin semillas con interesantes cualidades alimenticias para la nutrición de la humanidad (García et al., 2018; García-Bastidas et al., 2019). El cultivar Cavendish, es la variedad más importante en la industria comercial bananera, es reconocido por su alto contenido de potasio (K), vitamina C y B6, y consumido por niños, adultos y atletas para mejorar sus rendimientos (Organización de las naciones unidas para la alimentación y la agricultura (FAO), 2016). Este cultivo se desarrolla en más de 135 países siendo los principales productores; India (26%), China (12%), Indonesia, Brasil, Ecuador (6%) y Filipinas (5%), alcanzando 18,1 millones de toneladas (t) en el 2017 (FAO, 2018). En el Perú existen 165,466 hectáreas (ha) dedicadas a la producción de plátanos y bananos, concentrándose más del 70% en la región amazónica. Alrededor de 10,246.82 ha son destinadas a banano orgánico, de los cuales el 93% se concentran en la región Piura con 9,580.05 ha y un rendimiento promedio de 13,9 t/ha, seguido de Lambayeque (3,150 ha), La Libertad (192,93 ha) y Tumbes (158,5 ha). Aproximadamente 8,411 productores cultivan banano orgánico para exportación, el mismo que representa el 12,3% de la producción nacional y es exportada a los países de la Unión Europea (UE) y Estados Unidos, la diferencia es destinado para el autoconsumo, mercado regional y nacional (Ministerio de Agricultura y Riego, 2019). Este crecimiento se ve limitado por el daño de plagas y enfermedades como: thrips de la mancha roja Chaetanaphothrips signipennis (Bagnall) (Thysanoptera: Thripidae) (Paiva, 2019), pudrición del rizoma por Pectobacterium chrysanthemi por Ruíz (2015); nematodos fitoparásitos Radopholus similis (Cobb) Thorne, Pratylenchus coffeae Goodey (Nematoda: Secernentea: Tylenchida: Pratylenchidae), y Helicotylenchus sp. Goodey (Nematoda: Secernentea: Tylenchida: Hoplolaimidae) (Zatán, 2018). En los últimos años en Piura, y en otros países del mundo como: Australia, China, Taiwán, Indonesia, India, Israel, Pakistán, Líbano, Omán, Mozambique, y Colombia se viene presentando la enfermedad conocida como Marchitez por Fusarium (MF) ocasionando la muerte temprana de plantas en producción de banano en los cultivares Cavendish, (Ordoñez et al., 2015; Maymon et al., 2018; García-Bastidas et al., 2019; Maymon et al., 2020; Izquierdo-García et al., 2021). En campos de banano orgánico ubicados en la región Piura, se observa en cortes transversales y longitudinales del pseudotallo la necrosis de los haces vasculares y puntos necróticos en el rizoma, la incidencia de estos síntomas se incrementó después del fenómeno de “el niño costero” que se presentó durante los meses de marzo-abril del año 2017 (Arévalo, 2018). A mediados del siglo XX, la enfermedad conocida como MF devastó el cultivar Gros Michel en América y Centroamérica por el hongo Fusarium oxysporum f. sp. cubense (Foc) raza 1, siendo mitigada por cultivar Cavendish. Sin embargo, Foc raza tropical 4 (RT4) ataca a clones de Cavendish representando de esta manera una amenaza mundial para este cultivo (Mostert, 2017; Zheng et al., 2018; Aguilar-Hawod, 2019). En países como; Australia en 2015, Israel 2016 y Colombia 2019, se ha confirmado la presencia del patógeno y vienen ejecutando medidas oportunas y eficientes para contener y erradicar el avance del patógeno (Rodríguez, 2019; Martínez-Solórzano et al., 2020). Por la cercanía con el país vecino de Colombia, el flujo continuo de personas que ingresan y salen constantemente del Perú y el comercio internacional, el patógeno Foc raza tropical 4 (RT4) podría llegar a nuestro país (Perú), por lo cual ocasionaría un gran impacto en la producción de banano orgánico, y de esta manera afectaría enormemente a los productores bananeros del País. Maryani et al. (2019) indican que las especies de Fusarium son conocidas por su gran diversidad, amplio rango de hospedantes y por su vida cosmopolita, estos se encuentran asociados al cultivo de banano como; fitoparásitos, facultativos, saprofitos y endófitos. Actualmente, en Perú no hay información escrita, ni investigaciones sobre la pro blemática de esta enfermedad, y dada su importancia en cultivar Cavendish dedicada a la producción de banano orgánico se planteó el siguiente objetivo; identificar los principales patógenos fúngicos asociados al decaimiento del banano.
2. Materiales y métodos
2.1 Muestreo y recolección
Las muestras se obtuvieron de plantas de banano orgánico en producción con síntomas de necrosis vascular en el pseudotallo procedentes de diferentes zonas productoras de banano (cultivar Cavendish) del valle del Chira (Tabla 1). Se extrajeron pequeños segmentos de pseudotallo, rizomas y raíces, y las muestras debidamente codificadas se colocaron en bolsas de papel kraft, y posteriormente fueron llevadas al laboratorio de sanidad vegetal de la Universidad Nacional de Piura, para su análisis. El valle se encuentra ubicado a una altitud de 60 msnm, con una temperatura media de 24,4 °C, 63,7% de humedad relativa y 110,3 mm de precipitación anual (Távara, 2020).
2.2 Aislamiento de hongos
Muestras de raíces, rizoma y pseudotallo fueron lavadas con agua potable, posterior se cortaron pequeñas porciones de tejido (4 x 4 mm), y fueron inmersas en una solución de NaClO 1% durante un min, seguido se enjuagaron con agua estéril. Las porciones fueron sembradas en placas de Petri con medio PDA (papa dextrosa agar) + cloranfenicol, y medio de cultivo selectivo Komada e incubadas a 28 °C durante 5 días. Los aislados fueron purificados y preservados a temperatura de 5 °C (Komada, 1975; Nelson, 1983).
2.3 Características morfométricas de los aislados
Se evaluó las características morfológicas de los aislados como; el color de la colonia en el anverso y el reverso de la placa, textura, y crecimiento micelial. A nivel microscópico, se observó la presencia o ausencia de macroconidias, microconidias, clamidosporas y esporodoquios; así como la forma de la célula pie y célula apical. Se midió el ancho y la longitud de cincuenta macroconidios y microconidios al azar. Se emplearon las claves propuestas por Nelson (1983) y Leslie & Summerell (2006).
2.4 Alternativas de manejo integrado de la enfermedad
Se recopiló información bibliográfica de investigaciones realizadas y de artículos científicos publicados en algunos países del mundo.
3. Resultados y discusión
3.1 Descripción de síntomas en campos de banano orgánico en el Valle de Piura
En hojas, el borde de las hojas basales se tornó de coloración verde pálido a amarillamiento uniforme, seguido de pequeñas manchas necróticas rodeadas de halo amarillento avanzando hacia la nervadura central (Figura 1A), así mismo, se observó epinastía en el peciolo de las hojas (Figura 1B). La necrosis fue coalesciendo abarcando grandes áreas, generalizándose en toda la lámina foliar, observándose el colapso del peciolo, quedando la hoja colgada en el pseudotallo a manera de una falda (Figura 1C), finalmente estos síntomas avanzaron progresivamente hacia las hojas jóvenes del tercio superior quedando la planta con 3 a 4 hojas funcionales. Esta sintomatología coincide con lo descrito por De Beer et al. (2001), quienes indican que la enfermedad del Falso Mal de Panamá (FMP) empieza en las hojas más bajas o viejas con un amarillamiento generalizado, el margen de cada hoja se torna verde pálido a amarillo, aparecen rayas necróticas rodeadas por un margen amarillo y la hoja muere finalmente; los racimos por lo general son pequeños con dedos pequeños y delgados. Así mismo, los productores de banano orgánico de la región de Piura indican que los síntomas de la enfermedad se presentan con mayor incidencia en los meses de invierno (julio, agosto y setiembre) en el Valle del Chira, Piura-Perú.
En pseudotallo se realizó un corte trasversal a la altura de un metro sobre el nivel del suelo, y se observaron manchas necróticas discontinuas de coloración marrón oscuro rojizo en los haces vasculares, no se observó la formación de bolsillos gomosos en el cilindro central lo que es característico del Mal de Panamá (MP) y al realizar cortes longitudinales del pseudotallo se observó estrías necróticas continuas de coloración marrón rojiza en los haces vasculares (Figura 2A, 2B). Los síntomas observados coinciden con los descritos por De Beer et al. (2001), quienes observaron en el pseudotallo a una altura de 50-100 cm sobre el nivel del suelo la presencia de muchos filamentos vasculares rojo vino descolorado y desorden generalizado de las estructuras vasculares, tanto xilema como floema, y reportó que los haces vasculares del xilema se encontraron colapsados por sustancias amorfas.
En rizoma se observaron puntuaciones necróticas dispersos en el anillo vascular y en el centro del rizoma, además se observó filamentos blancos típicos del FMP (Figura 2C). Según investigaciones realizadas por Warman & Aitken (2018) describieron en cortes transversales realizados en el rizoma, oscurecimientos de los haces vasculares similares a los observados en el MP, que podrían continuar ascendiendo por el pseudotallo en forma continua, a diferencia del FMP este oscurecimiento es de forma discontinua.
En raíces se observó una escasa formación de raíces, puntos de pigmentación rojiza oscura y necrosis del tejido.
El hongo Fusarium oxysporum f. sp. cubense (Foc) fue encontrado en el xilema de raíces en Cavendish cv. Williams por Warman & Aitken (2018). Deltour et al. (2018) y Carvalhais et al. (2019) indican que el Foc es el agente causante de la enfermedad de marchitez vascular y se clasifica en distintas razas según las variedades de banano que infectan, su origen y virulencia son poco conocidos. Marchitez por Fusarium (MF) causada por Foc RT4, es una de las enfermedades más destructivas de bananos Cavendish en todo el mundo y viene afectando la industria bananera (Ploetz, 2015; García et al., 2018; Maryani et al., 2018; Cheng et al., 2019). Los factores bióticos que están asociados a la enfermedad es la interacción del nematodo Radopholus similis (Cobb) Thorne (Secernentea: Tylenchida: Pratylenchidae), y los picudos Cosmopolites sordidus Germar y Metamasius hemipterus L. (Coleoptera: Curculionidae). En Brasil, Almeida (2018) detectó a los nematodos de los géneros Meloidogyne, Helicotylenchus, Rotylenchus y Pratylenchus que son más destructivos que R. similis e indican que las heridas en las raíces facilitan la infección y colonización Foc. Así también, Dinesh et al. (2014) confirmaron que la inoculación combinada de R. similis y Foc aumentó la incidencia y la severidad de MF. Dita et al. (2018) señalaron que la interacción C. sordidus y M. hemipterus - Foc, pueden actuar como factores predisponentes para MF.
Así también, Meldrum et al. (2013) detectaron Foc RT4 en el exoesqueleto del picudo C. sordidus, sugiriéndolo como posible vector o agente predisponente de la enfermedad. El 2017, se presentó en la región de Piura el fenómeno de “el niño costero” causando en las plantaciones de banano inundaciones, generando de esta manera la compactación del suelo y anoxia de raíces (Arévalo, 2018). Según Van Asten et al. (2011), Wairegi & Van Asten (2011) y Machovina & Feeley (2013), los factores abióticos como el mal drenaje, lluvias continuas, y los cambios climáticos afectan los rendimientos y la producción de banano. En el valle de Chira, el cultivo de banano tiene de 10 a 15 años de edad, en un sistema de monocultivo. Dita et al. (2018) indican que este sistema de monocultivo es propicio para el desarrollo de ciclos continuos de MF y en la propagación del inóculo latente en el suelo. El patógeno (Foc) produce clamidosporas logrando sobrevivir en el suelo por más de 20 años (Buddenhagen, 2009; Li et al., 2011). Los primeros síntomas de la enfermedad se producen en las raíces y en los límites de la corteza del rizoma, así también en el cilindro central del pseudotallo en donde se presenta la mayor área vascular, observándose estrías necróticas de color marrón-rojizo y oscuro. El hongo crece a través de los tejidos afectando el crecimiento de los nuevos retoños (Pérez, 2004).

Figura 1 Síntomas en hojas de banano orgánico causadas por la Marchitez por Fusarium (MF). A) amarillamiento inicial y necrosis en el borde de las hojas, B) necrosis foliar con halo amarillento en el borde de las hojas que avanza hacia la nervadura central y epinastia, C) colapso del peciolo de las hojas basales del tercio inferior y posterior necrosis.

Figura 2 Sintomatología de marchitez vascular en banano orgánico en el valle de Piura. A) presencia de estrías necróticas continuas de coloración marrón rojiza en los haces vasculares del pseudotallo, B) en el corte transversal del pseudotallo se observa manchas necróticas discontinuas de coloración marrón, C) presencia de puntuaciones necróticas y filamentos blancos en haces vasculares del rizoma del banano.
3.2 Aislamiento e identificación
En total, se obtuvieron 44 cepas del género Fusarium, las cuales se identificaron a nivel de especie, 15 Fusarium solani, 13 F. oxysporum, 9 F. verticillioides y 7 Fusarium spp.
3.2.1 Características culturales y morfométricas de los aislados
Los aislados con los códigos RQSC, RQSC3, RQSR, RQH, R1VCE, R2VCE, RZCñ, RMSP, RQSA, RQSA2, RMapp, RGS, RN1, RPM y RUNP, en medio PDA desarrollaron colonia algodonosa de color blanco algodonoso en el anverso y en el reverso. Así también, se presentó una pigmentación ámbar a blanco amarillento o amarillo cremoso de la colonia. Las macroconidias fueron falcadas algo curvadas, cuyo tamaño osciló de 23-63 x 4-6 µm L x A y las microconidias fueron uni y bicelulares, con 8-16 x 3-5µ L x A, las clamidosporas se desarrollaron en forma solitaria y en pares, así también, se observó la formación de esporodoquios, estas características corresponden a la especie F. solani descriptas por Nelson et al. (1983).
Los aislamientos con código, CQSC, RQspp, RZQspp2x, SPQspp, PSVCEl, RVF, RZCb5, RZCb, y CrGS, en medio PDA desarrollaron colonia algodonosa de aspecto pulverulenta, crecimiento semirastrero, de coloración violeta en el centro, algunas cepas mostraron coloración blanquecina en los márgenes y en el anverso se observó pigmentación violácea, estas características corresponden a F. verticillioides. En medio PDA desarrollaron abundantes microconidios unicelulares hialinas cuyo tamaño fueron de 6 x 3 µ L x A, no se observó formación de macroconidias ni clamidosporas, estas características corresponden a la especie F. verticillioides según la clave de Nelson et al. (1983). F. verticillioides en Malasia ocasiona pudrición de la mazorca en el maíz, marchitez de las cucurbitáceas y la pudrición de la fruta del tomate y del banano (Najihah et al., 2017; Salem et al., 2020).
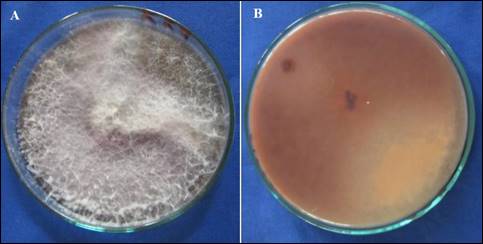
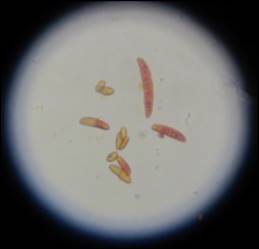
Los aislamientos, RQspp1, 2RZQspp, PSH, RQMb, PSVCEb, PSCb3, RCb, PSSCñ2, RZMSP, RMapp, R4PM, RZGM y RGM, en medio Komada desarrollaron colonia algodonosa de coloración violeta en el centro y en el envés se aprecia una tonalidad violácea (Figura 3A, 3B), presentaron abundante formación de macronidias falcadas con 3 a 5 septas cuyo tamaño fue de 20-59 x 2-6 µm L x A, las microconidias fueron uni y bicelulares 4-5 x 2-4 µm L x A, las clamidosporas se desarrollaron solitarias y en pares (Figura 4), estas características coinciden con la especie F. oxysporum según las claves de Leslie & Summerell (2006), Nelson et al. (1983).
3.3 Alternativas de manejo integrado de la enfermedad
El manejo de la enfermedad se ha basado en la exclusión del patógeno, evitando el ingreso de material contaminado como; material vegetal, herramientas, suelo entre otros, a áreas libres del patógeno, medidas de cuarenta efectivas, implementación de programas de contingencia, uso de hijuelos certificados libres de enfermedades, difusión de los conocimientos del patógeno y la enfermedad (Martínez-Solórzano et al., 2020). Así mismo, el área seleccionada debe tener un drenaje adecuado, los análisis nutricionales y del pH de suelo deben ser realizadas periódicamente ya que un pH ácido favorece a la MF y deben ser corregidos (Deltour et al., 2017; Dita et al., 2018; Teixeira et al., 2021). El Manejo Integrado de Enfermedades (MIE) busca las mejores opciones para garantizar la sanidad e inocuidad del cultivo, así como mejorar sus rendimientos (Pegg et al., 2019), basado en la comprensión actual de la epidemiología de MF, prácticas de manejo orientadas a la salud del suelo y supresión de patógenos, el uso de cobertura vegetales en cultivos, aplicación de enmiendas orgánicas y agentes de biocontrol, el uso de fertilizantes inorgánicos apropiados. Estas prácticas no solo reducen la MF, sino que también mejora el control de otras plagas y enfermedades (Haddad et al., 2018; Nasir et al., 2003; Pattison et al., 2014). Los suelos bananeros de Piura son arcillosos y contienen 0,4% de materia orgánica, después del fenómeno de “el niño costero” en el año 2017, las raíces de banano sufrieron anoxia por la compactación de suelo y falta de oxígeno. Según Dita et al. (2018) y Larkin (2015), la aplicación de materia orgánica es esencial para la salud del suelo y supresividad de patógenos, favoreciendo el desarrollo de microorganismos beneficiosos como Bacillus spp. y Trichoderma spp. Actualmente se han reportado suelos supresivos de banano en América Central y del Sur, Australia, Islas Canarias y Sud África para razas distintas de TR4. Köberl et al. (2017), Ploetz (2015), Shen et al. (2015), Xue et al. (2015), Orr & Nelson (2018), Wu et al. (2018) y Dignam et al. (2019) señalaron que los suelos supresivos poseen mayor riqueza y diversidad de bacterias como Bacillus spp., Chthonomonas spp., Pseudomonas spp. y Tumebacillus spp., son competitivos y antagonistas a Fusarium, así mismo incrementó 3,5 veces de la concentración de K (potasio).
El uso de cultivares resistentes sería alternativa al manejo de la enfermedad, tal y como se presentó en los clones del subgrupo Cavendish ante R1 de Foc. Sin embargo, el uso de nuevos cultivares resistentes, podrían alterar las características del fruto y afectar las demandas del mercado (Ploetz, 2015; Dita et al., 2018; Martínez-Solórzano et al., 2020).
El uso de plantas procedentes de cultivo in vitro reduciría la propagación de la enfermedad. Sin embargo, estas plantas una vez instaladas en campo han demostrado ser susceptibles a la marchitez por Fusarium, esto se debe a la eliminación total de microorganismos benéficos endófitos (Dita et al., 2018; Martínez-Solórzano et al., 2020).
La eliminación in situ de plantas sospechosas o infectadas reducirá en gran medida la propagación de Foc en campo (Dita et al., 2018; Martínez-Solórzano et al., 2020).
El uso de cultivos de cobertura vegetal en campos de banano, reducen la presencia de malezas, la propagación de plagas y enfermedades, las pérdidas de agua de riego mejoran las características; físicas, químicas y biológicas del suelo, reducen la presencia de marchitez por Fusarium en campos de banano (Dita et al., 2018; Martínez-Solórzano et al., 2020).
La deficiencia de macro y micronutrientes podrían estar relacionados con una alta intensidad de MF (Mur et al., 2016). El uso de nitrato (NO3) en la fertilización del cultivo reduce la incidencia de MF y el uso de amonio (NH4) lo incrementa. La nutrición a base de calcio (Ca) es el factor más importante para el manejo de enfermedades (Rahman & Punja, 2007). En la Tabla 2 se muestran los resultados obtenidos después de la implementación de algunas actividades de manejo y control de la enfermedad de MF.
Tabla 2 Actividades aplicadas en el manejo de marchitez por Fusarium y sus efectos de control en condiciones de campo en el cultivo de banano
| Prácticas de manejo | Características observadas | Foc raza | Referencias |
| Cultivo de cobertura (Arachis pintoi) | Reducción de la intensidad de la enfermedad y incremento de peso de racima. | R1 | Pattison et al. (2014) |
| Enmiendas orgánicas | Redujeron la incidencia en un 20% | R4 | Shen et al. (2015) |
| Fertilizantes bio orgánicos | Redujeron la incidencia en 15 %, incrementó los rendimientos en 24 % | Nd | Fu et al. (2016) |
| Aplicación de microorganismos | Pseudomonas fluorescens WCS 417 combinado con npFoxy redujeron la incidencia. | SR4 Aislado de Paspalum sp. y Amaranthus spp. | Belgrove et al. (2011) |
| Extractos botánicos y agentes de biocontrol | Aplicación combinación (Eb + P. fluorescens + B. subtilis) redujeron la incidencia en 75 %. | R1 | Akila et al. (2011) |
| Aceites esenciales | Origanum vulgare L. en dosis de 500, 700, 1000, 3000 y 5000 uL/L; inhibieron el 100 % del crecimiento miceliar. | R1 aislado de plátano manzano | Oltehua et al. (2019) |
| Aplicación de antagonistas | Streptomyces y Bacillus inhibieron las colonias de Foc in vitro | Nd | Widyantoro et al. (2020) |
Foc = Fusarium oxysporum f. sp. cubense, Nd = No determinó, npFoxy = no patogénico de F. oxysporum, Eb = Extractos botánicos.
4. Conclusiones
Se observó la necrosis en los haces vasculares del pseudotallo de banano orgánico, puntuaciones necróticas en el rizoma, amarillamiento y necrosis de las hojas, colapso del peciolo y muerte de la planta. Se han aislado 44 hongos del género Fusarium de los cuales 15 aislados se identificaron como Fusarium solani, 9 F. verticillioides, 13 F. oxysporum y 6 Fusarium spp., se recomienda implementar estrategias de manejo integrado, evitando el ingreso de material contaminado como; material vegetal, herramientas, suelo entre otros, fertilización balanceada, materia orgánica (25 t/ha), medidas de cuarenta efectivas, implementación de programas de contingencia, uso de hijuelos certificados libres de enfermedades, difusión de los conocimientos del patógeno y de la enfermedad.