1. Introducción
La producción de plásticos sintéticos se ha incrementado considerablemente en el mundo (~8300 millones de toneladas por año) (Geyer et al., 2017; Chamas et al., 2020). Estos plásticos sintéticos son en su mayoría polietileno, polipropileno y poliestireno, los cuales son usados como envases, embalajes, vehículos de transporte, equipos médicos e inclusive como materiales en prendas de vestir (Andrady & Neal, 2009; Geyer et al., 2017). No obstante, estos materiales en particular no son biodegradables ocasionando problemas de gestión ambiental, con daños irreversibles al medio ambiente (Scott, 2015). El carácter hidrofóbico y la ausencia de grupos funcionales en la estructura química de estos plásticos sintéticos impide su degradación por bacterias, enzimas e inclusive por otros factores tales como la temperatura ambiente, luz y el agua (Rosato et al., 1991; Alshehrei, 2017). Por ejemplo, se estima que las bolsas de plástico pueden demorar en degradarse entre 10 a 20 años, mientras que las botellas de plástico pueden demorar entre 70 y 500 años (Urbanek et al., 2018; Chamas et al., 2020). Por ello, diversos trabajos se han enfocado en promover la producción y uso de polímeros biodegradables como una alternativa para reemplazar los plásticos sintéticos y reducir los problemas de gestión ambiental.
Los polímeros biodegradables son metabolitos secundarios producidos bajo condiciones de estrés (temperatura, presión, pH entro otros) a partir de microorganismos tales como hongos y bacterias (Mohapatra et al., 2017). Estos polímeros debido a su naturaleza hidrofílica y a la presencia de grupos funcionales en su estructura química pueden hidrolizarse fácilmente a monómeros y oligómeros a través de diferentes mecanismos de degradación biológica (Nair et al., 2016), cuyo periodo de degradación es relativamente corto entre 20 y 500 días (Volova et al., 2010). Por ello, la búsqueda de nuevas fuentes naturales alternativas capaces de producir biopolímeros a bajo costo no solo con la finalidad de reemplazar a los plásticos sintéticos, sino también que permitan reducir significativamente el daño al medio ambiente es aún una tarea pendiente por resolver.
Los polihidroxialcanoatos (PHAs) y el alginato (AG) son dos polímeros biodegradables obtenidos de diferentes fuentes naturales (algas marinas y microorganismos), los cuales han ido ganando popularidad debido a sus altos rendimientos y bajos costo de producción (Yoneyama et al., 2015). Si bien, estos polímeros son resistentes, flexibles, biocompatibles, no tóxicos y biodegradables; sus excelentes propiedades viscoelásticas, estabilizantes y gelificantes permiten diferentes aplicaciones en la industria médica, farmacológica y alimentaria (Francesca, 1997; Gautam et al., 2007; García et al., 2014). Consecuentemente, el uso de ambos biopolímeros permitiría sustituir a los plásticos sintéticos, contribuyendo al desarrollo sostenible de las industrias (Vieira et al., 2011).
Si bien diferentes estudios se han enfocado en determinar qué tipos de algas marinas y microorganismos pueden ser utilizadas como fuentes naturales para la producción de PHAs y AG (Rehm, 2010), son los microorganismos Gram positivos quienes presentan una serie de ventajas tales como su capacidad para sintetizar ambos polímeros simultáneamente y según la modifica ción genética pueden controlar el peso molecular de es tos compuestos o en su efecto producir un solo polímero en particular (Galindo et al., 2007; Rehm, 2010). Azotobacter es un tipo de bacteria Gram positiva presente en suelo y agua dulce, que puede sintetizar simultánea mente PHAs y AG como mecanismo de protección natu ral, cuyas características químicas, físicas, mecánicas y ter modinámicas de ambos polímeros han mostrado cualida des particulares que pueden ser utilizadas en futuras aplicaciones en la industria (Rehm, 2010; Yoneyama et al., 2015). Por ello, esta revisión compila información sobre la síntesis de estos polímeros a partir de las especies de Azotobacter, luego se discuten algunas de sus propiedades físicas y mecánicas; y finalmente se presenta su potencial uso como una nueva alternativa para el sector alimentario, medico, farmacéutico y agronómico.
2. Género Azotobacter
A la fecha han sido identificadas 7 especies del género Azotobacter, un grupo de bacterias Gram negativas, no patógenas, estrictamente aerobias con una gran habilidad de fijar N2 en el suelo y sintetizar sustancias que favorecen el crecimiento de las plantas tales como hormonas, vitaminas, aminoácidos y N2 (Choi & Lee, 1999; Jiménez et al., 2011; Martyniuk & Martyniuk, 2003; Sumbul et al., 2020). No obstante, cada una de estas especies tienen características particulares de crecimiento que las diferencian, así como también en algunos casos difieren en la producción de algunos metabolitos (Tabla 1).
Si bien este grupo de especies es estrictamente aerobio, bajo condiciones de estrés o condiciones ambientales desfavorables (baja concentración de oxígeno) tienen la capacidad de formar quistes para entrar en un estado de reposo o inactividad (Gauri et al., 2012). La creación de este tipo de barrera defensiva permite que este tipo de microorganismos pueda generar metabolitos intra y extracelulares tales como polihidroxialcanoatos (PHA), y alginatos (AG) (Tabla 1) (Patil et al., 2020).
3. Síntesis y producción biopolímeros
Si bien las diferentes especies de Azotobacter tienen la capacidad de producir los biopolímeros de AG y PHA, son finalmente las especies A. vinelandii y A. chroococcum las que mayor presencia tienen en los suelos fértiles (> 80%) en comparación con las otras especies de Azotobacter (Aasfar et al., 2021). Por ello, el enfoque de los metabolitos extra e intracelulares producidos bajo condiciones de estrés por ambas especies de A. vinelandii y A. chroococcum son detallados a continuación.
3.1. Alginato (AG)
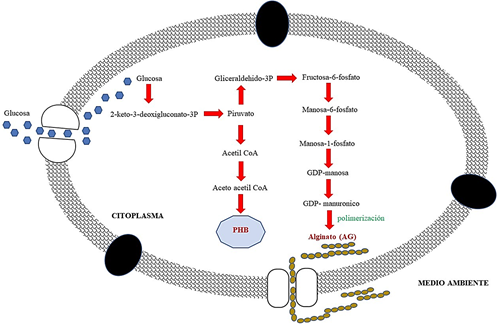
Bajo condiciones ambientales desfavorables, ambas especies de A. chroococcum y A. vinelandii tienen la capacidad de formar quistes con la finalidad de protegerse y entrar en un estado de reposo latente (Gawin et al., 2020). Estos quistes son capsulas compuestas por biopolímeros de AG, un tipo de metabolito extracelular, cuya estructura química presenta moléculas de ácido 𝛽-D-manurónico (M), ácido 𝛼-L-gulurónico (G) y algunos grupos acetilados (O-acetilo) (Figura 1) (Castillo et al., 2013; Gawin et al., 2020).
Tabla 1 Características morfológicas básicas del género Azotobacter
| Especie | Tamaño de célula | Condiciones normales de crecimiento | Metabolitos producidos bajo condiciones normales de crecimiento | Biopolímeros producidos bajo condiciones controladas | Fuente |
| Azotobacter chroococcum | 3,0 - 7,0 µm | T°: 15 - 30 °C pH: 7 - 7,4 | Aminoácidos Vitamina B2 y B3 CO2 NH3 | PHA AG | (Lenart, 2012) (Chennappa et al., 2019) (Patil et al., 2020) |
| Azotobacter vinelandii | 3,0 - 4,5 µm | T°: 20 - 30 °C pH: 7 - 8,5 | Aminoácidos Vitamina B2 y B3 CO2 N2 NH4 | PHA AG | (Jiménez et al., 2011) (Chennappa et al., 2019) |
| Azotobacter beijerinckii | 3,2 - 5,3 µm | T°: 10 - 30 °C pH: 4,9 - 5,5 | Aminoácidos Vitamina B2 y B3 CO2 NH3 | PHA AG | (Patil et al., 2020) (Hindersah et al., 2021) (Blunt et al., 2018) |
| Azotobacter paspali | 7,0 - 11,0 µm | T°: 15 - 37 °C pH: 6,0 - 7,5 | Aminoácidos Vitamina B2 y B3 CO2 Ácido indolacético | PHA AG | (Patil et al., 2020) (Saranraj & Sivasakthivelan, 2017) |
| Azotobacter armeniacus | 5,0 - 5,7 µm | T°: 28 - 37 °C pH: 6,0 - 7,5 | Aminoácidos Vitamina B2 y B3 CO2 NH3 | PHA AG | (Patil et al., 2020) |
| Azotobacter nigricans | 4,1 - 4,9 µm | T°: 9 - 37 °C pH: 6,0 - 7,5 | Aminoácidos Vitamina B2 y B3 CO2 NH3 | PHA AG | (Patil et al., 2020) |
| Azotobacter salinestri | 2,0 - 4,0 µm | T°: 15 - 35 °C pH: 6,0 - 7,5 | Aminoácidos Vitamina B2 y B3 CO2 NH3 | PHA AG | (Patil et al., 2020) |
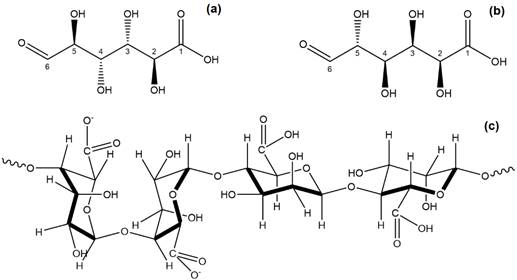
Figura 1 Estructura química del Alginato, (a) ácido manurónico (M); (b) ácido gulorónico (G); (c) estructura principal M y G.
El proceso de biosíntesis de este polímero se realiza bajo condiciones limitantes en la concentración de oxígeno disuelto en el medio, esto permite que la bacteria inicie un proceso de enquistamiento con la finalidad de proteger su membrana celular con una doble capa externa rica en AG (Pacheco-Leyva et al., 2016). El proceso de biosíntesis para obtener AG se inicia con la conversión de glucosa a fructosa-6-fosfato, la cual se isomeriza a manosa 6-P, luego es activada como GDP-manosa por la enzima GDP-manosa-pirofosforilasa. Después la enzima GDP-manosa-deshidrogenasa a través de un proceso de oxidación convierte la GPD-manosa a GPD-manuronico, el cual es polimerizado y acetilado para formar la estructura química del alginato (Figura 2) (Campos & Marti, 1996; Remminghorst & Rehm, 2006; Galindo et al., 2007; Pacheco-Leyva et al., 2016).
Si bien existen diferentes enzimas relacionadas con el proceso de biosíntesis de AG, son finalmente las enzimas GPD-manosa-deshidrogenasa y C-5 epimerasa las más importantes para la formación del polímero de AG, cuyos genes responsables para su codificación y producción se conocen como algD y algE respectivamente (Gawin et al., 2020; Hay et al., 2014).
Si bien ambas especies de Azotobacter producen AG, la presencia de bloques G y M, el grado de polimerización y el peso molecular son características decisivas para establecer futuras aplicaciones industriales, las cuales se pueden controlar mediante la modificación de las condiciones del medio de cultivo tales como oxígeno disuelto, agitación, temperatura y pH (Galindo et al., 2007; Gawin et al., 2020). Por ejemplo, En A. vinelandii las bajas concentraciones de oxígeno disuelto (< 5 mmol/g.h) permiten la obtención de AG de alto peso molecular (> 500 kDa) (Pacheco-Leyva et al., 2016); mientras que los pH menores a 5,5 en el medio de cultivo inhiben a la bacteria, consecuentemente la producción de AG se ve afectada (Clementi et al., 1995). Adicionalmente, los incrementos en la temperatura de 25 a 35 °C favorecen la producción de AG en ~80% (Tabla 2).
Interesantemente, la modificación genética de estas especies de Azotobacter permite incrementar el peso molecular durante la biosíntesis de AG (Núñez et al., 2013). Por ejemplo, en A. vinelandii la inactivación de la actividad de la enzima alginato liasa combinado con una reducción en la concentración de oxígeno disuelto de 5 a 1 % mejora la polimerización de AG, consecuentemente el peso molecular se incrementa significativamente en ~1900 kDa en comparación con las cepas naturales (680 kDa) (Trujillo-Roldán et al., 2003). Por ello, diferentes trabajos se enfoquen en realizar modificaciones genéticas para mejorar su capacidad de sintetizar AG de alto peso molecular en comparación con las cepas naturales de Azotobacter (Tabla 3).
Tabla 2 Parámetros óptimos de proceso para la obtención de AG a partir de especies de Azotobacter

Adaptado desde Pacheco-Leyva et al. (2016) y Clementi et al. (1995).
Tabla 3 Producción de alginato con diferentes cepas modificadas de Azotobacter vinelandii a 29 ± 1 °C
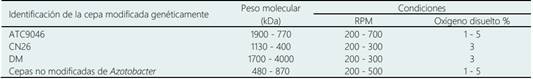
Adaptado desde Trujillo-Roldán et al. (2003); Peña et al. (2002); Flores et al. (2013);Pacheco-Leyva et al. (2016).
3.2. Síntesis y producción de polihidroxialcanoatos (PHA)
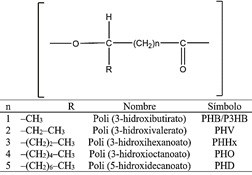
Los polihidroxialcanoatos (PHA) comprenden una familia de poliésteres biodegradables, los cuales son producidos no solo por las especies del género Azotobacter, sino también por una amplia variedad de microorganismos (Chen et al., 2011). Si bien la estructura química de los PHAs está definida en función de la sustitución de su cadena lateral R (Figura 3), también es posible clasificarlos en función de la longitud de su cadena como PHA de cadena corta (consta de 3-5 monómeros de carbono) y PHA de cadena larga (consta de 6-14 monómeros de carbono) (Li et al., 2016).
El proceso de biosíntesis de los polímeros de PHA inicia bajo condiciones limitantes de nutrientes y condiciones adversas en el medio de crecimiento (El-Nahrawy et al., 2018), cuyo proceso se inicia con la conversión de glucosa a piruvato y acetil-CoA para formar acetoacetil-CoA. Luego, la enzima acetoacetil-CoA reductasa convierte este compuesto en 3-hidroxibutiril-CoA, y una polimerasa permite iniciar la polimerización del PHA (Figura 2). El gen responsable de la síntesis de la molécula de ácido polihidroxibutirico es reconocido como phbBAC, mientras que los genes phBP y phBR permiten la polimerización de gránulos de para formar diferentes formas de PHAs (Chen et al., 2011; Fa et al., 2001; Segura et al., 2003).
El poli-3-hidroxibutirato (PHB) y el polihidroxivalerato (PHV) son probablemente los tipos más comunes de PHAs producidos de forma intracelular por ambas especies de A. vinelandii y A. chroococcum (Narendran et al., 2018; Pozo et al., 2002; Yoneyama et al., 2015). La producción de ambos polímeros, puede ser regulada en función de las condiciones del medio de cultivo (Domínguez-Díaz et al., 2015a; El-Nahrawy et al., 2018). Por ejemplo, un incremento en la temperatura de 20 a 30°C mejora en ~58% el rendimiento en la producción de PHB, mientras que las bajas concentraciones de oxígeno disuelto (< 5 mmol/g.h) permiten la obtención de PHB de alto peso molecular (~1600 kDa). Además, es importante considerar que los valores cercanos a pH: 7 mejoran los rendimientos en la producción de este polímero (Tabla 4).
Si bien el peso molecular de ambos polímeros de PHB y PHV varían considerablemente en función de las condiciones de proceso, son finalmente los polímeros de alto peso molecular los más atractivos para la industria, las cuales se pueden conseguir mediante las modificaciones genéticas de las especies de Azotobacter (Mok et al., 2017). Por ejemplo, el peso molecular del PHB producido por las cepas naturales de Azotobacter varía entre 190 - 1600 kDa, mientras que las modificaciones genéticas de estas especies permiten que los polímeros de PHB presenten altos pesos moleculares (> 2000 kDa) (He & Benson, 2016). Por ello, la modificación genética mediante el bloqueo de los genes ptsN y rsmA (genes reguladores negativos para la producción de PHB) ha permitido que las cepas modificadas de Azotobacter puedan producir polímeros de alto peso molecular (Domínguez-Díaz et al., 2015).
Otro aspecto importante a considerar es que las especies de Azotobacter pueden sintetizar simultáneamente ambos polímeros de PHAs y AG (Yoneyama et al., 2015). Por ejemplo, a 30 °C y bajas concentraciones de oxígeno (< 5 mmol/g.h) la producción de PHB es ~2 veces mayor comparada con la producción de AG (Mejía et al., 2010). Sin embargo, el solo hecho de producir ambos compuestos conlleva a un complejo proceso de purificación con la finalidad de separar ambos polímeros de PHB y AG. Por ello, diversos trabajos de investigación han demostrado que es posible bloquear los genes responsables de la producción de alginato con la finalidad de promover solo la producción de PHB o viceversa (Castillo et al., 2013; Flores et al., 2013).
4. Usos y aplicaciones tecnológicas
Si bien ambos biopolímeros de AG y PHAs son producidos simultáneamente por las especies de Azotobacter, la modificación genética puede permitir priorizar la producción de un compuesto en particular con la finalidad de que el proceso de extracción, purificación y comercialización sea económicamente atractivo (Jong-il Choi & Lee 1999). Entonces, según sus propiedades físicas, químicas y térmicas ambos polímeros pueden ser utilizados en sectores de la industria alimentaria, farmacéutica, médica y agronómica.
Tabla 4 Parámetros óptimos de proceso para la obtención de PHB a partir de especies de Azotobacter

Adaptado desde Domínguez-Díaz et al. (2015); El-Nahrawy et al. (2018).
4.1. Alginatos
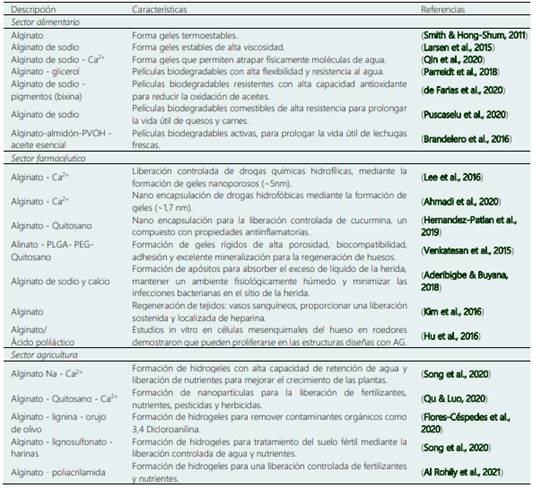
EL AG, un polímero de bajo costo, de naturaleza inerte, biocompatible, biodegradable y e fácil gelación ha despertado el interés de la industria alimentaria, farmacéutica y agricultura (Puscaselu et al., 2020). En particular, Las especies de Azotobacter producen AG acetilado de alto peso molecular, por ello tienen una mayor preferencia como estabilizante y gelificante en la industria alimentaria (Furth et al., 2007). No obstante, este polímero en particular no solo puede ser usado como ingrediente alimentario, sino también puede ser destinado como aditivos en el sector médico debido a su biocompatibilidad, baja toxicidad y bajo costo (Gregory et al., 2012), así como en la mejora de la productividad de diferentes cultivos desde un punto de vista agronómico (Tabla 5).
4.2. Polihidroxialcanoatos (PHA)
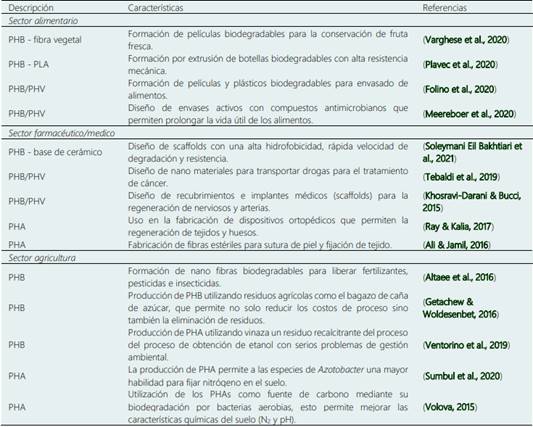
Si bien el PHB y PHV pueden usarse en la fabricación de plásticos biodegradables para reemplazar al plástico sintético debido a su alta biodegradabilidad, así como a sus propiedades físicas y mecánicas; también estos polímeros pueden ser usados en la fabricación de dispositivos médicos debido a su biocompatibilidad y alta resistencia a temperaturas de esterilización. Adicionalmente, desde un punto de vista agronómico, la biodegradación de estos polímeros permite no solo mejorar la flora microbiana aerobia benéfica para los cultivos sino también permiten regular el contenido de N2 en el suelo (Tabla 6).
5. Perspectivas y desafíos
Si bien los polímeros de PHA y AG son producidos por las especies Azotobacter, las características físicas, químicas y mecánicas de cada polímero les confiere usos particulares en el sector alimentario, farmacéutico, médico y agronómico; esto debido a sus propiedades de biocompatibilidad, biodegradación y no toxicidad que ha permitido el desarrollo de muchos trabajos de investigación enfocados en el aprovechamiento de estos polímeros.
No obstante, durante la producción de PHAs se producen diferentes polímeros de manera simultánea entre ellos el PHB y PHV con características química y usos diferentes. Por lo tanto, es importante que desde un punto de vista de biotecnología se desarrollen nuevos estudios que permitan modificar genéticamente estas especies para la producción de un polímero en particular, con la finalidad no solo de reducir los costos de producción, sino también poder establecer nuevos parámetros de producción de estos polímeros.
Con respecto a la producción de AG de fuentes bacterianas como las especies de Azotobacter, este proceso puede ser relativamente costoso sino se maneja a nivel industrial mediante el uso de reactores semicontinuos que controlen las condiciones del medio de cultivo. Por ello, es deseable que las futuras investigaciones se enfoquen en la modificación genética de estas especies con la finalidad de permitir que bajo condiciones normales de crecimiento puedan metabolizar estos polímeros.
Sin lugar a duda, el uso de AG y PHAs en el sector industrial puede llegar a tener diversas ventajas no solo desde un punto de vista económico sino también desde un punto de vista de cuidado del medio ambiente. Por lo tanto, el campo de desarrollo e investigación en ese sector siempre será atractivo debido al constante crecimiento de los sectores alimentario, farmacéutico, médico y agronómico.
6. Conclusiones
Los polímeros de alginato y PHAs son producidos por las especies de Azotobacter, cuyos genes responsables de producir estos polímeros son algD y phbBAC, respectivamente. La modificación genética permite la producción de un polímero de interés disminuyendo significativamente los costos de producción. Las características particulares de ambos polímeros permiten potenciales aplicaciones en la industria debido a su resistencia a la deformación, viscoelasticidad y propiedades de gelificación. Además, estos polímeros presentan una alta biocompatibilidad y biodegradabilidad para futuras aplicaciones en el sector médico. Adicionalmente, ambos polímeros tienen una rápida velocidad de biodegradación a condiciones atmosféricas normales, consecuentemente son amigables con el medio ambiente.