1. Introducción
La piña (Ananas comosus (L.) Merr.) (Bromeliaceae), originaria de América del Sur, es una de las frutas más populares por su capacidad nutracéutica dado su contenido de antioxidantes, vitamina C, carotenoides, minerales y polifenoles (Hajar et al., 2012; Septembre-Malaterre et al., 2016). Sin embargo, a nivel mundial, se han reportado afecciones en follaje, raíces y fruto por diversos fitopatógenos, entre ellos, Erwinia, Phytophthora, Pineapple mealybug wilt-associated virus 1, 2 y 3, Rotylenchulus reniformis y hongos (Ochoa-Martínez et al., 2016; Rohrbach & Schmitt, 2003). De las enfermedades fungosas, son de especial interés, por su impacto económico, la pudrición basal por Chalara paradoxa (=Thielaviopsis paradoxa), Fusariosis por Fusarium subglutinans (=F. moniliforme) y la Mancha Foliar (MF) por Curvularia eragrostidis (Rohrbach & Schmitt, 2003; Korres et al. 2011; Gao et al., 2014; Ferreira et al., 2014; Kusai et al., 2015; Lan-Cheng et al., 2016).
Actualmente el cultivo de la piña está consolidado en la región del Pacífico Centro de México, por lo que resulta crucial el monitoreo de las enfermedades y la identificación de sus agentes causales, con la finalidad de generar programas de manejo eficientes. Gracias a esta estrategia fitopatológica, recientemente Maldonado-Michel et al. (2021) reportaron a C. eragrostidis como agente causal de la MF en plantaciones comerciales de piña “híbrido MD2” en Tecomán, Colima. Sin embargo, poco se conoce sobre su manejo bajo condiciones de campo, por lo que una primera selección in vitro de productos químicos, biológico y/o biorracionales con alta efectividad, es una actividad a considerar para establecer un manejo integrado de la MF (Gaviria-Hernández et al., 2013).
Aunado a ese desconocimiento, se suma que, en las prácticas agronómicas del cultivo de la piña, generalmente se emplean grandes volúmenes de agua (entre 2000 a 3000 L) para realizar aplicaciones foliares por hectárea para el manejo de fitopatógenos, lo que trae consigo problemas para definir una concentración correcta de aplicación de fungicidas químicos y/o biorracionales para el manejo preventivo o curativo de la MF por C. eragrostidis. Por ello, conocer las concentraciones adecuadas de aplicación para obtener una adecuada efectividad y costo beneficio es un factor por considerar en el manejo integrado de la MF. El cual se basa en el manejo cultural [labranza del suelo, uso de láminas de riego adecuadas y desinfección de herramientas (Bartholomew et al., 2002), control biológico [aplicaciones de Trichoderma spp. y Bacillus sp., (Hernández-Mansilla et al., 2006; Sabando-Ávila et al., 2017) y como última instancia, el control químico [aplicación de fungicidas (Hernández-Mansilla et al., 2010)]. Especialmente, si se trata del control químico con fungicidas, estas concentraciones adecuadas permiten mitigar el desarrollo de la resistencia a fungicidas por parte de los agentes causales (Maldonado-Michel et al., 2021).
Curiosamente, a pesar de que la MF por C. eragrostidis no es una enfermedad reciente, para su manejo a través de fungicidas químicos, aún se desconoce la efectividad de los ingredientes (p. e. Metalaxil, Fosetyl-Al, Ácido sulfúrico, Bifloruro de Amonio, Amonio Cuaternario y Sulfato de Cobre, Gluconato de Cobre, Propiconazol, Fenpropimorf, Tiabendazol y Ditiocarbamato) sobre esta especie. Sin embargo, como referencia pudieran emplearse algunos compuestos que se han evaluado contra otras es pecies de Curvularia aisladas de diferentes hospedantes. Por ejemplo, para C. lunata, agente causal de la Mancha Foliar en sábila (Aloe vera (L.) Burm.f.), se ha reportado una efectividad in vitro del 100% con Tebuconazol (0,2%) + Dithane M-45 (0,2%), Propiconazol 70 WP (0,1%) + Dithane M-45 (0,2%), Propiconazol 70WP + Tebuconazol (0,2%) y Carbendazim (0,1%) + Tebuconazol (0,2%). Mientras que otros fungicidas como Carbendazim (0,01%) + Dithane M45 (0,02%) han registrado una menor efectividad (85,43%) (Bahekar et al., 2017).
Complementariamente, en C. lunata aislado de cóleo (Plectranthus rotundifolius (Poir.) Spreng. (=Solenostemon rotundifolius (Poir.) J.K.Morton), Tekade et al. (2017) encontraron que Propiconazol 0,1% y Tricyclozol + Mancozeb 0,2% registraron 100% de inhibición en la germinación del hongo; mientras que Tridemorph 0,1% y Dithane M-45 0,2% tuvieron 96,54% y 93,51% de inhibición de la germinación de esporas. Los valores mínimos se registraron para Carbendazim 0,1%, Clorotalonil 0,2% y Tiofanato M 0,2%, con 30,06%, 35,09% y 49,42% de inhibición, respectivamente.
Es de esperar que los fitopatógenos posean diferente respuesta ante la presión química de los fungicidas. Con base en esto, para el caso de C. eragrostidis se requiere generar la información sobre la efectividad y concentraciones óptimas de aplicación para el control de la MF con fungicidas químicos. Por lo tanto, el objetivo del presente estudio fue evaluar la efectividad in vitro de cinco fungicidas químicos contra C. eragrostidis bajo condiciones de laboratorio.
2. Materiales y métodos
2.1 Curvularia eragrostidis
El hongo fitopatógeno se reactivó en agar papa dextrosa (APD) y se obtuvo de la colección de hongos fitopatógenos de la Facultad de Ciencias Biológicas y Agropecuarias de la Universidad de Colima. La especie fue identificada morfológica y molecularmente por Maldonado-Michel et al. (2021). Además, fue evaluada a través de los postulados de Koch con el fin de determinar su habilidad patogénica en el híbrido de piña “MD2” (Maldonado-Michel et al., 2021).
2.2 Fungicidas químicos
Los fungicidas químicos evaluados se describen en la Tabla 1 y fueron adquiridos en tiendas agropecuarias en Tecomán, Colima, México.
2.3. Bioensayos dosis respuesta
Las concentraciones que se evaluaron de los fungicidas [1,0%, 0,5%, 0,25% y 0,125% (v/v o p/v)], se seleccionaron con base en su viabilidad económica. La inoculación del hongo en las cajas de Petri se realizó a través de un disco de micelio (8 días de edad, 6 mm de diámetro). Las cajas de Petri inoculadas se incubaron a temperatura de laboratorio (25,0±3,0 °C). Para la preparación de las concentraciones se calcularon las cantidades necesarias de los diferentes fungicidas, teniendo en cuenta el volumen final de medio a preparar por caja de Petri (20 mL de ADP+ fungicida). Los productos químicos requeridos se expresaron en g/L para los productos sólidos y en mL/L para los líquidos. Con el fin de evitar que las cajas con el medio más el fungicida se contaminaran, la mezcla se realizó en la cámara de flujo laminar (Labconco, E.U.A). Por último, se mezcló hasta lograr la homogeneización completa del medio de cultivo con los fungicidas.
Tabla 1 Características de fungicidas químicos evaluados contra Curvularia eragrostidis agente causal de la mancha foliar en piña híbrido “MD2”
| Producto | Ingrediente activo | Dosis | Concentraciones (%) i. a. |
| System Cu | Cobre + Gluconato de cobre | 4,0 mL/L | 14 y 35,6 |
| Tilt 250 CE | Propiconazol | 0,5 L/ha | 25,5 |
| Volley® 88 OL | Fenpropimorf | 1,0 L/ha | 93 |
| Tecto® 60 | Tiabendazol | 700 g/ha | 60 |
| Mancozeb 80 WP | Ditiocarbamato | 2,0 L/ha | 80 |
i. a. Ingrediente activo.
2.4. Variables de respuesta
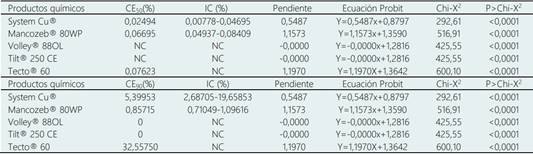
La tasa de crecimiento diaria del micelio (TCD) se calculó a partir del crecimiento diametral de la colonia, el cual se midió cada 24 h por siete días. El crecimiento diametral se sustituyó en la fórmula: TCD= [(R1 - R0) / (T1 - T0) / n], donde n= número de evaluaciones, R1 y R2 fueron el crecimiento diametral del hongo (mm) en los tiempos T1 y T2 (días) (Baldrian & Gabriel, 2002). El porcentaje de inhibición del crecimiento micelial (%ICM) se determinó con la ecuación: %ICM= [(C-T)/C] x 100%, donde C= diámetro del micelio en la caja de Petri del tratamiento testigo (mm) y T= diámetro del micelio en la caja del tratamiento con fungicida (mm) (Bahekar et al., 2017). La concentración efectiva media (CE50) y concentración efectiva noventa (CE90) se calculó empleando los porcentajes de inhibición en cada concentración de cada producto por medio de un análisis Probit, a través del software Statistical Analysis System (SAS, 2002) versión 9,0 para Windows (Manzo-Sánchez et al., 2018).
2.5. Diseño experimental
Se empleó un experimento dosis respuesta con cinco fungicidas y cuatro concentraciones de cada uno y un control (sin fungicida) empleando un diseño completamente al azar (Manzo-Sánchez et al., 2018). Cada concentración y control se estableció con seis repeticiones con un total de 126 unidades experimentales. Una unidad experimental, consistió en una caja de Petri con 20 mL de APD con la concentración de fungicida a evaluar.
2.6. Análisis de datos
Para la TCD y el %ICM se realizó un análisis de varianza y una comparación de medias empleando la diferencia mínima significativa (DMS) con 0,05 de significancia para ambas pruebas. Los datos del %ICM se transformaron con la ecuación: arcsen (% ICM/100)1/2 para lograr una distribución aproximada a la normal y su posterior análisis. Además, se determinó un análisis de regresión lineal (Y=mX+b) entre la concentración de los productos (X) y los porcentajes de inhibición (Y) con una significancia de 0,05, para conocer su relación directa (Manzo-Sánchez et al., 2018).
3. Resultados y discusión
3.1 Tasa de crecimiento diaria (TCD)
El análisis de varianza mostró efecto de los fungicidas evaluados comparado al control sobre el crecimiento de C. eragrostidis obteniendo diferencias altamente significativas (P=0,0001). El control exhibió una TCD de 1,59 cm/día a los cinco días de incubación (Tabla 2). Los productos Volley® y Tilt® registraron en las cuatro concentraciones evaluadas nulo crecimiento, sin diferencias significativas entre las concentraciones evaluadas. Para System Cu®, las concentraciones de 0,25 (0,19 cm/día), 0,5 (0,16 cm/día) y 1,0% (0,13 cm/día) presentaron las menores TCD en comparación con la concentración 0,125 (0,55 cm/día) y el control (1,59 cm/día). En cuanto al Mancozeb® 80WP, las TCD estadísticamente más bajas se encontraron en las concentraciones de 0,5 (0,02 cm/día) y 1,0% (0,0 cm/día), mientras que las concentraciones de 0,25 y 0,125% permitieron TCD de 0,31 y 0,54 cm/día, respectivamente; todas estas, estadísticamente menores al control (1,59 cm/día). Para el Tecto® 60, la TCD más baja se encontró en la concentración al 1,0% (0,39 cm/día), similar a la TCD en la concentración al 0,5% (0,44 cm/día), pero estadísticamente diferente a las TCD de las concentraciones 0,25 y 0,125% con 0,49 y 0,56 cm/día, respectivamente.
El presente estudio reporta concentraciones de fungicidas químicos y su efecto en la TCD de C. eragrostidis. Este fitopatógeno no se ha estudiado ampliamente |como agente causal de la MF en la producción de piña (híbrido MD2) en el Pacífico Centro de México. Sin embargo, C. eragrostidis se ha reportado en cultivos de piña en Brasil (Ferreira et al., 2014). Mientras que en otros países como en Nicaragua (García-Osorio and Orozco-Gómez, 2016) y China (Lan-Cheng et al., 2016) se ha reportado a Curvularia clavata, como agente causal de la MF en piña.
Tabla 2 Tasa de crecimiento diaria (cm/día) in vitro de Curvularia eragrostidis bajo diferentes concentraciones de fungicidas químicos
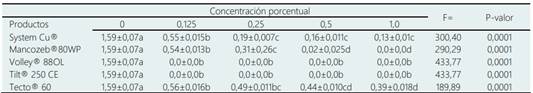
Medias (±error estándar) entre columnas con literales diferentes son significativamente diferentes entre sí (DMS, P ≤ 0,05).
Por otra parte, existen estudios similares bajo condiciones in vitro contra Curvularia lunata, agente infeccioso del follaje de Zea mays, Aloe vera y Solenostemon rotundifolius. Por lo general, C. lunata tiene un rápido crecimiento micelial en condiciones in vitro con un diámetro promedio de las colonias a los siete días de edad de 8,4 cm (Bahekar et al., 2017). Otros reportes, indican un crecimiento menor de C. lunata con 5,78 cm de diámetro a los 7 días (Tekade et al., 2017), por el contrario, C. eragrostidis posee un crecimiento de 8,6 cm de diámetro a los 7 días.
3.2 Porcentaje de inhibición
Los productos con mayor inhibición sobre C. eragrostidis fueron Volley® y Tilt® al presentar 100% en todas las (Tabla 3,Figura 1). System Cu® (F=6,76, P=0,0025) resultó efectivo para la inhibición del crecimiento de C. eragrostidis, las inhibiciones oscilaron entre 65,2 y 78,2% en las cuatro concentraciones evaluadas. Mancozeb® 80WP (F=70,59, P=0,0001) registró inhibición en todas las concentraciones, la más alta registró 90% (1%) y la más baja presentó 62,99% (0,125%). Tecto® 60(F=14,15, P=0,0001) presentó un bajo porcentaje de inhibición, el valor más alto fue en la concentración del 1,0% con 62,01% de inhibición, mientras que el valor más bajo que mostró fue 57,06% de inhibición (Tabla 3,Figura1).

Figura 1 Crecimiento de las colonias de Curvularia eragrostidis en medio de cultivo ADP con cuatro concentraciones (0,125, 0,25, 0,5 y 1,0%) de cinco fungicidas químicos.
En estudios previos, Cristóbal-Alejo et al. (2013) evaluaron la efectividad de los fungicidas sistémicos Azoxystrobin, Benomyl, Fosetil Aluminio (Fosetil Al), Tiabendazole, Imazalil y Procloraz con un testigo sin aplicación de fungicida contra C. lunata. El ingrediente activo que presentó el mayor porcentaje (100%) de inhibición fue Imazalil, mientras que los tratamientos con el Fosetil-Al y Procloraz inhibieron del 75 al 100%. Estos valores son similares a los obtenidos con Tecto® 60 (Tiabendazol) al presentar inhibiciones entre 57,06 y 62,01 %. Tekade et al. (2017) evaluaron la eficacia de fungicidas contra C. lunata, agente causal del tizón del coleo (Solenostemon rotundifolius) en condiciones de laboratorio. Los autores encontraron que todos los productos químicos evaluados fueron efectivos en la reducción de la germinación y significativamente superiores al control. El Propiconazole 0,1% y Tricyclozole + Mancozeb 0,2% fueron efectivos y registraron 100% de inhibición. En cuanto a Tridemorph 0,1% y Dithane M-45 0,2% registraron el 96,54% y 93,51% de inhibición del hongo. En comparación con los productos químicos que se evaluaron, como Volley® 88OL (Fenpropimorf) y Tilt® 250 CE (Propiconazol) estos fungicidas obtuvieron en todas sus concentraciones a 1, 0,5, 0,25 y 0,125% el 100% de inhibición. Por lo tanto, estos fungicidas son candidatos para futuros estudios en campo.
En otro estudio, Bahekar et al. (2017) evaluaron grupos de fungicidas a diferentes concentraciones para la inhibición in vitro de C. lunata aislada del cultivo de sábila (Aloe vera). La combinación de ingredientes activos mostró más eficiencia para inhibir al fitopatógeno, Tebuconazol (0,2%) + Dithane M-45 (0,2%), Propiconazol 70 WP (0,1%) + Dithane M-45 (0,2%), Propiconazol 70WP + Tebuconazol (0,2%) y Carbendazim (0,1%) + Tebuconazol (0,2%) mostraron 100% de inhibición. Estos resultados son similares a los encontrados en este estudio con Tilt® 250 CE (Propiconazol) y Volley® 88OL, al mostrar 100% de inhibición en todas las concentraciones evaluadas. Asimismo, Kotramma et al. (2018) realizaron la evaluación de diferentes fungicidas contra C. lunata, aislado de maíz, a diferentes concentraciones (0,1, 0,2 y 0,3%), Mancozeb® mostró 100% de inhibición en la concentración más alta (0.3%). Este resultado se asemeja a lo encontrado con C. eragrostidis, al inhibir su crecimiento en un 100% por efecto de Mancozeb® al 1,0%.
3.3 Concentración efectiva media (CE50) y noventa (CE90)
La CE50 representa la concentración de los productos quí micos que se requiere para inhibir el 50% y CE90 corres ponde a la concentración requerida para inhibir el 90% del crecimiento de C. eragrostidis bajo las condiciones evaluadas. La CE50 y CE90 para Volley® 88OL y Tilt® 250 CE no fueron calculadas por el software ya que no existió crecimiento del hongo, por lo tanto, estos fungicidas son ideales para usarse en las concentraciones más bajas para la reducción del crecimiento del fitopatógeno. La CE50 para System Cu®, Mancozeb® 80WP y Tecto® 60 fue de 0,02494, 0,06695 y 0,07623%, respectivamente (Tabla 4). El producto químico que mostró la CE50 y CE90 más baja fue System Cu® con 0,02494% y 5,39%, respectivamente (Tabla 4). Mancozeb® registró efecto sobre el hongo mostrando una CE50 de 0,06695% y CE90 de 0,85715%. Por otro lado, Tecto® 60 fue el que registró menor efecto contra el hongo ya que se obtuvo una CE50 0,07623% y CE90 32,55750%. Si se desea tomar los valores de CE50 para aplicaciones en campo, teóricamente para los productos: System Cu®, Mancozeb® 80WP y Tecto® 60 se requiere 0,049 L/ha, 0,133 kg/ha y 0,1524 kg/ha, respectivamente, para observar un efecto significativo (visual) en el control del hongo. En cuanto a la CE50 son escasos los estudios para los diversos fitopatógenos en piña, incluyendo a C. eragrostidis. Lo más cercano para el Tilt® 250 CE es su alta eficacia contra hongos anamorfos, al respecto Arahana et al. (2012) reportaron una CE50 menor a 1,15x10−5 µg/mL para inhibir la germinación de Monilinia sp., agente causal de la pudrición en durazno. En otro reporte, Adaskaveg et al. (2005) reportaron la eficacia del Tilt® 250 CE para deducir la incidencia de la pudrición café del durazno en postcosecha (> 5%).
3.4 Correlación lineal: inhibición vs concentración
Mancozeb® 80WP mostró un coeficiente de determina ción (r) alto a comparación de los demás fungicidas con un valor de r = 0,7123 y P = 0,0001, esto quiere decir que existe una fuerte relación entre la concentración de Mancozeb® 80WP y la inhibición del hongo, por lo que, a mayor concentración empleada, se encontrará una mayor inhibición (Figura 2). Por otra parte, el Tecto® 60 mostró un coeficiente de determinación de r = 0,4493 y P = 0,0003, sugiriendo que no existe una fuerte relación lineal entre el incremento en la inhibición de C. eragrostidis respecto a la concentración del fungicida, es decir se obtiene el mismo porcentaje de inhibición al emplear las concentraciones 1%, 0,5%; 0,25% y 0,125%. Mientras que System Cu® mostró un coeficiente de determinación bajo con un valor de r = 0,4094 y P = 0,0008 existiendo una baja relación entre la concentración y la inhibición del fitopatógeno. Mientras que Volley® 88OL y Tilt® 250 CE no presentaron significancia en el modelo lineal en la determinación del coeficiente de regresión, por lo que sugiere que las cuatro concentraciones poseen el mismo porcentaje de inhibición del hongo.
Tabla 3 Porcentaje de inhibición in vitro de Curvularia eragrostidis bajo diferentes concentraciones de fungicidas químicos
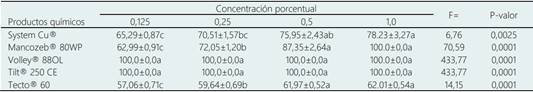
Medias (±error estándar) entre columnas con literales diferentes son significativamente diferentes entre sí (DMS, P ≤ 0,05).
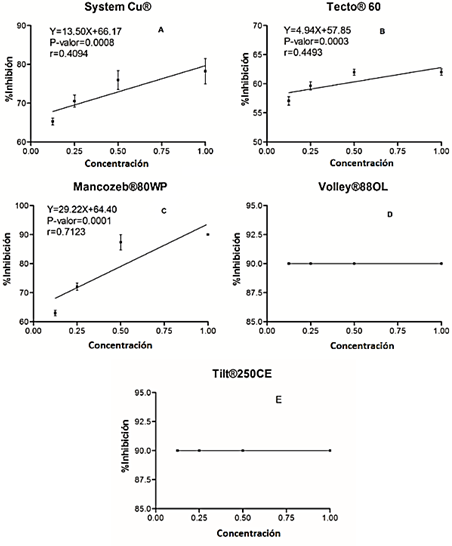
Figura 2 Regresión lineal entre la inhibición (%) del crecimiento de Curvularia eragrostidis y las concentraciones de productos químicos: A) System Cu®, B) Mancozeb® 80WP, C) Tecto® 60, D) Volley® 88OL y E) Tilt® 250 CE.
4. Conclusiones
Los fungicidas Volley® 88OL y Tilt® 250 CE redujeron el crecimiento de C. eragrostidis en todas las concentraciones estudiadas. El modelo Probit se ajustó solo para tres fungicidas, la CE50 más baja la obtuvo el System Cu®, seguido del Mancozeb® y Tecto® 60. Los cinco fungicidas estudiados fueron capaces de inhibir el crecimiento de C. eragrostidis en diferente porcentaje; por lo tanto, se deben realizar estudios epidemiológicos de la MF en Piña ante la aplicación de estos fungicidas para definir su efectividad en campo.