1. Introducción
El banano Musa spp (Musaceae) es un cultivo tropical perenne de rápido crecimiento, y constantes cosechas durante todo el año (Dadrasnia et al., 2020). Actualmente, este cultivo se produce en Asia (54,1%), América (25,5%), África (18,4%). El banano es un fruto muy popular en la alimentación humana, produciéndose en más de 135 países como; la India con 30 Millones de toneladas (Mtn), China (11 Mtn), Indonesia (7 Mtn), Brasil (6,8 Mtn) y Ecuador (6,5 Mtn) y Filipinas (6 Mtn) (FAO, 2019). En Perú, la variedad Cavendish es muy importante en el desarrollo socioeconómico del país con 15,000 hectáreas (ha) dedicadas al cultivo de banano orgánico, produciéndose significativamente en Piura, seguido de Lambayeque, Tumbes y La Libertad (Ministerio de Agricultura y Riego [MINAGRI], 2019). Este cultivo se ve seriamente amenazado por las diferentes enfermedades bacterianas, que causan importantes pérdidas económicas, afectando de esta manera la cadena de productiva del banano (Dadrasnia et al., 2020), cabe resaltar, uno de los principales problemas que enfrentan los productores bananeros del valle del Chira, es la pudrición blanda del pseudotallo, produciendo el colapso y muerte de plantas. La pudrición blanda es causada por los géneros de Pectobacteriaceae; Pectobacterium y Dickeya, que se caracterizan por su agresividad y producción de síntomas, mediante degradación enzimática de la pectina de los tejidos vegetales afectando la firmeza tisular de las plantas (Hugouvieux-Cotte-Pattat et al., 2014). Las pectobacterias de la pudrición blanda, se encuentra en todos los continentes y frecuentemente en zonas en donde se cultivan sus hospedantes. Sin embargo, su diversidad e impacto económico depende en gran medida de la diversidad de los cultivos agrícolas, las condiciones agroclimáticas y de su interés comercial (Van der Wolf et al., 2021). Cabe mencionar que el cultivo de la papa se ve seriamente afectado por estas Pectobacterias, así también otros cultivos de interés comercial y económico como: maíz, arroz, y banano. Por otro lado, el gran interés comercial de estos cultivos ha permitido la dispersión y propagación de estas Pectobacterias en los diferentes nichos ecológicos en el mundo (Toth et al., 2021; Charkowski, 2018; Ma et al., 2007). En el banano se ha reportado la presencia de agentes bacterianos causantes de la pudrición blanda como; Dickeya zeae en China (Zhang et al., 2014), D. paradisiaca en América del Sur y Central (Blomme et al., 2017), D. paradisiaca y P. carotovorum en la India (Gokul et al., 2019), entre otros países. El 2009, en China se reportó la presencia de pudrición blanda causado por D. zeae ocasionando pérdidas hasta en un 82% de su rendimiento en la zona infectada, con una incidencia que osciló entre 20% al 70% llegando hasta un 90%, asimismo, provocó la muerte de plantas en campo una semana después de la aparición de síntomas (van der Wolf et al., 2021; Zhang et al., 2014). Actualmente, en la región Piura-Perú no hay información descrita, ni investigaciones sobre la situación de esta enfermedad, y dada la importancia por su valor económico y su aporte a la seguridad alimentaria se plantearon los siguientes objetivos; aislar e identificar el agente causal de la pudrición blanda en campos bananeros del valle del Chira e implementar alternativas de manejo.
2. Materiales y métodos
2.1 Muestreo y recolección
Las muestras se obtuvieron de plantas de banano con síntomas de pudrición blanda en el pseudotallo procedentes de diferentes sectores del valle del Chira. Se extrajeron pequeños segmentos de tejido infectado, y se colocaron en bolsas de papel kraft. Las muestras fueron llevadas al laboratorio de Fitopatología de la Universidad Nacional de Piura para su análisis. El valle del Chira - Piura se encuentra ubicado a una altitud de 60 msnm, con una temperatura media de 24,4 °C, 63,7% de humedad relativa y 110,3 mm de precipitación anual (Távara, 2020).
2.2 Aislamiento bacteriano
Se tomó una pequeña porción de tejido con síntomas de pudrición blanda, se introdujeron en tubos de ensayo conteniendo 10 mL de agua destilada estéril, dejando en reposo durante 10 minutos para asegurar la liberación de células bacterianas. Luego, se realizó diluciones sucesivas hasta 10-8, y con ayuda de un asa de Kolle estéril se trazaron 4 líneas en placas de Petri con medio AN (agar nutritivo) e incubadas a 29±1 °C durante 24 horas.
2.3 Características culturales, morfológicas y bioquímicas
Se evaluó las características: culturales en medio AN (Snehalatharani & Khan, 2010), morfológicas mediante: tinción simple, Gram, tinción de flagelos (Skerman, 1960), y se sometieron a pruebas bioquímicas convencionales como: pruebas de catalasa, actividad pectolítica, hidrolisis de gelatina (Dickey & Kelman, 1988), prueba de TSI (Triple Azúcar Hierro); fermentación de lactosa en medio McConkey, la sensibilidad a la eritromicina, crecimiento en AN conteniendo 5% de NaCl (Schaad et al., 2001), crecimiento a diferentes temperaturas en AN (Shrestha et al., 2005).
2.4 Pruebas de patogenicidad
2.4.1 En laboratorio in vitro
Se utilizó segmentos del pseudotallo de dos meses de edad, desinfectándose la parte externa con alcohol al 70% durante 30 segundos, además fueron inmersos en una solución de hipoclorito de sodio al 1,5% durante 3 minutos, posteriormente se lavó con agua destilada estéril. La inoculación se realizó en cortes en forma de “V” en el centro del tejido, adicionando 0,5 mL de suspensión bacteriana (3 x 108 UFC/mL) incubadas durante 24 horas (Llanos, 1967).
2.4.2 En invernadero in vivo
Se emplearon hijuelos sanos de tres meses de edad, sembrados en envases de 10 L de volumen conteniendo sustrato estéril en proporción 1:1 (arena de río, suelo agrícola). Los hijuelos fueron inoculados con 0,5 mL de suspensión bacteriana (3 x 108 UFC/mL) incubadas durante 24 horas, a 10 cm de altura sobre el nivel del sustrato. El testigo se inoculó con agua destilada estéril (Llanos, 1967).
2.5 Prueba de virulencia en rango de hospedantes
Se utilizó zanahoria, cebolla y tubérculos de papa, lavados con agua potable e inmersos en una solución de hipoclorito de sodio al 1,5% durante 2 minutos, luego se enjuagaron con agua destilada estéril, y con ayuda de un bisturí estéril se realizó una incisión en el centro del fruto. Se inoculó con 0,5 mL de suspensión bacteriana (3 x 108 UFC/mL) incubadas durante 24 horas. El testigo se inoculó con agua destilada estéril (Llanos, 1967).
3. Resultados y discusión
3.1 Sintomatología
En Pseudotallo, los síntomas se inician con manchas necróticas blandas de aspecto húmedo en la zona del corte de las vainas externas del pseudotallo, avanza hacia la parte basal llegando a infectar entre 50% a 70% de la capa externa (Figura 1c) y como síntoma avanzado se observa pudrición acuosa de coloración marrón oscuro con olor fétido. A medida que transcurren los días, y en los meses de verano donde la temperatura máxima llega a 37 °C (enero a marzo) las plantas pierden vigor, las hojas del tercio inferior se muestran amarillentas, se necrosan y colapsan. La severidad de la enfermedad reduce el diámetro del fuste entre 12 a 15 cm respecto a las plantas sanas llegando a medir hasta 48 cm. (plantas infectadas) afectando, de esta manera, el tamaño de la racima, número de dedos y su calidad (Figura 1a). Así mismo, al reducir el diámetro del pseudotallo sufre ruptura al no poder soportar el peso de la racima (Figura 1b), y a nivel de rizoma se observó pudrición acuosa de olor fétido (figura 1d). Las características de los síntomas descritos coinciden con Blomme et al. (2017) y Ordosgoitty et al. (1974), siendo probable que la bacteria llega a la parte interna del rizoma por el daño del picudo Cosmopolites sordidus.
Augura (1997) y Gokul et al. (2019) indican que la pudrición acuosa se extiende desde la parte superior e inferior hasta alcanzar la base de la vaina, y desde la parte externa hasta la interna del pseudotallo llegando infestar hasta la parte interna de las vainas y rizoma, generando el colapso de la planta. La incidencia de la enfermedad es favorecida por diversos factores como alta densidad de plantas, riego por aspersión, deshierbos inoportunos, mala nutrición, falta de desinfección de las herramientas de trabajo (machete y/o cuchillas), napa freática alta y otros (Blomme et al., 2017). Rivera & Ezavin (1980) observaron síntomas adicionales en plantas “Cavendish” (AAA) como la pudrición de la vaina de color crema a marrón oscuro a nivel del suelo, y posterior la formación de una cavidad necrótica en el rizoma.

Figura 1 Sintomatología de pudrición blanda por Pectobacterium chrysanthemi en el cultivo de banano A) diámetro del fuste muy reducido y racima pequeña, B) ruptura del pseudotallo, C) pudrición necrótica y blanda en las capas externas del pseudotallo, D) pudrición acuosa en el del rizoma, daño del picudo (flecha roja).
3.2 Aislamientos bacterianos
Se aislaron y se codificaron 11 cepas bacterianas de los diferentes sectores y distritos del valle del Chira-Piura (Tabla 1).
3.3 Identificación
3.3.1 Características culturales y morfológicas
En medio de cultivo AN, las colonias presentaron; consistencia mucoide-brillante de color amarillo cremoso, forma circular, convexa con bordes enteros, estos rasgos son característicos del género Erwinia spp coincidiendo con las descritas por Agrios (1995). La tinción simple y Gram permitió observar la morfología de los aislados bacterianos que fueron forma de bacilo, coloración rojo perteneciente al grupo Gram negativo (-). Según García (2000), indica que las bacterias Gram (-) no retienen el colorante cristal violeta Gram y se tiñen con facilidad con safranina Gram, debido a las escazas capas de peptidoglucano. La tinción de flagelos permitió observar su naturaleza perítrica, resultados similares obtuvo Brenner et al. (2005) indicando que las bacterias del género Pectobacterium se caracterizan por presentar flagelos perítricos.
3.3.2 Caracterización bioquímica
Todos los aislados bacterianos tuvieron una reacción positiva a la prueba de la catalasa, produciendo una reacción efervescente al agregar alícuotas de peróxido de hidrogeno (H2O2) (Figura 2a). Asimismo, Ragavil et al. (2019) reportan una reacción positiva en la prueba de la catalasa para el género Pectobacterium. La actividad pectolítica, se observó en la degradación y formación de hendiduras en la superficie del medio CVP (Cristal Violeta Pectato) (Figura 2b). Esta degradación evidencia la actividad de las especies pectinolíticas, permitiendo identificar el género Pectobacterium spp. = Erwinia spp., estos resultados coinciden con los obtenidos por Cuppels & Kelman (1974) en cuanto a la selectividad del medio CVP para aislar Pectobacterium spp. de plantas con presencia de pudrición blanda en tubérculos de papa. Para la hidrolisis de gelatina, la reacción fue positiva observando una consistencia acuosa a liquida de los aislados (licuefacción) (Figura 2c), resultados que coincide con lo reportado por Schaad (2001), en la identificación de P. carotovorum y P. chrysanthemi. En medio de cultivo TSI (triple azúcar hierro) los aislados A2M, A3Ma, A5Mall, A7VF, A9Sa y A10 se evidenció la presencia de dióxido de carbono (Figura 2d), sin embargo, en los aislados A6Q y A11Sal no se presentó. Resultados similares fueron obtenidos Kado (2006) citado por Ragavil et al. (2019) en medio de glucosa de extracto de levadura con carbonato de calcio (YGC) un medio específico para especies de Pectobacterium; que produce la segregación y liberación del carbonato como dióxido de carbono. En medio McConkey la reacción fue positiva para la colonia de aislados (A2M, A3Ma, A5Mall, A7VF, A9Sa, A10, A6Q, A11Sal) los cuales tomaron una coloración rosada, indicando de esta manera la capacidad de fermentar lactosa (Figura 3a).
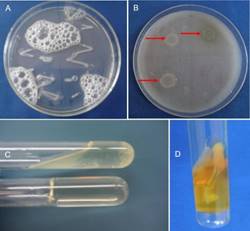
Figura 2 Caracterización bioquímica de aislados bacterianos: A) prueba de catalasa positiva por la presencia de burbujas efervescentes, B) presencia de hendiduras en la superficie del medio CVP, C) licuefacción del medio Gelatina Nutritiva con todos los aislados y D) presencia de gas en el fondo del medio TSI con los aislados A2M, A3Ma, A5Mall, A7VF, A9Sa y A10Que.
3.4 Pruebas diferenciales
Sensibilidad a eritromicina. Los aislados A2M, A3Ma, A5Mall, A7VF, A9Sa, A10, reaccionaron en forma positiva desarrollando halos de inhibición (Figura 3b), a diferencia de los aislados A6Q, A11Sal. Según García (2000), P. chrysanthemi y P. carotovorum ssp. atroseptica son sensibles y desarrolla un halo inhibitorio frente eritromicina y P. carotovorum ssp. carotovorum no desarrolla el halo inhibitorio en presencia de eritromicina. Todos los aislados a 5ºC mostraron un desarrollo negativo, no obstante, a 28, 30,36, 37 y 45ºC su desarrollo fue positivo para los aislados A2M, A3Ma, A5Mall, A7VF, A9Sa, A10, a diferencia de los aislados A6Q y A11Sal a 45ºC no mostraron desarrollo (Figura 3cyTabla 2). García (2000) indica que P. chrysanthemi agente causal de la pudrición blanda y pierna negra en papa, se desarrolló a 28, 30, 35, 36, y 45°C, pero no entre 3 a 6°C; además reporta que P. c. ssp. carotovorum no se desarrolla a 3, 6 y 45°C a diferencia de P. c. ssp. atroseptica que muestra un desarrollo entre 3 a 6 °C. Todos los aislados mostraron ser tolerantes a NaCl presentando un desarrollo normal de la colonia (Figura 3dyTabla 2). García (2000), indica también que D. chrysanthemi, P. c. ssp. atroseptica y P. c. ssp. carotovorum se desarrolla en forma normal en medios con NaCl 5%.
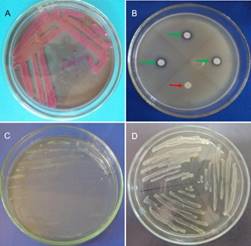
Figura 3 Pruebas diferenciales de los aislados: A) colonia de color rojo rosado en medio McConkey, B) halos de inhibición (flecha verde) con eritromicina en los aislados A2M, A3Ma, A5Mall, A7VF, A9Sa y A10, testigo (flecha roja) C) crecimiento de colonias a 45°C y D) desarrollo de colonias bacterianas en medio AN con 5% de NaCl.
3.5 Pruebas de patogenicidad
Los primeros síntomas in vitro e in vivo se observaron a los 3 días después de la inoculación (ddi) presentando manchas necróticas con aspecto húmedo en la zona de inoculación, avanzando hacia la parte superior e inferior de esta, cubriendo la capa externa e interna del pseudotallo, luego entre los 7 a 15 ddi los síntomas fueron más remarcados observando la necrosis, pudrición acuosa y el olor fétido del tejido (Figura 4). Resultados similares fueron obtenidos por Ordosgoitty et al. (1974), quienes reportan en el cultivo de plátano los síntomas iniciales de la pudrición 3 ddi, y 7 ddi la pudrición es más remarcada, resultados que difieren de los obtenidos por Ragavil et al. (2019) y Thomas et al. (2008). En condiciones in vivo, los síntomas se presentaron 6 ddi, observándose una coloración amarillenta en hojas inferiores a superiores y a 16 ddi se presentó la pudrición completa del pseudotallo y con olor fétido.

Figura 4 Patogenicidad en trozos de pseudotallo, A) se observa manchas necróticas de aspecto húmedo en la zona de inoculación, B) pseudotallo sano en el testigo.
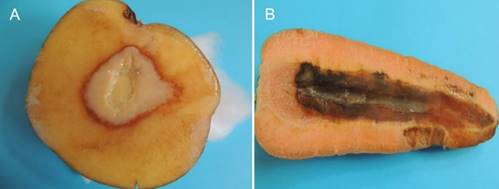
Los síntomas de pudrición blanda en hospedantes como: tubérculos de papa, zanahoria (Figura 5) y en bulbos de cebolla, se observaron a los 2 ddi y 7 ddi los síntomas de pudrición fueron más remarcados junto a la emisión del olor fétido. Resultados similares fueron obtenidos por Nabhan et al. (2012) citado por Ragavil et al. (2019) en rodajas de papa y zanahoria inoculadas con las cepas bacterianas 2 a 7 ddi. Ragavil et al. (2019) registró un mínimo de 3 ddi para la pudrición completa en el tubérculo de la papa y 4 ddi para la pudrición de la zanahoria, con máximo de 5 a 7 ddi para este último, estos resultados difieren de los obtenidos por Doolotkeldieva et al. (2016) quienes observaron una pudrición completa de la zanahoria 14 ddi.
3.6 Manejo integrado de pudrición blanda
El manejo de la enfermedad está basado en el uso de hijuelos certificados, buen drenaje en campo, corrección de deficiencias nutricionales, difusión de la etiología del patógeno y la enfermedad, aplicaciones de materia orgánica 20 t/ha, aplicaciones preventivas antes de los meses de verano sulfato de cobre granulado al voleo 5 kg/ha antes de los meses de verano (Aguilar-Anccota et al., 2021; Teixeira et al., 2021). Haddad et al. (2018), Pegg et al. (2019), Martínez-Solórzano et al. (2020) mencionan que el Manejo Integrado de Enfermedades (MIE), busca garantizar la sanidad e inocuidad del cultivo realizando aplicaciones de enmiendas orgánicas, usando agentes de biocontrol para la supresión de los patógenos, coberturas vegetales (mejorarán las características físicas, químicas y biológicas del suelo, reducen pérdidas de agua de riego), la aplicación de fertilizantes inorgánicos apropiados mejoran los rendimientos y controlan plagas y enfermedades. En los últimos años, el uso irracional de agroquímicos ha impactado en forma negativa en el medio ambiente, salud de los seres vivos y en la económica, generando un interés en la búsqueda de alternativas armoniosas y respetuosas con el medio ambiente basados en el control biológico de enfermedades (Dadrasnia et al., 2020). Dita et al. (2018) citado por Aguilar-Anccota et al. (2021) reportan que la aplicación de materia orgánica es esencial para la salud del suelo y supresión de patógenos, favoreciendo el desarrollo de microorganismos beneficiosos como Pseudomonas fluorescens, Bacillus spp. entre otros. Dignam et al. (2019) citado por Aguilar-Anccota et al. (2021) indican que los suelos supresivos a fitopatógenos poseen una mayor riqueza y diversidad de bacterias como Bacillus spp., Chthonomonas spp., Pseudomonas spp. y Tumebacillus spp. entre otros, remarcando sus mecanismos de competitividad y antagonismo. Vargas (2017) con la aplicación de B. subtilis cepa QST713 y B. pumilus QST2808 obtuvo mayor efecto antagonista, disminuyendo en 80% de incidencia de la pudrición blanda en frutos de banano. Rao et al. (2017), observaron la supresión de vermicompost enriquecido con B. subtilis IIHR BS-2, en el desarrollo de enfermedades bacterianas, fúngicas y nematodos, así también, mejoró el rendimiento en el cultivo de zanahoria. La aplicación B. subtilis dirigida al suelo en el momento de la siembra demostró ser una alternativa prometedora en el control biológico de la pudrición del rizoma del banano (Rajamanickam et al., 2018). Se observó que B. subtilis MJMP2 produce compuestos lipopéptidos y metabolitos secundarios que poseen actividades antimicrobianas contra patógenos vegetales (Cheng et al., 2016). El uso de B. amyloliquefaciens KC-1 durante el período de crecimiento de las plantas es una estrategia eficaz para la prevención de la pudrición blanda en el cultivo de col china (Cui et al., 2019). Antagonistas P. fluorescens SC3, P. parafulva SC11 y B. velezensis tuvieron efecto inhibitorio sobre D. zeae y mejoraron el rendimiento del cultivo de banano (Li et al., 2020). Voisard et al. (1989) y Keswani et al. (2020) reportan a P. fluorescens habita en la rizósfera, y produce metabolitos secundarios 2,4-diacetilfloroglucinol, pioluteorina, pirrolnitrina, fenazinas y cianuro de hidrógeno e indican su efecto promotor de crecimiento (rizobacterias) en plantas, además, producen sideróforos contribuyendo a la supresión de enfermedades. A partir de Bacillus spp. endófitos se desarrolla biopesticidas para supremir el desarrollo de enfermedades bacterianas de una manera ecológica (Sarangi & Ramakrishnan, 2017). Los compuestos a base de cobre (Cu) tienen efecto bactericida, liberando de forma lenta y constante el ion Cu2+ en contacto con el agua, siendo absorbidos por las células bacterianas hasta que su acumulación resulta ser letal. Los cúpricos actúan por contacto y en manera preventiva, formando una barrera protectora en la superficie del tejido vegetal (Heck et al., 2019). La resistencia inducida con ácido salicílico a 1000 ppm promovió la inmunidad endógena contra P. carotovorum subsp. carotovorum, e indujo el crecimiento vegetal, cumpliendo un papel importante en el manejo de la pudrición blanda del banano (Kalaivanan et al., 2020). La bacteria Enterobacter cloacae subsp. dissolvens es usado en el control de la pudrición blanda en patatas en Egipto (Marei et al., 2020). Fertilización adecuada y equilibrada, complementado con calcio (Ca) es el factor más importante para el control de enfermedades (Rahman & Punja, 2007; Aurivan et al., 2017). Fernández et al. (2013) compararon diversas medidas de MIE y concluyeron que la desinfección de herramientas con NaOCl (3,5%) reducen hasta en un 80% la enfermedad producida por D. paradisiaca en plátano. Así también, el control del agente diseminador y predisponente como el picudo (C. sordidus), reduce la incidencia de la enfermedad en campo (Blomme et al., 2017). Actualmente, se usan diferentes estrategias en el control del picudo. Rojas et al. (2019) reportan el uso trampas de pseudotallo + plátano maduro como atrayente, capturando un promedio 10,82 individuos por trampa. En Mallares y Salitral (Piura) con B. bassiana CCBLE- 265 causó el 70 % de mortandad de adultos del picudo (More, 1996).
4. Conclusiones
En banano, los síntomas observados en campo, in vivo e in vitro como manchas necróticas con aspecto húmedo de color marrón con olor fétido, son característicos de la pudrición blanda. Las características culturales, bioquímicas y pruebas de patogenicidad permitieron identificar seis aislados de la especie Pectobacterium chrysanthemi y dos aislados a P. carotovorum subsp. carotovorum. El manejo de pudrición blanda se basa en el empleo hijuelos certificados, buen drenaje, fertilización balanceada, aplicaciones de materia orgánica 20 t/ha aplicaciones preventivas en los meses de noviembre y diciembre sulfato de cobre granulado al voleo 5 kg/ha, desinfección de herramientas de trabajo y control del picudo.