1. Introducción
El cacao (Theobroma cacao L.) es un cultivo neotropical, originario de la región amazónica de Suramérica (Bartley, 2005), y que ha sido cultivado, comercializado y consumido desde la época precolombina por Aztecas, Mayas, Olmecas y Toltecas (Hurst et al., 2002). Es considerado uno de los cultivos más importante a nivel mundial principalmente para pequeños agricultores (Kongor, et al.,2016). Las almendras (granos) extraídas de sus frutos (mazorca), son materia prima para la industria alimenticia mundial, valorada en más de 47.000 millones de dólares en exportaciones mundiales (Vásquez et al., 2019), y es el ingrediente principal en la elaboración del chocolate, tras un proceso previo de fermentación y secado (Hartel et al., 2017).
La producción de granos de cacao entre 2019-2020 fue de aproximadamente 4700 t, siendo su gran mayoría producida en el continente africano (cerca de 3500 t). Sin embargo, países como Ecuador y Brasil aportan con el 25% de la producción mundial (Statista,2021). En esta región se cultivan los denominados cacaos Criollo, Forastero y Trinitario (Soria, 1970), destacándose el clon ecuatoriano CCN-51 producto del cruce entre los dos primeros tras un programa de mejoramiento, siendo resistente a enfermedades y altamente productivo, y cultivado en 90% de las nuevas plantaciones cacaoteras del Ecuador (Boza et al., 2014).
Pero a lo largo de la historia, la industria cacaotera se ha visto devastada debido a un desenfrenado declive ocasionado por enfermedades emergentes causadas por varios patógenos, algunos causando muerte en árboles, manteniéndose a flote gracias al establecimiento de nuevas plantaciones (Marelli et al., 2019). En orden de importancia y afectación en el cultivo se citan la pudrición negra de la mazorca (principalmente Phytophthora megakarya y P. palmivora), la escoba de bruja (Moniliophthora perniciosa), la monialisis (M. roreri), la muerte vascular regresiva (Ceratobasidium theobromae), y la virosis denominada de hinchazón de los brotes (Cacao swollen shoot virus) (Akrofi et al., 2016; Cárdenas et al, 2017; Marelli et al., 2019; Sánchez-Mora & Garcés-Fiallos, 2012). Sin embargo, otras enfermedades como mal del machete (Ceratocystis cacaofunesta), así como la pudrición de la mazorca y muerte regresiva o descendente, ambas causadas por Lasiodiplodia (syn. Botryodiplodia) theobromae, también requieren de atención (Marelli et al., 2019). Entre las especies de Lasiodiplodia que infectan cacao, se reportan hasta el momento L. parva (Alves et al., 2008), L. pseudo-theobromae (Serrato-Diaz et al., 2020) y L. theobromae (Asman et al., 2020), consideradas como especies crípticas según Alves et al. (2008). Sin embargo, L. theobromae parece ser la especie más importante, estudiada y citada.
L. theobromae es un hongo necrótrofo asociado a graves daños en diferentes cultivos de importancia económica a nivel mundial (Salvatore et al., 2020), siendo considerado un patógeno peligroso que puede causar la muerte de plantas (Dwiastuti & Aji, 2021). Algunas enfermedades re portadas en cultivos de importancia agrícola son pudri ción de raíz (Sathya et al., 2017), gomosis (Guajardo et al., 2018), cáncer, muerte descendente (Asman et al., 2020), tizón de la hoja (Fan et al., 2020) y pudrición de mazorcas (Puig et al., 2021). Entre los daños internos ocasionados como la gomosis en duraznero, están el aumento de los niveles de H2O2 y malondialdehido, y la reducción de los contenidos de clorofila a y b (Li et al., 2014). En los últimos años la severidad y sus daños han venido aumentando, causando una serie de problemas en diferentes cultivos incluyendo el cacao (Pereira et al., 2006), lo que ha hecho que se tome más interés en esta patología. L. theobromae pasó de ser un hongo con actividad endófita a ser un pa tógeno oportunista, y ahora es considerado potencial mente una amenaza para el cultivo de cacao (Ali et al., 2019). Tal vez, el ser un microrganismo con dichas carac terísticas y además cosmopolita, polífago, ha hecho que este se prolifere en los cacaotales del continente ameri cano, asociado especialmente a plantas estresadas por otros factores abióticos y bióticos (Tavares et al, 1994; Pereira et al., 2006).
Hasta la presente fecha, poco se conoce al respecto de L. theobromae en el cultivo de cacao. Por ello, esta revisión profundiza cada uno de los temas relacionados al patógeno y sus enfermedades producidas en el cultivo, abordando desde la etiología hasta su manejo integrado, objetivando brindar información actualizada al lector. Cabe destacar, que ante la falta de estudios con L. theobromae en cacao, nos hemos visto en la necesidad de usar artículos científicos no solo en cacao, sino también en otros cultivos.
2. Etiología
Lasiodiplodia theobromae (Pat) Griffon & Maul (forma sexuada Botryodiplodia theobromae Pat) es un hongo patógeno necrótrofo perteneciente al Filo Ascomicota, clase Dothideomycetes, orden Botriosphaeriales y familia Botryosphaeriaceae (Slippers et al., 2013; Sathya et al., 2017). Un dato interesante, es que Botryosphaeria rhodina (Berk. y M.A. Curtis), taxonómicamente ha sido tema de confusión a lo largo del tiempo, debido principalmente a su sinonimia en la nomenclatura con L. theobromae (Burgess et al. 2006). Un claro ejemplo de esta aseveración es el trabajo de Slippers et al. (2013), donde analizando el linaje filogenético de diferentes especies del Orden Botryosphaeriales, incluyeron el aislado CBS 164.96 de L. theobromae, codificado, identificado y depositado como B. rhodina, en el Centro de biodiversidad fúngica, localizado en Utrecht, Países Bajos. De manera general, en la actualidad la denominación del género Lasiodiplodia puede ser considerado válido.
En condiciones de laboratorio, inicialmente el patógeno presenta un desarrollo micelial de color blanco, tornán dose posteriormente de color cenizo oscuro, hasta vol verse finalmente negruzco (Figura 1A y B). Los picnidios (Figura 1C) formados son de color negro (estructuras de resistencia) y ostiolados con parafisis de 4 y 55 μm de an cho y longitud, respectivamente (Barnett & Hunter, 1998; Alves, 2008). Esta última característica diferencia al género Lasiodiplodia spp., de otros estrechamente relacionados (Akrofi et al., 2016). Las hifas son completamente septadas (Figura 1D), formando conidióforos cortos y simples (Barnett & Hunter, 1998), que a la postre generan conidios (Figura 1E y F; esporas asexuadas) que oscilan entre 13,0 y 15,4 μm de ancho y entre 23,6 y 28,2 μm de largo (Alves, 2008). Las conidias son hialinas en estado inmaduro, elipsoidales, unicelulares, de pared gruesa y con un contenido granular, mientras que en estado maduro son septadas con estrías longitudinales de color marrón oscuro (Hendra et al., 2019).
En un estudio genómico y trangenómico reciente reali zado por Ali et al. (2019), donde se investigaron 13061 genes codificadores de proteínas en 52 cepas de L. theobromae aislados de tejidos sintomáticos de cacao, se encontraron 2862 exclusivos para la especie en estu dio, en comparación con otras miembros de Botryos-phaeriaceae estrechamente relacionadas. Mien tras tanto, a nivel bioquímico se conoce que L. theobromae posee 134 compuestos químicamente defini dos pertenecientes a las clases de metabolitos secunda rios y ácidos grasos, i.e. ciclohexenos y ciclohexenonas, indoles, jasmonatos, lactonas, melleínas, fenoles y otros (Salvatore et al., 2020).
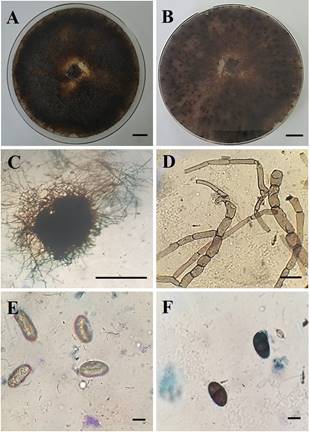
Figura 1 Estructuras asexuadas de Lasiodiplodia spp. obtenidas a partir de tejidos sintomáticos de cacao. A-B, Crecimiento del patógeno en placas de Petri conteniendo medio de cultivo Papa Dextrosa Agar (PDA), mostrando un aspecto algodonoso con rápida extensión micelial (superficie completamente cubierta). C, Formación de picnidios (conidiomata) desarrollados sobre placas de Petri conteniendo medio PDA. D, Hifas septadas de color marrón oscuro. E, Conidias hialinas unicelulares inmaduras. F, Conidias maduras (septadas y oscuras con estrías longitudinales).
3. Distribución geográfica
El movimiento de material vegetal infectado por Botryosphaeriaceae incluido L. theobromae mediado por humanos, puede facilitar su dispersión a nivel mundial (Mehl et al., 2017). Actualmente, la especie está ampliamente distribuida concentrándose mayormente en los trópicos y sub-trópicos (Rodríguez-Galvez et al., 2017). En cacao, el patógeno fue descrito por primera vez en Camerún en 1895, causando pudrición de mazorcas en cacao (Mbenoun, 2008). Posteriormente, se lo reportó en India (Kannan et al., 2010), Samoa Occidental (Bourke, 1992), Bangladesh (Shamsi et al., 2010), y Filipinas (Alvindia & Gallema, 2017).
L. theobromae tiene un rango superior a 500 especies hospederas (Farr & Rossman, 2021), lo cual aumenta su distribución. En Sudamérica, por ejemplo, algunos cultivos de importancia agrícola donde se ha reportado el hongo son: aguacate en Perú y Cuba (Alama et al., 2006; Cabrera et al.,2016), mango en Brasil, Perú y Cuba (Marques et al., 2013; Rodríguez-Gálvez et al., 2017; Cabrera et al., 2016), cítricos en Chile, México y Cuba (Guajardo et al., 2018; Valle-de la Paz et al., 2019; Cabrera et al., 2016), papaya en Brasil (Netto et al., 2014), vid en Perú (Vergara, 2017), y teca en Brasil (Ferreira et al., 2018). Con respecto al cultivo de cacao, L. theobromae ha sido aislado de tejidos sintomá ticos en Venezuela (Urdaneta & Delgado, 2007), Cuba (Martínez de la Parte & Pérez-Vicente, 2015) y México (Torres-de la Cruz et al., 2018), pero al no existir pruebas de patogenicidad, este microorganismo no puede ser asociado como un patógeno en ese cultivo. En Ecuador hasta la fecha se ha reportado al patógeno únicamente afectando árboles de T. gileri (Evans et al., 2003).
4. Sintomatología
El patógeno puede infectar tejidos vegetales sanos sin que presenten síntomas, comportándose como un endófito (Mohali et al., 2005). Sin embargo, si la planta atraviesa algún tipo de estrés los síntomas se pueden hacer visibles (Mullen, 1991).
En condiciones controladas, los primeros síntomas pueden ser visibles a los 14 días después de la inoculación (DDI) de L. theobromae en plantas de cacao (Mvondo et al., 2019), pudiendo estas morir (Figura 2A) en un lapso de 10 semanas (Alvindia & Gallema, 2017). A nivel de campo, el patógeno puede afectar ramillas jóvenes (Burgess et al., 2006), causándoles la muerte sin afectar ramas principales (Figura 2B). No obstante, con la colonización del patógeno en los tejidos pueden observarse clorosis en todo el follaje (Alvindia & Gallema, 2017), marchitamiento y posteriormente muerte de la planta (Figura 2C), fenómeno que toma el nombre de “muerte regresiva” (Kannan et al., 2010).
Otros de los síntomas observados en campo son la pudrición y la momificación de mazorcas (Valarmathi & Ladhalakshmi, 2018). Luego que el hongo penetra muy fácilmente los tejidos de mazorcas sanas aparecen manchas de coloración marrón en la corteza (Figura 2D, E), pudiendo alcanzar las almendras de cacao, donde finalmente se puede observar la mazorca totalmente necrosada e inviable (Figura 2G y 2F). Las mazorcas afectadas presentan en su interior una masa de micelio negruzco que envuelve las almendras (Figura 2H). Aunque otros síntomas como gomosis, cancros y agallas pueden también observarse en el tallo (del Castillo et al., 2016), en cacao aún no hay evidencias al respecto.

Figura 2 Síntomas causados por Lasiodiplodia theobromae en cacao. A, Plántula infectada artificialmente mostrando marchitez. B, Rama muerta (flecha roja). C, Planta evidenciando muerte regresiva. D, Mazorcas infectadas artificialmente mostrando necrosis (flechas rojas). E-F, Mazorcas infectadas en condiciones de campo, mostrando pudrición parcial (E) y total (F). G-H, Daños internos y externos observados en tejidos de mazorcas. Ex: Exocarpio; Me: Mesocarpio; En: Endocarpio; Pu: Pulpa; Fu: Funículo; Al: Almendras.
5. Condiciones agroclimáticas óptimas para el patógeno
L. theobromae es un hongo fitopatógeno encontrado comúnmente en las regiones tropicales y subtropicales del planeta (Salvatore et al., 2020), pudiendo desarrollarse ágilmente en suelos arcillosos o subsuelo impermeable y con alta humedad (Rodrigues, 2003). Aunque su crecimiento óptimo está entre 29 y 30 °C (Pitt, Huang, & Savocchia, 2013), el microorganismo puede esporular entre 15 y 40 °C (Shaidul et al., 2001), siendo favorecido por períodos lluviosos que estimula la masiva producción de esporas y su diseminación (Vásquez-López et al.,2009). Algunos factores abióticos como el estrés hídrico y un bajo nivel de nutrición influyen positivamente en el crecimiento y desarrollo del patógeno en tejidos vegetales de mango (Khanzada et al.,2005). En el duraznero, se ha reportado que la alta humedad y heridas mecánicas promueven el desarrollo de la gomosis ocasionada por L. theobromae (Li et al., 2014).
6. Ciclo de la enfermedad
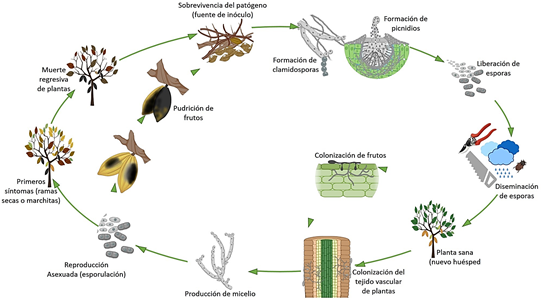
El fitopatógeno sobrevive en el suelo y en restos culturales (fuente de inóculo, Figura 3), principalmente en forma de picnidios, esclerocios (Michereff et al., 2005; Kuswinanti, 2019) y/o clamidósporas que actuan como estructuras de resistencia en restos de tejidos infectados y/o en el suelo (Ogundana, 1983). El microorganismo en esta fase del ciclo tal vez podría permanecer como un saprófito. Las esporas contenidas en los picnidios son liberadas al ambiente en condiciones óptimas (Muhamad et al., 2009), siendo diseminadas por el viento, la lluvia (Vásquez-López et al., 2009) o transportadas a través de herramientas e insectos de la familia Miridae (Helopeltis thetvora, H. ammonli y H. theobromae) (Kranz et al., 1977; Ploetz, 2003, Figura 3).
Una vez que el hongo llega a la planta, pueden observarse lesiones en frutos (Kranz et al., 1977), brotes y ramillas jóvenes (Martoredjo et al., 1995), causando graves daños en el rendimiento de mazorcas especialmente en variedades de cacao susceptibles (Adu-Acheampong et al., 2011, Figura 3).
El patógeno invade los tejidos del huésped tanto inter como intracelularmente en vides (Al-Saadoon et al., 2012) y anacardo (Muniz et al., 2011), pudiendo causar una desorganización de las células de los haces vasculares a los 7 DDI de L. theobromae, y finalmente una necrosis en la región parenquimatosa y del xilema (Figura 3). En el caso de cacao, el patógeno puede afectar tanto ramillas, ramas y troncos, así como mazorcas. De hecho, en este cultivo se puede observar la presencia de picnidios en ramillas jóvenes muertas. En brotes y pecíolos de vides, el patógeno produce picnidios que originan conidios, similar a los producidos en condiciones in vitro (Al-Saadoon et al., 2012; Figura 1C, 1E y 1F). Por otro lado, la ocurrencia de pudrición en mazorcas se da principalmente por la intensa fuente de inóculo presente en el área de cultivo (Twumasi et al., 2014), debido a que el fitopatógeno aprovecha los desechos provenientes de la cosecha para sobrevivir y completar su ciclo de vida (Kuswinanti, 2019).
7. Manejo de la enfermedad
Una vez L. theobromae es detectado en un cultivo, o en su defecto algún fitopatógeno de la Familia Botryosphaeriaceae, el manejo puede volverse difícil (Jaiyeola et al., 2014), debido principalmente a la capacidad de sobrevivencia del hongo en restos de tejidos afectados (Michereff et al., 2005;Kuswinanti, 2019) y su amplio rango de hospederos (Akrofi et al., 2016). Aunque el uso de medidas convencionales de manejo como el uso de fungicidas sintéticos es una de las alternativas, también se pueden emplear otras alternativas ecológicas, que incluso pueden ser económicas (Adu-Acheampong et al., 2011). Para describir cada uno de los métodos de manejo de la muerte regresiva y de la pudrición de mazorcas causadas L. theobromae en cacao, se optó por usar artículos donde hayan abordado su manejo, independientemente del cultivo abordado.
a. Control genético
Existe evidencias de la existencia de resistencia en cacao a la muerte regresiva causada por L. theobromae. De hecho, Adu-Acheampong et al. (2011) evaluando el tamaño de lesiones, la colonización de tejidos del tallo y la incidencia de muerte regresiva en 29 y 15 genotipos de cacao en condiciones de laboratorio e invernadero, respectivamente, encontraron que los materiales CATIE 1000, T85/799 y MXC 67 presentan resistencia a L. theobromae, pudiendo ser fuentes útiles en futuros programas de mejoramiento genético. Aunque los factores relacionados a la resistencia de cacao a la infección por L. theobromae aún no son conocidos, en otros cultivos como la vid, se sugiere que la inmunidad innata, la señalización de fitohormonas y muchos compuestos fenilpropanóides, constituyen una compleja red de defensa contra el patógeno (Zhang et al., 2019). A su vez, en tejidos del tallo de plantas resistentes y susceptibles de marañón a la gomosis causada por L. theobromae, durante los primeros momentos de la infección, se han encontrado proteínas relacionadas a las vías del metabolismo energético, estrés y defensa, señalización celular y metabolismo de proteínas (Cipriano et al., 2015). Interesantemente en plantas de cacao, cinco de esas proteínas previamente han sido asociadas al estrés y defensa (proteínas Chaperonas similares a HSP20 y tipo Germen 10), y a la señalización (no identificada).
b. Control cultural
Este método consiste básicamente en interferir los procesos del patógeno como sobrevivencia, diseminación y reproducción, minimizando los efectos de la enfermedad. Como medida importante, se recomienda realizar un saneamiento adecuado en toda la plantación, eliminando partes, tejidos o plantas infectadas mediante podas adecuadas (Akrofi et al., 2016), y restos presentes en el suelo, pues este es una fuente de inóculo importante para el fitopatógeno. Esta práctica en conjunto con otras detalladas en esta revisión puede resultar muy efectiva para el control de L. theobromae en el campo, ya que al ser un patógeno de comportamiento monocíclico, se debe actuar al inicio de su ciclo de vida (Uc-Várquez et al., 2017).
Otros de los métodos culturales que pueden ser implementados, están la selección del área de plantación libre de patógenos, la elección de la época de siembra (vivero) o trasplante (campo), el uso de material de propagación libre de patógenos, y tal vez uno de los más importantes, evitar lesiones en las plantas, puesto que las heridas pueden ser la principal puerta de ingreso para el patógeno (Michereff et al., 2005).
c. Control físico
Este método consiste en el uso de factores físicos (por lo general temperatura y radiación) para controlar enfermedades. Aunque no existe ningún trabajo mostrando el uso de este método en el control de enfermedades causadas por L. theobromae, la solarización del suelo podría ser una interesante alternativa en la etapa de propagación de plantas de cacao, debido a la reducción del inóculo localizado en el sustrato (Katan et al., 1976; Michereff et al., 2005). Para este caso específico, tal vez lo ideal sería el uso de un colector solar, como el desarrollado por Ghini (1993) en Brasil.
d. Control biológico
Esta es una gran alternativa al momento de prevenir alguna infección fúngica, pudiendo en algunos casos ser comparado con el control químico (Mortuza & Ilag, 1999). Tanto hongos, bacterias y levaduras han sido evaluados en el manejo de enfermedades causadas por L. theobromae en diferentes cultivos. Sin embargo, los hongos podrían tener un mayor potencial antagónico (Borges et al., 2018). Recientemente en cacao, Nurlaila et al. (2020), probando la capacidad de Trichoderma asperellum en la supresión del estriado vascular causado por Ceratobasidium theobromae, después de un año de tratamiento, encontraron que la incidencia de Lasiodiplodia sp. disminuyó en raíces y ramas tratadas con el agente biológico. La capacidad antagonista de aislados de Trichoderma contra L. theobromae, fue también demostrada por Mortuza & Ilag (1999), encontrando que a pesar de que T. harzianum inhibe el patógeno en pruebas de antagonismo (cultivo dual), tanto esta especie como T. viride lo parasitan directamente, causando daño en sus células. En frutos de banano, el tratamiento preventivo con T. viride 4 h antes de la inoculación con L. theobromae, reduce la pudrición en más del 60%. Así también, T. harzianum puede reducir L. theobromae en vides, sin alterar sus aspectos fisiológicos, pudiendo incluso ser usado para proteger heridas generadas por podas (Rusin et al., 2021).
Con respecto al uso de bacterias, recientemente, Kamil et al. (2018), evaluando el control in vitro de L. theobromae en mango usando 53 actinobacterias (66% estreptomicetos y 34% no-estreptomicetos), se destacaron 7 estreptomicetos y 12 no estreptomicetos por presentar actividades antagonistas (producción de metabolitos antifúngicos difusibles, enzimas que degradan la pared celular-EDPC) contra el patógeno. Las cepas con un efecto inhibidor superior se evaluaron en bioensayos con frutos de mango, destacándose Streptomyces samsunensis UAE1 (antibiosis, y producción de quitinasa y sideróforos), S. cavourensis UAE1 (desarrollo de antibióticos) y Micromonospora tulbaghiae UAE1 (producción de EDPC). Finalmente, la pre-inoculación en plantas de mango con dichas actinobacterias en condiciones de invernadero, pudo reducir fuertemente la severidad de la muerte regresiva causada por L. theobromae. Así también en mango, pero usando la levadura Candida maritima LM-5 en el biocontrol de la pudrición de frutos causada por L. theobromae, este organismo pudo proporcionar un control superior de la enfermedad e inhibir fuertemente la germinación de los conidios (Michereff et al., 1997).
e. Control botánico
El empleo de extractos vegetales o de alguno de sus derivados, pueden funcionar como fungicidas botánicos o simplemente bioestimulantes. Por ejemplo, recientemente Mvondo et al. (2019) demostró el efecto inhibidor del extracto etanólico (100 mg L-1) de semillas de neem (Azadirachta indica), consiguiendo reducir el crecimiento de L. theobromae en plantas de cacao, relacionado probablemente al contenido de Azadiractina en el extracto. Extractos etanólicos foliares de Dioscorea dumetorum y Moringa oleífera, pueden reducir significativamente el crecimiento micelial y esporulación de L. theobromae en mazorcas de cacao, posiblemente debido a glucósidos, antraquinonas y compuestos reductores presentes en los extractos (Okey et al., 2015). Aunque únicamente en condiciones in vitro los extractos etanólicos de Schinus molle (Segura-Contreras et al., 2015), Caryophyllus aromaticus y Allium satibum (Rusin et al., 2021), así como el aceite esencial de hojas de Chenopodium ambrosioides (Kumar et al., 2017) pueden inhibir el crecimiento de L. theobromae, este último puede incluso proteger al grano de trigo del biodeterioro en la fase de poscosecha. Finalmente, Sudha et al. (2019) evaluando el efecto de 30 extractos de plantas contra L. theobromae aislado de plantas de coco, el extracto foliar (5% y 10%) de diferentes especies de Allium spp., inhibieron el crecimiento micelial del patógeno en condiciones in vitro.
f. Control químico
Aunque el uso de fungicidas en el cultivo de cacao en América Latina es mínimo, el uso de diferentes fungicidas de origen sintético (comúnmente denominado de químico) han sido usados para el control enfermedades producidas por L. theobromae como gomosis, muerte regresiva, pudrición de frutos, debido principalmente a que estas moléculas pueden suprimir el crecimiento micelial y la germinación de conidios del patógeno. Entre los fungicidas usados de forma aislada están azoxistrobina, carbendazim, clorotalonil, difenoconazol, fosetil-aluminio, iprodiona, mancozeb, metil tiofanato, piraclostrobina, procloraz, propiconazol y tebuconazol, así como en mezclas ciprodinil + fludioxinil, Clorotalonil + carbendazim y piraclostrobin + boscalid (Tovar-Pedraza et al., 2013; Yang et al., 2019; Rusin et al., 2021; Yang et al., 2021), Sin embargo, hay reportes de la reducción de la sensibilidad de aislados de L. theobromae a fungicidas como difeconazol (Li et al., 2020; Rusin et al., 2021), sugiriendo la presencia de aislados resistentes.
En esta revisión, se ha considerado importante citar diferentes trabajos donde se ha evaluado la sensibilidad de aislados de L. theobromae obtenidos a partir de varios tejidos y especies vegetales, fungicidas usados de forma habitual en condiciones de campo (Tabla 1). El desarrollo de la resistencia del patógeno a los fungicidas podría ser una de las principales razones, de la reducción en la eficacia del manejo de las enfermedades causadas por L. theobromae.
Tabla 1 Estado de la resistencia a fungicidas en aislados de Lasiodiplodia theobromae en diferentes cultivos
| Fungicida | Cultivo | Concentración letal media (CL50) | Referencia |
| Mancozeb | cacao | 1 µl L-1 | Mvondo et al. (2019) |
| Clorotalonil + carbendazim | 0,97-10-6 µl L-1 | Mvondo et al. (2019) | |
| Hidróxido de cobre | mango | 40,3-738,1 mg L-1 | Al-Jabri et al. (2017) |
| Iprodiona | 0,01-8,75 mg L-1 | Al-Jabri et al. (2017) | |
| Metil tiofanato | 0,1-1000 mg L-1 | Al-Jabri et al. (2017) | |
| Oxicloruro de cobre | 0,1-242,8 mg L-1 | Al-Jabri et al. (2017) | |
| Azoxistrobina | papaya | 0,4-364,2 μg L-1 | Chen et al. (2020) |
| Benomil | 0,002-0,13 μg L-1 | da Silva Pereira et al. (2012) | |
| Difenoconazol | 6,1-6,3 μg mL-1 | Li et al. (2020) | |
| Imazalil | 0,001-2,3 μg L-1 | da Silva Pereira et al. (2012) | |
| Metil tiofanato | > 300 μg L-1 | Cavalcante et al. (2014) | |
| Procloraz | 0,04-1,8 μg L-1 | da Silva Pereira et al. (2012) | |
| Tebuconazol | 0,1-4,05 μg L-1 | da Silva Pereira et al. (2012) | |
| Tiabendazol | 0,4-1,3 μg L-1 | da Silva Pereira et al. (2012) |
g. Manejo integrado de enfermedades (MIE)
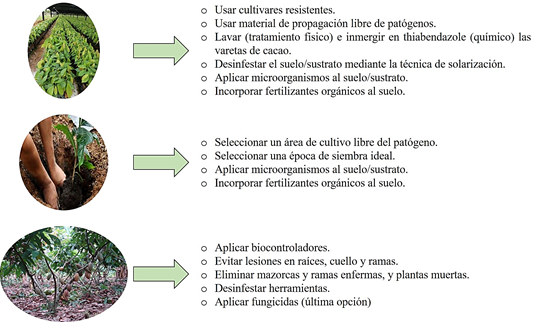
La integración de los componentes de manejo, podría ser una herramienta importante en el control de enfermedades causadas por L. theobromae. En la Figura 4 se describen varias medidas que pueden ser implementadas en conjunto para reducir la muerte regresiva y pudrición de mazorcas en el cultivo de cacao (adaptado de Michereff et al., 2005; Tovar-Pedraza et al., 2013; Yang et al., 2021). Lo importante es el uso integrado de dos o más medias de manejo, pues de esta manera se tendría suceso en la reducción de enfermedades causadas por L. theobromae.
8. Conclusiones
L. theobromae es un hongo patógeno que ha tomado importancia en los diferentes países de América Latina, especialmente Ecuador, causando principalmente muerte regresiva y pudrición de frutos en cultivos comerciales de cacao. El gran número de hospederos conformado principalmente por cultivos de importancia agrícola, hacen de este patógeno un organismo cosmopolita y su capacidad de sobrevivir en el suelo y en restos vegetales lo vuelve difícil de controlar. Varias medidas para su manejo han sido detalladas en esta revisión actualizada, e incluso se ha propuesto la integralización de medidas que pueden ayudar a reducir tanto la muerte regresiva como la pudrición de frutos en cacao. De cualquier manera, se requieren investigaciones adicionales que objetivasen evaluar un poco más el patógeno, así como los factores que contribuyen al aumento de sus enfermedades en cacao, más que todo en países dedicados a este cultivo. En vista de la poca información científica acerca de L. theobromae en cacao a nivel mundial, se torna importante elucidar varias interrogantes sobre su etiología y manejo, especialmente en países sudamericanos.