1. Introducción
La transmisión de virus patológicos a través de los alimentos es un problema permanente en la seguridad alimentaria y salud pública. La globalización de las cadenas de fabricación y suministro ha empeorado la situación (Huang, Hsu, & Lai, 2021). La mitad de las enfermedades transmitidas por alimentos son de origen viral y han despertado interés en estudios anteriores (Hirneisen et al., 2010). Estas enfermedades contribuyen de manera significativa a la morbilidad mundial, sino que además contribuyen a los costos asociados a las medidas adoptadas para mitigar sus efectos en las poblaciones. Por ejemplo, el ébola causó la fragilidad de los múltiples sistemas interconectados que componen la cadena de valor de los alimentos para una nutrición óptima en Sierra Leona (Kodish et al., 2019). En general las posibilidades de que las enfermedades transmitidas por los alimentos se propaguen a través de las barreras nacionales y continentales son inmensas (Bosch et al., 2018).
Existe una pandemia mundial que ha causado un gran impacto a la humanidad, en múltiples aspectos sociales (Roman-Alcala, 2020), económicos (Sands, El Turabi, Saynisch, & Dzau, 2016), en la agricultura (Nayak et al., 2021), en la seguridad alimentaria (Ma et al., 2021), en el manejo integrado de plagas, en la productividad animal (Nicola et al., 2020; Seleiman, Selim, Alhammad, Alharbi, & Juliatti, 2020; Siddiquei & Khan, 2020), así como en aspectos psicológicos (Davulis, Gaspareniene, & Raistenskis, 2021). Sin embargo, el más relevante es el que afecta a la salud de las personas, por ejemplo, en la actual pandemia se ha reportado una tasa de letalidad de 5,3 a 8,4% para COVID-19 (Kitajima et al., 2020). Antes de la declaración de la pandemia ya se había informado que los virus son una de las principales causas de enfermedades transmitidas por los alimentos. Así, en los Estados Unidos, los virus son responsables del 66,6% de las enfermedades relacionadas con los alimentos, de los cuales el 9,7% causado por Salmonella y el 14,2% causado por Campylobacter (Alhadrami et al., 2020).
Generalmente, la fuente principal de transmisión viral entre humanos es el hacinamiento y el contacto directo (Van Doremalen et al., 2018); pero, existen otras fuentes posibles de contaminación indirecta, tales como el contacto con superficies que contengan al virus (Quevedo-león et al., 2020). Por ejemplo, estudios científicos recientes han revelado que el virus COVID-19 puede estar activo entre 6 horas a 9 días en las superficies, dependiendo del material de la superficie (Fathizadeh et al., 2020); y mantiene una alta tasa de infección secundaria y una rápida propagación y transmisión (Kowalski, Walsh, & Petraitis, 2020). Es posible que los productos contaminados listos para el consumo puedan ser un vehículo potencial para la transmisión zoonótica de coronavirus a los humanos (Mullis et al., 2012).
La gran demanda creciente por el consumo de alimentos preparados ha promovido la oferta de alimentos informales (Cortese, Veiros, Feldman, & Cavalli, 2016), los cuales, a la falta de fiscalización y control de parte de los organismos de salud, pueden llegar a ser más riesgoso para la salud de las personas por no haber un control de la cadena de frio, higiene y manipulación de alimentos (Tittonell et al., 2021). En los últimos años, el aumento de alternativas de acceso a alimentos preparados fuera de casa se puede apreciar en páginas web, aplicaciones para alimentos de entrega a domicilio, etc.; y debido al brote de coronavirus más personas usan estas aplicaciones de entrega de alimentos y otros servicios de entrega (Bezerra, 2020), como alternativa a la compra directa de alimentos y aumento de la posibilidad de contagio. Así, la presencia de nuevos virus en la cadena agroalimentaria generará impactos en los mercados de insumos, mano de obra y cambios estructurales en la industria de los alimentos (Richards & Rickard, 2020).
El objetivo de esta revisión fue discutir las posibles rutas de transmisión de virus a humanos a través de los alimentos, temas como la presencia y tipos de virus en alimentos, virus entéricos, virus zoonótico, el agua como un medio de transmisión, riesgos de infección, otros alimentos no convencionales como potenciales transmisores de virus e inocuidad de alimentos, además de desafíos actuales y futuros. La Figura 1 muestra una recopilación de publicaciones desde el año 2017 a 2021 por transmisión de virus asociados a productos alimenticios.
2. Definición de virus
Los virus son microorganismos infecciosos intracelulares, incapaces de reproducirse fuera de las células de otro organismo. Los virus son partículas coloidales cargadas que tienen la capacidad de adsorberse en superficies dependiendo del pH (Lahrich et al., 2021). Se componen de un genoma de ADN o ARN envuelto por una cubierta proteica, es decir que necesitan una célula huésped para reproducirse y multiplicarse dentro de células vivas de otros organismos (Bosch et al., 2018; Miranda & Schaffner, 2019). En su ciclo de vida, un virus infecta una célula, permitiendo que la información genética viral dirija la síntesis de nuevas partículas virales fuera de la célula. Existen diferentes tipos de virus que infectan a los seres humanos: la poliomielitis (Esteve-Jaramillo & Lopez-Collada, 2012), influenza (Sharma, Chatterjee, Kumar, Lal, & Kondabagil, 2020), herpes (Oyaizu et al., 2012), viruela (Lozano et al., 2020), varicela (George, 2020) y el virus de la inmunodeficiencia humana (VIH) que causa el SIDA que ha afectado a 39 millones de personas (Muñoz, 2019), los coronavirus; entre otros virus.
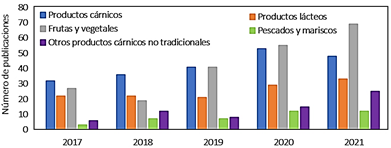
Figura 1 Número de publicaciones por transmisión de virus asociados a productos alimenticios, utilizando una ecuación de búsqueda en la Web of Science con las palabras claves: productos cárnicos, frutas y vegetales, otros productos cárnicos no tradicionales, productos lácteos, pescado y mariscos, reportados en la literatura científica los últimos 5 años. (https://apps.webofknowledge.com/).
Los virus han existido a través de la historia, pero debido al incremento de la población humana su transmisión ha aumentado por todo el mundo; permitiendo la aparición de nuevas enfermedades infecciosas. Reportes indican, que ya desde hace 10000 mil años, los primeros asentamientos agrarios permitieron que los microbios enzoóticos selváticos puedan hacer contacto con el Homo sapiens (McMichael., 2004). Los virus pueden persistir por un tiempo en todo tipo de superficies biológicas y no biológicas; esto incluye a los alimentos, los cuales pueden portar virus en su superficie. Por ejemplo, pueden conta minar cebollas y lechugas antes de la cosecha (Hirneisen, Markland, & Kniel, 2011), así mismo se ha determinado que los virus pueden estar presentes en frutas y hortalizas expuestas a ambientes no sanitarios (Kowalski et al., 2020).
El tamaño y la forma de los virus son muy variables (Samandoulgou, Fliss, & Jean, 2015). Existen dos grupos básicos, los isométricos que tienen forma de varilla o alargados; y los complejos, con cabeza y cola como los bacteriófagos. Estos se separan en diferentes grupos según su ciclo de vida. hay algunos virus con forma icosaédricos como polígonos de 20 lados, entre 18 y 20 nanómetros de ancho. Los de mayor tamaño son los alargados, y de varios micrómetros de longitud; aunque, no suelen medir más de 100 nanómetros de ancho. Más del 96% de los fagos tienen cola y contienen dsDNA (Prabhurajeshwar, Desai, Waghmare, & Rashmi, 2020). Los Coronavirus (CoVs) se definen como virus envueltos de 120 -160 nm de diámetro con una especie de corona como apariencia; su nombre "coronavirus" es derivado del griego "κορώνα", que significa corona y que contiene los genomas entre 26,4 a 31,7 kb. Sus ARN son conocidos por contener enlaces G + C que varían entre 32% a 43% (Henwood, 2020).
Los virus en los alimentos no se multiplican ni producen toxinas, solo producen diversas epidemias de origen alimentario. Ello debido a su capacidad de persistir en alimentos mantenidos a distintas temperaturas de refrigeración y en el medio ambiente marino; debido a estas características los virus son causas importantes de enfermedades transmitidas por los alimentos en todo el mundo, por tal motivo se exigen alimentos más seguros para su consumo (Bai et al., 2020; Melotto et al., 2020; Park et al., 2019). El desarrollo urbano mundial ejerce importantes impactos en el aumento de contacto con poblaciones de vida silvestre y, por lo tanto, es probablemente otro factor importante que da forma a la transmisión de patógenos en la vida silvestre hacia los humanos (Kozakiewicz et al., 2020).
2.1 Tipos de virus según forma de transmisión
De acuerdo con su forma de transmisión los virus se pueden clasificar en entéricos o zoonóticos. Los virus entéricos se transmiten directamente de los alimentos a los humanos, o por contacto entre humanos. Los zoonóticos se transmiten a través de los animales hacia los humanos.
2. 1.1 Transmisión de virus entéricos
Los virus entéricos son conocidos como causantes de enfermedades transmitidas por alimentos contaminados en los seres humanos (Hirneisen et al., 2010; Miranda & Schaffner, 2019). En Estados Unidos, el año 2011 se reportaron que 1 de cada 6 personas se enferma por virus transmitidos por los alimentos. Por ejemplo, la manipulación de carnes sin la utilización de guantes por algunos carniceros puede ser algunos de los causantes en la transmisión de virus a humanos (Soon & Wahab, 2021; Tasiame et al., 2021). Los alimentos frescos o mínimamente procesados no ofrecen garantías efectivas contra la transmisión de virus transmitidos por alimentos (Aboubakr et al., 2015). Con la aparición del COVID-19, China comenzó a regular el uso de fauna silvestre como fuente de alimentos para prevenir la exposición humana al nuevo virus, incluida una mayor conciencia social de los peligros al comer animales salvajes. Asimismo se fortaleció la legislación sobre la alimentación y el comercio de animales, mejorando los estándares de seguridad alimentaria y estableciendo un mecanismo de supervisión del mercado de estos alimentos (Yuan, Lu, Cao, & Cui, 2020; Yuan et al., 2020).
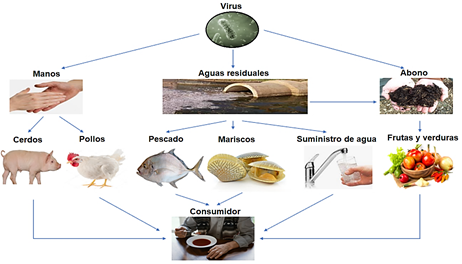
Figura 2 Esquema de transmisión de virus entéricos en heces humanas a través de diferentes rutas alimentarias.
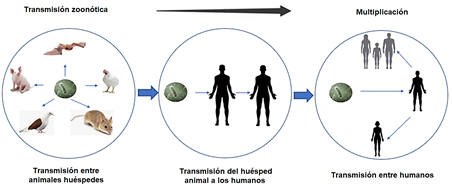
Figura 3 Transmisión zoonótica de virus (adaptado de reporte del Ministerio de Salud de Nicaragua 2020; https://confidencial.com.ni/wp-content/uploads/2020/03/Protocolo_Coronoavirus.pdf)
Los virus entéricos causan la mayoría de las enfermedades transmitidas por los alimentos, y los síntomas comunes de muchas enfermedades incluyen vómitos, diarrea, dolor abdominal y fiebre. La exposición humana a agua contaminada para beber, cocinar o recreación es otra vía de transmisión (Upfold, Luke, & Knox, 2021). También la elaboración de mezclas con tierra y la aplicación de estiércol como abono, es un conocido factor de riesgo para la propagación del virus de la gripe aviar (Malladi et al., 2021). Entre los virus entéricos, el Norovirus humano (NoV) (Duret et al., 2017) y el virus de la hepatitis (HAV y HEV) son los principales virus sospechosos de causar brotes transmitidos por alimentos y representan una salud pública grave (Hennechart-Collette, Martin-Latil, Fraisse, Niveau, & Perelle, 2020; Hennechart-Collette, Martin-Latil, Guillier, & Perelle, 2015). Tuladhar et al. (2013) reportaron estudios en la transferencia de norovirus entre dedos y fómites y productos alimenticios.
Los virus al infectar una célula liberan cientos o miles de partículas virales que pasan al medio en donde se incuba (Ong et al., 2020). Las aguas contaminadas con virus, utilizadas en el sector alimentario tales como en los sectores de la pesca, carnes, vegetales, lácteos, entre otros; pueden ser fuentes contaminantes y de infección hacia personas sanas (Shin et al., 2019). De hecho, los virus entéricos que contaminan a los alimentos a través del uso de aguas residuales (Carvalho et al., 2020; Parada-Fabian, Juarez-Garcia, Natividad-Bonifacio, Vazquez-Salinas, & Quinones-Ramirez, 2016), son una preocupación en materia de seguridad alimentaria ya que infectan a las personas por vía oral o vía fecal directa o indirectamente (Okitsu et al., 2020; Sciandra et al., 2020). Generalmente la contaminación de virus en los alimentos puede darse a lo largo de la cadena de elaboración; se sabe que los brotes de enfermedades vírales de origen alimentaria son asociados generalmente con alimentos crudos o mínimamente preparados, tales como los mariscos, frutas y verduras. Ejemplos son los norovirus y el virus de la hepatitis A, los cuales han sido implicados en la mayoría de los brotes, otros virus alimentarios como el virus de la hepatitis E, el sapovirus y el rotavirus, pueden ser también un riesgo para los humanos (Miranda & Schaffner, 2019). En la Figura 2 se observa que la transmisión puede realizarse a través de las manos, aguas residuales y abonos; relacionados al contacto con los alimentos.
2.1.2 Transmisión de virus zoonóticas
Las enfermedades zoonóticas pueden ser provocadas por virus, bacterias, parásitos y hongos, que se transmiten entre animales y pueden ser transferidos de animales a humanos a través de la cadena alimentaria o por contacto con heridas (Wang et al., 2020). La mayoría de los patógenos zoonóticos se originan en la vida silvestre, se pueden transmitir ya sea por la picadura de insectos u otros animales como los murciélagos, por acariciar o manipular animales enfermos o al consumir carnes sin procesar (Lahrich et al., 2021; Wielinga & Schlundt, 2013); así como el consumo de leche no pasteurizada o de aguas contaminadas. Algunas enfermedades zoonóticas son relativamente benignas, pero otras como la enfermedad de Lyme, son bastante dañinas. Algunos patógenos, como los del tipo coronavirus; que está relacionado genéticamente con el virus del SARS-CoV-2 y que causa el COVID-19, pueden llegar a ser mortales (Mackenzie & Smith, 2020).
Como agente zoonótico el virus de la hepatitis E (HEV) puede ser responsable de una hepatitis aguda en huma nos, que generalmente es auto limitada. La progresión hacia una etapa crónica es posible, especialmente en pa cientes inmunocomprometidos (Dzierzon, Oswaldi, Merle, Langkabel, & Meemken, 2020). En los últimos años, en Alemania, el número de casos de hepatitis E en humanos aumentó a 3491 casos en 2018. En el caso de Japón, se evaluaron tres casos de pacientes que habían consumido carne de cerdo a la parrilla y vísceras en el mismo restaurante, para investigar el brote se realizó un estudio para aclarar la ruta de transmisión de un brote de hepatitis E por transmisión zoonótica (Miyashita et al., 2012). Ver Figura 3 esquema transmisión zoonótica de virus.
3. El agua, como un medio de transmisión de virus
Las personas infectadas con virus pueden eventualmente contagiar al resto de la población de distintas formas. Por ejemplo, eliminando una gran cantidad de partículas virales con sus heces. De ahí, que las aguas al contacto con las heces puedan convertirse en un primer vehículo de diseminación, pudiendo contaminar por vía fecal-oral o por medio de alimentos y aguas contaminadas y convertirse en un reservorio humano de hepatitis A (Villena et al., 2017); estos virus llegan al medio ambiente principalmente a través del vertido o la filtración de aguas residuales sin tratar o mal tratadas en fuentes de agua como manantiales, ríos, represas o estuarios marinos (Upfold et al., 2021) y usada para el consumo humano, o empleadas en los cultivos vegetales, abonos, cultivos de moluscos o en la elaboración de los alimentos. El agua contaminada llega al mar, los moluscos y peces tomarán contacto con estos microorganismos, diluidos en el agua y en la materia orgánica (Loh, Fujioka, & Lau, 1979). También los vegetales pueden ser diseminadores, mientras que los moluscos pueden estar contaminados de forma natural. Recientemente, se identificaron las infecciones por Piscichlamydia salmonis y el virus de la viruela branquial del salmón del atlántico transmitida por el agua de peces enfermos como fuente de infección (Wiik-Nielsen et al., 2017).
Tabla 1 Transmisión de virus por consumo de carne y productos cárnicos y por contactos estrechos con animales contaminados
| Virus/ Enfermedad | Familia / Genero | Vía de transmisión | Síntomas | Referencias |
| Gripal A(H1N) porcina | Orthomyxoviridae / Influenzavirus | Transmisión zoonótica a través de gotitas. Contacto estrecho de granjeros con cerdos. | Fiebre, tos, estornudos, secreción nasal, dificultad respiratoria y disminución del apetito. Incubación 2 a 10 días. | (Mon et al., 2020) |
| Ébola (EVD) | Filoviridae / ebolavirus | Transmisión zoonótica. contacto directo con fluidos corporales (sangre, heces, vómito) consumo de carne cruda, mal cocida, de animales silvestres de países africano). Cerdos. | Fiebre, dolor de cabeza, diarrea, vómitos, dolor de estómago, erupción rojiza en la piel, ojos rojos, alteración de la función renal y hepática, etc. Incubación 2 a 21 días. | (Barrette et al., 2009; Efsa, 2015; Maguiña Vargas, 2015) |
| Hepatitis E | Hepeviridae / Orthohepevirus | Transmisión zoonótica por consumo de productos porcinos crudos: hígado, jamón y músculo de los cerdos, conejo, jabalí | Cansancio, náuseas y vómitos. pérdida de apetito, dolor abdomen, orina de color más oscuro, heces de color más claro, ojos y piel amarillentos. Incubación entre 2 y 10 semanas. | (Bigoraj, Kozyra, Kwit, & Rzeżutka, 2020; Dzierzon et al., 2020; Müller, Collineau, Stephan, Müller, & D.C. Stärk, 2017; Sarno et al., 2017) |
| Nipah (NiV) | Paramyxoviridae / Henipavirus | Transmisión zoonótica por contacto estrecho con cerdos | Fiebre, tos, respiratorio, dolor de cabeza, confusión, coma. Incubación 4 días a 2 meses | (Aditi & Shariff, 2019; Ang et al., 2018; Nazneen et al., 2019; Pallivalappil et al., 2020) |
| Fiebre hemorrágica de Crimea Congo (CCHFV) | Bunyaviridae / Nairovirus | Transmisión enzoótica por exposición o manipulación de carne, sangre o tejidos de animales infectados como camellos dromedarios (bovino, ovino, caprino) | Fiebre inicial, dolor de cabeza y malestar, síntomas gastrointestinales, sangrado, shock y fallo multiorgánico. Incubación 2 a 7 días | (Camp et al., 2020) |
| Batai (BATV) | Bunyaviridae / Orthobunyavirus | Transmisión zoonótica y enzoótica de foca portuaria, cerdos domésticos y aves silvestres | Síntomas leves de fiebre, dolor en las articulaciones y erupción cutánea. Incubación 3 a 12 dias. | (Dutuze, Nzayirambaho, Mores, & Christofferson, 2018; Jo et al., 2018) |
| Gripe Aviar | Orthomyxoviridae/Alphainfluenzavirus | Transmisión zoonótica por contacto directo con aves domésticas y silvestres. | Fiebre, tos, neumonía, choque séptico, síndrome respiratorio, conjuntivitis, gastrointestinales, encefalitis, encefalopatía. Incubación de 2 a 5 días. | (Sánchez et al., 2020) |
| Fiebre del Valle del Rift (VFVR) | Bunyaviridae / Phlebovirus | Transmisión zoonótica por consumo de productos o contacto con la sangre y tejidos del ganado infectado | Estado gripal con cefalea y dolores musculares y articulares. Incubación 2 a 6 días. | (Anyangu et al., 2010; Clark, Warimwe, Di Nardo, Lyons, & Gubbins, 2018; Kroeker et al., 2020) |
| Adenovirus | Adenoviridae / Mastadenovirus | Transmisión entérica por embutidos procesados de origen porcino como salami salchichas y patés de carne o hígado de cerdo | Faringitis, congestión nasal, tos, infección de oído. conjuntivitis, fiebre. Incubación 2 a 14 días. | (de Souza et al., 2020) |
| SARS-CoV-2 | Coronaviridae/ Betacoronavirus | Transmisión entérica por carne de cerdo y conejo. | Fiebre, tos seca, cansancio, dolor de garganta, diarrea, conjuntivitis, dolor de cabeza, pérdida del sentido del olfato o del gusto, erupciones cutáneas. Incubación 11 a 14 días | (Yekta, Vahid-Dastjerdi, Norouzbeigi, & Mortazavian, 2021) |
Tabla 2 Transmisión de virus por consumo de leche y productos lácteos y por contactos estrechos con animales contaminados
| Virus | Familia/Genero | Vía de transmisión | Síntomas | Referencias |
| Vaccinia (VACV) | Poxviridae / Orthopoxvirus | Transmisión zoonótica en manos de ordeñadores en contacto con leche de vaca contaminada y consumo de leche, suero y queso. | Erupción cutánea, fiebre, dolor de cabeza, y dolores en el cuerpo. Incubación 12 a 13 días. | (de Oliveira et al., 2018; Rehfeld et al., 2017) |
| Hepatitis E | Hepeviridae / Orthohepevirus | Transmisión entérica por consumo de leche de pequeños rumiantes. | Gripe, seguidos fiebre, dolor, vómitos y signos de hepatitis aguda. Incubación 2 a 10 semanas | (Dziedzinska et al., 2020) |
| Hepatitis A | Picornaviridae / Hepatovirus | Transmisión entérica por leche, yogur y el helado contaminado artificialmente con frutas blandas. | Fatiga, Náuseas y vómitos repentinos, dolor abdominal lado costillas inferiores (en la zona del hígado). Pérdida de apetito, poca fiebre, orina de color oscuro, dolor articular. Incubación de 14 a 28 días. | (Battistini et al., 2020) |
| Bacteriófago MS2 | Enterobacteriaceae / Levivirus | Transmisión entérica por consumo de leche cruda, mantequilla, helados. | Fatiga, tos y falta de aire. Incubación hasta 3 días. | (Fatemizadeh et al., 2017; Ghadirzad et al., 2018) |
| Poliovirus | Picornaviridae / Enterovirus C | Transmisión entérica por contagio vía fecal-oral. Consumo de leche cruda, mantequilla, helados. | Fiebre, cansancio, cefalea, vómitos, rigidez del cuello y dolores en los miembros. Incubación (promedio de 7 a 14 días) | (Hamisu et al., 2018; Lickness et al., 2020; World Health Organization = Organisation mondiale de la, 2020) |
| Flavivirus (TBFV) y (TBEV) | Flaviviridae /Flavivirus | Transmisión entérica por leche de cabra y materna. | Fiebre, dolor de cabeza, malestar general y vómitos. Incubación 5 a 7 días. | (Mann et al., 2018; Offerdahl, Clancy, & Bloom, 2016) |
| Powassan (POWV) | Flaviviridae / Flavivirus | Transmisión entérica por leche cruda de cabra | Fiebre, dolor de cabeza. convulsiones, vómitos, debilidad y confusión, pérdida de la memoria, meningitis. Incubación 8 a 34 días. | (Woodall & Roz, 1977) |
| MERS-CoV | Coronaviridae / Betacoronavirus | Transmisión Zoonótica por consumo de leche de dromedarios | Fiebre, tos seca, cansancio, molestias y dolores de garganta diarrea, conjuntivitis, dolor de cabeza, pérdida del sentido del olfato o del gusto, erupciones cutáneas. Incubación 5 a 6 días. | (Reina & Reina, 2015; van Doremalen, Bushmaker, Karesh, & Munster, 2014) |
| Norovirus humano (Nov) | Caliciviridae/ Norovirus | Transmisión entérica por mezcla de leche con jugos. Quesos y mezcla de queso cuajado con bayas. | Diarrea, vómitos, náuseas y dolor de estómago. La diarrea suele ser acuosa y sin sangre. La diarrea es más común en los adultos y el vómito es más común en los niños. | (Fumian, Leite, Marin, & Miagostovich, 2009; Horm & D'Souza, 2011; Maunula et al., 2009) |
| SARS-CoV-2 | Coronaviridae / Betacoronavirus | Transmisión vertical. Leche humana | Fiebre, tos seca, cansancio, molestias y dolores de garganta diarrea, conjuntivitis, dolor de cabeza, pérdida del sentido del olfato o del gusto, erupciones cutáneas. Incubación 5 a 6 días. | (Walker et al., 2020) |
4. Riesgos de infección de virus, asociados a los alimentos
Los alimentos pueden transmitir virus al hombre y el agua puede ser otra fuente de contaminación. Los virus son incapaces de reproducirse fuera de la célula, pero sí pueden trasladarse a través de los alimentos biológicos (Rzezutka & Cook, 2004). Dentro de los riesgos de infección viral por consumo de alimentos, es la ingestión de alimentos contaminados y no procesados, lo que representa un mayor esfuerzo para la industria de los alimentos en los protocolos inocuidad (Schirone, Visciano, Tofalo, & Suzzi, 2017). Los riesgos biológicos de origen alimentario incluyen organismos como bacterias, virus y parásitos. Estos organismos están frecuentemente asociados a fallas en la inocuidad alimentaria; como por ejemplo en empresas minoristas de alimentos (Franklin, Hope, Glasgow, & Glass, 2020), en el consumo de productos crudos y en la contaminación cruzada durante el procesamiento (Bidawid, Malik, Adegbunrin, Sattar, & Farber, 2004). Varios de estos microorganismos están naturalmente presentes en el ambiente donde los alimentos se producen y son manipulados por personas (Kurup, Manickam, & Gurav, 2020) y pueden ser inactivados por la aplicación de temperaturas, usando prácticas adecuadas de manipulación, de almacenaje, de higiene, entre otras prácticas (Ambrozic, Bozic, Jevsnik, Cook, & Raspor, 2011; Lee, Si, Yun, & Ko, 2015; Serafim et al., 2015).
5. Tipos de alimentos asociados con enfermedades virales
Entre los principales alimentos asociados con enfermedades virales de origen alimentario, se incluyen los mariscos, como las ostras, mejillones, crustáceos y sus productos que se recolectan y/o se crían en aguas cercanas a salidas de aguas residuales humanas; Las plantas regadas con aguas servidas, frutas u hortalizas que han crecido en tierras fertilizadas con abono animal o regadas con agua contaminada; carnes crudas, como el cerdo (Miranda & Schaffner, 2019; Wielinga & Schlundt, 2013).
5.1 Carnes y productos cárnicos
Carnes y productos cárnicos, son alimentos biológicos que pueden transmitir virus a humanos; ya sea por consumo de carne cruda o debido al inadecuado procesamiento de sus derivados. Por ejemplo, en el consumo de productos elaborados con carne de cerdo crudo y/o poco cocidos (frescos, embutidos, interiores), han sido relacionado con la infección por hepatitis E transmitida por alimentos a humanos (Dzierzon et al., 2020). El virus Nipah el cual es un virus zoonótico, se transmite a los seres humanos a través de animales como los murciélagos o los cerdos; pero también, puede transmitirse a través de alimentos contaminados o directamente de persona a persona mediante un contacto estrecho con fluidos y excrementos corporales que contienen virus (Ang, Lim, & Wang, 2018). Ver Tabla 1 Transmisión de virus por consuno de carne y productos cárnicos y por contactos estrechos con animales contaminados. La enfermedad de Newcastle, causada por el virus paramixovirus aviar tipo 1, es otra de las enfermedades más importantes responsables de los brotes devastadores en las aves de corral en Etiopía. Sin embargo, la enfermedad de Newcastle (EN), causada por el paramixovirus aviar virulento de tipo 1, es una de las enfermedades responsables de brotes devastadores en las manadas de aves de corral en Etiopía (Damena et al., 2016). China ha encontrado restos de coronavirus SARS-CoV-2 en productos envasados de cerdo congelado, en importaciones desde de Francia.
5.2 Leche y productos lácteos
Leche y productos lácteos pueden ser transmisores de virus; así, se ha asociado el consumo de leche fresca y de quesos mal procesados con infecciones relacionadas a la enfermedad vaccinia bobina causado por el virus vaccinia (de Oliveira et al., 2018; Rehfeld et al., 2017). Así mismo, Dziedzinska, Krzyzankova, Bena, and Vasickova (2020) concluyeron que la leche de pequeños rumiantes podría representar una fuente de infección por el virus de la hepatitis E para los consumidores. Se ha detectado la presencia de virus TBEV que produce la encefalitis humana, tanto en leche como en queso de cabra (Ronai & Egyed, 2020). Fatemizadeh, Yavarmanesh, and Habibi Najafi (2017) Determinaron la presencia de virus entéricos en mantequilla tradicional iraní. Ghadirzad, Yavarmanesh, and Najafi (2018) reportaron la presencia de virus entéricos en leche pasteurizada, yogurt, queso y en helados de crema. Como se puede observar, la reciente evidencia científica expuesta indica que infectarse con un virus, a través de diferentes productos lácteos (y causar una enfermedad), es un riesgo y una gran posibilidad. Por ello, en la industria láctea se deben reforzar los procedimientos y normas para una inocuidad viral de productos lácteos elaborados. Algunas normas de alimentos como las ISO / TS-15216-1: 2017 e ISO / TS-15216-2: 2019 describen métodos estándar para la investigación del virus de la hepatitis A en productos lácteos. Los productos a base de leche que contienen uno o más tipos de fruta no están cubiertos por los procedimientos ISO, aunque pueden estar contaminados por la fruta agregada a estos productos o por los manipuladores de alimentos (Battistini et al., 2020). Ver Tabla 2 Transmisión de virus por consumo de leche y productos lácteos y por contactos estrechos con animales contaminados.
5.3 Frutas y vegetales
La contaminación de vegetales frescos y bayas con virus entéricos humanos es una de las principales causas de intoxicación alimentaria (Shin et al., 2019). El consumo de productos vegetales frescos en los países desarrollados ha aumentado debido al deseo de estilos de vida más saludables (Mir et al., 2018), y estos productos pueden contaminarse con virus tanto en la etapa previa como en la posterior a la cosecha; sea con el agua de riego, el contacto con suelo, usos de fertilizantes orgánicos de mala calidad y/o por el manejo humano, tal como han sido reportados por la literatura (Brassard, Gagne, Genereux, & Cote, 2012; Cook, Bertrand, Gantzer, Pinto, &Bosch, 2018). El virus de la hepatitis A (VHA) es uno de los agentes más comunes de las enfermedades transmitidas por los alimentos y se ha asociado con muchos brotes relacionados con las bayas frescas o congeladas en todo el mundo (Nasheri, Vester, & Petronella, 2019). Por ejemplo, se han encontrado virus entéricos en arándanos congelados (Butot, Galbusera, Putallaz, & Zuber, 2021) y también se ha demostrado que ellos pueden sobrevivir a 4 °C en fresas, cerezas y melocotones (Konowalchuk & Speirs, 1975). Por otra parte, para el caso de hortalizas, estudios en verduras y aderezo para ensaladas (lechuga, zanahorias ralladas y una mezcla de verduras crudas ralladas (zanahorias, apio y repollo) han reportado infecciones virales transmitidas por alimentos causadas principalmente por norovirus (NoV) y el virus de la hepatitis A (HAV), que causan respectivamente gastroenteritis y hepatitis. Esta es principalmente por vía fecal-oral, ya sea por contacto de persona a persona o por ingestión de agua o alimentos contaminados (Hennechart-Collette et al., 2015; Hennechart-Collette, Niveau, Martin-Latil, Fraisse, & Perelle, 2019; Prez et al., 2018; Purpari et al., 2018). Ver Tabla 3 Transmisión de virus por consumo de frutas y vegetales y por contactos estrechos con animales contaminados.
Tabla 3 Transmisión de virus por consumo de frutas y vegetales y por contactos estrechos con animales contaminados
| Virus | Familia / Genero | Vía de transmisión | Síntomas | Referencias |
| Norovirus | Caliciviridae / Sapovirus | Transmisión entérica por contacto con frutas contaminadas frambuesas congeladas, pure. Ensaladas de lechugas. | Diarrea, vómitos, náuseas, dolor de estómago. Incubación 24-48 h. | (Barker, Amoah, & Drechsel, 2014; Bouwknegt et al., 2015; Jacxsens et al., 2017; Kokkinos, Karayannis, & Moustakas, 2020) |
| Ébola (EVD) | Filoviridae / ebolavirus | Transmisión entérica por contacto con cacao en grano Aceite de palma Anacardos | Fiebre, dolor de cabeza, diarrea, vómitos, dolor de estómago, erupción rojiza en la piel, ojos rojos, alteración de la función renal y hepática, etc. Incubación 2 a 21 días. | (Bergeron et al., 2016) |
| Norwalk | Caliciviridae / ARN | Transmisión entérica por ensaladas crudas (lechuga) y frutas (manzana, frutilla) | Gastroenteritis. Incubación 1 a 3 días. | (Capece & Gignac, 2020) |
| Nipah (NiV) | Paramyxoviridae / Henipavirus | Transmisión zoonótica por ingesta de savia de palmera datilera contaminada | Fiebre, tos, respiratorio, dolor de cabeza, confusión, coma. Incubación 4 días a 2 meses | (Ang et al., 2018) |
| Hepatitis A | Picornaviridae / Hepatovirus | Transmisión entérica por cadenas de suministro de frutos rojos y lechugas. | Gastroenteritis | (Bouwknegt et al., 2015; Kokkinos et al., 2020) |
| Rotavirus | Reoviridae / Rotavirus | Transmisión entérica por ensaladas crudas callejeras (lechuga, repollo y cebolleta). | Boca y garganta secas, sentirse mareado al estar de pie, llorar sin lágrimas o con pocas lágrimas, somnolencia o irritación inhabitual, orinar poco, gastroenteritis. Incubación 24 a 48 h. | (Barker et al., 2014) |
| Coronavirus bovino (BCoV) | Coronaviridae / Coronavirus | Transmisión entérica por lechugas | Fiebre, tos seca, cansancio. Incubación de 2 a 8 días. | (Mullis et al., 2012) |
| SARS-CoV-2 | Coronaviridae / Betacoronavirus | Transmisión entérica por manzanas, tomates y chiles jalapeños | Fiebre, tos seca, cansancio, molestias y dolores de garganta diarrea, conjuntivitis, dolor de cabeza, pérdida del sentido del olfato o del gusto, erupciones cutáneas. Incubación 5 a 6 días. | (Haddow et al., 2020) |
| Adenovirus humano (HAdV) | Adenoviridae / Mastadenovirus | Transmisión entérica-zoonótica por frambuesas frescas y congeladas. También lechugas, fresas y cebollas verdes | Infecciones respiratorias leves, queratoconjuntivitis, gastroenteritis, cistitis y neumonía primaria. Incubación 5 a 12 días. | (Marti & Barardi, 2016; Maunula et al., 2013; Shin et al., 2019) |
| (MuNoV), norovirus murine tipo 1 | Caliciviridae / Norovirus | Transmisión entérica por bayas frescas | Diarrea, vómitos, náuseas, dolor de estómago. Incubación 24 a 48 h | (Pimenta, Margaca, & Verde, 2019) |
5.4 Pescados y mariscos
Los productos del mar normalmente están en contacto con diferentes virus que afectan a la población humana. Así, las norovirus (NoV) y el virus de la hepatitis A (HAV), se relacionan comúnmente con brotes de enfermedades transmitidas por alimentos relacionados con los mariscos; para estos casos, la seguridad de los mariscos se maneja generalmente mediante el uso de indicadores de contaminación fecal (Torok et al., 2018). Por ejemplo, una revisión de brotes alimentarios de origen viral relacionados a mariscos a nivel mundial entre 1980 y 2012 informó que el NoV (83,7%) y el VHA (12,8%) son los patógenos virales y las ostras (58,4%) como la combinación más frecuentemente asociada con brotes (Bellou, Kokkinos, & Vantarakis, 2013). Esto es debido a que los productos del mar generalmente se desarrollan en ambientes que pueden estar muy contaminados. La presencia de virus en los mariscos puede afectar la salud pública (Roldan, Rodriguez, Garcia, & Navajas, 2013), y generalmente se encuentran en moluscos bivalvos, productos frescos y/o alimentos preparados, que suelen ser consumidos en celebraciones. Ver Tabla 4 Transmisión de virus por consumo de pescados y mariscos y por contactos estrechos con animales contaminados.
Recientes estudios han reportado la presencia de la hepatitis B (VHB), en pescado crudo de cabeza de serpiente y de haberse pinchado con las aletas del pescado en la pierna izquierda (Huang et al., 2020). También en otros estudios se ha determinado la presencia de un virus similar a la hepatitis B en trucha (Oncorhynchus clarkii) adulta en desove (Bochud, Schafer, Roth, & Ros, 2019; von Nordheim, Boinay, Leisi, Kempf, & Ros, 2016). Datos obtenidos en otros estudios muestran que el pescado Atlántico caballa (Scomber scombrus) vendido para el consumo puede albergar una gran diversidad de virus (Filipa-Silva et al., 2020).
En ocasiones, las fallas de inocuidad en diversos puntos de la cadena de producción de estos productos derivan en daños para la salud. Como medida preventiva para la eliminación de parásitos o bacterias y virus, se deben tratar térmicamente los mariscos y/o pescados frescos a temperaturas adecuadas (Powell, 2015).
5.5 Otros alimentos no tradicionales como potenciales transmisores de virus
Debido al aumento de la población mundial (INE, 2019) y un cambio en los hábitos alimentarios en todo el mundo (Vega & Manzanera, 2020), la producción industrial de insectos se está expandiendo, por su contenido de proteínas, particularmente en regiones o países donde los insectos no se consumen tradicionalmente (Vandeweyer, Lievens, & VanCampenhout, 2020) en comparación con la carne de cerdo, res, cordero y aves de corral; este tipo de alimentos no convencionales no produce daños ambientales por el uso de menor tecnología; además, producen beneficios nutricionales y económicos. El uso de insectos como alimento para el consumo humano y/o como alimentos para los animales es una alternativa para la creciente y elevada demanda de proteínas (Maciel-Vergara & Ros, 2017), y tiene varias ventajas ambientales y sociales sobre la producción intensiva tradicional de ganado (D'Antonio, Serafini, & Battista, 2021; Ordonez-Araque & Egas-Montenegro, 2021; Van Huis et al., 2013). Entre los ejemplos en la producción de insectos para la alimentación y piensos se encuentran: el grillo doméstico europeo (Acheta domesticus), el grillo de campo (Gryllus bimaculatus), la mosca doméstica (Musca domestica ), la mosca soldado negra (Hermetia illuscens) y tres tipos diferentes de gusanos de la harina: el super gusano (Zophobas morio), el gusano de la harina amarillo (Tenebrio molitor) y el gusano de la harina menor (Alphitobius diaperinus) (van Broekhoven, Oonincx, van Huis, & van Loon, 2015; van Huis, 2013).
Tabla 4 Transmisión de virus por consumo de pescados y mariscos y por contactos estrechos con animales contaminados
| Virus | Familia/Genero | Vía de transmisión | Síntomas | Referencias |
| Hepatitis A HAV o MNV-1 | Picornaviridae / Hepatovirus | Transmisión entérica por almejas de manila, mejillones mediterráneos. Ostras crudas, mariscos | Fatiga, náuseas y vómitos, dolor abdominal lado costillas inferiores (en la zona del hígado). Pérdida de apetito, poca fiebre, orina de color oscuro, dolor articular. Incubación de 14 a 28 días. | (Pinto, Costafreda, & Bosch, 2009; Polo, Feal, & Romalde, 2015; Thebault, Teunis, Le Pendu, Le Guyader, & Denis, 2013; Torok et al., 2018) |
| Norovirus NoV, GI and GII | Caliciviridae / norovirus | Transmisión entérica por Ostras y pescados. | Gastroenteritis epidémica aguda, náuseas, vómitos y diarrea. Incubación 12 a 48 hrs. | (Capece & Gignac, 2020; Lowther, Gustar, Powell, Hartnell, & Lees, 2012; Thebault et al., 2013) |
| Astrovirus humano (HAtVs) | Astroviridae / Mamastrovirus | Transmisión entérica por mariscos de cultivo. Pescados. | Diarrea leve, vómitos, fiebre, anorexia y dolor abdominal. Incubación 3 a 4 días. | (Geoghegan et al., 2018; Riou et al., 2007) |
| Bocavirus humano HBoV | Parvoviridae / Bocavirus | Transmisión entérica por mejillones | Infección aguda del tracto respiratorio, gastroenteritis. Incubación 3 a 5 días. | (La Rosa et al., 2018; Onosi, Upfold, Jukes, Luke, & Knox, 2020) |
| Sapovirus | Caliciviridae / Sapovirus | Ostras, almejas | Náuseas, calambres estomacales / abdominales, escalofríos, dolor de cabeza, mialgia o malestar, gastroenteritis. Incubación 12 a 48 h. | (Oka, Wang, Katayama, & Saif, 2015) |
| Adenovirus humano (HAdV) | Adenoviridae / Mastadenovirus | Transmisión entérica por consumo de peces, moluscos bivalvos, crustáceos y cefalópodos de supermercados. | Fiebre, tos, faringitis y adenitis cervical. Incubación 2 a 14 días. | (Ghosh, Lekshmi, Das, Kumar, & Nayak, 2019) |
| Norwalk (NV) | Caliciviridae/ ARN | Transmisión entérica por consumo de mariscos. | Náuseas, vómitos y retorcijones estomacales, diarrea. Incubación de 10 a 60 h. | (O'Ryan et al., 1998) |
| Hepatitis E (VHE) | Hepeviridae / Orthohepevirus | Transmisión zoonótica por mejillones, ostras vendidas al por menor | Gripe, seguidos fiebre, dolor, vómitos y signos de hepatitis aguda. Incubación 2 a 10 semanas | (La Bella et al., 2021) |
| Aichi virus AiV-1 | Picornaviridae / Kobuvirus | Transmisión entérica por consumo de ostras y mejillones crudas | Gastroenteritis, diarrea. Incubación de 1 a 8 h. | (Terio et al., 2018; Yamashita, Sakae, Ishihara, Isomura, & Utagawa, 1993) |
| Enterovirus EV | Picornaviridae / enterovirus | Transmisión entérica por pescado, camarones, ostras, mejillones y almejas | Fiebre, dolor de cabeza, enfermedad respiratoria, dolor de garganta. Incubación 2 y 30-40 días. | (Lekshmi, Das, Kumar, & Nayak, 2018) |
La cría masiva de insectos, en condiciones de cultivo de insectos o incluso en entornos industriales, puede ser la clave para un cambio en la forma en que se utilizan los recursos naturales para producir carne, proteína animal y una lista de otros productos animales valiosos. Sin embargo, el conocimiento es crucial para el éxito del desarrollo de productos basados en insectos. Pero también existe un problema que puede comprometer el éxito de la cría y producción de insectos, es el brote de enfermedades virales que portan por ejemplo la patogénesis del virus de la poliedrosis citoplásmica CPV en gusano de seda tras la infección cruzada (Noguchi & Yamaguchi, 1984). En particular, las enfermedades virales pueden ser devastadoras para la productividad y la calidad de los sistemas de cría en masa y para la salud de la población. La prevención y el manejo de los virus y de sus enfermedades, implican la comprensión de los diferentes factores que interactúan en la cría masiva de insectos (Maciel-Vergara & Ros, 2017). Otros alimentos no convencionales que son susceptibles en la transmisión de virus entéricos o zoonóticos a humanos son, murciélagos, palomas, aves silvestres, dromedarios, caracoles, mono, gorila, chimpancé, grillos e insectos, cerdos, jabalíes, ciervos, mangostas, conejos, lirones africanos, etc. Ver Tabla 5 Transmisión de virus por consumo de alimentos no convencionales y por contactos estrechos con animales contaminados.
Tabla 5 Transmisión de virus por consumo de otros alimentos cárnicos no tradicionales y contactos estrechos con animales contaminados
| Virus | Familia / Genero | Vía de transmisión | Síntomas | Referencias |
| Rabia (RABV) | Rhabdoviridae | Transmisión zoonótica y entérica por consumo o contacto con carne de perro | Fiebre, dolor de cabeza, exceso de salivación, espasmos musculares, parálisis y confusión mental. Incubación de 2 a 3 meses. | (Tasiame et al., 2021) |
| Newcastle (EN) | Paramyxovirus / Avulavirus | Transmisión zoonótica por contacto con heces infectadas de palomas, aves silvestres. | Gripe leve, conjuntivitis, infección de los ojos, laringitis, irritación e inflamación de la laringe y la zona que la rodea. Incubación: 2 a 15 días. | (Damena et al., 2016) |
| Coronavirus respiratorio de oriente medio (MERS-CoV) | Coronaviridae / Betacoronavirus | Transmisión zoonótica por sangre de dromedarios (camellos). Ordeño, alimentación, abrevadero, sacrificio o pastoreo | Fiebre, tos y dificultad para respirar. Otros síntomas son las náuseas, los vómitos y la diarrea. Incubación: 14 días. | (Corman et al., 2014; Deem et al., 2017; Hughes & Anderson, 2020; Liljander et al., 2016; Munyua et al., 2017) |
| Adenovirus humano (HAdV) | Adenoviridae / Mastadenovirus | Transmisión entérica por consumo de carne cruda de caracoles | Fiebre, tos, faringitis y adenitis cervical. | (Paszkiewicz, Kozyra, Bigoraj, Ziomek, & Rzezutka, 2016) |
| Ébola (EVE) | Filoviridae / ebolavirus | Transmisión zoonótica por consumo de carne animal silvestre (Mono, Gorila, Chimpancé). | Fiebre, dolor muscular, de cabeza y garganta, vómitos, diarrea, disfunción renal y hepática, hemorragias internas y externas. Incubación: 2 a 21 días. | (Duonamou et al., 2020) |
| Iflavirus (IFLA) | Iflaviridae/ Iflavirus | Transmisión zoonótica por contacto con grillos e insectos comerciales. | Diarrea. | (de Miranda, Granberg, Onorati, Jansson, & Berggren, 2021) |
| Nipah (NiV) | Paramyxoviridae / Henipavirus | Transmisión zoonótica por murciélagos. | Fiebre, tos, respiratorio, dolor de cabeza, confusión, coma. Incubación: 4 días a 2 meses | (Ang et al., 2018) |
| Virus Hepatitis E (VHE) | Hepeviridae / Orthohepevirus | Transmisión entérica por cerdos, jabalíes, ciervos, mangostas y conejos. | Fiebre leve, disminución del apetito, náuseas y vómitos. Incubación: 2 a 10 semanas | (Geng & Wang, 2016) |
| Virus Dugbe (DUG) | Bunyaviridae / Nairovirus | Transmisión zoonótica por cabras y camellos. | Fiebre, leucopenia, respiración rápida, anorexia y depresión profunda, seguido por diarrea fétida, cólicos, etc. Incubación: 1 a 15 días. | (Lutomiah et al., 2014) |
| Virus Camelpox (CMLV) | Poxviridae / Orthopoxvirus | Transmisión enzoótica y zoonótica, la infección puede extenderse a las manos de quienes trabajan en ordeña de camello. | Fiebre y lesiones en las manos. Incubación: 1 a 15 días | (Dahiya et al., 2016; Duraffour, Meyer, Andrei, & Snoeck, 2011) |
| Viruela del mono Monkeypox | Orthopoxvirus / Poxviridae | Transmisión zoonótica en criaderos de Lirón Africano | Fiebre temprana, dolor de cabeza de espalda, hinchazones, músculos adoloridos. Incubación: 7 a 14 días | (Dell, Souza, & Willcox, 2020; Kastenmayer, Moak, Jeffress, & Elkins, 2010) |
6. Inocuidad de los alimentos para la prevención de virus
Las fallas en la inocuidad en la cadena agroalimentaria es uno de los principales factores para originar ETAs; un buen plan de inocuidad es una principal herramienta en la prevención de las enfermedades transmitidas por los alimentos a los humanos (Yuan et al., 2020). Las ETAs son causadas mayormente por la ingesta de alimentos o agua contaminados con entes biológicos tales como Escherichia Coli, Campylobacter, Salmonella, Shigella y Listeria Monocytogenes, Norovirus, virus de la hepatitis A, astrovirus, rotavirus y virus coxsackie (Bosch et al., 2018; Bosch et al., 2011; Cook et al., 2018; Hennechart-Collette et al., 2020; Hennechart-Collette et al., 2015). Cuando las ETAs son producidas por la ingesta de toxinas estas pueden provenir de hongos o microflora marina; lo que acompañado de la presencia de contaminantes orgánicos persistentes también pueden causar serios problemas de salud (Martinovic, Andjelkovic, Gajdosik, Resetar, & Josic, 2016; Melotto et al., 2020; Tewari & Abdullah, 2015). La seguridad alimentaria se ha convertido en un tema importante debido a un consumidor más exigente e informado y al comercio exterior de alimentos (De Borba, Rodrigues, & Badiale-Furlong, 2020; Vilne, Meistere, Grantina-Ievina, & Kibilds, 2019). Las medidas que conducen a garantizar una mejor seguridad alimentaria nos permitirán prevenir diversas enfermedades transmitidas por los alimentos; principalmente en el sistema digestivo, causado por diferentes agentes etiológicos. Esto se puede lograr mediante la implementación de las diferentes medidas propuestas por la comisión internacional llamada Codex Alimentarius (Moreno & Alarcón, 2010).
Las instituciones de salud a nivel mundial están actuando para frenar la transmisión del virus y están en busca de posibles estrategias de mitigación en caso de un nuevo brote de COVID-19; por ejemplo, la capacitación del personal médico, el apoyo psicológico, de seguridad, logístico, etc. (Weng, 2020; Zeneli et al., 2020). Se deben abordar algunas actividades prioritarias para lograr estos objetivos, como los esfuerzos mundiales para aumentar la inocuidad y la seguridad alimentaria, que se beneficiarían de la mejora de la agricultura, la alimentación de los pequeños agricultores, apoyo a los productores, servicios ecosistémicos y mantenimiento de la biodiversidad local (Galimberti et al., 2020). Se necesita un monitoreo masivo de datos del campo y las cadenas alimentarias de los productos frescos para desarrollar estrategias efectivas de prevención de brotes transmitidos por los alimentos; por ejemplo, el simple lavado no es suficiente para eliminar la contaminación del virus entérico en los productos (Kozak, MacDonald, Landry, & Farber, 2013; Seymour & Appleton, 2001). La contaminación por virus de productos frescos se ha investigado en muchos países, incluidos los Estados Unidos, Europa, Bélgica, Canadá y Francia (Baert et al., 2011; Baert et al., 2009; Callejon et al., 2015).
7. Desafíos actuales y futuros
La pandemia ha puesto en evidencia el riesgo de la industria alimentaria en la producción de alimentos, pese a las restricciones de movilidad producto del COVID 19 (Gonzalez-Alejo, Ajuria, Manzano-Fischer, Flores, & Monachon, 2020; Hepp, Marquart, Jauck, & Gefeller, 2021), la industria alimentaria ha tenido que mantenerse activa para garantizar el abastecimiento suficiente, para ello la industria se ha tenido que adecuar y adoptar medidas para mitigar la propagación del virus (Acheson, 2021; Nakat & Bou-Mitri, 2021; Pedreira, Taskin, & Garcia, 2021). Esto ha significado que millones de personas en el mundo se queden confinadas en sus casas y otra gran cantidad realizando teletrabajo. Muchas empresas han rebajado su producción a la mitad, otras empresas medianas han dejado de producir y otras prácticamente quebraron. En este contexto, los países hacen grandes esfuerzos para mantener las cadenas de valor de productos alimenticios y sus servicios relacionados en operación; sin embargo, la disponibilidad, el acceso y la utilización biológica de los alimentos como componentes de la seguridad alimentaria se ven afectados, por tanto, asegurar el abastecimiento permanente para las familias se convierte en un verdadero desafío. En ese sentido, la seguridad alimentaria y su impacto sobre el estado nutricional como la desnutrición, el sobrepeso y la obesidad, afectan a los países menos desarrollados y grupos vulnerables, entre ellos niños, mujeres y adultos mayores. Algunos elementos protectores, pueden mitigar el escenario actual, por ejemplo, el desplazamiento en la cadena de suministro, acceso físico y económico seguros a centros de expendio de alimentos frescos (como algunos productos básicos), pero que pueden incrementar el precio por limitaciones logísticas o la especulación. Bajo estas consideraciones, la seguridad alimentaria nutricional es seguramente uno de los retos más relevantes, una tarea prioritaria para el mediano y largo plazo. Las medidas de salvaguarda sanitaria han generado una interrupción en las formas en que los individuos han encarado la cobertura de sus necesidades básicas, entre ellas salud, alimentación y nutrición. Actualmente la pandemia ha modificado los patrones de vida y de consumo de la población, afectando las operaciones del mercado, generando cambios en los modelos de producción y todos sus servicios relacionados (Beckman & Countryman, 2021; Zhou et al., 2021).
Los desafíos futuros son, establecer regulaciones sanitarias, de inocuidad y bioseguridad para el funcionamiento gradual de las operaciones en la cadena de suministro personal y procesos como el distanciamiento físico de los trabajadores, el uso de mascarillas y de otros elementos de protección, además de incentivar el frecuente lavado de manos durante los procesos. Fortalecer el sistema de monitoreo de los mercados de alimentos y otros productos básicos, con la intención de evitar malas prácticas comerciales como el acaparamiento de mercaderías, la especulación y el mercado negro. Fortalecer los mecanismos y programas de protección social que garanticen el acceso a alimentos nutritivos, basados en recomendaciones nutricionales de cada país, con vitaminas, minerales y nutrientes fundamentales para el desarrollo del sistema inmunológico de las personas. Definir nuevas políticas para el sector agroalimentario cuidando la disponibilidad de materia prima, insumos y recursos financieros y asegurar el abastecimiento. Modernización los modelos de producción y comercialización mediante la incorporación de mejores prácticas y de tecnologías digitales que permitan escalar la productividad, mejorar las operaciones en la cadena de suministro y simplificar las transacciones en la cadena de pagos. Robustecer los sistemas alimentarios locales, especialmente en las ciudades, vinculándolos con las principales cadenas de suministro de alimentos y otros productos básicos. Incorporar políticas sobre medidas de bioseguridad para todos los actores que participan en la cadena alimentaria, como productores, transportistas, distribuidores, comercializadores, clientes, etc., por ejemplo, incluir inteligencia artificial en la industria alimentaria como una herramienta que le permitirá al hombre interactuar lo menos posible en el procesamiento de alimentos.
8. Conclusiones
La mayoría de los alimentos tales como, carnes, productos cárnicos, leche, productos lácteos, frutas, vegetales, pescados, mariscos, así como el agua y otros alimentos no convencionales son susceptibles de portar y transmitir virus a los humanos; como, por ejemplo, los virus entéricos y zoonóticos.
La complejidad composicional de los alimentos, la manera de ser procesados y los procedimientos de control de inocuidad son de vital importancia para reducir la transmisión de virus a las personas por el consumo de alimentos.
La rápida transmisión de virus por los alimentos y su comportamiento en la última década ha permitido la aplicación de instrumentos de evaluación de riesgos y la evaluación de la eficacia en la elaboración de alimentos, con tecnologías para controlar los virus. Los alimentos antes de llegar a los consumidores finales atraviesan distintos procesos de elaboración donde intervienen distintos tipos de personas. El aumento significativo de enfermedades transmitidas por alimentos en mal estado o la existencia de cualquier punto débil en la cadena que pueda dar lugar a un alimento inseguro, ocasiona un riesgo grave para los consumidores y un costo económico considerables para las empresas. Las empresas deben tener un sistema de gestión que asegure la inocuidad de los alimentos a lo largo de toda la cadena alimentaria hasta el punto de venta.
La mayoría de los procedimientos de inocuidad de alimentos se basan en procedimientos de inocuidad aplicados a elementos microbiológicos como bacterias y mohos, pero poco procedimiento se ha vasado en la eliminación de virus. Deben buscarse instrumentos y tecnologías eficaces para garantizar el control de los virus en los procesos de la cadena alimentaria puede reducir significativamente las infecciones de origen alimenticio causadas por los virus. Por este motivo se recomienda realizar trabajos futuros en procedimientos de inocuidad para evitar la transmisión de virus a humanos, realizar estudios donde se involucre la inteligencia artificial en la industria alimentaria, la relación de los recursos naturales con los alimentos, el agua y la biodiversidad en tiempos de pandemia. Se recomienda realizar estudios futuros en investigación sobre virus más resistentes a los tratamientos térmicos en alimentos. Además, estudios que determinen los mecanismos de mutación de virus en relación a las condiciones del manejo y procesamientos de alimentos.















