1. Introducción
Una de las hortalizas que tiene una aportación importante y nutricional en la dieta humana es el tomate (Solanum lycopersicum L.), pertenece a la familia de las Solanáceas, siendo el género más grande y con mayor importancia económica, con origen en Sudamérica y amplia extensión de cultivo en el mundo (Tamburino et al., 2020). El cultivo de esta hortaliza se encuentra constantemente en ajuste sobre el manejo agronómico de los sistemas productivos intensivos (Zhu et al., 2018). Sin embargo, los sistemas productivos se encuentran con restricciones por el cambio climático que limitan fuertemente el desarrollo del cultivo de tomate (Mutale-joan et al., 2020), originando la aparición de enfermedades y de insectos plaga, que sin el control oportuno, limitan el rendimiento y la eventual perdida de la producción (Liu & Wang, 2020).
Una de estas plagas que causan daños económicos en el tomate y otras solanáceas es el psílido B. cockerelli. presente en el sur de Canadá, Estados Unidos y México principalmente (Sumner et al., 2020). El daño que efectúa es de manera directa por la alimentación de la savia de la planta e indirecta por la transmisión de Candidatus Liberibacter solanacearum (CLso) (Gutiérrez-Ramírez et al., 2021), siendo responsable de la disminución de hasta un 60% en los rendimientos esperados (Rivera-Martínez et al., 2018). Recientemente, se determinó la distribución del haplotipo Central de B. cockerelli en Aguascalientes, Zacatecas, Jalisco, Guanajuato, Hidalgo, Puebla, San Luis Potosí, Nayarit, Nuevo León, Durango, Michoacán, Coahuila y Tamaulipas, en México; así como se determinó la presencia de CLso en el 88.57% de las poblaciones B. cockerelli procedentes de los estados antes mencionados (Cerna et al., 2021).
El manejo agronómico de B. cockerelli se ha realizado de manera cultural con mallas de poro pequeño que limitan el acceso del psílido a las zonas de cultivo y trampas pegajosas de color amarillo (Roller Trap) (Vereijssen et al., 2018); eliminar hospederos alternos dentro y fuera del cultivo (Delgado-Ortiz et al., 2019); así como acolchados plásticos de color gris-plata (Lozano et al., 2018). El manejo químico es el más usado por su rápido efecto y su alta mortandad sobre el insecto para la protección de la planta (Tucuch-Haas et al., 2020); efectuándose hasta 30 aplicaciones en el cultivo de papa para el manejo esta plaga (Cerna et al., 2012), con insecticidas superficiales (mineral de aluminosilicato, aceites minerales) (Vereijssen et al., 2018), de contacto (cipermetrina, cyfluthrin, dime toato, pyriproxifen, esfenvalerato, spiromesifen) (Beltran et al., 2015; Cerna et al., 2012; Tucuch-Haas et al., 2010) y sistémicos (abamectina, aldicarb, cianiliprol, ciantraniliprol, imidacloprid, espirotetramat, endosulfan, disulfoton, ditiofosfato, tiametoxam, thiacloprid, methamidophos) (Carmo-Sousa et al., 2020; Tucuch-Haas et al., 2020).
Sin embargo, los métodos de control químico han desarrollado resistencia en B. cockerelli, la eliminación de enemigos naturales, fitotoxicidad en los suelos y cultivos agrícolas (Kolomiiets et al., 2019). Una alternativa biorracional a esta problemática es el manejo a través de extractos de plantas (Barrios-Díaz et al., 2016), por su baja toxicidad para el ser humano y el ambiente, así como la baja resistencia que pueda llegar a generar en el insecto (Delgado-Oramas et al., 2020).
La planta Crotalaria longirostrata (Hook. & Arn.), de la familia Fabaceae (Mateos-Maces et al., 2020), una planta nativa de América central y México (Jiménez & Grusak, 2015). Conocida como chipilín y empleada como alimento por su alto contenido de aminoácidos esenciales como arginina, histidina, isoleucina, lisina, leucina, treonina y valina (Mateos-Maces et al., 2020); presenta un alto contenido de metabolitos secundarios como ácidos orgánicos, flavonoides, compuestos fenólicos y alcaloides, con actividad biológica en plagas y enfermedades (Cruz-Rodríguez et al., 2020; Rovira et al., 2019).
Se ha reportado el efecto inhibitorio del extracto acuoso de hojas C. longirostrata, el cual presentó acción fungistática a las 96 h sobre Fusarium sp. (31%), F. solani (21%), F. oxysporum (27%) y la fracción de éter etílico generó únicamente actividad bactericida sobre Staphylococcus epidermidis (27%) (Miranda-Granados et al., 2018). Al igual que el extracto metanólico de las raíces inhibieron el crecimiento micelial y la esporulación sobre F. verticillioides (71%, respectivamente); los extractos metanólicos de ramas, tallo y raíz inhibieron el crecimiento micelial y la esporulación de Aspergillus flavus en un 90% (Cruz-Rodríguez et al., 2017). De lo anterior, para el manejo de F. verticillioides en el cultivo de Zea mays, se reporta la presencia de ácido cafeico, ácido gálico y el alcaloide pirrolizidínico (AP) monocrotalina, como los compuestos con mayor abundancia del extracto crudo de ramas de C. longirostrata, como los posibles responsables de la acción fungistática, los cuales generaron una disminución en la incidencia y severidad del 11 y 30%, respectivamente (Cruz-Rodríguez et al., 2020). Se ha demostrado el control de Meloidogyne incognita y M. arenaria en el cultivo de tomate bajo invernadero, mediante el manejo de residuos en suelo de C. longirostrata del 2% (p/p); obteniendo una disminución del daño en un 71% (Del Prado-Vera et al., 2018).
Se ha identificado que el género Crotalaria muestra contenidos elevados de APs como la monocrotalina, que inhibe las proteasas de los herbívoros generalistas asociados con los cultivos agrícolas. Así mismo, dichos APs hacen que las plantas de Crotalaria sean atrayentes de enemigos naturales de insectos como Chrysoperla externa, Doru luteipes, Nephila clavipes, Orius insidiosus y Trichogramma papilionis (Rech et al., 2022).
Hasta el momento no existe evidencia del efecto insecticida de C. longirostrata, sin embargo, en otras especies del género Crotalaria se ha demostrado este efecto insecticida, como con C. retusa para el control de Callosobruchus maculatus con la cual se obtuvo una mortalidad de hasta el 54% y la reducción del 62% de emergencia de adultos (Obembe & Kayode, 2013). Las semillas de C. pallida se han empleado para la elaboración del extracto de diclorometano; el cual desencadenó un efecto insecticida sobre pupas y larvas de Drosophila melanogaster con una CL50 de 7,95 ppm de usamarina y 156,47 ppm, respectivamente (Peñaloza & Peláez, 2014). El estigmasterol extraído de semillas de C. juncea presentó efecto insecticida sobre pupas de D. melanogaster a una concentración de CL50 de 178,8 ppm (Peñaloza & Peláez, 2017). Por lo anterior, el objetivo de la investigación fue identificar los compuestos del extracto metanólico crudo de hojas de C. longirostrata, así como evaluar su actividad biológica sobre ninfas de B. cockerelli.
2. Materiales y métodos
Colonia de Bactericera cockerelli
El insecto fue obtenido en 2018 de zonas de cultivo de papa y tomate en Nuevo León y Coahuila.
El mantenimiento y desarrollo de la colonia se ha llevado a cabo en jaulas entomológicas con plantas de tomate variedad Río Grande, con un fotoperiodo de 14:10 h (Luz/Oscuridad) a 22 °C en el invernadero del departamento de parasitolo gía agrícola, de la Universidad Autónoma Agraria Antonio Narro (Roque-Enríquez et al., 2021).
Muestreo y obtención de extracto de Crotalaria longirostrata
El muestreo fue realizado según lo descrito por Miranda-Granados et al. (2018, con modificaciones), la colecta se llevó a cabo en el municipio de Chiapa de Corzo, Chiapas, México. Se recolectaron tallos con hojas y se trasladaron en bolsas de papel. Posteriormente se eligieron únicamente hojas (con foliolos elíptico-obovados y cara adaxial sin puntos glandulares) para secarlas a la sombra por siete días, después se pulverizaron en una licuadora (Waring Commercial, modelo 7011s), se sometió a maceración en metanol al 96% (Meyer, CDMex, México) durante 30 días (0,2 g de materia seca/ mL de solvente). Después se filtró con ayuda de una bomba de vacío y papel Whatman N° 1, se almacenó el extracto crudo en un frasco ámbar a 4 °C hasta su uso.
Análisis de Cromatografía de Gases acoplada a Espectrometría de Masas (GC-MS)
Se llevó a cabo en el laboratorio de Biogeoquímica (UBIPRO) de la Universidad Nacional Autónoma de México, Iztacala, México. Los metabolitos presentes en el extracto de hojas de C. longirostrata se identificaron en un cromatógrafo de gases modelo 6850 (Agilent Technologies, USA) empleando una columna HP-5MS (Agilent) con longitud de 30 m x 250 mm de diámetro interno y una película de 0,25 µm; el horno se programó a una temperatura de 150 °C por 2 minutos, enseguida se incrementó 10 °C/min hasta 300 °C por 4 minutos, en la fase móvil se utilizó Helio (flujo 1 mL/min). El detector de espectrometría de masas 5975C (Agilent Technologies, USA) se acondiciono a un barrido completo en un rango de masas de 35 a 400 m/z, a una ionización de 70 eV, con temperatura de la fuente de ionización de 230 °C y temperatura del cuadrupolo 150 °C. La tipificación de los compuestos se estableció con base en los espectros generados, usando la base de datos del Instituto Nacional de Estándares y Tecnología (por sus siglas en inglés, NIST versión 08 MS).
Densidad relativa
Esta determinación fue realizada según lo descrito por Solihah et al. (2018, con modificaciones), a partir del extracto metanólico de hojas de C. longirostrata con un picnómetro Gay-Lussac de 25 ml (Brand 16038, Alemania) a 24 °C. Se calculó la densidad del extracto mediante la fórmula:
Donde, m es la masa del picnómetro vacío (g), m1 la masa del picnómetro con la muestra de ensayo (g), m2 masa del picnómetro con agua (g) y 𝑑 24 𝑡 es la densidad del agua a 24 °C (0,997299 g/cm3). Los resultados se expresaron en mg/mL. Se ha reportado la perdida de acción biológica al fraccionar el extracto de C. longirostrata (Cruz-Rodríguez et al., 2020); debido a dicho antecedente, en este estudio se optó por trabajar el extracto crudo sin fraccionar y la preparación de las concentraciones se empleó como base el porcentaje de abundancia del compuesto 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina obtenido del análisis de GC-MS.
Bioensayo
Empleando el calculó de las concentraciones del alcaloide pirrolizidínico 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidi-na, se estableció una ventana de respuesta bio lógica con las concentraciones de 10, 20, 40, 60, 80 y 100 mg/mL, un testigo absoluto con agua destilada estéril. Se empleó el método de prueba de susceptibilidad número 032 versión 1 del Comité de Acción de Resistencia a Insec ticidas (IRAC, 2014) con modificaciones. A partir de la ventana biológica se prepararon siete tratamientos a 2, 4, 8, 12, 16, 20 y 30 mg/mL para posteriormente sumergir en ellos las hojas de tomate variedad Río Grande en cada tratamiento con 11 ninfas del 3ro y 4to instar de B. cockerelli durante 5 segundos, así como en agua destilada como testigo absoluto; las hojas se dejaron secar y poste riormente se colocaron dentro de cajas Petri con papel filtro saturado con agua destilada estéril. Considerando cada hoja infestada como una unidad experimental. El ensayo se mantuvo a una temperatura de 23 °C con un fotoperiodo de 14:10 h (luz/oscuridad). La evaluación de la mortalidad se realizó cada 24 h posteriores a la aplica ción del extracto. Se utilizó un microscopio estereoscópico (Carl Zeiss Stemi DV4) para registrar el número de ninfas muertas, comprobando con ayuda de un pincel la respuesta de algún movimiento coordinado del insecto.
Análisis de datos
Los resultados se expresaron como porcentaje de mortalidad y se corrigió la mortalidad empleando la fórmula de Abbott (Abbott, 1925). El análisis Probit se efectuó con la mortalidad corregida para curva de concentración-mortalidad. Posteriormente los datos fueron sometidos a un análisis de varianza (ANOVA) y las medias se compararon a través de la prueba de Tukey (p = 0,05), bajo un diseño completamente al azar, mediante el programa estadístico SAS versión 9.0.
3. Resultados y discusión
El análisis cromatográfico (GC-MS) demostró la presencia de 25 metabolitos secundarios, en la Tabla 1 se observa el alcaloide pirrilozidinico 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina con mayor abundancia (10,2 %) presente en el extracto metanólico de hojas de C. longirostrata.
Tabla 1 Metabolitos secundarios obtenidos del extracto metanólico de C. longirostrata
| Compuesto | CAS | Referencia | Rt* | Área % |
| 1β,2β-Epoxy-1α-methoxymethyl-8α-pyrrolizidine | 015211-08-2 | 37050 | 4,79 | 10,23 |
| 1-Octanamine | 000111-86-4 | 12887 | 5,32 | 0,9 |
| Phenol, 4-(1-phenylethyl)- | 001988-89-2 | 58058 | 11,74 | 2,52 |
| 3-Aminomethyl-3,5,5-trimethylcyclohexanol, cis- | 130343-30-5 | 38150 | 13,91 | 1,97 |
| Cyclododecanol, 1-aminomethyl- | 000832-29-1 | 69507 | 14,74 | 0,57 |
| Hexadecanoic acid, methyl ester | 000112-39-0 | 113682 | 15,61 | 3,02 |
| n-Hexadecanoic acid | 000057-10-3 | 102726 | 16,53 | 4,18 |
| Ethanol, 2-bromo- | 000540-51-2 | 10128 | 18,74 | 0,98 |
| 9,12,15-Octadecatrienoic acid, methyl ester, (Z,Z,Z)- | 000301-00-8 | 130796 | 18,87 | 6,58 |
| 11-Tridecen-1-ol | 1000130-96-8 | 58021 | 19,33 | 10,05 |
| 9,12,15-Octadecatrienoic acid, (Z,Z,Z)- | 000463-40-1 | 119801 | 19,8 | 17,83 |
| Pyrimidine, 4,6-dimethoxy-5-nitro- | 015846-14-7 | 48364 | 20,13 | 6,06 |
| Hexanedioic acid, bis(2-ethylhexyl) ester | 000103-23-1 | 182869 | 23,94 | 1,62 |
| Phenol, 2,4-bis(1-phenylethyl)- | 002769-94-0 | 138543 | 24,1 | 3,3 |
| Phenol, 2,4-bis(1-phenylethyl)- | 002769-94-0 | 138543 | 24,37 | 3,95 |
| Phenol, 2,4-bis(1-phenylethyl)- | 002769-94-0 | 138543 | 25,37 | 2,63 |
| N-(3-Methylbutyl) acetamide | 013434-12-3 | 12820 | 26,6 | 0,66 |
| 2,4(1H,3H)-Pyrimidinedione, dihydro-5-hydroxy- | 001635-26-3 | 13029 | 28,7 | 0,58 |
| Urea, N, N'-diethyl- | 000623-76-7 | 7925 | 30,67 | 0,73 |
| 1-Dodecanamine | 000124-22-1 | 48301 | 32,55 | 7,83 |
| 2-Aminoethylethyl sulfide | 036489-03-9 | 4883 | 33,11 | 1,17 |
| Oleylamine | 000112-90-3 | 111106 | 38,15 | 8,41 |
| Nonadecylamine | 001430-05-3 | 123645 | 45,31 | 2,8 |
| Nonadecylamine | 001430-05-3 | 123645 | 51,2 | 0,71 |
| L-Alanine, 3-[(aminocarbonyl)amino]- | 001483-07-4 | 22001 | 52,71 | 0,72 |
*Rt: tiempo de retención (min).
Los alcaloides de pirrolizidina (AP) son compuestos tóxicos producidos frecuentemente por plantas en todo el mundo, se estima que el 3% (más de 6000 especies) del total de las plantas los sintetizan (Dreger et al., 2009; Robinson & Gummow, 2015); se han descrito cerca de 660 AP que afectan a animales silvestres y ganado (Chen et al., 2010; Diaz, 2015). Se ha identificado que los AP se encuentran en especies de la familia de las Fabáceas, son tóxicos para insectos herbívoros polífagos como el género Hoplitis (Sedivy et al., 2013). Especies del género Crotalaria son ricas en AP, que han sido asociados a la defensa de la planta contra herbívoros, siendo reportados por pri mera vez en 1935 (Casimiro et al., 2013; Prada et al., 2020).
La especie C. spectabilis demostró alta abundancia del AP monocrotalina (0,21 mg/g de peso seco) en las hojas, en orden decreciente se encuentran los nódulos, raíces y tallos (Schramm et al., 2019), coincidiendo dicho reporte con nuestros resultados en la abundancia del AP en el ex tracto metanólico de hojas de C. longirostrata. El com puesto 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina es una iminoazúcar ramificada en la base de la necina exclu sivamente en el carbono C1 con un doble enlace 1,2 en el anillo de pirrolizidina, descrito en 1963 en C. trifoliastrum (Dehoux-Baudoin & Génisson, 2019) y en la especie C. medicaginea var. neglecta en 2009 (Fletcher et al., 2009). Los iminoazúcares son compuestos hidrofílicos, de fácil administración por vía oral; son inhibidores de en zimas modificadoras de carbohidratos para la absorción y asi milación en el tracto digestivo (glucosidasas), inhibido res en la síntesis de polisacáridos (glucosiltransferasas), así como inhibidores de enzimas procesadoras de nucleóti dos y metaloproteinasas (Esposito et al., 2020). Este tipo de inhibidores intervienen en la hidrolisis de enlaces gli cosídicos de los procesos biológicos en humanos e insec tos, por lo que el potencial de aplicación se basa como agentes terapéuticos en la medicina y en el área agrícola como insecticida (Ramesh, 2020).
De los 25 metabolitos secundarios identificados en el ex tracto metanólico de C. longirostrata, la Tabla 2 muestra que ocho de estos compuestos muestran actividad biocida; no obstante, la relación con la actividad insecticida en la mayoría de ellos es limitada.
El bioensayo efectuado a partir del extracto metanólico de hojas de C. longirostrata se observó una mortalidad supe rior al 80% en las concentraciones superiores a 16 mg/mL; en las primeras 24 horas de aplicación; siendo que a las 48 h a partir de 12 mg/mL se generó un incremento sig nificativo en la mortalidad del 90 % (Tabla 3), observán dose una tendencia en el aumento de la mortalidad a las 72 h en las dosis bajas. En base al contenido del AP del extracto crudo metanólico de C. longirostrata, los datos de la mortalidad correspondientes a las 48 h arrojaron una CL50 de 4,78 mg/mL y CL95 14,52 mg/mL (con p ˂ 0,05) (Tabla 4).
Es limitada la información del efecto insecticida del 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina, sin embargo, hay evidencia de algunos AP identificados en plantas del género Crotalaria con dicha capacidad. Tal es el caso de C. pumila que se suministraron diversas partes de la planta como fuente de alimento en larvas de Estigmene acrea y Grammia geneura, se obtuvo la acumulación de APs (supinina, subilacina, necina, pumilina A, B y C) del 70 y 37% respectivamente, que generaron un bajo desarrollo de las larvas (Hartmann et al., 2004). También se ha reportado el control de pupas de D. melanogaster con semillas de C. pallida mediante el compuesto usamarina (Peñaloza & Peláez, 2014).
Tabla 2 Actividad biocida de metabolitos secundarios reconocidos en el extracto metanólico de C. longirostrata
| Metabolito secundario | Solvente de extracción/Especie vegetal/actividad biológica | Patógeno | Referencia |
| 11-Tridecen-1-ol | Metanol/ Juglans regia/ Antimicrobiano | Bacillus subtilis, S. aureus, Salmonella suis, Pseudomonas aeruginosa, Escherichia coli y Shigella sonnei | (Ara et al., 2013) |
| Phenol, 4-(1-phenylethyl)- | Metanol y acetona/ Carica papaya/ Antifúngico | Ganoderma boninense | (Tay & Chong, 2016) |
| Phenol, 2,4-bis(1-phenylethyl)- | Etanol/ Tamarindus indica/ Antimicrobiano Metanol/ Vernonia cinerea/ Antimicrobiano | E. coli, Xanthomonas oryzae pv. oryzae | (Mala et al., 2017); (Joshi et al., 2021) |
| Hexadecanoic acid, methyl ester | Acetona/ Melia azedarach/ Insecticida Diclorometano/ Ficus sycomorus/ Acaricida e insecticida Metanol/ Chromolaena odorata/ Insecticida Metanol y acetona/ Azolla pinnata/ Insecticida Metanol/ Chenopodium album/ Fungicida Cloroformo/ Sonchus oleraceous/ Fungicida Cloroformo/ Ageratum conyzoides/ Fungicida | Spodoptera littoralis Tetranychus utricae, Aphis craccivora y Sitophilus oryzae S. zeamais Aedes albopictus Sclerotium rolfsii Macrophomina faseolina M. faseolina | (Farag et al., 2011); (Romeh, 2013); (Lawal et al., 2015); (Ravi et al., 2018); (Ali et al., 2017); (Banaras et al., 2020); (Banaras et al., 2021) |
| n-Hexadecanoic acid | Diclorometano/ Ficus sycomorus/ Insecticida Metanol y acetona/ A. pinnata/ Insecticida Éter de petróleo/ Nigella sativa/ Insecticida | T. utricae, A. craccivora y S. oryzae A. albopictus Culex pipiens | (Romeh, 2013); (Ravi et al., 2018); (Farag et al., 2021) |
| 9,12,15-Octadecatrienoic acid, methyl ester, (Z,Z,Z)-; 9,12,15-Octadecatrienoic acid, (Z,Z,Z)- | Etanol/ Acanthus montanus/ Insecticida Éter de petróleo/ Robinia pseudoacacia/ Insecticida Acetato de etilo/ Moringa oleifera/ Nematicida | Periplaneta americana, Tettigonia viridissima y Anopheles gambiae. A. gossypii y Brevicoryne brassicae. Haemonchus contortus y Nacobbus aberrans. | (Okonkwo & Moses, 2017); (Jiang et al., 2018); (Páez-León et al., 2022) |
| Hexanedioic acid, bis(2-ethylhexyl) ester | Cloroformo/ Carthamus oxycantha/ Fungicida Metanol/ Senegalia gaumeri/ Nematicida | Rhizoctonia solani H. contortus | (Rafiq et al., 2021); (Castañeda-Ramírez et al., 2019) |
Tabla 3 Efecto del extracto metanólico de C. longirostrata sobre el porcentaje de mortalidad de ninfas de B. cockerelli
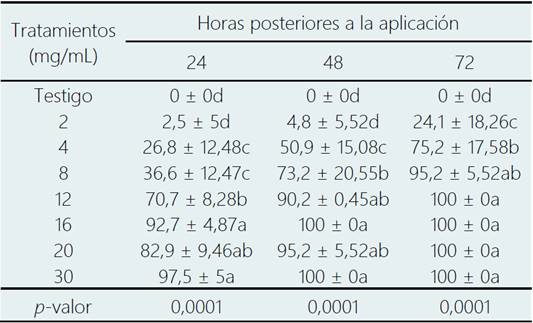
* Medias con la misma letra en cada columna no son estadísticamente diferentes (Tukey; p < 0,05).
Tabla 4 Concentraciones letales y limites fiduciales del extracto metanólico de C. longirostrata sobre ninfas de B. cockerelli

CL: Concentración Letal (en mg/mL); LFI: Limite Fiducial Inferior; LFS: Límite Fiducial Superior.
Asimismo, en larvas de Heliothis virescens se logró un efecto insecticida suministrando una dieta con hojas de C. pallida con una concentración de 1,29x10-3 μg AP/mg de hoja (Cogni & Trigo, 2016). La especie Jacobaea vulgaris (Asteraceae) presenta APs (senecionina, senkirkine y retrorsina) que inhibieron la supervivencia en ninfas de Frankliniella occidentalis del 40 al 100% con la concentración de 50 ppm y monocrotalina hasta el 80% (Macel et al., 2005). Liu et al. (2017) reportan la mortalidad de larvas del segundo estadio de F. occidentalis por el metabolito jacobina obtenida de la planta J. vulgaris a una concentración de 2,45 ppm.
Este efecto insecticida probablemente se deba a que los alcaloides de manera general afectan en el insecto las conexiones nerviosas, alteraciones de la membrana celular y cambios en el citoesqueleto; los AP interactúan con los microorganismos del tracto digestivo debido a la alcalinidad del intestino del insecto, generando una toxicidad y una actividad sinérgica con algunas enzimas como la P450 (Fürstenberg-Hägg et al., 2013; Tlak Gajger & Dar, 2021); la inhibición de enzimas de insectos como la trehalasa presente en el intestino delgado (esta enzima genera la energía a través de la hidrólisis del disacárido trehalosa para el crecimiento, síntesis de quitina, metamorfosis y energía para el vuelo del insecto), esta glucosidasa es inhibida en ambos subsitios en el centro catalítico; por lo que los iminoazúcares naturales podrían funcionar como insecticidas o larvicidas (Shukla et al., 2015). De igual manera, se observó la inhibición de la enzima α-glucosidasa del psílido Cacopsylla bidens por los compuestos 1-deoxynojirimycina, N-butyl-deoxyno-jirimycina y N-butyl-deoxygalctonojirimycina (hasta el 90 % a las 24 h) (Ya’kobovitz et al., 2016).
4. Conclusiones
Los resultados demuestran que el extracto metanólico crudo obtenido de las hojas de chipilín contiene AP del grupo de las iminoazúcares (1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina); reportándose como el compuesto de mayor abundancia en el extracto de hojas de chipilín, que ocasionó la mortandad de las ninfas del psílido B. cockerelli. Alcanzando a las 48 h una mortalidad del 73,2-100% en los tratamientos 8, 12, 16, 20 y 30 mg/mL, obteniéndose una CL50 de 4,78 mg/mL y una CL95 de 14,52 mg/mL. Demostrando con esta investigación el potencial como insecticida del extracto de C. longirostrata para ser empleado como un insecticida alternativo en el control de B. cockerelli. Las investigaciones futuras deberían de considerar la evaluación de su eficacia contra diferentes plagas de insectos; así como el posible impacto en el ciclo de desarrollo de la plaga objetivo y su efecto con las enfermedades trasmitidas por el insecto.















