1. Introducción
Los ecosistemas poseen diversos grupos de microorganismos que interactúan entre ellos y con plantas y animales para mantener la organización funcional de sus componentes (Topalović & Heuer, 2019). Entre los organismos más importantes se encuentran los hongos y nematodos por su enorme abundancia en el planeta (Yu et al., 2021). La población de nematodos se ha calculado en 4,4±0,64×1020 individuos distribuidos en todos los hábitats naturales (van den Hoogen et al., 2019). Los hongos y nematodos coexisten en una variedad de ecosistemas naturales y artificiales (Stelinski et al., 2019), particularmente en la rizosfera de las plantas de los diferentes cultivos agrícolas (Hamza et al., 2020).
Actualmente se han descrito alrededor de 700 especies de hongos que pueden alimentarse de nematodos (Jiang et al., 2017), por lo que pueden influir en la diversidad y abundancia, así como en la estructura de la comunidad. Algunos hongos nematófagos se encuentran entre los enemigos más importantes de los nematodos y pueden reducir sustancialmente su número en el suelo (Li et al., 2015). Sin embargo, la abundancia y la actividad depredadora puede verse afectada por ciertos factores como la temperatura, la humedad y la textura de los suelos (Xiang et al., 2010).
Los hongos nematófagos se distribuyen mundialmente y se encuentran formando parte de la biodiversidad de los suelos (Farah et al., 2019). Por ejemplo, el género Arthrobotrys es uno de los más frecuentes en los muestreos de campo (Hafeez et al., 2020). Los hongos depredadores capturan a sus presas mediante la modificación de sus hifas en variadas formas y tamaños, incluidas hifas adhesivas, redes adhesivas, anillos constrictores, botones adhesivos y anillos no constrictores (Vidal-Diez de Ulzurrun & Hsueh, 2018). La formación de estructuras de atrapamiento es un indicador de que los hongos y los nematodos interactúan y compiten entre sí. Los hongos nematófagos son capaces de producir estructuras de atrapamiento para capturar los nematodos vivos en el suelo, matarlos y emplearlos para su nutrición (Zhang et al., 2014).
Las recientes investigaciones ponen en evidencia la importancia de las funciones de los microorganismos del suelo, así como las interacciones ecológicas que se producen entre ellos, siendo crucial para el desarrollo de nuevas innovaciones en el sector agrario, especialmente para un mayor rendimiento de los cultivos tropicales (Ahmad et al., 2021; Olivares et al., 2021a; Peng et al., 2021; Zhang et al., 2020). Aunque se ha demostrado que el control fúngico puede reducir las poblaciones de nematodos formadores de agallas en un 45% en comparación con condiciones no controladas, el uso de nematicidas químicos sigue siendo uno de los principales medios de utilización (Peiris et al., 2020; Saxena, 2018). Entonces, las preocupaciones por la creciente contaminación de los sistemas de producción por el uso descontrolado de pesticidas han aumentado la demanda de mayores estudios para el desarrollo de agentes de control biológico, razón por la cual aumenta el interés por conocer las interacciones naturales de los hongos nematófagos. Por tanto, el objetivo de esta revisión fue discutir sobre la biología y mecanismos de acción de los hongos nematófagos que se encuentran naturalmente y que pueden ser aprovechados para el biocontrol contra nematodos fitoparásitos de cultivos tropicales, la cual servirá de utilidad para los investigadores que diseñan programas de control biológico.
2. Hongos nematófagos
Los hongos nematófagos han generado enorme importancia para diversos estudios de distribución, ecología, sistemática y su potencial utilización en el control biológico. Se encuentran en todo el mundo, formando parte de los principales grupos de los hongos inferiores (Chytridiomycetes, Zygomycetes) de los hongos superiores (Ascomycetes, Basidiomycetes y Deutero-mycetes) (Dasgupta & Khan, 2015), incluso de otros protistas como Oomycetes, que, a pesar de compartir ciertos fenotipos de crecimiento y características morfológicas, así como modos de nutrición y nichos ecológicos (Klinter et al., 2019), difieren de los hongos verdaderos (Thines, 2018).
Los hongos nematófagos viven en el suelo donde capturan y matan a los nematodos para utilizarlos como fuente de nutrientes (Meerupati et al., 2013). Además, emplean diferentes estructuras de captura especializadas para atrapar a sus presas, por lo que aumenta la diversidad de adaptaciones morfológicas de las trampas (Yang et al., 2007), las cuales están provistas de proteínas que les permiten establecer un contacto firme con la presa para posteriormente penetrar la cutícula y devorarlos (Figura 1) (Andersson et al., 2014; Dijksterhuis et al., 1994).
Existe una variada diversidad de estructuras de atrapamiento de los hongos nematófagos que se forman después de la inducción de estímulos externos (Nordbring-Hertz, 2004) o de manera espontánea (Dijksterhuis et al., 1994). Se han estudiado cinco tipos de estructuras morfológicas (Tabla 1). La red adhesiva es la más distribuida, formada por una capa de polímeros extracelulares fibrilares que se forman a partir de una hifa vegetativa que se curva para fusionarse con la hifa principal (Rosén et al., 1997).
En general, las trampas adhesivas utilizan polímeros extracelulares que se acumulan en el lugar de la infección. En el caso de los anillos constrictores, estos atrapan a su presa por medio de una rápida hinchazón de las células del anillo. Los anillos de constricción están formados por tres células que aumentan rápidamente su volumen cerrando la abertura para atrapar a su presa (5-8 μm de ancho y 20-28 μm de longitud), luego las hifas penetran, paralizan y consumen al nematodo (Liu et al., 2012). De entre los tipos de trampas, los botones adhesivos son los más efectivos en el atrapamiento de los nematodos, pues sólo una célula puede capturar nematodos grandes (Ji et al., 2020). Mientras que los anillos constrictivos suelen ser más eficientes que las redes adhesivas en reducir las poblaciones de nematodos (Cooke, 1963). Por tanto, dependiendo de la especie, los hongos nematófagos difieren en su capacidad parasitaria.
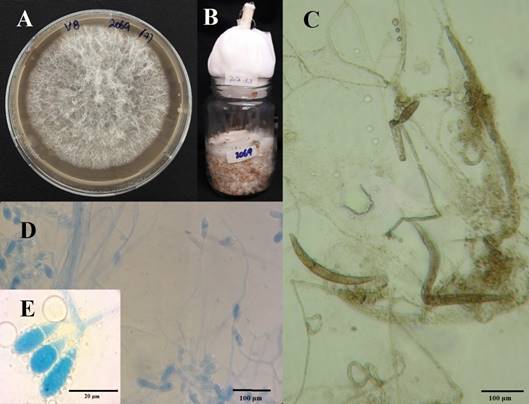
Figura 1 Observación de hongos nematófagos y la formación de estructuras de atrapamiento contra nematodos. (A) Crecimiento micelial de Arthrobotrys musiformis (Drechsler) Matsush en medio de cultivo sintético de jugo v8 durante 7 días. (B) Crecimiento micelial de A. musiformis en sustrato de quinua durante 13 días. (C) Estructuras de atrapamiento de A. javanicus contra nematodos. (D) Estructuras morfológicas de A. javanicus (Rifai & R.C. Cooke) Jarow (Conidióforo, célula conidiógena, Conidios). (E) Conidios A. javanicus.
Tabla 1 Taxonomía, estructura de atrapamiento y proceso de infección de los hongos nematófagos Deuteromycetes
| Representantes de hongo nematófago | Estructura de atrapamiento | Proceso de infección | Referencias |
| A. oligosporus Fresen A. vermicola (R.C. Cooke & Satchuth.) Rifai D. musiformis Drechsler | Redes adhesivas | Reconocimiento mediante interacción lectina-carbohidrato lo que termina con la unión firme al nematodo. | (Tunlid et al., 1992) |
| Drechslerella dactyloides (Drechsler) M. Scholler, Hagedorn & A. Rubner | Anillos constrictores | Los nematodos ejercen presión en el anillo activando las proteínas G lo que conduce a un aumento citoplasmático. Las células del anillo se expanden y contraen la abertura, dejando al nematodo atrapado. | (Chen et al., 2001;Liu et al., 2012) |
| Dactylellina haptotyla (Drechsler) M. Scholler, Hagedorn & A. Rubner D. appendiculata (Anastasiou) M. Scholler, Hagedorn & A. Rubner | Esporas adhesivas y anillos no constrictores | Los botones adhesivos son los más eficientes para capturar nematodos. Se adhieren a la cutícula y penetran en su interior para devorarlos. | (Ji et al., 2020) |
| Gamsylella cionopaga E.C. Yang | Columnas adhesivas | Las columnas pueden extenderse, doblarse y anastomosarse y unirse a otras estructuras de captura multicelular. Las células adhesivas contiguas pueden atrapar a un nematodo, cada una penetrando y formando un bulbo de infección | (Dowsett et al., 1984) |
2.1 Sustrato y requerimientos ambientales de los hongos nematófagos
Los hongos nematófagos están ampliamente distribuíos en casi todos los tipos de suelo, alrededor de la zona radicular de las plantas, en el estiércol y en material vegetal en descomposición (Webster & Weber, 2007) por lo que también se encuentran formando parte de la estructura microbiológica de los cultivares tropicales. La transición del estilo de vida de los hongos nematófagos es una respuesta de los microorganismos a las señales del entorno, incluidos los compuestos secretados por nematodos (Nordbring-Hertz et al., 2011). Estudios demuestran que la presencia de hongos depredadores requiere de factores que contribuyan en su estilo de vida como pH, humedad, nutrientes y materia orgánica (Morgan et al., 1997), así como múltiples factores edáficos que pueden contribuir a la presencia de este tipo de hongos (Olivares et al., 2021a; Olivares et al., 2021b). En el hongo Duddingtonia flagrans (Dudd.) R.C. Cooke la temperatura óptima para la producción de trampas es de 30 ºC, logrando inducir entre 700-800 trampas/cm2/2días (Grønvold et al., 1996).
Las condiciones del ambiente y el sustrato inciden en el efecto depredador de los hongos nematófagos. Se ha reportado que la aplicación de estiércol de vaca puede favorecer la depredación de A. dactyloides y reducir el número de nudos de raíces, hembras, masas de huevos y número total de nematodos en campo (Kumar & Singh, 2006). Así mismo, la introducción de residuos de vainas de garbanzo puede proporcionar energía para la supervivencia y colonización de los hongos nematófagos Acremonium strictum W. Gams y Aspergillus terreus Thom (Singh & Mathur, 2010). Las enmiendas orgánicas suelen estimular las actividades de los microorganismos, especialmente aquellos que son antagonistas de los nematodos parásitos de plantas (Akhtar & Malik, 2000). Por tanto, los organismos del suelo se ven afectados directamente por la calidad de desechos orgánicos aplicados (Eo et al., 2012), considerándose un factor clave de sostenibilidad para mejorar la función de la estructura del suelo (Ghani et al., 2019).
2.2 Ecología de los hongos nematófagos y sus presas
Numerosos enemigos en el entorno natural atacan a los nematodos y reducen sus poblaciones. Los enemigos incluyen ácaros (Ekmen et al., 2010), colémbolos (Hodson et al., 2012), bacterias (Bajaj & Walia, 2005), otros nematodos (Helmberger et al., 2017) y un grupo de hongos nematófagos. Los hongos nematófagos regulan la abundancia de los nematodos por medio de la competencia para colonizar una amplia variedad de hábitats, ocupando una importante posición entre los microorganismos que regulan la densidad en el suelo. Algunas especies de Metarhizium utilizan el hábitat de sus presas favoreciendo a la planta en la reducción de poblaciones de nematodos (St. Leger & Wang, 2020). La capacidad de matar nematodos proporciona una fuente de nitrógeno que puede intercambiar con la planta por carbono (Ciancio et al., 2016).
Aunque la interacción en los microcosmos del suelo es compleja, existen microhábitats que revelan una correlación positiva entre la densidad de propágulos de hongos nematófagos y sus presas (Jaffee et al., 1992). El número de trampas en los hongos nematófagos aumenta significativamente con el tamaño y la motilidad de los juveniles de nematodos (Xie et al., 2010), así como también por las condiciones del entorno, el contacto con nematodos o por compuestos nitrogenados (Wang et al., 2018). Los hongos depredadores pueden atacar todos los estadios de los nematodos, incluyendo los huevos, juveniles y adultos (Khan et al., 2006; Thongkaewyuan & Chairin, 2018).
Los nematodos pueden reducirse natural o artificialmente en el suelo, debido a la acción que ejercen otros organismos sobre sus poblaciones, esto es, alimentándose o causando daño en su estructura. La introducción de hongos nematófagos provoca acciones como la depredación, antibiosis, inducción de resistencia a la planta, micoparasitismo, competencia de nutrientes, producción de enzimas, metabolitos y toxinas que degradan la pared celular de los nematodos (Liang et al., 2019; Wan et al., 2021).
A pesar de que los hongos son sésiles, el movimiento de los nematodos permite un rápido crecimiento y desarrollo del micelio, lo que genera mayor dispersión, colonización y supervivencia en el entorno natural (Naranjo-Morán et al., 2021). Por ejemplo, A. oligosporus puede crecer y colonizar rápidamente el sistema radicular, incluso crecer quimiotrópicamente hacia la punta de las raíces, logrando tener mucho éxito en la depredación de los juveniles nematodos (Bordallo et al., 2002). Además, el sistema radicular puede proporcionar hábitat apropiado para el desarrollo y colonización de propágulos de hongos nematófagos (Persmark & Jansson, 1997).
Los hongos nematófagos forman estructuras de atrapamiento para pasar del estilo saprófito al carnívoro. Sin embargo, se ha demostrado que ciertos fungicidas inhiben la germinación de los propágulos fúngicos (Fravel et al., 2005), tal como la aplicación de propiconazol en el suelo, donde se inhibió el potencial depredador de A. dactyloides en la captura de nematodos (Kumar et al., 2015). La aplicación de fungicidas no afecta negativamente el crecimiento de los hongos nematófagos, pero inhibe la actividad depredadora, por lo que no disminuyen las poblaciones de los nematodos según resultados esperados (Woodward et al., 2005).
2.3 Interacciones de hongos nematófagos para el control de nematodos
Las interacciones entre hongos y nematodos son parte de las complejidades microbiológicas en el ambiente de la rizosfera. Los hongos nematófagos pueden permanecer en un estado de actividad depredadora siempre que existan diferentes fuentes de energía orgánica y no solo la de nematodos (Cooke, 1962). Estos hongos pueden mejorar la eficiencia del parasitismo cuando tienen disponibles sustancias que le permiten aumentar sus mecanismos de depredación. Se ha demostrado que el quitosano mejora la eficiencia del biocontrol. En un estudio donde se mezclaron quitosano e Hirsutella minnesotensis tuvo como resultado el aumento de parasitismo de los juveniles de Heterodera glycines (Mwaheb et al., 2017). La quitina y el quitosano pueden ser degradados y utilizados eficientemente por el hongo nematófago Pochonia chlamydosporia (Aranda-Martinez et al., 2016).
Se han realizado evaluaciones in vitro e in vivo para estudiar la acción de A. oligosporus en la degradación de la madera y en la captura de nematodos. In vitro los hongos nematófagos degradan mucha madera cuando los nematodos están presentes (Jaffee, 2004). Además, es posible que mayor cantidad de nematodos en el suelo estimulen el aumento de A. oligosporus (Nguyen et al., 2007). Esto es posible debido a que los hongos nematófagos requieren de fuentes de nitrógeno para aumentar las estructuras de atrapamiento (Persson & Bååth, 1992; Su et al., 2016).
3. Proceso de infección y depredación de los hongos nematófagos
Los hongos nematófagos pueden vivir tanto en la materia orgánica o como depredadores especializados (Pramer, 1964; Su et al., 2017). La depredación es una estrategia para obtener de sus presas elementos nutricionales como el nitrógeno (Kerry, 2000). Además, la depredación permite la organización de los ecosistemas en cadenas alimenticias y juega un papel importante en el flujo de energía y nutrientes.
Las estructuras de atrapamiento son de diversas formas y tamaños. Existen cuatro grupos de hongos nematófagos que se clasifican en función de sus mecanismos de depredación, incluyendo el uso de trampas adhesivas o mecánicas, esporas, parásitos de huevos de nematodos y productores de toxinas que inmovilizan al organismo (Swe et al., 2011). El atrapamiento se produce cuando los nematodos migran hacia las trampas, por lo que quedan adheridas al tegumento de la presa. Los nematodos atrapados son muertos y digeridos por el hongo (Askary, 2015). Drechmeria coniospora contra M. incognita, el proceso de infección inicia con la adhesión de la espora en el tegumento, luego desarrolla un micelio que penetra la cutícula y posteriormente brota en el cuerpo de todo el nematodo (Wan et al., 2021).
Luego de la formación de trampas, se desencadenan una serie de procesos que incluyen el atrapamiento, penetración mecánica e inmovilización del nematodo. Generalmente, los nematodos son rápidamente colonizados en su interior por medio de las hifas del hongo quien rompe el tegumento y produce una estructura bulbosa por todo el cuerpo (Olthof & Estey, 1963). Los hongos nematófagos utilizan proteínas funcionales patógenas para infectar a los nematodos y degradar su cutícula, en las cuales se incluyen las quitinasas, subtilisinas (similares a los entomopatógenos) y proteínas adhesivas (Liu et al., 2014).
3.1 Señales químicas y proceso bioquímico ligado a la depredación
Los nematodos inducen en los hongos la autofagia la cual es crucial para la formación de estructuras de atrapamiento (Chen et al., 2013). Los hongos nematófagos pueden detectar y responder a ciertas familias de feromonas de moléculas de señalización llamados ascarósidos (Yu et al., 2021). Los ascarósidos son sustancias que producen los nematodos en su desarrollo y comportamiento capaces de regular la atracción, la repulsión, la agregación y la plasticidad olfativa (Choe et al., 2012). Los ascarósidos provocan en los hongos nematófagos el inicio de la morfogénesis, por lo que forman estructuras de atrapamiento en condiciones de escases de nutrientes. Los ascarósidos de Caenorhabditis elegans induce la formación de anillos (Hsueh et al., 2013). Otros, como M. incognita, M. graminicola, Hoplolaimus indicus, Helicotylenchus dihystera, Xiphinema basiri, Tylenchorynchus brassicae han sido empleados para producir nemin, que inducen la morfogénesis (Kumar et al., 2011).
Además de los ascarósidos, otros compuestos como el nitrato de sodio, urea y extracto de levaduras han sido identificados como inductores en la formación de trampas fúngicas (Liang et al., 2016). Los hongos nematófagos no solo pueden atraer químicamente a sus presas, sino que identifican los compuestos atractivos específicos para confundirlos y atraparlos en sus estructuras adhesivas (Vidal-Diez de Ulzurrun & Hsueh, 2018). Entre los metabolitos asociados a la atracción de los nematodos se incluyen la furanona y pirona (Figura 2). Mientras que el maltol actúa como regulador morfológico de las estructuras de atrapamiento (Wang et al., 2018).
Al inicio de la formación de estructuras de atrapamiento, los nematodos inducen varios procesos ligados a la depredación: la autofagia, el aumento de la expresión de genes que están asociados a la biosíntesis de aminoácidos y señalizaciones (Chen et al., 2013). En A. oligosporus los nematodos activan la vía Fus3 de la cascada de señalización de la proteína quinasa por mitógenos (MAPK) que se utilizan para los ciclos de fosforilación/desfosforilación de proteínas para trasmitir información y los cuales son esenciales en la morfogénesis de las estructuras de atrapamiento (Chen et al., 2021). En este hongo nematófago la vía de señalización compuesta por proteína quinasa activadas por mitógenos (MAPK) AoBck1 y AoMkk1 son necesarios para mantener la integridad de la pared celular, el crecimiento, desarrollo del micelio, conidiación, formación de trampas y patogenicidad (Xie et al., 2021).
Se han identificado varias proteínas adhesivas, incluida una que se halla en la pared celular denominada AoMad1 y que puede provocar la formación de trampas o inhibirla y cuyo resultado previene el cambio del estilo de vida del hongo (Liang et al., 2015). Así mismo, la proteína quinasa Ime2 desempeña un papel fundamental en el crecimiento del micelio, la conidiación y la formación de trampas (Xie et al., 2020). Además de las proteínas quinasas en el proceso de señalización también se requieren fosfolipasas las cuales intervienen en múltiples funciones celulares, como el crecimiento, adquisición de nutrientes, traducción de señales incluso la patogénesis de los hongos (Barman et al., 2018). Por ejemplo, la fosfolipasa C (AoPLC2) es una enzima que hidroliza los fosfolípidos y está implicada en la regulación del desarrollo del micelio, la morfogénesis de las estructuras de atrapamiento y la patogenicidad en el hongo A. oligosporus (Xie et al., 2021)
4. Importancia de los hongos nematófagos en cultivos tropicales
La infección con nematodos ha devastado cultivares agrícolas y contribuido a enfermedades en los animales (Åhman et al., 2002). Debido a su ciclo de vida y comportamiento es un enorme desafío controlarlos con productos químicos y antagonistas microbianos (Jones et al., 2013), pues a pesar de que la mayoría de los nematodos son bisexuales, un número considerable de especies son partenogénicas, es decir, una forma de reproducción donde no interviene la fecundación. Los hongos nematófagos comenzaron a investigarse con la primera observación realizada en la especie Harposporium anguillulae (Lohde, 1874). Sin embargo, con el desarrollo de pesticidas comerciales a partir de 1940, se mermaron los estudios de control biológico a nivel mundial (Abd-Elgawad & Askary, 2018).
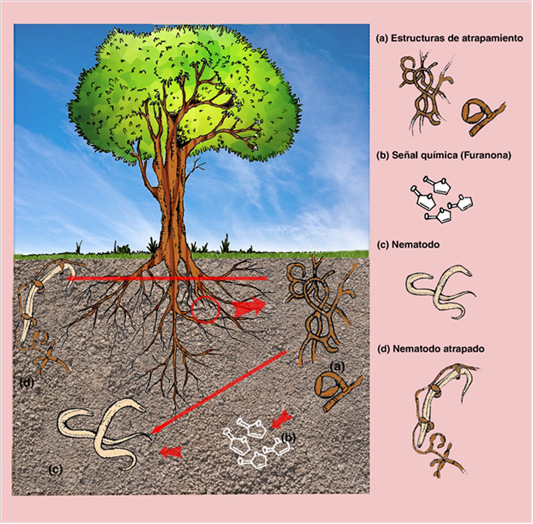
Figura 2 Esquema de las interacciones de señales químicas entre hongos y nematodos. El hongo nematófago produce señales químicas para atraer al nematodo y formar estructuras de atrapamiento para inmovilizarlo y finalmente devorarlo. (a) Formación de las estructuras de atrapamiento. (b) Producción de señales químicas (Furanona). (c) Nematodo atraído por las señales químicas. (d) Nematodo atrapado.
Actualmente, por el creciente aumento de los problemas ambientales acuñados a los químicos, las investigaciones se han dirigido hacia el desarrollo de productos comerciales a partir de cepas microbiológicas (Forghani & Hajihassani, 2020), particularmente fúngicas pues presentan beneficios asociados con la síntesis de fitohormonas y la absorción de fósforo en las plantas (Duponnois et al., 2006), así mismo tienen la capacidad de afectar positivamente al crecimiento de las plantas (Osman et al., 2020; Singh et al., 2007), colonizar la rizosfera y controlar las poblaciones de nematodos (Soares et al., 2020). Incluso una sola especie de hongo puede controlar varias especies de una comunidad de nematodos fitoparásitos, ejecutando su capacidad de estilo de vida depredador y permitiendo el crecimiento de brotes de la planta en general (Hafeez et al., 2020; Yang et al., 2020).
Así mismo se han desarrollado numerosas investigaciones con cepas fúngicas, para el desarrollo de productos especialmente con Purpureocillium lilacinum y Pochonia chlamydosporia por el gran potencial de biocontrol que presentan (Flores et al., 2021). P. lilacinum es una de las especies mayormente estudiadas en el biocontrol de nematodos. Posee la capacidad de reducir significativamente hembras y huevos de M. incógnita (Leong et al., 2021). Puede colonizar la capa externa de los huevos de nematodos, así como penetrar directamente sus hifas en la cutícula de los juveniles. Por su capacidad de depredación y excelentes propiedades de colonización, este hongo ha aplicado en ensayos de invernadero empleando diferentes formulaciones (Giné & Sorribas, 2017; Kepenekci et al., 2018). Incluso es posible aplicarlo en planes de manejo con la combinación de productos químicos (Dahlin et al., 2019).
En el cultivo de zanahorias se han empleado varias especies de hongos nematófagos para el control de M. hapla, estas especies pertenecientes a A. oligosporus, Dactylella oviparasitica, Clonostachys rosea, Stropharia rugosoannulata y Lecanicillium muscarium han sido eficientes tanto en pruebas in vitro como in vivo (Hussain et al., 2016). En el cultivo de tomate, la especie A. oligosporus ha sido la más estudiada en evaluaciones en invernadero y campo con juveniles de nematodos del género Meloidogyne (Soliman et al., 2021). La literatura sobre la aplicación efectiva de los hongos nematófagos en el control biológico de nematodos es amplia, por lo que en el presente estudio se detallan algunos que tienen relevancia para los cultivos tropicales (Tabla 2).
Actualmente se han desarrollado varias formulaciones en base a los hongos nematófagos para ser empleados en ciertos cultivares agrícolas, especialmente para contrarrestar las poblaciones del nematodo agallador Meloidogyne spp. (Aminuzzaman et al., 2013). En este sentido, una investigación revela que la aplicación de fórmulas individualizadas no es tan significativa como cuando se emplean varias especies fúngicas en el mismo producto, logrando incluso mayor colonización del sistema radicular y mejorar la vigorosidad de los cultivos (Dávila & Hío, 2005; Singh & Mathur, 2010). Sin embargo, es posible que ciertas condiciones del suelo exijan que los microorganismos sean empleados bajo una modalidad de manejo integrado combinando otras alternativas en el control de plagas (Silva et al., 2017).
4.1 Aislamientos y utilización de hongos nematófagos en cultivos tropicales
En países latinoamericanos, se ha desarrollado una extensa investigación en aspectos de aislamiento y utilización de microorganismos. En este sentido, se presentan algunos ejemplos enfocados en la región, como medida para contrarrestar los efectos causados por los productos químicos y producir microorganismos inocuos para el suelo.
En Cuba, se han reportado aislamientos en diferentes localidades provenientes de cultivos de café de las variedades caturra y robusta. Los hongos nematófagos aislados fueron evaluados en laboratorio e invernadero en plántulas de tomate, logrando buenos resultados en la reducción del número de masas de nematodos con uno de los aislados de Verticillium chlamydosporium (Goddard) (Hidalgo-Diaz et al., 2010). En Costa Rica, se realizaron recolecciones en suelos y desechos orgánicos, de 12 diferentes zonas de vida según Holdridge, incluido cultivos de la zona de bosque tropical (Koziak et al., 2007).
En Brasil empezaron con aislar y probar in vitro la depredación de hongos nematófagos provenientes de suelos y raíces de cultivos como café, cítricos, soja, eucalipto, cebolla, limón, hortalizas, entre otros (Naves & Campos, 1991; Silva & Campos, 1991). En condiciones de invernadero se probaron cepas de Pochonia chlamydosporia contra Meloidogyne javanica en plantas de tomate, reduciendo hasta en un 72% el número de masas de huevos de nematodos (Dallemole-Giaretta et al., 2012). Experimentos en cultivos de soja y maíz empleando P. chlamydosporia y Trichoderma sp. demostraron ser eficientes en el biocontrol del nematodo Pratylenchus brachyurus considerado uno de los fitopatógenos más relevantes en ambos cultivares (Pacheco et al., 2020). Además, las asociaciones de Duddingtonia flagrans y P. chlamydosporia no solo redujeron significativamente poblaciones de M. javanica en soja, sino que además de promueven la adquisición de nutrientes (Balbino et al., 2021). Por tanto, estas investigaciones sugieren que los hongos nematófagos pueden ser una alternativa eficiente de control biológico contra diferentes poblaciones de nematodos (Hahn et al., 2019).
En el norte de Perú en cultivos de espárragos se encontró diferentes antagonistas biológicos de nematodos fitoparásitos Drechslerella brochopaga (Drechsler), Lecanicillium psalliotae (Treschew) y Monacrosporium sp. (Murga-Gutierrez et al., 2012). En otro estudio se demostró que P. lilacinus posee la capacidad de mitigar las poblaciones de nematodos de M. incognita y Globodera pallida en papa (Jatala et al., 1979), llegando incluso a duplicar la producción de tomates en condiciones de campo con relación al control (Cabanillas & Barker, 1989).
Tabla 2 Ejemplo de cultivares afectados por nematodos y sus posibles controladores biológicos
| Nematodo | Controlador biológico | Cultivos tropicales | Referencia |
| Heterodera zeae Globodera rostochiensis Wollenweber G. pallida Stone | Purpureocillium lilacinum (Thom) Luangsa-ard, Houbraken, Hywel-Jones & Samson | Zea mays L. Solanum tuberosum L | (Baheti et al., 2017) |
| Heterodera glycines Ichinohe | Hirsutella minnesotensis | Glycine max L. Merr. cv Kent | (Mwaheb et al., 2017) |
| Meloidogyne graminicola | Arthrobotrys dactyloides Dactylaria brochopaga | Oryza sativa | (Singh et al., 2007) |
| Meloidogyne incognita | Dactylaria brochopaga | Solanum tuberosum L. | (Aboul-Eid et al., 2016) |
| Meloidogyne javanica | Trichoderma harzianum Purpureocillium lilacinus | Arachis hypogaea L. | (Osman et al., 2020) |
| Meloidogyne incognita | Aspergillus niger | Citrullus lanatus | (Jang et al., 2016) |
| Meloidogyne species | Verticillium chlamydosporium (Goddard) | Solanum lycopersicum L. | (Hidalgo-Diaz et al., 2010) |
| Meloidogyne enterolobii | Pochonia chlamydosporia Purpureocillium lilacinum | Tomate (cv. Santa Clara) Banano (cv. Terra) | (Silva et al., 2017) |
| Meloidogyne enterolobii | Pochonia chlamydosporia Purpureocillium lilacinum | Psidium guajava | (Carneiro et al., 2011) |
| Meloidogyne spp. | Beauveria bassina, Metarhizium anisopliae y Purpureocillium lilacinus | Solanum quitoense Lam | (Salazar et al., 2012) |
| Varias especies de nematodos | Clonostachys rosea | Daucus carota Triticum aestivum | (Iqbal et al., 2018) |
En Colombia, se ha evaluado con resultados exitosos el potencial nematicida de cepas de B. bassina (Bals.), M. anisopliae (Metschn) y P. lilacinus (Thom) para controlar nematodos del género Meloidogyne de un cultivar de naranjilla (Solanum quitoense L.) (Salazar et al., 2012). En la producción de flores el hongo nematicida Purpureocillium sp. demostró tener una alta capacidad nematicida contra juveniles de Meloidogyne spp. y Paratylenchus spp. en condiciones de campo (Sánchez & Cardona, 2018).
En Ecuador, las investigaciones iniciaron con la identificación y reporte de varias especies de hongos nematófagos provenientes de diferentes localidades con un extenso estudio realizado en 1994 (Rubner, 1994). Así mismo, en muestreos de campo del bosque tropical, se han reportado el potencial uso de A. oligosporus como control biológico para nematodos del género Meloidogyne, realizándose pruebas in vitro e in vivo demostrando ser una alternativa de manejo para la producción de tomate en condiciones de invernadero (Quevedo et al., 2021). Además, se probaron formulaciones de hongos de Pleurotus ostreatus (Jacq.) y T. harzianum (Rifai) sobre M. incognita (Kofoid & White) en tomate (S. lycopersicum Mill.) demostrando tener resultado parecidos al control químico (Erazo et al., 2020), mientras que P. chlamydosporia (Goddard) y P. lilacinum (Thom) se evaluaron en condiciones de campo (Solano et al., 2015).
5. Brechas críticas de conocimiento y prioridades de investigación en el uso de hongos nematófagos en cultivos tropicales
Las investigaciones para la reducción de la brecha del conocimiento deben ir encaminadas hacia la comprensión holística de los factores biológicos y ecológicos del suelo (Abd-Elgawad & Askary, 2020), como base para entender los mecanismos de acción de los microorganismos y los factores determinantes en el éxito o fracaso de la aplicación de cepas con potencial nematicida. Las interacciones entre estos microorganismos proporcionan nuevos modelos que pueden emplearse en el plan de manejo de cultivos tropicales (Olivares et al., 2020), tomando en cuenta las variables ambientales junto con las prácticas culturales sostenibles (Olivares et al., 2021a; Olivares et al., 2021b), para mantener el funcionamiento y equilibrio de los ecosistemas (Ahmad et al., 2021; Zhang et al., 2020).
Los hongos nematófagos se encuentran naturalmente en el suelo, por lo que forman parte de la rizosfera de las plantas, pudiendo colonizar sus raíces y competir con otros organismos por el hábitat (Soares et al., 2020). Por lo que el conocimiento ecológico es esencial para evaluar los indicadores de biocontrol en ensayos de invernadero y campo (Olivares-Campos et al., 2019; Olivares, 2016). Tales condiciones ponen en evidencia la importancia de generar nuevas formulaciones que permitan el uso de estos microorganismos en diferentes cultivos, tales como hortalizas, frutales y tubérculos mediante técnicas innovadoras en el sector agrícola (Sasanelli et al., 2021).
En síntesis, el descubrimiento de nuevos aislados fúngicos que controlan ciertas poblaciones de nematodos en condiciones específicas, así como los avances en la biología molecular, la ingeniería genética, la nanotecnología y la bioinformática, en especial las tecnologías ómicas en la investigación del microbioma del suelo (Olivares et al., 2022), han permitido mejorar las capacidades de los hongos en el proceso de la depredación. El rápido aumento de las investigaciones en el campo del biocontrol han permitido que varios países de Latinoamérica puedan sacar al mercado productos innovadores de origen biológico convirtiéndose en un ejemplo a seguir en el camino de la investigación, desarrollo e innovación (I+D+i).
6. Conclusiones
Actualmente el uso de microorganismos está siendo investigado por diversas entidades asociadas al mejoramiento de la agricultura para reducir las pérdidas económicas que provocan los nematodos fitopatógenos y desarrollar nuevas estrategias inocuas ambientalmente. Los hongos nematófagos son muy diversos y se presentan como una alternativa en el control biológico, pues se han especializado en el desarrollo de estructuras morfológicas para atrapar y devorar nematodos eficientemente. Según los reportes, estos hongos pueden atacar una o varias poblaciones de nematodos, por lo que los resultados sugieren ser empleados con otras estrategias como nematicidas microbianos para el manejo integrado de nematodos.
A pesar de los avances recientes en el estudio de control biológico asociados con hongos nematófagos, son pocas las aplicaciones de estrategias de control con microorganismos en los cultivares tropicales. Por tanto, es importante conocer las interacciones de estos organismos para fortalecer las capacidades del sector agrícola. En este sentido, los futuros estudios deberían centrarse en investigaciones de aplicabilidad de los hongos, así como en ampliar los constructos sobre las condiciones ambientales e interacciones que afectan la diversidad y abundancia de los microorganismos fúngicos en entornos agrícolas.















