1. Introducción
El fitopatógeno Macrophomina phaseolina, es un hongo necrotrófico perteneciente a la división Ascomycota, clase Dothideomycetes y familia Botryosphaeriaceae. Además, es el agente causal de la enfermedad denominada pudrición carbonosa del tallo y la raíz, que afecta a más de 500 especies de plantas, incluyendo cultivos económicamente importantes como soja, maíz, sorgo, sésamo, algodón, estevia, frijol, girasol y cucurbitáceas (Baird & Brock, 1999; Bandara et al., 2018; Fuhlbohm et al., 2013; Gupta et al., 2012; Koehler & Shew, 2018; Martínez-Villarreal et al., 2016; Reis et al., 2014). La gran variabilidad morfológica sugiere una alta adaptabilidad a las diferentes condiciones ambientales y a su vez podría explicar su amplia distribución geográfica, presenta además una gran variabilidad patogénica y genética que podría estar asociada a la gran variedad de especies de hospederos que infecta (Kaur et al. 2013; Khan et al., 2017; Pandey et al., 2020; Reyes-Franco et al., 2006; Reznikov et al., 2018; Viejobueno et al., 2022).
Para minimizar el impacto negativo de M. phaseolina en el rendimiento de los cultivos se han realizado numerosos esfuerzos a nivel mundial para conocer la biología del hongo, la diversidad genética, la virulencia y las moléculas secretadas, de manera a comprender el patosistema y permitir el diseño de una estrategia efectiva de control de la enfermedad (Beas-Fernández et al., 2006; Islam et al., 2012; Khan et al., 2017; Paiva Negreiros et al., 2019; Sarkar et al., 2014; Singh et al., 2022).
En varios trabajos se identificaron varios metabolitos secundarios secretados por M. phaseolina, entre ellos, asperlina, isoasperlina, fomalactona, ácido faseolínico, fomenona, faseolinona (Dhar TK, 1982; Mahato et al., 1987), macrofominol (Trigos et al., 1995) y botriodiplodina (Ramezani et al., 2007). Además, se demostró la actividad fitotóxica para algunos de ellos, faseolinona, botriodiplodina (Abbas et al., 2020; Bhattacharya et al., 1994; Bhattacharya et al., 1987), dos faseociclopentanonas A y B, una guignardone A (Masi et al., 2021) y meleína (Li et al., 2021). Recientemente se han descrito nuevos metabolitos secretados por M. phaseolina, como el ácido azelaico y tirosol, sin embargo, aún se desconoce su contribución en el proceso de infección (Khambhati et al., 2020; Salvatore et al., 2020).
Trabajos previos en los que se analizaron las proteínas secretadas por M. phaseolina se detectaron proteínas con actividad xilanasa (Sarkar et al., 2014), enzima que ejerce un rol fundamental en el proceso de infección de hongos fitopatógenos en diferentes sistemas biológicos (Lai & Liou, 2018; Lu et al., 2020; Ramos-Santos et al., 2014). En otros trabajos se detectaron proteínas secretadas con actividad catalasa, superóxido dismutasa, amilasa, lipasa, proteasa y enzimas que degradan pared celular, proteínas que podrían estar implicadas en el proceso de infección (Bandara et al., 2018, Khan et al., 2017, Sinha et al., 2021). Recientemente se ha publicado el secretoma de M. phaseolina en cultivo sólido enriquecido con salvado de trigo, en el cual se han identificado un total de 117 proteínas (Sinha et al., 2022).
La mayoría de los trabajos realizados hasta la fecha se centran en proteínas con actividad hidrolítica, sin embargo, resulta de gran importancia analizar las proteínas secretadas independientemente de su actividad enzimática, debido a que las mismas podrían estar implicadas en la señalización molecular modulando la respuesta del hospedero durante el proceso de infección (Ceulemans et al., 2021; Toruño et al., 2016).
Por ello en este trabajo se planteó evaluar métodos de extracción de proteínas que permitan el análisis de proteínas totales secretadas por este hongo fitopatógeno, teniendo en cuenta pasos de extracción y separación electroforética de las proteínas secretadas por M. phaseolina en dos tipos de medios de cultivos suplementados o no con hojas de una de sus plantas hospederas, la soja. El interés de este trabajo radica en la necesidad de optimizar en primer lugar los protocolos de extracción antes de profundizar en la identificación y cuantificación de las proteínas para estudios descriptivos y/o comparativos con este sistema experimental.
2. Materiales y métodos
Microorganismo y material vegetal utilizados para preparación de medios de cultivo
Se utilizó un aislado de M. phaseolina codificado como FCQ 39, aislado de rastrojos de soja de la ciudad de Edelira, Departamento de Itapúa, Paraguay. El inóculo se conservó en discos de micelio sumergidos en una solución acuosa de glicerol al 80% a una temperatura de -20 °C y se mantiene en el cepario micológico del Departamento de Química Biológica de la Facultad de Ciencias Químicas de la Universidad Nacional de Asunción (FCQ-UNA). El cultivo de M. phaseolina se realizó en medio líquido papa dextrosa (PDB) y Czapek-Dox (CZP) y en los mismos medios con suplemento de hojas de soja PDBs y CZPs. Para la preparación del suplemento se utilizaron hojas de soja de la variedad Nidera A5909 RG completamente desarrolladas y sin signos de estrés recolectadas del jardín de aclimatación de plantas medicinales del Departamento de Botánica de la FCQ-UNA. El suplemento de hojas se preparó agregando 20 g de hojas enteras a 1 L de agua destilada, la mezcla se introdujo al autoclave (VA-SJ, Modelo FT1350, China) a 121 °C por 20 minutos. La mezcla fue llevada a temperatura ambiente y filtrada con gasa para separar el tejido vegetal. El filtrado fue utilizado como solución disolvente para la preparación de los medios suplementados.
Cultivo de M. phaseolina y obtención del filtrado del medio de cultivo
Para la producción del inóculo, los discos de micelio de M. phaseolina procedentes del cepario fueron inoculados en medio de cultivo Papa-Dextrosa-Agar (PDA) y fueron crecidos en una estufa microbiológica (Nahita, Modelo 636 Plus, España) a 30 °C en oscuridad hasta que el micelio cubrió toda la superficie de la placa. Posteriormente, se tomaron tres discos de micelio de 0,8 cm de diámetro de la zona de crecimiento activo y se inocularon en botellas Roux con 200 mL de cada medio de cultivo líquido, PDB, PDB suplementado, CZP y CZP suplementado (MpPDB, MpPDBs, MpCZP y MpCZPs, respectivamente). Los medios se incubaron durante ocho días en estufa microbiológica a 30 °C, en oscuridad, momento en el cual el micelio cubrió toda la superficie del medio. Se utilizaron como control negativo medios de cultivo sin inocular (PDBc, PDBsc, CZPc y CZPsc) que fueron mantenidos en las mismas condiciones experimentales. Posterior a los ocho días de crecimiento, se procedió a la separación del micelio y el medio líquido mediante filtración al vacío con embudo de Büchner y papel de filtro (Whatman No. 1). El filtrado obtenido, que contiene las proteínas secretadas por el hongo, fue congelado a -20 °C y posteriormente liofilizado en el equipo Labconco 4.5 (Freezone- EE.UU) hasta la obtención de un polvo homogéneo y libre de agua. El liofilizado fue pesado y mantenido a -20 °C hasta su utilización.
Extracción y cuantificación de proteínas secretadas
Para la extracción de proteínas se evaluaron tres métodos de extracción. El método A, consistió en la resuspensión de 200 mg del liofilizado en 400 µL medio de solubilización (MS) que contenía 7 M de urea, 2 M de tiourea, 2% de Tritón X-100 y 0,1 M de β-mercaptoetanol, el material insoluble fue separado por centrifugación y el sobrenadante conteniendo las proteínas secretadas fue mantenido a 4 °C para su posterior cuantificación. En el método B, 200 mg de liofilizado fueron resuspendidos en 400 µL medio de MS, fueron tratados con ácido tricloro acético (TCA) al 10% (p/v) en acetona (González-Fernández et al., 2014); el precipitado final fue resuspendido en 100 µL de MS y fue mantenido a 4 °C para su posterior cuantificación. En el método C, 200 mg de liofilizado fueron resuspendidos en 400 µL de MS y se sometieron al protocolo de limpieza con agua-metanol-cloroformo siguiendo el protocolo por Wessel y Flügge de Fic, (Wessel & Flügge, 1984). Las proteínas contenidas en el extracto proteico procedente de los tres métodos fueron cuantificadas siguiendo el método de Bradford utilizando albúmina de suero bovino como estándar (Bradford, 1976), se realizaron tres repeticiones para cada método. Las proteínas extraídas fueron almacenadas a 4 °C hasta el momento de su uso. En base a los datos obtenidos en la cuantificación se calculó el rendimiento, expresado en miligramos de proteína por gramo de liofilizado y analizados estadísticamente mediante ANOVA seguido de un post-hoc test de Tukey.
Electroforesis en geles desnaturalizantes y análisis de imagen
Cantidades equivalentes a 20 µg de BSA de cada extracto proteico, fueron separadas mediante electroforesis discontinua unidireccional en condiciones desnaturalizantes (SDS-PAGE) para evaluar los perfiles electroforéticos obtenidos para cada método y en cada condición de cultivo, siguiendo la metodología descrita por Laemmli (Laemmli, 1970). Los geles fueron teñidos con Azul de Coomassie R-250 y las imágenes fueron digitalizadas utilizando el sis tema Gel Doc EZ (Bio-Rad). Los perfiles proteicos de M. phaseolina obtenidos por los distintos métodos de extracción y a partir de los filtrados de los medios de cultivo evaluados, fueron analizados utilizando el programa ImageLab de BioRad. Este análisis permitió obtener valores adimensionales de intensidad para las bandas detectadas, que fueron normalizados para eliminar las posibles diferencias por cantidad de proteínas cargada por muestra (Valledor & Jorrín-Novo, 2011). Los valores normalizados fueron sometidos al análisis estadístico para detectar si existen diferencias significativas en la secreción de proteínas en las diferentes condiciones de cultivo estudiadas.
3. Resultados y discusión
En el presente trabajo se evaluaron tres métodos de extracción de proteínas secretadas por M. phaseolina crecida en medio PDB, con el objetivo de seleccionar una metodología para el estudio de las proteínas secretadas que pueda ser aplicada en posteriores trabajos en los cuales se evalúen la implicancia de las proteínas secretadas en el proceso de infección.
Selección del método de extracción de proteínas para el análisis de las proteínas secretadas
Para la evaluación de los métodos de extracción de proteínas secretadas por M. phaseolina se seleccionaron los liofilizados provenientes del medio PDB sin suplemento de hojas de soja (MpPDB) con su respectivo control (PDBc).
Las proteínas fueron extraídas mediante tres métodos: A, B y C. Las proteínas contenidas en el extracto proteico resultante fueron cuantificadas mediante el método de Bradford y separadas mediante SDS-PAGE.
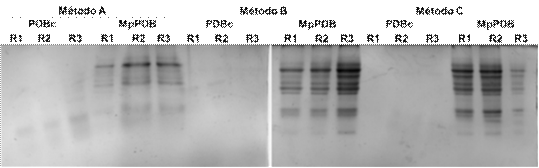
Figura 1 Perfiles de proteínas secretadas por M. phaseolina obtenidos mediante tres métodos de extracción de proteínas. 20 μg de proteínas equivalentes BSA fueron separadas mediante SDS-PAGE en geles de poliacrilamida al 12% y teñidas con Azul de Coomassie R250. PDBc, corresponde al medio de cultivo sin hongo. MpPDB, corresponde al medio inoculado con el hongo. R1, R2 y R3 son las repeticiones de cada extracto analizado.
Los rendimientos de extracción fueron 7,1 ± 3,1; 3,9 ± 0,8 y 3,7 ± 0,8 mg de proteína por gramo del liofilizado para los métodos A, B y C, respectivamente. No se detectaron diferencias estadísticamente significativas al realizar la comparación de los rendimientos obtenidos en cada método de purificación. Sin embargo, el rendimiento obtenido con los métodos B y C fue menor en comparación al método A, lo cual puede deberse a las pérdidas que ocurren durante el proceso de extracción de proteínas, estos resultados no pudieron ser comparados con datos previos debido a que hasta la fecha no se encontraron datos de rendimiento de extracción de proteínas secretadas por hongos reportados en la literatura.
Los perfiles proteicos de las proteínas secretadas por M. phaseolina al medio de cultivo PDB sin suplemento de hojas de soja (MpPDB), obtenidos mediante los tres métodos de extracción evaluados presentaron diferencias en la resolución de las bandas (Figura 1).
En los perfiles proteicos obtenidos por el método A para el medio de cultivo utilizado como control (PDBc) se observaron bandas tenues que pueden corresponder a proteínas del medio de cultivo utilizado, debido a que se trata de un medio a base de papa, en contraste se pudo observar que en el medio de cultivo en el cual fue inoculado el hongo (MpPDB), el perfil proteico presentó mayor complejidad y las bandas fueron más intensas, por lo que se puede decir que las mismas corresponden a proteínas secretadas por M. phaseolina. Sin embargo, con este método no se observó una separación adecuada de las bandas de proteínas secretadas (Figura 1).
En los perfiles proteicos evaluados con el método B (precipitación de las proteínas con TCA-Acetona) y el método C (Partición Metanol/Cloroformo), se observó que en MpPDB presentó una adecuada separación de las bandas proteicas, en cambio en los carriles correspondientes a los controles del medio (PDBc), no se observaron bandas de proteínas, esto puede deberse a que las trazas de proteí nas que fueron observadas en el control en el método A, fueron eliminadas durante el proceso de extracción.
En el análisis de imagen, se examinaron los perfiles proteicos obtenidos por SDS-PAGE para cada método. El análisis demostró que los métodos basados en la extracción de proteínas por medio de la precipitación con TCA-acetona (Método B) y partición Metanol/Cloroformo (Método C), fueron los que permitieron obtener perfiles con bandas definidas. Por lo tanto, se puede decir que los métodos B y C permitieron obtener perfiles proteicos con bandas resueltas facilitando el análisis del perfil de proteínas secretadas por M. phaseolina en las condiciones experimentales evaluadas en el presente trabajo.
Los perfiles proteicos obtenidos por el método B y C son similares al perfil de proteínas secretadas por M. phaseolina obtenido en trabajos previos (Sarkar et al., 2014, Sinha et al., 2022), con algunas diferencias en el número de bandas detectadas que pueden deberse al medio de cultivo y al método de extracción utilizado. Además, la complejidad del perfil de proteínas secretadas fue similar a lo descrito previamente para otros hongos fitopatógenos como Botrytis cinerea y Fusarium graminearum (González-Fernández et al., 2014; Yang et al., 2012).
Con los resultados obtenidos se ha seleccionado el método B para evaluar las proteínas secretadas por M. phaseolina, pues, aunque el rendimiento de extracción y los perfiles proteicos fueron similares al método C, el método B implicó un menor número de pasos para obtener el extracto proteico a ser evaluado, lo cual disminuiría las posibles pérdidas durante el proceso de extracción y permitiría obtener una mejor y realista interpretación biológica de la interacción planta-patógeno.
Perfil diferencial de proteínas secretadas por M. phaseolina a diferentes medios de cultivo
Se procedió a la extracción de proteínas secretadas por M. phaseolina a todos los medios de cultivo analizados inoculados con el hongo y sus respectivos controles, aplicando el método B.
Al realizar la comparación del rendimiento de extracción proteína se encontró que el medio PDB suplementado con hojas de soja (MpPDBs), presentó un rendimiento significativamente superior a los demás medios evaluados (Figura 2), la nula o baja cantidad de proteínas secretadas en los medios CZP y CZPs se confirmó con los resultados obtenidos en el análisis de los perfiles proteicos en SDS-PAGE (Figura 3). El mayor rendimiento de extracción de proteínas en PDB suplementado podría indicar una mayor secreción de proteínas de M. phaseolina al medio de cultivo, donde la presencia de moléculas de hospedero que podría incluir metabolitos y proteínas, estimulan la producción diferencia de proteínas con potencial implicancia en la patogénesis y estas no son secretadas en ausencia del estímulo del hospedero. La ausencia de bandas en perfil de proteínas del extracto proteico obtenido del medio PDB con suplemento de hojas sin inóculo (PDBsc) permitió comprobar que las proteínas extraídas y cuantificadas en MpPDBs son secretadas por M. phaseolina (Figura 4).
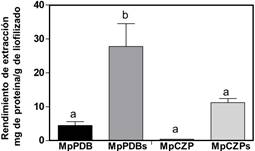
Figura 2 Rendimiento de extracción de proteínas obtenidos con el método B a partir de los distintos medios inoculados con el hongo. MpPDB: PDB inoculado con hongo. MpPDBs: PDB suplementado con hojas de soja inoculado con hongo. MpCZP: Czapek-Dox inoculado con hongo. MpCZPs: Czapek-Dox suplementado con hojas de soja inoculado con hongo. Las letras diferentes indican diferencias estadísticamente significativas (p<0,05) utilizando un ANOVA y en post test de Tukey.
El rendimiento de extracción de proteínas en CZP suplementado (MpCZPs) fue de 11,2 ± 2,1 mg de proteína por gramo del liofilizado, sin embargo, en CZP estándar (MpCZP) no se detectó proteínas mediante el método de cuantificación utilizado.

Figura 3 Perfiles de proteínas secretadas por M. phaseolina al medio CZP y CZPs. 20 μg de proteínas equivalentes BSA fueron separadas mediante SDS-PAGE en geles de poliacrilamida al 12% y teñidas con Azul de Coomassie R250. CZPc y CZPsc, corresponden al medio de cultivo Czapek-Dox sin hongo, sin y con suplemento, respectivamente. MpCZP y MpCZPs, corresponden al medio inoculado con el hongo, sin y con suplemento, respectivamente. R1, R2 y R3 son las repeticiones de cada extracto analizado.
Está demostrado que el medio de cultivo ejerce un efecto importante sobre el crecimiento y secreción de metabolitos en hongos del género Fusarium (Westphal et al., 2021), además se ha demostrado que existe una producción diferencial de metabolitos cuando el hongo es crecido en medios enriquecidos con suplemento de tejido del hospedero (VanderMolen et al., 2013). En otros trabajos se encontró que la adición de tejido del hospedero aumenta la fitotoxicidad del filtrado en los cuales ha crecido Phytophthora capsici (Flores-Giubi et al., 2013), lo cual puede estar asociado a una mayor secreción de proteínas o metabolitos con actividad biológica que pueden constituir la maquinaria bioquímica para que el microorganismo complete el proceso de infección al hospedero.
La separación de proteínas mediante SDS-PAGE no permitió detectar bandas resueltas en los extractos provenientes del medio CZP con y sin suplemento, incluso en los medios inoculados con M. phaseolina (Figura 3), por otro lado, en los extractos proteicos provenientes de MpPDB y MpPDBs se observaron perfiles proteicos con bandas resueltas (Figura 4). La ausencia de bandas proteicas en los extractos provenientes de CZP y CZPs, podría deberse a que el método de extracción de proteínas seleccionado no permite una correcta eliminación de los componentes de este medio de cultivo, en su mayoría iones (Shaukat & Siddiqui, 2003), que podrían interferir en la migración correcta de las proteínas en una electroforesis.
Los perfiles electroforéticos de las proteínas secretadas al medio PDB suplementado o estándar, permitieron realizar un análisis comparativo del perfil de proteínas secretadas por M. phaseolina en presencia o ausencia de moléculas provenientes de su hospedero. El análisis de imagen realizado con el programa ImageLab Bio-Rad permitió detectar un total de diecisiete tipos de bandas (Figura 4).
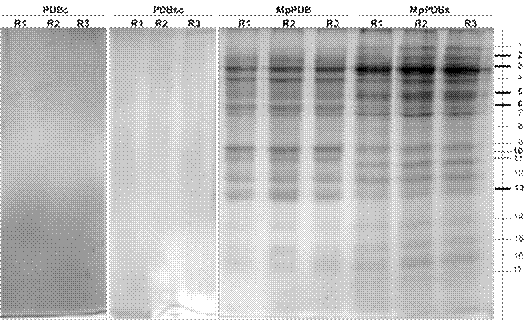
Figura 4 Perfil diferencial de proteínas secretadas por M. phaseolina al medio PDB y PDBs. 20 μg de proteínas equivalentes BSA, extraídas mediante el método B, y separadas mediante SDS-PAGE en geles de poliacrilamida al 12 % y fueron teñidos con Azul de Coomassie R250. A la derecha se muestra un esquema de las bandas detectadas en el programa Image Lab 5.2.1. Las líneas más intensas representan las diferencias cuantitativas estadísticamente significativas (p < 0,05) mediante una prueba t-Student. Las líneas discontinuas representan bandas diferenciales cualitativas. PDBc y PDBsc corresponden al medio de cultivo sin hongo, sin y con suplemento, respectivamente. MpPDB y MpPDBs corresponden al medio de cultivo inoculado, sin y con suplemento, respectivamente. R1, R2 y R3 representan las réplicas analizadas.
El análisis estadístico de la intensidad normalizadas de las bandas detectadas en el extracto proteico obtenido de MpPDB y MpPDBs, permitió encontrar diferencias estadísticamente significativas entre las bandas dos, tres, cinco, seis y trece, entre las dos condiciones de cultivo (Figura 4). Las bandas dos, tres y cinco presentaron mayor intensidad en MpPDBs, esto podría indicar que la secreción de la o las proteínas contenidas en estas bandas se vio favorecida por el suplemento de hojas de soja. Por otro lado, la secreción de la o las proteínas contenidas en las bandas seis y trece se vio aumentada en el medio PDB sin infusión (Figura 4). Además, se detectaron bandas específicas como la banda 10 de MpPDB, y la banda 11 de MpPDBs (Figura 4).
Estos resultados de producción diferencial de proteínas en medios de cultivo suplementado con tejido del hospedero pueden deberse a que la composición del medio afecta al crecimiento del hongo, donde, como se ha descrito para otros hongos, la relación Carbono/Nitrato del medio de cultivo ejerce un papel fundamental (Oh et al., 2017). El medio suplementado con hojas de soja (PDBs) indujo una producción diferencial de proteínas, lo cual podría deberse a que el enriquecimiento de este medio de cultivo con moléculas de tejido del hospedero conlleva a la estimulación de la secreción de ciertas proteínas del hongo. Hasta la fecha en la literatura no existen datos del efecto de diferentes medios de cultivo in vitro sobre la secreción de proteínas por M. phaseolina, sin embargo, los resultados del presente trabajo coinciden con los descritos en la literatura para otros hongos como Aspergillus fumigatus (Margalit et al., 2020), Aspergillus flavus (Medina et al., 2005) y Trichoderma harzianum (Suárez et al., 2005) en los cuales también se observaron diferencias en las proteínas secretadas en distintas condiciones de cultivo.
4. Conclusiones
En el presente trabajo se estableció un modelo de estudio de las proteínas secretadas por M. phaseolina. Se seleccionó la metodología de extracción de proteínas mediante una precipitación con ácido tricloroacético en acetona que permitió una buena recuperación de proteínas y una resolución electroforética óptima de las bandas de los perfiles proteicos a partir del filtrado del medio de cultivo PDB. El filtrado del hongo crecido en medio PDB suplementado con hojas de soja (MpPDBs) presentó un mayor rendimiento de extracción de proteínas con respecto a PDB, CZP y CZPs. Además, en el extracto proveniente del medio PDB se observó una mayor resolución de las bandas proteicas en SDS-PAGE con respecto a CZP.
El suplemento de hojas de soja al medio de cultivo tuvo un efecto sobre el tipo y abundancia de proteínas que fueron secretadas por M. phaseolina. Se detectaron siete bandas diferenciales, cinco de las cuales constituían diferencias cuantitativas y dos diferencias cualitativas, una de estas bandas fue específica del medio MpPDBs. Estas bandas diferenciales podrían contener proteínas que cumplen un papel relevante en el proceso de infección, lo cual deberá demostrarse en estudios posteriores. Este trabajo constituye un inicio de la evaluación de proteínas secretadas por M. phaseolina, en el que se seleccionó una metodología eficiente de extracción de proteínas, un paso fundamental, para realizar el análisis de las proteínas mediante técnicas de espectrometría de masas para la identificación de proteínas candidatas implicadas en el proceso de infección o en la interacción M. phaseolina-hospedero.















