1. Introducción
El pescado es un alimento cuyo contenido nutricional respecto a proteínas, vitaminas, minerales y ácidos grasos (especialmente: ω-3 y ω-6) son fundamentales para la salud humana (Idowu et al., 2019a,b). El aprovechamiento industrial del pescado genera desechos como piel, huesos, musculo, hígado, riñón, gónadas y cabeza, representando un total de 60% (Idowu & Benjakul, 2019; Idowu et al., 2019a). Estos desechos históricamente han sido vertidos en el mar generando una mayor contaminación ambiental, en los últimos tiempos este descarte de desechos directamente al mar está prohibido, por lo que se exige procesos de refinamiento altamente costosos antes de desechar (Klomklao & Benjakul, 2016). Se ha estimado que el crecimiento de la industria del pescado para el 2025 llegará a procesar aproximadamente 196 millones de toneladas de pescado (OECD/FAO, 2016). Adicionalmente, se considera que para el año 2050 existirá una demanda de ~9800 millones de personas por el consumo de proteínas de pescado (Raut & Sahu, 2018). Por lo tanto, este crecimiento industrial y demanda mundial es de gran importancia para los científicos en el desarrollo alimentos a partir del pescado y aprovechar adecuadamente sus residuos (Idowu et al. 2019b). Por ello, este sector ha desarrollado nuevos productos a partir de estos desechos de forma rentable, especialmente en la producción de fertilizantes, piensos, enzimas aisladas, aceite, quitina, péptidos, colágeno y harina de pescado como alimento de animales (Hsu, 2010; Xing et al., 2018; Coppola et al 2021). También se han desarrollado productos con fines de alimentación humana a pesar de la existencia de limitaciones como la presencia de sabores amargos en los hidrolizados. Sin embargo, diversos estudios han logrado la reducción significativa del sabor amargo y aplicarlos en panes, galletas y helados (Idowu & Benjakul, 2019; Sinthusamran et al., 2019a; Karnjanapratum & Benjakul 2017; Egerton et al., 2018; Sinthusamran et al., 2019b; Idowu et al., 2019b). La hidrólisis enzimática es el biotratamiento más barato y relativamente seguro en comparación con la hidrolisis química para la recuperación de péptidos fisiológicos y nutricionales de proteínas de pescado (Moreira et al., 2022; Idowu & Benjakul, 2019).
La acción enzimática (proteasas) genera la ruptura hidrolítica de enlaces peptídicos con mecanismos de acción variables (endopeptidasas y exopeptidasas), los péptidos generados poseen propiedades tecno funcionales (capacidad de retención de agua, formación de espuma, emulsionante, etc.) y funcionales o bioactivas como las antimicrobianas, anticancerígenas, anticoagulantes, antioxidantes, antihipertensivas, moduladoras del sistema inmunológico, entre otras (Hemker et al., 2020; Wong et al., 2019; Vázquez et al., 2020; Nasir & Sarbon, 2019; Ahn et al., 2015; Lima et al., 2019; Singh & Benjakul, 2018). El estudio de hidrolizados proteicos de pescado (FPH) es amplio; Sin embargo, nuevas tecnologías y metodologías para su extracción, purificación, cuantificación.
Esta revisión pretende describir cuales son los avances en materia de FPH, especialmente residuos, su potencial de aplicación e industrialización en alimentos detallándose aspectos comerciales y regulaciones normativas.
FPH via enzimática
El FPH es un producto de descomposición de las proteínas de pescado que contiene péptidos y aminoácidos más pequeños entre 2 a 20 unidades (Nurilmala et al., 2018; Ozyurt et al., 2020). La FPH se obtiene mediante el tratamiento de acción química o enzimática en condiciones controladas. La hidrólisis enzimática es un método rápido, amigable con el ambiente y en el que se pueden controlar los pesos moleculares de los péptidos formados, este método puede mejorar las propiedades biológicas de las proteínas y sus péptidos (Zamora-Sillero et al., 2018). Este método se suele realizar en un reactor con controles de temperatura, pH, tiempo, relación [E]/[S], velocidad de agitación, concentración de oxígeno y otros aditivos (Figura 1).
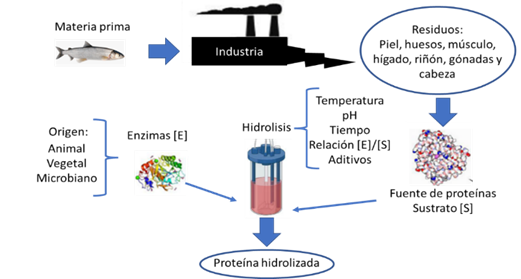
Figura 1 Esquema general del aprovechamiento de residuos de pescado para obtención de hidrolizados enzimáticos.
Tabla 1 Características de las proteasas comerciales
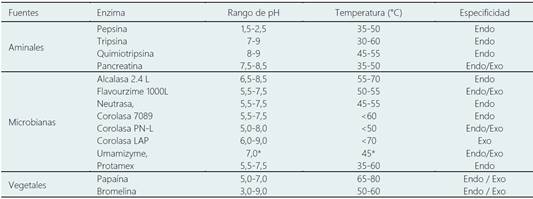
*Condiciones óptimas. Adaptado de Luna-Vital et al., 2015; Gao et al., 2021 y Siddik et al., 2020.
Cuando se agrega la enzima (proteasa), la reacción entre la enzima y el sustrato provoca cambios en el pH de la solución debido a la ruptura de los enlaces peptídicos para formar nuevos grupos amino o carboxilo capaces de liberar o aceptar protones. Frente a lo anterior, algunos métodos se basan en la adición de solución tampón para moderar los cambios de pH; Sin embargo, se considera que la presencia de sales en soluciones tampón puede afectar propiedades funcionales de interés, como la capacidad emulsionante y espumante (Kristinsson & Rasco, 2000). Mientras tanto, otros estudios optan por mantener el pH óptimo de la actividad enzimática mediante la adición constante de solución neutralizante durante el proceso de hidrólisis (Silva et al., 2014). En ambos procesos, cuando se obtiene el grado de hidrólisis esperado, la peptidasa se desactiva por cambios de temperatura, pH o ambas variables simultáneamente.
El mercado ha desarrollado proteasas comerciales derivadas de fuentes animales, vegetales y microbianas (Gao et al., 2021, Siddik et al., 2020). Además de las enzimas comerciales, a nivel de investigación se han utilizado extractos crudos de enzimas con origen microbiano, generando nuevos péptidos proteicos a escala de laboratorio, pero con limitaciones para imitar exitosamente en la escala industrial (Su et al., 2011). El proceso de proteólisis más económico es la fermentación; sin embargo, es la hidrolisis enzimática es el método más común ya que permite obtener hidrolizados de tamaño, secuencia y bioactividad especifica (Bhandari et al., 2020; Raveschot et al., 2018; Lee et al., 2017). Condiciones de optimización de temperatura (40-60 ® C), tiempo (1-8 h) y concentraciones de enzima (1-2 %) para la generación de FPH a partir de desechos de pescado de trucha (Onchorynchus mykiss), anchoveta (Engraulis encrasicolus) y merlán (Merlangius merlangus) han sido probadas utilizado el modelo de superficie respuesta, generando rendimientos del grado de hidrolisis (GH) en el rango de 50,92% y 74,30% según el tipo de desecho de pescado y enzima (Alcalasa, Protamex y Flavourzyme) (Korkmaz &Tokur, 2021). En la Tabla 1 se presentan diversas enzimas y condiciones de hidrolisis empleadas en la producción de FPH.
También se ha evaluado el uso enzimas (Protamex) en hidrólisis de proteínas de anchoveta entera y a través de un modelo de superficie de respuesta se determinó los valores de la relación enzima/sustrato: 60 UA × kg-1 proteína cruda, factor de dilución: 0,7 kg pescado × kg-1 agua y el tiempo de reacción: 60 min, obteniendo los valores óptimos de GH: 16,90%; RP: 68,72% y un PM mínimo de los péptidos de 10,10 kDa (Sifuentes et al, 2018).
Los grandes problemas relacionados a la hidrolisis enzimática incluyen la solubilidad y el amargor los cuales están directamente influenciados por el grado de hidrolisis (DH) de la enzima sobre el sustrato (Heffernan et al., 2021), esto genera cambios en cambios en el peso molecular, hidrofobicidad y los grupos polares (Leni et al., 2021). Este panorama genera desafíos en la obtención del hidrolizado además del procesamiento de inclusión en alimentos y su respuesta sensorial sobre consumidores. Los péptidos de naturaleza hidrofóbica son responsables del sabor amargo (Ishibashi et al., 1988). Algunos estudios han demostrado que una hidrolisis enzimática profunda (↑DH) reduciría la intensidad del sabor amargo (Fu et al., 2018; Newman et al., 2014). Por ejemplo, la hidrolisis de Collichthys niveatus con Neutrase® generó un hidrolizado con un mayor contenido de aminoácidos de sabor dulce (Ala, Asp y Glu) y menos amargo (Phe) que la hidrólisis realizada con Alcalase® (Shen et al., 2012). Los hidrolizados obtenidos mediante el uso de Alcalase® son más amargos que los obtenidos con Flavourzyme®; sin embargo, un tratamiento del FPH tratado con n -butanol y resina de colestiramina redujo el amargor (Dauksas et al., 2004). Recientemente, Yu et al. (2022) identificaron péptidos bioactivos obtenidos de los hidrolizados de nebulina de Oncorhynchus mykiss como bloqueadores del receptor del sabor amargo mediante la predicción de propiedades fisicoquímicas, el acoplamiento molecular y la determinación in vitro de la intensidad del amargor utilizando la lengua electrónica.
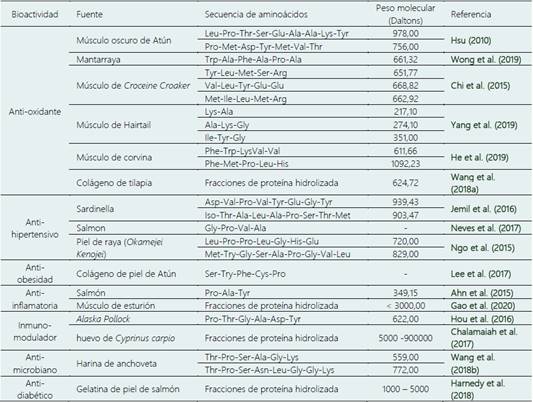
Por otro lado, los pesos moleculares de los FPH están relacionados con sus propiedades biofuncionales. Por ejemplo, la actividad antihipertensiva de los hidrolizados de bacalao fue ~ 60% para una fracción de 10 a 30 kDa y ~88% para una fracción <1 kDa (Je et al., 2005). La actividad antioxidante de los hidrolizados de corvina croceína y bacalao exhibieron fue más potente cuando tenían pesos moleculares por debajo de 3 kDa y 10 kDa, respectivamente (Chi et al., 2015; Jeon et al., 1999).
Separación, purificación e identificación del FPH
Para un adecuado aprovechamiento de las FPH, es necesario separar la fracción proteica de las grasas (fracción insoluble). Esto se puede lograr mediante la centrifugación y filtración en placas y marcos (Petrova et al., 2018). Para una mayor eficiencia en la filtración de pequeñas partículas de péptidos y aminoácidos se utiliza la ultrafiltración (~10 nm) que sirve para el fraccionamiento de partículas y nanofiltración (~1 nm) cuyo fin es la concentración de partículas, ambos métodos de filtración se pueden trabajar en continuo (ultra → nanofiltración), mejorando considerablemente los rendimientos (Abejón et al., 2018). En algunos casos, también se utiliza la filtración por electromembrana para el fraccionamiento de FPH, por ejemplo, para fraccionar péptidos activos de hidrolizados complejos (Suwal et al. 2018). Es importante tener en cuenta que para micro y nano filtrar se utilizan membranas cuyo material esta hecho de nylon, polietersulfona, difluoruro de polivinilideno, politetrafluoroetileno, éster de celulosa mixto, acetato de celulosa, polipropileno y otros (Microlab Scientific, 2018). Conseguir maximizar la pureza del producto y el rendimiento del proceso en separación es una tarea compleja, se deben ajustar factores como las dimensiones de los poros de las membranas, la presión, los caudales, el pH, la concentración de sal (cloruro de sodio) de la solución entre otros, incluso logrando el ajuste de los factores mencionados el reto sigue siendo complejo (Abejón et al., 2018). En algunos casos, debido a la interacción de proteína-proteína o proteína-membrana producen la obstrucción de la membrana lo conduce a una mala separación y bajo rendimiento de péptidos (Roslan et al. 2018). A nivel industrial Abejón et al. (2018) desarrolló un modelo basado en ecuaciones de transporte de membrana, balances de masa y ecuaciones económicas para calcular los principales costos del proceso continuo de separación de FPH de desechos de atún, implementando un sistema de recuperación y reutilización de agua dulce con la instalación adicional de una nanofiltración hermética. Posterior a la obtención de la fracción proteica, la mezcla se pasteuriza una o varias veces, según la tecnología utilizada en determinados productos, para eliminar la posible contaminación microbiana (Pasupuleti & Braun, 2010).
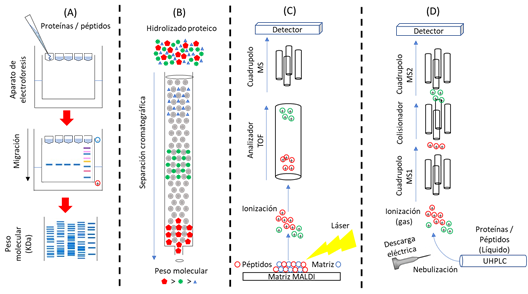
Los FPH obtenidos se pueden caracterizar e incluso identificar la secuencia de péptidos que contiene (Hong et al., 2019). Con esta finalidad se han desarrollado diversos métodos analíticos como la electroforesis (SDS-PAGE, sodium dodecyl sulfate polyacrylamide gel electrophoresis), cromatografía de exclusión por tamaño, MALDI-TOF/MS y LC-MS/MS. En la electroforesis (Figura 2A) existen dos técnicas populares para separar proteínas y péptidos conocidas como la Laemmli-SDS-PAGE y Tricine-SDS-PAGE. La primera puede determinar restos grandes no digeridos en hidrolizados de colágeno (Hong et al., 2017,2018), mientras que la segunda sirve para separar proteínas y péptidos pequeños < 30 kDa e incluso péptidos de 500 Da (Schägger, 2006). La cromatografía de exclusión por tamaño presenta una columna (fase estacionaria) que separa las proteínas, péptidos o aminoácidos (fase móvil) en función de su peso molecular (Figura 2B), donde los péptidos más grandes se eluyen primero y los más grandes al final, la detección de estos componentes se realiza a longitudes de onda de 215 nm y 280 nm (Hong et al., 2019).
Un método sofisticado para el análisis de peso molecular y secuencias de péptidos es la espectrometría de masas. El método está basado en la ionización de las moléculas y pueden llevarse a cabo mediante la ionización electrospray (ESI) o por la desorción/ionización láser asistida por matriz (MALDI). La espectrometría de masas que incluye como fuente a la ionización MALDI con analizadores de tiempo de vuelo (TOF) y de masa molecular (MS) se denominan MALDI-TOF/MS. El procedimiento se describe en la Figura 2C, primero consiste en mezclar los péptidos con un compuesto matriz DHB (ácido 2,5-dihidroxibenzoico) para lograr ionizar los péptidos, luego matriz que transporta los péptidos por acción de alto vacío se vaporiza mediante radiación láser, los péptidos ionizados atravesaran por los analizadores TOF y el MS para finalmente detectar la masa molecular de los péptidos. Por otro lado, la espectrometría de masas que incluye como fuente la ESI combina la cromatografía liquida (LC) y el análisis de masa en tándem (MS/MS). LC-MS/MS (Figura 2D) primero separa los péptidos en el LC o cromatógrafo liquido de ultra alta eficiencia (UHPLC) para luego ionizar las moléculas mediante descargas eléctricas (fuente de ionización - ESI), las moléculas ionizadas con ayuda de alto vacío son analizadas en el primer cuadrupolo MS, donde se seleccionarán las masas moleculares de los péptidos, si el análisis requiere la fragmentación de moléculas con fines de verificación de isotopos (diferente masa molecular de un mismo elemento) entonces las moléculas se fragmentan en un colisionador para analizar en un segundo cuadrupolo MS y finalmente detectarlos.
FPH a partir de residuos de pescado: propiedades bioactivas y tecnofuncionales.
Actualmente, diversos estudios demuestran que los FPH presentan importantes propiedades bioactivas o también denominadas “propiedades funcionales”, cuyo potencial beneficiaría la salud humana. Las condiciones de presión, temperatura, iluminación y salinidad en la que se encuentran los organismos marinos producen compuestos bioactivos con gran potencial (Heffernan et al., 2021). En la Tabla 2 se presentan algunos ejemplos del aprovechamiento de diversas especies de pescado (músculo y residuos) para producir péptidos bioactivos como resultado del FPH. El peso molecular influye directamente sobre estas propiedades bioactivas, Heffernan et al. (2021) ha demostrado que el FPH de peso molecular pequeño generalmente exhiben bioactividad más favorable que las fracciones de peso molecular grande a través de una absorción mejorada en el tracto gastrointestinal. Otro aspecto valioso en los FPH son sus características tecnofuncionales en la preparación de alimentos, estas características incluyen principalmente: la capacidad de retención de agua, formación de espuma y poder de emulsificación (Wangkheirakpam et al., 2019). Los desechos producto del procesamiento en la industria de pescado (incluyendo cabezas, pieles, aletas, armazón y vísceras) que no tienen uso de recuperación para consumo humano presentan una gran cantidad de proteínas (Mahanand et al., 2019; Ahuja et al., 2020), que pueden ser aprovechadas para la producción de FPH y convertirlos en compuestos bioactivos y tecnofuncionales útiles. A continuación, presentamos algunos estudios hechos en función de los residuos de pescado.
Piel
Harnedy et al. (2018) encontraron un fuerte potencial antidiabético de la gelatina de piel de salmón (Salmo salar) y de los hidrolizados proteicos tratados con enzimas Alcalase® 2.4L and Flavourzyme® 500L derivados de los recortes in vitro. Otro estudio sobre el colageno de piel de salmon lo realizó Wu et al. (2018) quienes hidrolizaron con la proteasa extracelular de Vibrio sp. SQS2-3, encontrando que el FPH exhibió actividad anticongelante (>3 kDa) y actividad antioxidante (<3000 Da) después de la ultrafiltración, se obtuvieron 19 péptidos de los cuales el péptido Pro-Met-Arg-Gly-Gly-Gly-Gly-Tyr-His-Tyr fue una secuencia nueva y componente principal antioxidante. Residuos de piel de salmón con huesos y musculo residual también han sido estudiados por Neves et al. (2017), quienes generaron FPH utilizando Alcalasa 2.4 L, Alcalasa 2.4 L en combinación con Flavourzyme 500 L, Promod 144MG, Corolase PP y Brewer's Clarex. Se indentificaron cuatro secuencias (Gly-Gly-Pro-Ala-Gly-Pro-Ala-Val, Gly-Pro-Val-Ala, Pro-Pro y Gly-Phe) y dos aminoácidos libres (Arg y Tyr) del FPH generado con la enzima Corolase PP presentó propiedades antihipertensivas al inhibir la enzima convertidora de angiotensina y la dipeptidil peptidasa IV; Además, estos péptidos y aminoácidos libres presentaron una elevada capacidad de absorción de radicales de oxígeno (propiedades antioxidantes). Los péptidos de bajo peso molecular (<3 kDa) de FPH de gelatina de piel de trucha tratados con las enzimas pepsina, Corolase o papaína también presenta propiedades antihipertensivas (Cheung & Li, 2017). Los FPH de piel de bacalao (Gadus macrocephalus) hidrolizada con proteasa alcalina y tripsina presentaron actividad anti-fotoenvejecimiento en un sistema in vitro de fibroblastos de piel de ratón irradiados luz ultravioleta de 280-320 nm (Lu et al., 2017). Yin et al. (2010) prepararon FPH a partir de la piel del bagre y evaluaron las características tecnofuncionales (capacidad de emulsión, capacidad de retención de agua y propiedades de unión al aceite) y reológicas del hidrolizado insoluble y soluble. Llegando a la conclusión de que las propiedades viscoelásticas del hidrolizado aumentaban con el tra-tamiento de diferentes enzimas y que estos presentarían usos potenciales como ingredientes alimentarios.
Cabeza
Valcarcel et al. (2020) también han preparado FPH a partir del producto de desecho de la cabeza de pescado lubina (Dicentrarchus labrax) y mediante hidrólisis enzimática utilizando alcalasa determinaron importantes propiedades espumantes y gelificantes.
Zhang et al. (2019) estudiaron los FPH de cabezas de atún (Katsuwonus pelamis) desechadas, usando un sistema de digestión gastrointestinal in vitro (pepsina-tripsina) generaron seis péptidos de naturaleza antioxidante y dentro de ellos tres con potencial aplicable a productos para el cuidado de la salud (S1: Trp-Met-Phe-Asp-Trp, S2: Trp-Met-Gly-Pro-Tyr y S3: Glu-Met-Gly -Pro-Ala). Erol et al. (2017) estudiaron los FPH de los desechos de cabeza producidos de la lubina (Dicentrarchus labrax), dorada (Sparus aurata) y trucha (Oncorhyncus mykiss), determinando que las mejores propiedades antioxidantes y tecnofuncionales fueron del FPH de la dorada. Ruthu et al. (2014) determinaron que el FPH a partir de la cabeza de un pez de agua dulce (C. catla) presentan características antioxidantes y antimicrobianas. Prihanto et al. (2019) investigó el FPH fabricado a partir de cabezas de pez loro (Chlorurus sordidus) utilizando diferentes proporciones de pH, tiempo y muestra, generan un alto nivel de aminoácidos esenciales y una alta actividad antioxidante, dejando el campo abierto a que el estudio también se realice utilizando enzimas.
Vísceras
Giannetto et al. (2020) evaluaron las actividades biológicas in vivo e in vitro del FPH obtenido de las vísceras de anchoveta (Engraulis encrasicolus) usando las enzimas: Protamex, Flavourzyme 500 mg y Alcalasa 2,4 L; Informando que estos FPH ejercen un papel beneficioso respecto a actividades antiinflamatorias y antioxidantes. Sampath et al. (2011) informaron de que las vísceras del jurel (M. cordyla) utilizada para la producción de FPH en presencia de las enzimas pepsina y tripsina generaron una secuencia de Ala-Cys-Phe-Leu (518,5 Da) con una elevada actividad antioxidante que redujeron la oxidación de las grasas (PUFA) en los productos alimenticios comparables con los antioxidantes naturales como el alfatocoferol. Mangano et al. (2019) determinó que a partir de las vísceras de anchoveta (E. encrasicolus) hidrolizadas con Protamex, Flavourzyme 500MG y Alcalase 2,4 L se obtiene un FPH formado por péptidos de diferentes tamaños y aminoácidos libres (42% de aminoácidos esenciales sobre el total de aminoácidos) con un gran valor nutricional y biológico. Vásquez et al. (2019) determinó que las vísceras del pescado Rodaballo (Scophthalmus maximus) sometidas a hidrólisis con alcalasa mostraron un alto rendimiento de digestión (>83%), contenido de proteína soluble (>62 g/L), grado de hidrólisis (30-37%), digestibilidad in vitro casi total (superior al 92%), un excelente perfil de aminoácidos y una elevada actividad antihipertensiva y antioxidante. Los FPH de vísceras de la sardina obtenidas con Bsy proteases presentaron excelentes tecnofuncionales de formación de espuma (79,2%), capacidad de emulsificación (80,1 m2/g), capacidad de unión en aceite (5,8 g/g) y formación de espuma (79,2%); Además, el hidrolizado presento propiedades antioxidantes y antihipertensivas, este último con inhibición de la enzima que convierte la angiotensina I (ACE-I) (Vieira et al., 2017).
Aplicación en la industria de alimentos y nutracéutica
Las propiedades tecno-funcionales de los FPH son prioritarias para su aplicación en la industria de alimentos, ya que así se les puede utilizar como ingredientes y/o aditivos alimentarios (Halim et al., 2016). Posterior a la pasteurización, los FPH son concentrados y secados para su aplicación industrial. La tecnología de secado por aspersión en polvo (atomización) de los FPH ha servido para su aplicación en alimentos y piensos (Wang & Selomulya, 2020). Este tipo de tecnología se basa en la encapsulación del FPH, utilizando diversas agentes como el almidón que eviten la destrucción o desnaturalización de los FPH. Algunos parámetros de funcionamiento están determinados por el tipo de secador por atomización, como la eficiencia de evaporación y el flujo de aire, de modo que es necesario determinar las condiciones adecuadas para incrementar la eficiencia de los rendimientos del encapsulado de FPH, otros parámetros están vinculados son la humedad y pH de los FPH antes de su encapsulación. A diferencia del secado de péptidos puros, se deben tener en cuenta más factores para la encapsulación, incluido el tipo de portador, la relación entre el péptido y el portador, los pretratamientos, etc. (Rao et al., 2016; Cian et al., 2019). Los polvos de FPH de tilapia negra secados por atomización mostraron una alta digestibilidad in vitro (hasta 92,1%) para lograr una mayor proporción de eficiencia proteica en pienso de animales (Abdul-Hamid et al., 2002). El polvo de FPH de pescado Sauvage secado por atomización mostró una mejor capacidad de absorción de aceite y actividad de emulsión cuando la hidrólisis se terminó con álcali o ácido en lugar de enzima, pero el polvo hidrolizado con enzima tiene una mayor solubilidad en agua que los polvos de hidrólisis de álcali o ácido (Hassan et al., 2018). Actualmente, existen diversos estudios en micro y nano encapsulación usadas como estrategias para aumentar la eficiencia de la encapsulación, reducir la concentración de material de la pared e introducir un perfil de liberación dirigido (Ye et al., 2019). En particular, existe la necesidad de desarrollar ensayos especiales para péptidos encapsulados para analizar adecuadamente la bioactividad y biodisponibilidad del péptido después del proceso de encapsulación y liberación (Acar et al., 2017; Anandhakumar et al., 2017). La necesidad de nuevas tecnologías en la fabricación se agravará en situaciones en las que los polvos de péptidos / hidrolizados pueden introducir sabores desagradables en la matriz alimentaria. Diferentes combinaciones de parámetros de secado por atomización y portadores de encapsulación pueden conducir a algunas mejoras, pero es difícil resolver el problema por completo (Wen et al., 2017). Recientemente existe un interés creciente respecto a la aplicación de agentes enmascaradores (como xilitol, sacarosa y maltodextrina) para mejorar las propiedades sensoriales (Bertelsen et al., 2018).
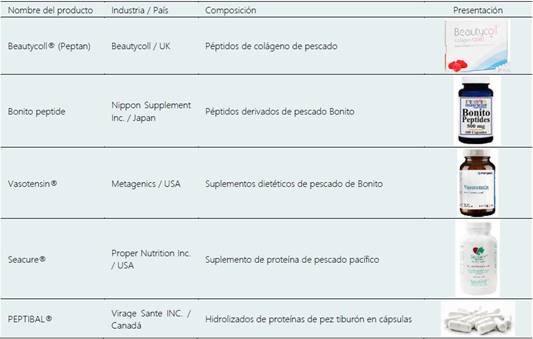
Los beneficios sobre la salud humana por parte de los FPH han llevado a la industria a desarrollar productos alimentarios incluyendo las bebidas, así como en forma de tabletas capsulas, polvos y líquidos. Algunos productos comerciales se muestras en la Tabla 3, por ejemplo, el Beauttycoll® promueve envejecimiento saludable, la salud de los huesos y las articulaciones y los huesos para un estilo de vida activo, previniendo el envejecimiento de la piel y apoyar los tejidos conectivos. Bonito peptide y Vasotensin® actúan en la regulación de la enzima que convierte la angiotensina (ACE). Seacure® ayuda a la cicatrización de heridas y apoya al sistema inmunológico. Finalmente, PEPTIBAL® Mantiene el sistema inmunológico saludable en el intestino y reduce la inflamación mejorando la fisiología de la piel. Entre otros hidrolizados investigados se encuentra el Amizate®, que es un hidrolizado de proteínas derivado del salmón del Atlántico (Salmo salar), cuya suplementación en niños desnutridos de seis a ocho años con un consumo diario de 3 a 6 g del hidrolizado influyó positivamente sobre el crecimiento de los niños (peso corporal, cambios en la altura e índice de masa corporal) (Nesse et al., 2014).
Los FPH también se utilizan en productos dietéticos, soufflés, merengues, macarrones, pan, preparación de sopa de pescado y pasta de pescado (Muzaddadi et al., 2016). También son utilizados como alimento para peces, sustitutos de la leche para terneros y cerdos (Gildberg, 1993). La combinación de 14% de FPH y 0,2% de sal (cloruro de sodio) logró casi el mismo nivel de retención de agua que la práctica estándar de la industria de agregar casi un 2 % de sal (cloruro de sodio). Esto podría significar que los procesadores podrían reducir los niveles actuales de adición de sal (cloruro de sodio) en un 90% sin comprometer el rendimiento del proceso, el color o la textura del producto final (Ibarra et al., 2013).
En el campo de la investigación respecto a la aplicación de FPH en alimentos para consumo humano se vienen realizando estudios que tratan de lograr la persistencia de las propiedades bioactivas a lo largo del proceso y/o transformación alimentaria, por ejemplo Rivero-Pino et al. (2020) incluyó FPH de sardina en sopa de pescado comercial (bajo en azúcar) y en jugo de manzana comercial (alto en azúcar) encontrando que la matriz alimentaria que contenía mayor presencia de azúcar mejoraba la actividad antioxidante y antihipertensiva del producto, hasta en 80% (incluso después del tratamiento térmico y el almacenamiento), concluyendo que son los productos de la reacción de Maillard los responsables de los cambios observados en las matrices alimentarias estudiadas. La producción de nuevos péptidos puede generar un incremento, así como la reducción se la alergenicidad del producto durante el procesamiento (Fritsche, 2003).
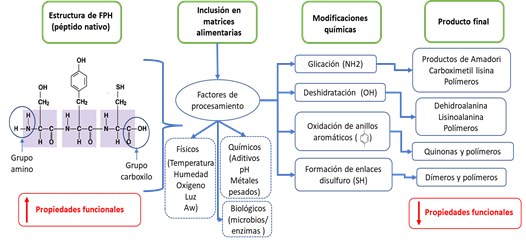
Por lo tanto, hay que tener en cuenta que la incorporación de FPH en alimentos podría terminar con la modificación química de péptidos bioactivos de forma negativa, reaccionando en los grupos nucleófilos amino, carboxilo, imino y sulfhidrilo, provocando la formación de nuevos compuestos (Figura 3). La condensación de péptidos y enlaces pueden ser el resultado de la glicación y la formación de disulfuros de cisteína (Udenigwe & Fogliano, 2017). La N-glicación de los péptidos con azúcares reductores conduce a la formación de productos Amadori, y posteriormente productos de la reacción de Maillard (Van Lancker et al., 2011). La presencia de residuos de aminocidos hidrofóbicos adyacentes a la lisina promueven la glicación del dipéptido (Mennella et al., 2006). Los productos carbonílicos reactivos de la oxidación de los lípidos también pueden reaccionar fácilmente con la cadena lateral del péptido (imidazol, guanidina, sulfhidrilo, ɛ-amino) para formar nuevos productos (Van Lancker et al., 2011). Los restos de aminoácidos de las proteínas y los péptidos inducidas por condiciones de procesamiento severas (temperatura, presión, etc.) siempre dan lugar a la formación de polímeros (Lambrecht et al., 2017). Incluso, algunos péptidos pueden formar complejos con metales divalentes, lo que puede afectar a la disponibilidad de los péptidos y su bioactividad (Udenigwe & Fogliano, 2017). Todas estas reacciones reducen el rendimiento total de péptidos bioactivos.
Análisis de mercado y regulación de los FPH en el mundo
Según el informe de la Market Analysis Report (2020) a nivel mundial el mercado de los FPH presentó un ingreso de 243,7 millones de dólares para el 2019 y se ha proyectado un incremento anual del 5,1% al 2027, el pescado más usado fue la anchoveta (32% del volumen total) seguido de los arenques, sardinas y otros. La tecnología de hidrólisis ácida para la obtención de FPH representó el 46% del mercado en el 2019, superando claramente a la hidrolisis enzimática; Sin embargo, se prevé que la tecnología enzimática presente crecimientos significativos los próximos años. El mercado americano quien tiene la mayor participación de ingresos en el mundo (40%) muestra una interesante proyección de los FPH al 2027 (Figura 4), especialmente en el consumo de alimentos para animales (46,0% de participación en los ingresos globales en 2019). Otro dato muy importante del informe es que los productos en polvo tuvieron una mayor participación en el mercado (57% del volumen total) sobre los productos líquidos, esto debido a que el producto en polvo presenta una mayor vida útil que los líquidos.
Las principales empresas a nivel mundial vinculadas con la producción de FPH son: Scanbio, Sopropeche Copalis Sea Solutions, Diana Group, United Fisheries, Neptune's Harvest, Shenzhen Taier, Janatha Fish Meal & Oil Products, Alaska Protein Recovery LLC, Dramm Corporation, Hofseth BioCare, Great Pacific BioProducts Ltd., Bio-marine Ingredients Ireland Ltd., Marutham Bio Ages Innovations (p) Limited, U.S. Ag Florida, Inc., New Alliance Dye Chem Pvt. Ltd., BrownsFish Genesis y Sampi.
Los FPH se utilizan en los suplementos dietéticos y nutricionales, la incertidumbre por las regulaciones en diversos países no ha sido sinónimo de retraso, al contrario, países como China, Australia, India y Japón están evolucionando en los cambios de las regulaciones alimentarias, basándose en evidencia científica que refuerce la relación dieta - salud (Market Analysis Report, 2020).
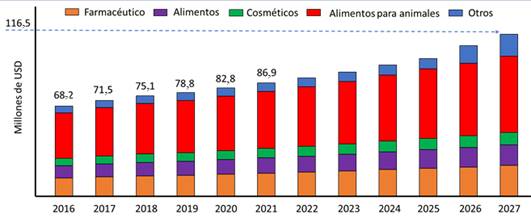
Figura 4 Proyección del mercado americano de los FPH por sector, 2016 - 2027 (Adaptado de Market Analysis Report, 2020).
Respecto a las regulaciones sobre FPH y péptidos bioactivos, diversos países han desarrollado sistemas de regulación (comercio, etiquetado y seguridad alimentaria) que previenen posibles afectaciones a la salud de los consumidores, así como proporcionar la mayor cantidad de información sobre los efectos benéficos en seres humanos, en los diferentes países.
En los Estados Unidos de América (USA), no existen marcos normativos específicos para los FPH y péptidos bioactivos; Sin embargo, los alimentos funcionales están regulados por la “Federal Food, Drug, and Cosmetic Act”. Existen dos tipos de declaraciones respecto a la bioactividad de péptidos bioactivos y FPH. La primera declaración es la de estructura/función que está relacionada con los efectos benéficos demostrados por los péptidos sobre la estructura o función del cuerpo humano. Siempre que no sean declaraciones falsas, los fabricantes no necesitan contar con la aprobación de la Food and Drug Administration (FDA) pero si requieren presentar un texto con la declaración de la FDA. La etiqueta del producto no debe utilizar palabras afines a la prevención o tratamiento de enfermedades. La segunda declaración es la alegación de salud de los péptidos que ofrezcan reducir el riesgo de padecer alguna enfermedad. Esta declaración si requiere la aprobación de la FDA, cuyos veredictos se basan en la solidez de las pruebas científicas, especialmente estudios en humanos. Finalmente, los péptidos deben ser sustancias generalmente reconocidos como seguros (GRAS) (Chalamaiah et al., 2017).
En la Unión Europea (EU), el reglamento CE 1924/2006 regula las declaraciones nutricionales y de propiedades saludables de los alimentos. Los alimentos presentan en sus etiquetas las alegaciones nutricionales y las alegaciones de salud. Las alegaciones nutricionales están vinculados a los efectos benéficos, como “alto en sodio”, “bajo en grasas trans” o “alto en azúcar”. Las alegaciones de salud están relacionadas con los efectos sobre la salud que producen los componentes de los alimentos. En el tema de FPH y péptidos bioactivos existe una subdivisión: “Alegaciones de función general”, “alegaciones de reducción del riesgo de enfermedad” y “alegaciones relacionadas con el desarrollo o salud de niños”. En el caso de los fabricantes, si se encuentran en algún país de la EU, deberán presentar una solicitud a la European Food Safety Authority (EFSA), esta organización también realiza una evaluación de evidencia científica (pruebas en humanos) y la capacidad de los consumidores para comprender los efectos benéficos de lo declarado por el fabricante (Regulation (CE) nº 1924/2006, 2006).
En Canadá, la Food and Drugs Act supervisa la declaración de propiedades saludables, etiquetado y publicidad de los productos alimenticios pero la declaración de propiedades saludables de alimentos debe ser aprobada por “Health Canada”. La Health Canada basa sus declaraciones en función de estudios exhaustivos de las propiedades saludables de los alimentos. En Canadá no existe una normativa específica para los péptidos bioactivos e hidrolizados de proteínas. Sin embargo, los péptidos bioactivos pueden considerarse alimentos funcionales. Los péptidos bioactivos no entran en la categoría de fármacos y se destinan a aplicaciones alimentarias funcionales por ello no necesitan aprobación previa a la comercialización ni modificación reglamentaria. La declaración de propiedades saludables en los alimentos debe estar respaldada por pruebas sustanciales de estudios en humanos. El fabricante debe presentar una solicitud a la “Natural and non-prescription health products directorate”, para obtener una licencia y vender. La solicitud debe contener la información relativa a la eficacia, la seguridad y la calidad del FPH (Chalamaiah et al., 2019).
En Japón, las alegaciones de salud en el etiquetado de los alimentos funcionales son reguladas por la Foods for Specified Health Use (FOSHU) y la Foods with Nutrient Function Claims (FNFC). Para que los fabricantes puedan comercializar los péptidos bioactivos o FPH deberán presentar pruebas científicas de la caracterización con componente activo de los FPH y su seguridad en el consumo humano al Ministry of Health, Labor, and Welfare (MHLW), entidad que regula al FOSHU (Shimizu, 2002; Ono & Ono, 2015). La declaración de propiedades saludables de los péptidos bioactivos es aprobada por el MHLW, los fabricantes pueden utilizar la etiqueta FOSHU en los envases de sus productos para finalmente comercializarlos (Gevaert et al., 2016).
La República Popular China concibe a los péptidos bioactivos o FPH como alimentos saludables y están bajo la Food and Drug Administration (CFDA). Según el sistema de regulación de chino los alimentos saludables se definen como "cualquier alimento que afirme tener funciones específicas para la salud (O'Brien, 2015). Sin embargo, los péptidos bioactivos que se declaran alimentos saludables no deben estar destinados al tratamiento de enfermedades y no deben de utilizarse como medicamentos para tratar a los pacientes. Así como en los demás países la aprobación del uso de estas sustancias debe estar sustentadas fuertemente por evidencia científica. El sistema regulador chino aprueba las declaraciones de salud, de péptidos bioactivos, relacionadas con 27 funciones fisiológicas (Chalamaiah et al., 2018).
En Perú, la autoridad sanitaria competente en materia de inocuidad de productos hidrobiológicos es el Organismo Nacional de Sanidad Pesquera (SANIPES). La regulación peruana en materia de obtención de los FPH no es específica, pero se pueden encontrar algunas directrices para los productos hidrobiológicos, como la Norma Técnica Sanitaria NTS N°071 MINSA/DIGESA V.01 (2008) que establece los criterios microbiológicos de calidad sanitaria e inocuidad para hidrobiológicos deshidratados (concentrados proteicos y otros de consumo humano) donde se admite en un máximo de 2 muestras que el contenido en de Mohos mínimo 102 /g y máximo 103 /g; Levaduras mínimo 102 /g y máximo 103 /g; Enterobacterias mínimo 10 /g y máximo 102 /g y ausencia/25g en todas las muestras de Salmonela spp. Por otro lado, el Instituto Nacional de Calidad (INACAL) a la fecha cuenta con la Norma Técnica Peruana (NTP) afín: NTP 209.036: 1974 (Revisada 2017) para caldos concentrados. La misma que establece que otros caldos concentrados deben cumplir mínimamente en base seca en base 100 g, un contenido máximo de 500mg de Nitrógeno total; 6,5 g de Materia grasa; 12,5 g de Sal (Cloruro de sodio); 5 g de Glutamato de sodio o calcio y 5% Humedad.
Respecto a la regulación de la declaración de propiedades saludables y/o alimentos nutraceúticos, en el Perú a la fecha no existe normativa específica que regulen este tipo de declaraciones. Sin embargo, el rotulado de los alimentos debe ajustarse a lo establecido en el Reglamento sobre Vigilancia y Control Sanitario de Alimentos y Bebidas aprobado por Decreto Supremo N.º 007-98-SA (MINSA, 1998). Las etiquetas de los productos también deberán declarar información de los ingredientes (NTP 209.038: 2019, 2019) e información nutricional (NTP 209.652: 2017, 2017). Asimismo, la veracidad de la información declarada en rotulado (etiquetas de los alimentos) está bajo la fiscalización del Instituto Nacional de Defensa de la Competencia y de la Protección de la Propiedad Intelectual (INDECOPI) en cumplimiento del código de protección y defensa del consumidor “Ley N.º 29571” (INDECOPI, 2010).
Perspectivas a futuro
Está demostrado que los productos de FPH, así como los péptidos bioactivos, presentan propiedades funcionales importantes sobre la salud humana (antioxidante, antihipertensiva, antiobesidad, antiinflamatoria, inmunomodulador, antimicrobiana, antidiabético, etc.); Sin embargo, estas propiedades dependerán de la secuencia de aminoácidos hidrolizados por ello se requieren estudios de hidrolisis, especialmente las de naturaleza enzimática, y la caracterización con las técnicas presentadas en esta revisión (MALDI - TOF/MS, LC - MS/MS, etc.). También requieren más estudios clínicos en seres humanos de tal manera que los fabricantes puedan evidenciar ante las autoridades gubernamentales de cada país el potencial bioactivo de sus productos y así poder comercializar. Queda mucho por investigar respecto a las propiedades tecnofuncionales, especialmente cuando los FPH son incluidos en alimentos y producto del proceso de transformación se pueden generar compuestos negativos sobre la salud de los consumidores (dímeros, polímeros, quinonas, etc.). Además, se encuentra el problema de las características sensoriales, especialmente el sabor amargo, tecnologías de hidrolisis enzimática combinadas con el secado por atomización pueden solucionar de forma importante este problema. El mercado global de los FPH presenta una perspectiva de crecimiento al 2027, considerando las enormes cantidades de residuos en la industria pesquera (cabezas, víscera, piel, etc.) queda pendiente el enorme reto de transformar eficientemente todos esos residuos en FPH no solo a nivel de laboratorio sino también a nivel industrial.
Conclusiones
Se analizaron los avances de los procesos de obtención de los hidrolizados proteicos desde pescado y sus subproductos por tecnología de enzimas y su aplicación a la obtención de nuevos alimentos fortificados, explicando de manera sucinta las bondades de los FPH y sus péptidos bioactivos sobre la salud humana y en el desarrollo de alimentos. Los problemas del inadecuado aprovechamiento de los residuos de pescado en la industria alimentaria pueden enfocarse en la producción de FPH, debido a la demanda en crecimiento de estos productos a nivel mundial en los próximos años (~5% anual). Sin embargo, existen retos a ser superados, especialmente la identificación de las cadenas cortas de aminoácidos y su bioactividad en seres humanos, muchos productos de FPH presentan sabor amargo lo que afecta la aceptabilidad sensorial, la aplicación en alimentos no siempre resulta en el aprovechamiento eficiente de los FPH, debido al proceso de transformación de los alimentos los péptidos bioactivos resultan transformándose en sustancias químicas negativas. Finalmente, se revela que en materia de normativas a nivel mundial no se han implementado reglamentos específicos para hidrolizados; sin embargo, la aprobación para su comercialización requiere de una fuerte evidencia científica.
Se recomienda estudiar la optimización de la producción enzimática de FPH a fin de mejorar el sabor y su aplicación en la fortificación de alimentos de consumo masivo como arroz, harinas de trigo y derivados del maíz.