1. Introducción
El cultivo de la vid en el Perú es de gran importancia por ser la materia prima en la producción vinícola (Cáceres et al., 2020). En los años de 1555, se introdujo plantas de vid provenientes de las Islas Canarias y se plantó en Condesuyos, luego las cultivaron en Vítor por tener un clima ideal para el desarrollo de viñedos, siendo el Valle de Majes uno de los últimos en ser instaurado (Brown, 2008), A partir de 1580 los valles de Majes, Siguas, Vítor y Tambo estuvieron en plena producción para satisfacer la demanda de vino generada desde Cuzco a Potosí (Huertas, 2004; Buller, 2013), hacia mitad del siglo XVI, los valles de Vítor, Majes, y Siguas, se convirtieron en las zonas productoras más importantes de vino en el Perú (Huertas, 2004). El Ministerio de Agricultura (2008) indica que Arequipa es productora en su mayoría de variedades ¨Negra Criolla¨ 48% y ¨Moscatel¨ 26%, otras de minoría producción son Uvina, Red Globe, Italia, Flame, Cardinal, Quebranta, Alfonso Lavalle, Thompson seedless, Borgoña. En este contexto se consideraría que el Valle Majes, conservaría ejemplares de variedades locales de más de 50 años. El desconocimiento por parte de los productores del valor de la diversidad de variedades locales así como en la calidad de fruto y su potencialidad adaptativa frente a los cambios climáticos puede conllevar a la erosión genética por el desplazamiento de otras variedades expandidas internacionalmente (Marsal et al., 2017). La biodiversidad intraespecífica puede aportar la composición deseada del fruto (Frioni et al., 2020), adaptación a cambios de temperaturas y precipitación que podrían afectar la futura distribución geográfica de zonas vitícolas y características de idoneidad (Leeuwen et al., 2019), la presencia de variedades y clones locales ha contribuido a la distribución de genotipos y a la confusión de nombres, diferentes variedades con el mismo nombre, o la misma variedad con nombres distintos (Cervera et al., 1998), problemática que afrontan los productores al ingresar en un mercado competitivo. Existe la técnica de caracterización e identificación de variedades de vid, mediante el uso de la ampelografía y caracterización morfológica de las plantas (Jiménez, 2014; Matus & Rodríguez, 1999; Yana, 2019). La caracterización ampelográfica con 50 descriptores de la OIV puede abarcar dos años consecutivos (Casanova & Marcide, 2011), pero para facilitar este aspecto, la OIV (2009) da una Lista prioritaria de 14 descriptores primarios, asimismo se ha evaluado la eficacia de la iden tificación ampelográfica de variedades de vid a partir de imágenes digitales (Murgo et al., 2014) o realizar técnicas combinadas a nivel ampelográfico y a nivel molecular por medio de microsatélites, en el comparativo de 3 cultivares (Blanco et al., 2007), en muestras colectadas en el sur de Italia (Alba et al., 2011), en la diversidad genética de varie dades sudamericanas (Martínez et al., 2006). En el análisis multivariado de características morfológicas hay diferentes metodologías caso de Alba et al. (2011) quienes utilizan un análisis del método de grupos pares no ponderados (UPGMA) para generar un dendrograma, basado en el índice DIST. El análisis discriminante a diferencia de otros métodos multivariados permite describir y elucidar las diferencias entre grupos en función a los caracteres en estudio (Rencher, 2002). El uso de marcadores moleculares SSRs, proporcionan diferencia y confianza para identificar variedades de vid (Jiménez, 2014). En los 19 cromosomas de la vid se han detectado un alto número de marcadores microsatélites que permiten realizar estudios de identidad varietal y parentesco (Ibáñez et al., 2009; Lacombe et al., 2013). La identificación genética, caracterización y análisis de mostos de cuatro variedades permitió discriminar entre variedades autóctonas con diferentes genotipos con características fenotípicas similares (Sancho-Galán et al., 2020). Con el establecimiento del Catálogo Internacional de Variedades de Vitis (VIVC), que se remonta hacia los años 1984, en el cual se junta todas las muestras de manera virtual mantenidas en colecciones en todo el mundo se podrá enfrentar a la erosión genética (Maul & Töpfer, 2015). En cuanto a variedades de Perú inscritas en la VIVC, hasta el momento se registraron la variedad Quebranta, que desciende de la cruza entre Mollar Cano y Listan Prieto (Lacombe et al., 2013), anteriormente se estudiaron varie dades del Valle Majes, junto con variedades argentinas utilizando caracterización ampelográfica y marcadores microsatélites 6-SSR (Martinez et al., 2006) a fin de conocer la identidad genética de las variedades sudamericanas.
El presente estudio se planteó como objetivo analizar la diversidad de variedades locales de viñedos antiguos, que hay mediante una prospección varietal y zonificación en el Valle de Majes con el agrupamiento de variedades por sus diferentes nombres locales relacionados, caracterizar ampelográficamente e identificar genéticamente con la utilización de marcadores moleculares (9-SSR).
2. Materiales y métodos
Zona de Estudio
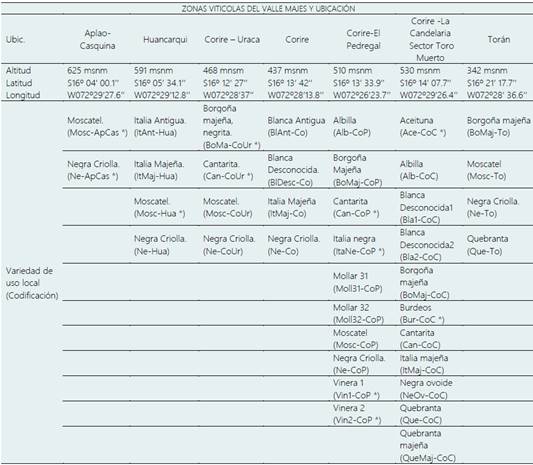
Se consideraron diversas zonas vitícolas del “Valle de Majes” en la provincia de Castilla, georreferenciándolas con equipo de sistema de posicionamiento Global (GPSMAP 78s - Garmin), con entrevistas a los propietarios de los viñedos representativos cuya información sirvió para la determinación de zonas de muestreo y selección de plantas de variedades locales de uso tradicional en el Valle, con más de 50 años (Moreno-Sanz et al., 2011). Las altitudes se encuentran entre los 342 m.s.n.m (zona de Torán) a 625 m.s.n.m (zona de Casquina), altitud que corresponde a una de las 13 ecorregiones, clasificado como Desierto Semicálido Tropical (DST) que está desde el nivel del mar hasta 1.000 m.s.n.m. (Britto, 2017).
Material vegetal
El estudio se realizó en cada una de las zonas, en 2 etapas. La primera entre los meses de enero a marzo (plena maduración de fruto); la segunda en la campaña siguiente entre octubre y marzo (brotación hasta la maduración del racimo). Se seleccionaron las plantas de variedades locales de vid, constituyéndose en las unidades de estudio las que fueron codificadas por su denominación local y ubicación, con un “muestreo no probabilístico por conveniencia” (Hernández-Sampieri et al., 2014) se genotiparon 11 fenotipos a partir de brotes de hojas.
Caracterización morfológica y/o ampelográfica
Esta caracterización se realizó en diferentes etapas fenoló gicas de la planta, durante dos campañas consecutivas (2017 y 2018) de acuerdo con las directrices propuestas por la OIV (2009) y Alcalde (2008). La hoja adulta fue caracterizada en época de envero, y racimo y baya en época de maduración previo a la cosecha (vendimia). Las bayas maduras fueron tomadas de la parte media del racimo, exponiendo la baya sin pruina para determinar la coloración de la epidermis, directamente a la luz.
Las muestras de estudio de cada variedad fueron codificadas por su nombre local y zona de ubicación, estableciéndose grupos de análisis. Se emplearon 14 descriptores ampelográficos según la “Lista prioritaria de descriptores primarios” (OIV, 2009), de distintos estadios fenológicos y órganos de la planta, cuyo código y descriptor son: de características del pám pano joven, hoja joven adulta, bayas de racimos maduros.
Análisis de ADN
Del total de muestras caracterizadas morfológicamente, 11 muestras fueron genotipadas mediante nueve marcadores microsatélites (9-SSR, Simple Sequence Repeat). A partir de brotes de hojas se extrajo el ADN inicialmente en el laboratorio de Genómica y Bioinformática de la UNALM con la metodología de Doyle & Doyle, (1990) y en el Laboratorio de genética, Facultad de Biología, UNSA. mediante kit de extracción, Plant Mini kit (DNeasy plant mini kit, Qiagen), por duplicado. Se realizaron las amplificaciones por PCR para los marcadores: VVS2, VVMD5, VVMD7, VVMD25, VVMD27, VVMD28, VVMD32 VrZAG62 y VrZAG79., las condiciones de amplificación por PCR se realizaron de acuerdo con el trabajo de Aliquó et al. (2017). Las secuencias de los fragmentos fueron obtenidos a través de un secuenciador ABI 3130 Genetic Analyzer (Applied Biosystems, Foster City, CA, USA) y del software GeneMapper v.3.7 (Applied Biosystems). Para la identificación varietal de cada muestra se empleó la base de datos VIVC (https://www.vivc.de/) en donde se compararon los pesos moleculares de cada alelo, llevado a cabo en el Laboratorio de Recursos Genéticos de la EEA Mendoza INTA, Argentina.
Análisis estadístico
Basados en el análisis discriminante, en el gráfico Biplot y en los caracteres de una matriz de datos multivariantes, según Rencher (2002), se realizó el análisis discriminante canónico de 39 muestras en base a los descriptores ampelográficos de la “Lista prioritaria de descriptores primarios” de la OIV. Para la diferenciación de los 13 grupos de muestras se aplicó el análisis de componentes principales y el grafico Biplot, para expresar la dispersión de las 29 variedades locales utilizando 12 descriptores. Se utilizó el software PAST (PAleontological STatistics), Versión 4.07 (Hammer et al., 2001).
3. Resultados y discusión
Identificación variedades de uso locales
En la Tabla 1 se muestra la prospección en el Valle de Majes identificando siete zonas de reconocida tradición en la producción vitícola, con viñedos de más de 50 años de cultivo de variedades de uso local (fenotipos), codificadas independientemente las que poseen un mismo nombre en la misma zona y en diferentes zonas (nombre de la denominación local de la variedad y de la zona), se registra el mayor número de variedades en Corire Pedregal, Corire la Candelaria que destaca con una diversidad de variedades 10 y 11 respectivamente, lo cual indicaría que los productores conservan la diversidad de viñas.
Las otras zonas también destacan por las variedades que utilizan en la elaboración de vino y pisco de peculiar tradición, dando en total 39 fenotipos de variedades locales, cabe indicar que en el valle se detectó más variedades pero enfatizamos en las de mayor antigüedad, considera das cultivares locales que poseerían amplia adaptación a los cambios climáticos como lo indican Marsal et al. (2017), y también edáficos que por los elementos químicos que poseen cada lugar influenciarían en las características enológicas (Gao et al., 2022) y que podrían presentar genes del grupo AHL presente en la vid (Li et al.,2021), asimismo, tendrían genes de resistencia al hongo Mildiu polvoroso Erysiphe necátor (Lukšić et al., 2022), o ser fuente de genes de resistencia a factores bióticos como abióticos a nivel ci toplasmático como los mTERF (Yin et al., 2021); además podrían poseer genes que se expresan en determinadas condiciones caso de las vides apirenas (Tang et al., 2021) para futuras investigaciones en el mejoramiento genético.
Caracterización Morfológica
La caracterización morfológica basado en 14 descriptores (OIV, 2009) de 39 muestras de variedades locales colectadas en el Valle de Majes, se presentan en la Tabla 2, con la codificación de nombres locales y localidad de muestreo mostradas en la Tabla 1, se observa que 29 corresponden a “tintas” con 10 grupos de nombres diferentes denominados como Aceituna, Borgoña, Burdeos, Cantarita, Italia Negra, Mollar, Moscatel, Negra, Quebranta y Vinera y 10 que corresponden a “Blancas”, las mismas se diferencian en 3 grupos de nombres diferentes Albilla, Blanca e Italia y tomando los mismos grupos de variedades locales se presentan los racimos en la Figura 1 los que podrían representar a cada grupo cuando hay más de una, en la que se observa las diferencias de forma y color, asimismo, al referirse al grupo de negras se muestran 2, dado por las marcadas diferencias fenotípicas que muestran y que no podría ser solo una representativa de este grupo. Es importante señalar que dentro de cada grupo se observan diferencias también mostrados en la Tabla 2. Las diferencias entre grupos de diferentes zonas posiblemente sean genéticas, aunque sean denominadas con el mismo nombre (Aliquó et al., 217), o también por respuesta a cambios climáticos (Cabré et al., 2020), edáficos y/o o disponibilidad de agua (Romero et al., 2022). El carácter apertura del extremo del pámpano joven (OIV 001) presenta una única muestra diferente en el grupo de las Borgoña Majeña (Tabla 2), el cual es abierto en Vitis vinifera y variaciones de este estado del carácter nos señalan que el fenotipo observado podría pertenecer a una especie emparentada.
En la Tabla 2 se observa un polimorfismo en las características morfológicas de hojas, bayas, asimismo en racimos (Figura 1), tal como lo indica Salimov et al. (2015). Asimismo, con relación a la característica de color de epidermis de baya, descriptor 0025 de Tabla 2, se muestra 4 tipos de color de epidermis de baya (OIV 225) de las variedades con pigmentación, en base a los datos se obtiene 4 grupos, de mayor a menor intensidad: grupo 1 azul-negra, grupo 2 rojo violeta oscuro, grupo 3 rojo-gris y grupo 4 rosa. Se observa que el grupo de variedades Borgoña, Negra, Burdeos y Aceituna pertenecen al grupo 1 de color de Azul Negro, a excepto de Negra-Ovoide que pertenece al grupo 2, el grupo de variedades Cantarita comparten 3 grupos de color el azul-negro, rojo-violeta-oscuro, y rojo, el grupo de variedades Mollar y Moscatel comparten 2 grupos de color , rojo-violeta-oscuro, y rojo, el grupo de variedades Quebranta comparten 2 grupos de color el rojo y rosado, el grupo de Vineras pertenecen a un solo grupo de color el rojo, y la variedad Italia Negra pertenece al grupo de color rojo violeta-oscuro. Se puede indicar que predominan las variedades de color azul negra, importante característica relacionado con el alto contenido de antocianinas. El estudio de Ju et al. (2021) relaciona el color azul negro con perfiles de antocianinas y propiedades del color de vinos tintos. La diversidad de color influenciada por el genotipo puede ocurrir por efecto de la polinización en la característica de baya por alguna variedad polinizante (xenia y metaxenia). Sabir (2015) reporta las diferencias en las características de las bayas y semillas de la uva según la influencia de diferentes fuentes de polen, asimismo Sabir & Kucukbasmaci (2020) determinan la influencia de la polinización en un cultivar de interés comercial donde el color de la baya mejoró notablemente presentando un color de piel más oscuro e intenso con los pólenes del cultivar 'Kyoho', al realizar el estudio del color de baya en los viñedos de Majes habría que considerar este fenómeno dada la biodiversidad de color que presenta (Ferreira et al., 2018) lo cual puede aprovecharse en la producción de los viñedos, en la elaboración de vinos, piscos y programas de mejoramiento genético.
Diferenciación de grupos de variedades locales
El análisis discriminante canónico de los grupos formados con las 39 muestras, cada una con 12 caracteres, de los 14 mostrados en la Tabla 2, ya que dos de ellos se mostraron monomórficos, OIV 016 que corresponde al número de zarcillos consecutivos del pámpano y OIV 081-2 relacionado con la base del seno peciolar limitado por la nervadura de hoja adulta. En la Figura 2 se observa la diferenciación de los grupos de variedades locales en los dos primeros ejes canónicos, los que hacen máxima la separación entre los grupos. Los primeros ejes canónicos explican respectivamente el 64,67% y el 13,75% de la variación total mostrada.
Tabla 2 Caracterización con Catorce descriptores según la OIV de 39 fenotipos de Vid agrupados de acuerdo con su nombre local en la provincia de Castilla, Valle Majes
001 Pámpano joven: apertura de la extremidad 3 semi abierto 5 completamente abierto; 004 Pámpano joven: densidad de pelos tumbados de la extremidad, 1 nulo o muy bajo, 3 bajo, 5 medio 7 alto, 9 muy alto; 016 Pámpano: número de zarcillos consecutivos, 1 dos o menos; 051 Hoja joven: color del haz del limbo (4ª hoja), 1 verde, 2 amarillo, 3 bronceado; 067 Hoja adulta: forma del limbo, 2 cuneiforme 3 pentagonal,4 orbicular; 068 Hoja adulta: número de lóbulos, 2 tres, 3 cinco; 070 Hoja adulta: área con pigmentación antociánica en los nervios principales en el haz,1nula, 2 punta peciolar 3 hasta la 1ra bifurcación 4 hasta la 2da bifurcación; 076 Hoja adulta: forma de los dientes, 2ambos lados rectilíneos 3 ambos lados convexos 5 mezcla de ambos lados; 079 Hoja adulta: grado de apertura/ solapamiento del seno peciolar,1muy abierto 3 abierto, 5 cerrado; 081.2 Hoja adulta: base del seno peciolar limitada por los nervios, 1 no delimitado 084 Hoja adulta: densidad de pelos tumbados entre los nervios principales en el envés, 1nulo, 3baja 5 media,7alta, 9 muy alta; 087 Hoja adulta: densidad de pelos erguidos en los nervios principales en el envés;1 nula, 3 baja, 5 media, 7 alta, 9 muy alta; 223 Baya: forma, 2 esférica 3eliptica corta, 7 ovoide 8 ovoide inversa; 225 Baya: color de la epidermis. 1 verde amarillo, 2 rosa 3 roja 5 rojo violeta oscuro 6 azul negro.

Figura 1 Imágenes de racimos de Variedades descritas representativas de grupos en la localidad de Majes (a) Aceituna (La Candelaria), (b) Borgoña Majeña (Uraca) , (c) Burdeos (La Candelaria),(d) Italia Negra (El pedregal), (e) Negra Ovoide ( La candelaria), (F) Cantarita (El Pedregal), (G) Mollar 31 ( el pedregal ) ,(H) Moscatel (Huancarqui), (I) Negra Criolla (Casquina) (J) Quebranta (La Candelaria) (K) Vinera 1, (El Pedregal), (L) Albilla ( Pedregal), (M) Blanca Desconocida 2 ( La Candelaria), (N) Italia Antigua (Huancarqui).
El carácter más influyente en la separación de los grupos de variedades locales, expresado en el primer eje canónico, según OIV (2009), fue el color de la epidermis de la baya (OIV 223), seguido del carácter densidad de pelos erguidos en los nervios principales del envés de la hoja adulta (OIV 087), los restantes caracteres tuvieron poca influencia. En el segundo eje canónico el carácter más influyente fue densidad de pelos tumbados entre los nervios principales del envés en la hoja adulta (OIV 084), seguido del carácter densidad de pelos tumbados de la extremidad en pámpano joven (OIV 004). El análisis discriminante en base a los caracteres evaluados ha permitido corroborar la mayoría de los grupos inicialmente identificados. Las variedades locales del grupo de Cantarita muestran diferencias entre ellas, especialmente Can-CoC, igualmente entre los integrantes del grupo de Moscatel se observa apreciable variación y es notoria la diferencia mostrada por Mosc-CoUr. Estas dos variedades locales, Mosc-CoUr y Can-CoC, son diferentes de los grupos a los que inicialmente fueron adjudicados, debido al color de la epidermis de la baya. En el caso del grupo de Borgoña, se observa una marcada diferencia entre ellas, las variedades locales BoMaj-CoUr y BoMaj-CoC se muestran más cercanas, e igualmente BoMaj-To muestra mayor seme janza a Bur-CoC y a NeCoC. Con relación al grupo de negras, se observa menor variabilidad entre ellas excepto NeOv-CoC que tiene más semejanza a Moll32-CoP. El grupo de las Quebranta muestra poca variabilidad dentro del grupo y mayor separación de los otros grupos. También se puede identificar otras variedades locales que podrían conformar grupos del siguiente modo: las varie dades locales BlAnt-Co, BlaDesc-Co, Bla1-CoC, Bla2-CoC, ItAnt-Hua, ItMaj-Hua, ItMaj-Co, ItMaj-CoC podrían consti tuir un gran grupo; igualmente, las variedades locales ItaNe-CoP* Vin1-CoP* Vin2-CoP*. Por otra parte, las variedades locales Moll32-CoP y NeOv-CoC se muestran muy cercanas y pueden conformar un grupo, aunque sin la participación de Moll31-CoP. Este análisis nos muestra que hay diferencias dentro de los grupos propuestos por su denominación local y también entre ellos, lo cual podría indicarnos que cada fenotipo debería ser estudiado por separado a pesar de poseer el mismo nombre, cuyas diferencias podrían deberse a factores genéticos como también ambiental y posiblemente con alta interacción genético-ambiental, Camussi et al. (1990) indican que para un análisis discriminante en base a variables descriptivas para la ampelografía se sugiere el uso de varianzas y covarianzas de interacciones de variedad por año para la matriz de error dentro de un procedimiento de análisis discriminante múltiple, para simplificar el registro de datos y permitir comparaciones útiles. El análisis discriminante aplicado (Rencher, 2002) permite establecer que existen diferencias entre los grupos propuestos y dentro de ellos, e incluso algunas variedades que podrían conformar otros grupos por la menor variabilidad entre ellas.
Análisis de componentes principales (CP)
El análisis de componentes principales (CP) y el gráfico biplot, mostrado en la Figura 3, representa la dispersión de las variedades locales considerando los 12 caracteres disponibles e identificó aquellos con mayor influencia en la variabilidad o dispersión.
Las dos primeras componentes principales explican el 20,52% y 18,72% de la variación total de las observaciones. Las restantes CP explican porcentajes menores de la variación total. En el primer CP los caracteres, según OIV (2009), más influyentes fueron en la hoja adulta la forma del limbo en hoja adulta (OIV 067), la densidad de pelos erguidos en los nervios principales en el envés en hoja adulta (OIV 087) y color de la epidermis de la baya (OIV 225), los cuales explican el 74,53% de la variación en esa primera CP. En el segundo CP los caracteres, según OIV (2009), más influyentes fueron densidad de pelos tumbados entre los nervios principales en el envés en hoja adulta (OIV 084), color del haz del limbo (4ª hoja) en hoja joven (OIV 051), la forma de la baya (OIV 223) y número de lóbulos en hoja adulta (OIV 068), explicando el 81,89% de la variación en ese CP. En el primer CP, expresado como eje de abscisas, el carácter forma del limbo en hoja adulta (OIV 067) separa a las muestras de variedades locales con predominancia de forma cuneiforme de aquellas con predominancia de forma pentagonal, así también la variable densidad de pelos erguidos en los nervios principales en el envés en hoja adulta (OIV 087) separa a las variedades locales con predominancia de densidad de pelos medio y denso, de aquellas con predominancia de densidad muy laxa y laxa. Igualmente, en este CP, la variable color de la epidermis de la baya (OIV 225), separa a las variedades con color predominante de epidermis roja violeta-oscura y azul negro, de aquellas con predominancia de color de epidermis verde amarilla. En el segundo CP, expresado como eje de ordenadas, el carácter, según OIV (2009), densidad de pelos tumbados entre los nervios principales en el envés en hoja adulta (OIV 084) separa a las variedades locales con predominancia de densidad muy laxa y media, de aquellas con predominancia de densidad densa, muy densa. Igualmente, el carácter color del haz del limbo (4ª hoja) en hoja joven (OIV 051), separa a las variedades locales con predominancia de color amarillo de aquellas con predominancia de color verde. Kupe et al. (2021) también señalan que el análisis de componentes principales indica la fuente variación entre los cultivares.
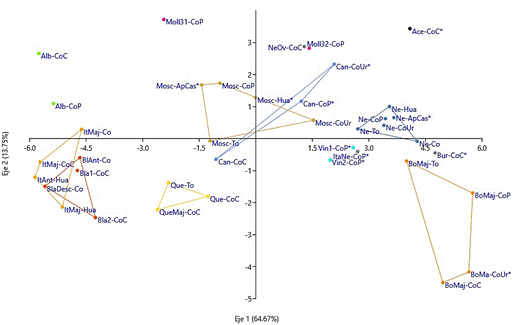
Figura 2 Diferenciación mediante Análisis discriminante canónico de 12 características morfológicas de 39 muestras de variedades locales, del Valle Majes-Arequipa.
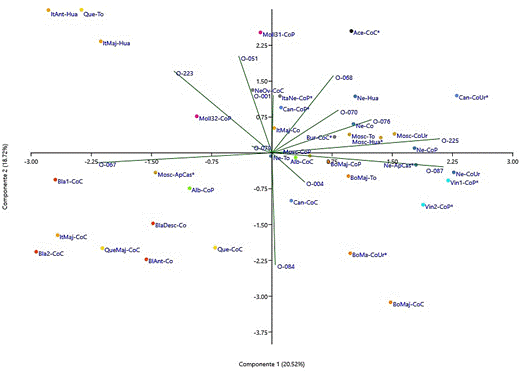
Figura 3 Análisis de componentes principales y Gráfico Biplot de 39 variedades locales de vid del Valle de Majes-Arequipa y 12 caracteres morfológicos.
Tabla 3 Análisis de Identidad con 9 SSR. Comparación de los perfiles genéticos con la base de datos de VIVC de 11 fenotipos de vid del Valle de Majes
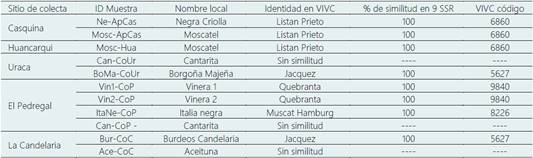
ID= identificación de muestra códigos de Tabla 1.
En la Tabla 3 se observa sinonimia (una misma variedad con diversos nombres) y homonimia (variedades distintas con el mismo nombre), lo cual sin análisis molecular causaría confusión en la denominación de las variedades de vid, (Aliquó et al., 2017), habiendo sinonimia caso de “Borgoña Majeña” y “Burdeos Candelaria” (esta última posiblemente mal denominada), cuyos genotipos corresponde a ‘Jacquez’ variedad que ha sido introducida en la zona de Majes. En el caso de la nominada “Negra Criolla” y “Moscatel” que no solo poseen nombres diferentes sino fenotipos diferentes y presentan similitud genética con la variedad ´Listan Prieto`, también indicado por Almanza et al. (2021).
Tomando en consideración el agrupamiento de variedades de la Tabla 2 y Figura 1, con preferencia las pigmentadas se describe 7 grupos de variedades con denominación local diferente, Aceituna, Borgoña Majeña, Burdeos de Candelaria, Cantarita, Italia Negra, Moscatel y Negra criolla.
Variedad “Aceituna”: Hay un fenotipo con esta denominación, en la zona de La Candelaria, cuya procedencia fue de Cotahuasi (zona tradicional vitivinícola). Es descrita a nivel ampelográfico (Tabla 2), presentando extremidad del brote completamente abierta con escaza densidad de pelos tumbados, de color cobrizo-rojizo el haz de hoja joven. La hoja adulta es pentagonal con antocianina en los nervios principales hasta la segunda bifurcación, los dientes a ambos lados convexos, abierto el seno peciolar y no se encuentran limitado por los nervios, con muy baja densidad de pelos tumbados entre los nervios principales sobre el envés y una alta densidad de los pelos erguidos sobre los nervios principales del envés, con baya esférica y color de epidermis azul-negra. En el análisis discriminante se muestra diferente al resto y en el análisis de componentes (Figura 3) influencian en ella el número de lóbulos y el color del haz del limbo de hoja joven. Al ser genotipada, se obtuvo pesos moleculares en los 9 loci de: VS2 135-149; MD5 234-242; MD7 239-249; MD25 239-239; MD27 180-190, MD28 244-268;MD32 256-272; ZAG62 186-196, ZAG79 251-255, lo cual indica que ninguna de las variedades de la base de datos VIVC se asoció al perfil de SSR obtenido (Tabla 3), considerada variedad no registrada (Marsal et al., 2017, Aliquó et al., 2017) y por el análisis realizado sobre el origen parental asociados a 3 patrones (2, 3 y 9) deriva de la cruza entre la var. ´Listan Prieto` y ´Muscat of Alexandria`, por lo que se le consideraría variedad criolla (Aliquó et al., 2017; Pszczólkowski et al., 2022).
Variedad “Borgoña Majeña”: Los 4 fenotipos con esta denominación se registraron en las zonas de Uraca, El Pedregal, La Candelaria y Toran. La descripción ampelográfica se muestra en la Tabla 2, al realizar el análisis discriminante (Figura 2), muestra diferencias entre las Borgoñas, y se evidencia la semejanza entre la Borgoña Majeña de Toran y la Burdeos de la zona de Candelaria, debido a la punta peciolar como al área con pigmentación antociánica en los nervios principales en el haz y la forma de los dientes en la hoja adulta. La proximidad de la Negra de Corire a la Borgoña Majeña de Toran se debe a que presenta tres lóbulos en la hoja adulta, característica que la diferencia del resto de las uvas negras. El análisis por componentes principales, la variable más influyente en la dispersión individual (Figura 3) es la alta densidad de pelos tumbados entre nervios del envés en hoja adulta, aproxima a Borgoña Majeña de Uraca y a la de Corire Candelaria, mientras que la misma característica en densidad baja o media aproxima a Borgoña Majeña de Toran a la del Pedregal. Al ser genotipada una de las variedades de Borgoña (BoMaj-CoUr*) según la base de datos VIVC se asoció al perfil de SSR del cultivar ‘Jacquez’ (Tabla 3), que presenta semejanza con la variedad Uvina para pisco (Cáceres et al., 2017 y Almanza et al., 2021), se trataría de una sinonimia. Sin embargo, no necesariamente podríamos decir que el resto del grupo de Borgoña Majeña sean también el mismo cultivar al ser nominadas con el mismo nombre, dada algunas diferencias que se observaron entre ellas (Figura 2 y Figura 3), siendo importante su análisis molecular. También cabe mencionar que por ser variedad ´Jacquez` la denominada Borgoña Majeña de Uraca seria sinónimo de la denominada “Uvina” del banco de germoplasma de Ica (Almanza et al., 2021), cuyas características ampelográficas también muestran algunas diferencias.
Variedad “Burdeos”: Se registró un fenotipo en la zona de La Candelaria, cuyas características se observan en la Tabla 2. Con el análisis discriminante (Figura 2), se asocia con Negra de Corire y Borgoña Majeña de Toran, mientras que con el análisis de componentes principales (Figura 3) las características, según OIV (2009), que influyen en la variedad son el color de la baya, la forma de dientes de hoja, la pigmentación con antocianina de nervios principales y el número de lóbulos de hoja. Al ser genotipada, se asoció al perfil de SSR del cultivar ‘Jacquez’ en la base de datos VIVC (Tabla 3), que en la misma tabla también hay con esa similitud una de las variedades de Borgoña Majeña, sin embargo por la denominación de Burdeos se podría pensar que correspondería a otras variedades conocidas en otros lugares de la Region Arequipa donde predomina la variedad Burdeos que se asocia a una ‘Malbec’ como lo señala Martínez et al. (2006), de allí las confusiones al momento de denominarlas localmente como en este caso, mal denominada Burdeos y que correspondería a la denominada localmente Borgoña Majeña o Uvina asociado a la variedad registrada ‘Jacquez’.
Variedad “Cantarita”: Las tres muestras de este grupo fueron registrados en las zonas de Uraca, El Pedregal y La Candelaria. A nivel ampelográfico, según OIV (2009), se muestra en la Tabla 2, El análisis discriminante evidencia diferencias entre estas variedades locales. La variedad Can-CoC se diferencia debido a que presenta color rojo la epidermis de la baya, a diferencia de las accesiones Can-CoUr* y Can-CoP* que presentan color rojo violeta oscuro y azul negro. Las tres variedades se diferencian entre ellas por densidad de pelos tumbados entre los nervios principales en el envés en la hoja adulta y en la densidad de pelos tumbados de la extremidad del pámpano joven. El análisis de componentes principales permite corroborar que el color de la epidermis de las bayas y la densidad de pelos tumbados entre los nervios principales en el envés de hojas adultas, son las principales características que diferencian entre el grupo de Cantarita. El término “Cantarita” es una denominación propia del valle, se ha genotipado las cepas de las zonas de Uraca y El Pedregal resultando un mismo genotipo cuyos pesos moleculares en los 9 loci son: VS2 133-133; MD5 230-242; MD7 239- 249; MD25 241-249; MD27 180-190, MD28 244-268;MD32 258-272; ZAG62 186-196, ZAG79 243-255, lo cual no se ha registrado anteriormente en la base de datos VIVC (Tabla 3), por lo tanto, se trataría de una variedad no registrada (Marsal et al., 2017, Aliquó et al., 2017) y por el análisis realizado sobre el origen parental asociados a 3 patrones (2, 3 y 9) deriva de la cruza entre la var. ´Listan Prieto` y ´Muscat of Alexandria`, por lo que se le consideraría variedad criolla, que, al ser utilizada en la producción de vino tinto, formaría parte del patrimonio vitivinícola del valle. (Prieto, 2021).
Variedad “Italia negra”: Esta única muestra fue identificada en la zona de El Pedregal, las características a nivel ampelográfico, según OIV (2009), se muestra en la Tabla 2. La muestra ItaNe-CoP (Italia negra), al ser genotipada (Tabla 3) según la base de datos VIVC se asoció al perfil de SSR del cultivar ´Muscat Hamburg’ (VIVC 8226).
Variedad “Moscatel”: Los cinco fenotipos con esta nominación se registraron en las zonas de Casquina, Huancarqui, Uraca, El Pedregal y Toran. La descripción ampelográfica, según OIV (2009) se muestra en la Tabla 2, mediante el análisis discriminante se observa diferencias entre ellas (Figura 2). La variedad Moscatel Mosc-CoUr se distancia del resto por presentar la epidermis de la baya color rojo violeta oscuro, mientras que el resto de moscateles las presentan de color roja; asimismo, Mosc-To muestra cierta distancia del grupo por su alta densidad de pelos tumbados en la extremidad de la hoja joven y alta densidad de pelos tumbados entre los nervios principales en el envés de la hoja adulta. El análisis de componentes principales (Figura 3) muestra que Mosc-ApCas* se diferencia del resto de Moscateles por presentar el limbo de la hoja adulta de forma orbicular, mientras que el resto son cuneiforme; asimismo, presenta densidad laxa de los pelos erguidos en los nervios principales en el envés en la hoja adulta frente a las otras que son de densidad media. Las muestras Mosc-ApCas y Mosc-Hua, al ser genotipadas fueron idénticas y con una similitud total en los 9 marcadores analizados con la variedad ‘Listan Prieto’ (VIVC 686) en Tabla 3, lo cual indicaría que las dos Moscateles analizadas y la variedad Negra Criolla son del mismo genotipo pero con variaciones fenotípicas e incluso a nivel de racimo (Figura 1) y otras características de interés comercial diferentes, descritos por Cáceres et al. (2017) que Listan Prieto llamado “Negra criolla” son racimos más oscuros (Figura 1) y descritos por Martinez et al. (2006). Es probable que las diferencias fenotípicas del mismo genotipo pueda deberse a factores ambientales o sea diferente en algún locus o loci no detectable con los 9 marcadores suponiendo que la variedad Moscatel sea una variante clonal de ´Listan Prieto`, por la ocurrencia de alguna mutación somática (This et al., 2006), pudiendo estudiarse con mayor número de marcadores moleculares o con SNPs (Laucou et al., 2018) sin embargo cabe señalar, que en forma natural la planta de Moscatel puede también presentar ramas con racimos de negra ´Listan Prieto´ (observado personalmente por los investigadores en viñedos fuera de la localidad de Majes) que da la idea de profundizar estudios con el factor de terminación de la transcripción mitocondrial (mTERF) familia de genes que juega un papel importante durante el crecimiento de la planta bajo diversos estreses ambientales, caso de los genes mTERF (VvmTERF) de la uva estudiado por Yin et al. (2021), es de suponerse, que cuando un productor de vid observa una variante en la planta y le llama la atención, es clonado, que si fuera una mutación somática podría dar lugar a una nueva variedad pero si es ocasionado por respuesta a factores ambientales, el genotipo seguirá siendo el mismo.
Variedad “Negra criolla”: Los seis fenotipos nombrados localmente como “Negra” se registraron en 6 zonas, A nivel ampelográfico, según OIV (2009) presentado en la Tabla 2, de acuerdo al análisis discriminante (Figura 2), se muestran similares a excepción de la variedad Negra Ovoide (NeOv-CoC) que se muestra muy diferente en el grupo de las seis variedades locales, mediante el análisis de componentes principales (Figura 3) se confirman las características que hacen que la variedad NeOv-CoC se muestre diferente. La muestra Ne-ApCas colectada en Casquina, al ser genotipada con SSR y por comparación con la base de datos de la VIVC se identificó con una similitud total a la variedad Listan Prieto (VIVC 6860) (Tabla 3). Las variedades dentro del grupo de Negra Criolla podrían suponerse que corresponderían a Listan Prieto tal como indica Milla et al. (2005) que Negra Corriente, Criolla Chica, Misión, and Mission, son sinonimos ´Listán Prieto`.
Variedad “Vinera” Se han registrado dos fenotipos con esta denominación en la zona de El Pedregal. Al realizar el análisis discriminante (Figura 2) se evidencia la alta similitud de este grupo, diferenciándose entre ellas solamente en la densidad de pelos tumbados de la extremidad del pámpano joven y en la forma de los dientes en la hoja adulta. El análisis de componentes principales (Figura 3) influye la densidad de pelos erguidos en los nervios principales y la densidad de pelos tumbados entre los nervios principales ambos en el envés de la hoja adulta. Al genotipar las muestras Vin1-CoP y Vin2-CoP, tuvieron similitud total en los 9 marcadores analizados con la variedad ´Quebranta` (VIVC 9840) (Tabla 3), que al ser comparadas con el grupo de Quebranta (Figura 2) muestran alta diferenciación, lo que podría tratarse de un tipo de Quebranta diferente que se asemeja más al grupo de Negra Criolla, que al tomar como referencia las características de la variedad ´Quebranta` del Banco de germoplasma de Ica (Almanza et al., 2021) presentan algunas similitudes morfológicas sobre todo en el color de baya, apertura de extremidad de pámpano, numero de zarcillos, número de lóbulos , forma de dientes, apertura de hoja, base del seno peciolar limitada por nervios de la hoja adulta, lo cual nos indicaría que podrían ser características no influenciables por el medio ambiente comparado con el resto de características que se mostraron diferentes, de allí que, sería importante tomar en cuenta en la caracterización morfológica las características del lugar donde desarrolla la variedad para establecer un patrón de referencia varietal.
De acuerdo a los análisis realizados en el presente estudio tanto morfológico y genético de las variedades locales se observan diferencias intergrupales así como diferencias intragrupales, lo que da lugar a la variabilidad y riqueza varietal en el valle de Majes que debería ser conservado y aprovechado en el mejoramiento genético (Goncalves & Martins, 2022), además es importante conocer la identidad genética de las variedades, sobre todo de las variedades criollas, lo cual apoyaría a la denominación de origen de los productos derivados de ellas (Pszczólkowski et al., 2022) y por ende competitividad en el mercado.
4. Conclusiones
La prospección en el valle de Majes y el análisis ampelográfico demostró una gran diversidad varietal en las diferentes denominaciones de variedades locales. El análisis molecular de once variedades al ser comparadas con la base de datos VIVC se encontró cuatro variedades registradas ´Listan Prieto`, ´Jacquez` , ´Quebranta` y ´Moscato de Hamburgo` que aclara casos de sinonimia y homonimia, a su vez se encontraron dos variedades criollas con coloración Negra no registradas “Cantarita” y “Aceituna” ambas de interes vitivinicola, quedando la perspectiva de la identificacion genetica del resto de variedades presentes en el valle para una mejor conservacion y aprovechamiento de sus caracteristicas en el mejoramiento genético con la valorizacion de los produtos derivados, que algunos productores desconocen del gran potencial vitivinicola que poseen.