1. Introducción
En México los principales estados productores de espárragos son Sonora, Guanajuato, Baja California Sur y Baja California, en el 2021 se sembraron un total de 37,489.40 ha, de ellas 22, 073.80 ha fueron para exportación con un valor de $8, 414,014.56 (SIAP, 2022). En Veracruz es de reciente introducción.
Una de las enfermedades de importancia mundial que afecta a cultivos agrícolas es la fusariosis, conocida también como podredumbre de raíces y corona (Elmer & Pignatello, 2001; Quilambaqui et al., 2004; Borrego-Benjumea et al., 2014). Se ha reportado que el cultivo de espárrago es susceptible al ataque de microorganismos del género Fusarium (Corpas-Hervias et al., 2006; Hu et al., 2021), que causa importantes pérdidas económicas por las afectaciones en el rendimiento y producción (Mašková et al., 2021). Las especies reportadas en México son Fusarium oxysporum Schltdl (1984), Fusarium moniliforme Sheldon (1904) y Fusarium solani Mart. (1842) (Quilambaqui et al., 2004; Quilambaqui & Miguel, 2005), que producen síntomas como clorosis, amarillamiento, marchitez, decoloración de la raíz, podredumbre, lesiones de color castaño en la superficie de tallos, raíces y disminución en el tamaño de los turiones (Quilambaqui & Miguel, 2005; Corpas-Hervias et al., 2006; Kato-Noguchi et al., 2017). Estos patógenos se presentan en cualquier etapa del desarrollo del cultivo, lo que se asocia a factores de edad, temperatura, estrés y un mal manejo agrícola (Parikh et al., 2018). El cultivo de espárrago en áreas donde no se cultivaba, pueden ser susceptibles a plagas y enfermedades endémicas (Dietzel et al., 2019; Ristaino et al., 2021), por lo tanto, se debe realizar estudios de identificación de especies de Fusarium para su posterior manejo (Arie, 2019).
El objetivo de la investigación fue caracterizar por morfología, técnicas moleculares y pruebas de patogenicidad las especies de Fusarium aislados de tejidos sintomáticos de turiones de espárrago.
2. Materiales y métodos
2.1 Área de estudio y muestreo
Se realizó un muestreo dirigido a 40 plantas de espárrago de cuatro años de edad en febrero 2020 y abril 2021, en una superficie de cuatro hectáreas, ubicada en Perote, Veracruz, México a una altitud de 2358 m.s.n.m, con coordenadas geográficas 19°37ˈ34.2″ N, -97°14ˈ53.6″O. Se cortaron turiones con síntomas característicos de daños causados por hongos. Las muestras se almacenaron en bolsas de plástico y refrigeraron a 4 °C.
2.2 Aislamiento y purificación de los hongos
Se recolectaron raíces, tallos y turiones, y se cortaron en pequeños cilindros de tamaño de tres milímetros, fueron desinfectados de acuerdo con Hernández et al. (2011), se realizaron enjuagues, uno con agua corriente, dos con NaClO al 2% y dos lavadas con agua destilada estéril, cada uno durante un minuto. Para el crecimiento y desarrollo del hongo, el tejido vegetal fue colocado en cajas de Petri con agar papa dextrosa (PDA) y se incubaron a 25±2 °C durante cinco días o hasta observar crecimiento micelial. De cada aislamiento fúngico, se obtuvieron cultivos monospóricos, luego se tomaron con un asa bacteriológica cinco porciones de 0,5 cm2 de micelio crecido en PDA, el cual se resuspendió en 5 ml de agua estéril y se agitó por un minuto para posteriormente realizar diluciones seriadas de las esporas (10-1 a 10-6) en placa vaciada en PDA, se incubó a 25 ± 2 °C hasta observar crecimiento micelial (Cañedo & Ames, 2004). En seguida se aislaron las colonias y se observó que las cepas estuvieran purificadas.
2.3 Caracterización morfológica y morfométrica
Con agar hojas de clavel (CLA) se estimuló la producción de macro y microconidios, las hojas se maceraron con agua destilada en un mortero, se filtraron a través de una gasa, se agregó agar (15 g/L) y se esterilizó. Se colocó un cuadro de un cm2 de cada cultivo purificado y se incubó por doce días a 27± 2 °C. La identificación taxonómica se realizó con base en la morfología de fiálides, micro y macroconidios (Leslie et al., 2006). Para la caracterización morfométrica, se realizaron 50 mediciones de cada una de las estructuras identificadas (macroconidios, microco nidios, monofiálides) calculando la media aritmética.
2.4 Pruebas de patogenicidad
Para realizar los postulados de Koch se utilizaron turiones de espárragos sanos en un estado de madurez fisiológica, los cuales se desinfectaron de acuerdo con lo descrito por Hernández et al. (2011). Los turiones de 20 a 25 cm de largo se inocularon con cada una de las especies aisladas de Fusarium; para esto, se hizo un cultivo previo en medio PDA y a los siete días de edad se inocularon en cada pedazo de turión, se hicieron pequeñas heridas superficiales con un bisturí estéril, y se colocó un trozo de agar con micelio del hongo (5 mm aprox.) en la parte apical y basal de cada turión. Todas las especies de Fusarium fueron inoculadas por triplicado y un control sin inocular. A continuación, se colocaron en recipientes de polietileno con tapa hermética se colocaron toallas absorbentes humedecidas con agua destilada estéril, para generar una humedad relativa cercana al 80% y se incubaron a 25 ± 2 °C. Después del periodo de incubación se observó crecimiento, signos y síntomas característicos de daños causados por las especies de Fusarium a las 48, 72, 96 y 144 h. Finalmente, se aislaron los hongos que aparecieron en las lesiones inducidas en los tratamientos de turiones, con el fin de corroborar que las características morfológicas en medio PDA y CLA coincidieran con el agente causal.
2.5 Caracterización molecular de las especies patógenas
La extracción de ADN se realizó según el método descrito por Möller et al. (1992). La reacción en cadena de la polimerasa (PCR) se logró mediante una reacción de amplificación con volumen final de 50 μL que contenía: 1X de buffer de PCR, 3 mM de MgCl2, 200 μM de mix dNTP’S, 0,4 pM de iniciador ITS1 (5´TCC GTA GGT GAA CCT TGC GG 3´), 0.4 pM de iniciador ITS4 (5´TCC TCC GCT TAT TGA TAT GC 3´), 2,5 U de Taq Polimerasa, agua libre de nucleasas grado molecular 31,5 μL y 50 ng de ADN. Las condiciones de amplificación fueron: desnaturalización inicial a 95 °C durante 3 min, seguido de 35 ciclos a 95 °C por 45 s, 53 °C por 30 s y 72 °C por 90 min y una extensión final a 72 °C por 10 min. Los amplificados se purificaron con el kit Wizard (Pro-mega®, USA) siguiendo las instrucciones del fabricante y fueron secuenciados en un secuenciador (Applied Biosystems, modelo 391). La búsqueda de la similitud de las secuencias de ADN se desarrolló por medio del programa BLAST (Basic Local Alignment Search Tool), y se compararon con las secuencias del GenBank. Las secuencias se alinearon con el algoritmo ClustalW del software MegAlign de Mega 6 (Tamura et al., 2013). Los árboles filogenéticos fueron construidos usando el algoritmo de máxima verosimilitud (K2+G) del software Mega 6, con un bootstrap de 1000 réplicas.
3. Resultados y discusión
3.1 Aislamientos fúngicos y sintomatología
La sintomatología observada en las plantas enfermas de espárrago, como pudrición, amarillamiento y marchitez (Figura 1), coincide a lo reportado por Fusariosis (Schreuder et al., 1995; Corpas-Hervias, 2016). De las 40 plantas que se muestrearon, se obtuvieron 50 aislamien tos que pertene-cieron al género Fusarium caracterizados con base en sus estructuras microscópicas (Leslie et al., 2006).
3.2 Identificación morfológica y morfométrica
La identificación de los 50 aislados se agruparon en cuatro tipos de especies que coincidieron con la descripción de F. oxysporum, F. proliferatum, F. graminearum y F. avenaceum. Para F. oxysporum se observó una colonia con micelio aéreo de color blanco y pigmentación rosa en el reverso de la colonia y bordes irregulares en medio PDA (Figura 2. 1 y2). En medio CLA se observaron macroconidios agrupados en esporodoquios de color amarillo claro, los cuales tenían células apicales con ganchos, célula basal en forma de pie bien desarrollada, con 3 septos y con promedio de 27 µm de largo por 3 µm de ancho (Figura 2A). Abundantes clamidosporas grandes esféri cas, de pared gruesa, agrupadas en pares o en cadenas (Figura 2B). Monofialides cortas en forma de botella de tamaño aproximado de 13 µm de largo (Figura 2C). Microconidios, agrupados en falsas cabezuelas, de forma ovalada con un largo entre 7-10 µm, y con un ancho de 3µm, sin septos (Figura 2D); los datos de morfometría corresponden a lo descrito por Arbeláez (2000).
Para el caso de F. proliferatum, la colonia presentó micelio aéreo algodonoso de color blanco y por el reverso pig mentación color durazno (Figura 3. 1 y2). En medio CLA se observaron microconidios ovalados, sin septos y con un tamaño promedio de 6 µm de largo por 2 µm de ancho, unidos en cadenas cortas (Figura 3A). Forma pseudocla midosporas (Figura 3B). Los macroconidios son delgados con 43 µm de largo por 1 µm de ancho, con célula apical curva y célula basal poco desarrollada (Figura 3C). Monofialides largas con un tamaño que oscila entre 20-40 µm de largo y 2 µm de ancho, con ausencia de polifialides (Figura 3D). Los datos morfométricos se ajustan a lo reportado por Martínez et al. (2015).
Para F. graminearum se observó micelio aéreo, algodonoso, blanco, con un halo amarillo y otro blanco. Al reverso fue de color naranja, con halo marcado de color marrón y bordes amarillos. Se observaron abundantes macroconidios con 3 a 5 septos, delgados, con célula apical en forma de gancho y con un tamaño entre 27 a 45 µm de largo por 2 µm de ancho. Presencia de abundantes esporodoquios de color naranja en medio CLA; clamidosporas intercalares, globosas; monofialides cortas y medianas, con un promedio de 25 µm de largas; microconidios ausentes. Con respecto a F. avenacium, ésta presentó micelio algodonoso blanco, con halo amarillo y borde irregular, al reverso fue amarillo con borde blanco. Abundantes macroconidios, delgados, curvos, con célula basal en forma de pie, agrupados en esporodoquios de color amarillo claro en medio CLA. Su tamaño va entre 50 a 68 µm de largo. Hay presencia de clamidosporas intercalares, monofialides cortas y microconidios ovalados, sin septos con un tamaño de 5 µm.
3.3 Pruebas de patogenicidad
En las pruebas de patogenicidad, de las cuatro especies de Fusarium spp. asociadas al cultivo de espárrago, sólo las especies F. oxysporum y F. proliferatum indujeron crecimiento micelial algodonoso de color blanco y sintomatología de marchitez de la parte inferior de la planta después de las primeras 48 h de incubación (Figura 4A y4E), respectivamente. Comparado con el testigo, el cual no presentó crecimiento de micelio. Con respecto al cultivo de F. oxysporum, a las 144 h se desarrolló pudrición húmeda en los turiones (Figura 4D), mientras que con el cultivo de F. proliferatum, en el mismo tiempo el hongo colonizó el resto del turión lo que provocó su deshidratación (Figura 4H).
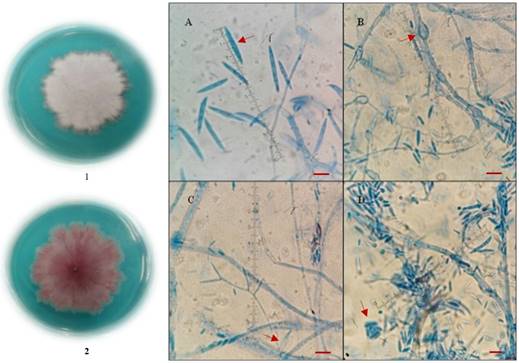
Figura 2 Colonia de F. oxysporum en medio PDA incubada a 25 ± 2 °C durante 7 días. 1. Vista de frente. 2. Vista de reverso. Estructuras microscópicas a 100x de F. oxysporum desarrolladas en medio CLA incubada a 25 ± 2 °C durante 7 días. A. Macroconidios. B. Clamidosporas, C. Monofialides cortas en forma de botella. D. Microconidios, algunos agrupados en falsas cabezuelas. Las barras de escala representan 10 μm.
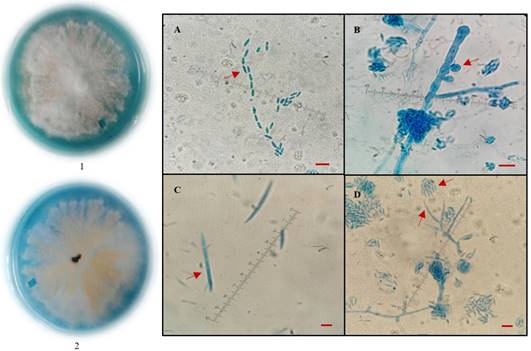
Figura 3 Colonia de F. proliferatum en medio PDA incubada a 25 ± 2 °C durante 7 días. 1) vista de frente y 2) vista de reverso de la colonia. Estructuras microscópicas de F. proliferatum 100x desarrolladas en medio CLA incubada a 25 ± 2 °C durante 7 días. A. Microconidios. B. Pseudoclamidosporas. C. Macroconidios. D. Monofialides y falsas cabezuelas. Las barras de escala representan 10 μm.
De esta manera, los postulados de Koch confirmaron la patogenicidad de las cepas, se observó desarrollo de estructuras asexuales en medio de cultivo PDA para F. oxysporum y en CLA para F. proliferatum, las cuales fueron reaisladas del crecimiento micelial de los turiones utilizados en las pruebas de patogenicidad (Figura 5). Por lo tanto, se asocian estas dos especies de Fusarium a la pudrición en raíces y tallos, con síntomas claramente visibles, ambos pueden causar daños, como lo observado en este estudio sobre la pudrición y deshidratación de turiones, lo que conlleva a la muerte de la planta (Schreuder et al., 1995; Corpas-Hervias et al., 2006).
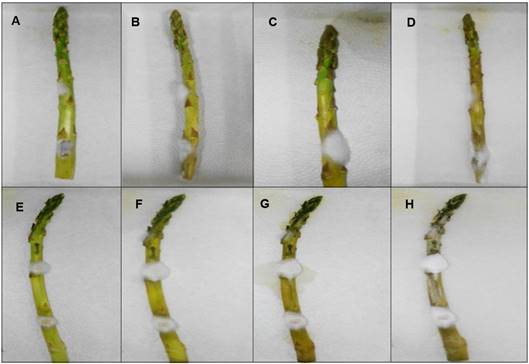
Figura 4 Prueba de patogenicidad en espárrago observando crecimiento micelial y síntomas de enfermedad. En F. oxysporum a las 48 (A), 72 (B), 96 (C) y 144 h (D). En F. proliferatum a las 48 (E), 72 (F), 96 (G) y 144 h (H).
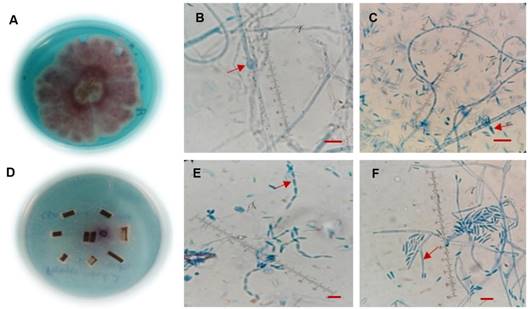
Figura 5 Postulado de Koch de F. oxysporum y F. proliferatum reaislados de los turiones utilizados en la prueba de patogenicidad. A. Colonia típica en PDA. B. Clamidospora y C. Monofiálide corta en forma de botella características de F. oxysporum. D. Desarrollo micelial en CLA, E. Microconidios en cadena. F. monofiálides largas características de F. proliferatum. Las barras de escala representan 10 μm.
3.4 Identificación molecular
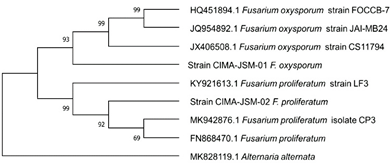
Las cepas patógenas obtenidas con los postulados de Koch, se corroboraron la identidad mediante el análisis molecular del gen ADN ribosomal y sus espaciadores internos ITS1 e ITS4. Los cuales mostraron un 99% de similitud con secuencias de F. oxysporum y F. proliferatum depositadas en el GeneBank, situada la cepa CIMA-JSM-01 en el clado de F. oxysporum y CIMA-JSM-02 en el clado correspondiente de F. proliferatum (Figura 6). Las dos especies de Fusarium identificadas como patógenas en espárrago ya fueron reportadas en cultivos de Guanajuato, México por Quilambaqui & Miguel (2005). También se han reportado en Estados Unidos (California, Carolina del Norte), donde el patógeno dominante en los cultivos de espárrago ha sido F. proliferatum, lo que coincide también con reportes en México y Perú (Elmer, 2000). Por otra parte, en el sur de España se ha reportado a F. proliferatum, F. oxysporum f. sp. asparagi, F. moniliforme y F. solani (Corpas-Hervias et al., 2006).
El hongo F. oxysporum se ha reportado en zonas templadas y tropicales lo que indica la plasticidad que tiene el hongo para adaptarse a diferentes climas, ocasiona podredumbre radicular, las plantas maduras son las más susceptibles, sin embargo, también pueden afectar a plántulas y trasplantes jóvenes (Elmer, 2015). En el trabajo de Quilambaqui & Miguel (2005) realizaron un estudio de inductividad de suelo, encontraron que se podría considerar a F. oxysporum como la especie más prevalente y severa, probablemente por su adaptación al conjunto de factores físicos, químicos y biológicos que determinan la inductividad de un suelo. Respecto a las pruebas de patogenicidad in vitro se ha indicado que se podría sobreestimar que las plántulas sean más susceptibles que las cultivadas en campo, en condiciones in vitro el patógeno tiene ventajas, debido a que no compite con otros microorganismos, tampoco está expuesto a condiciones ambientales adversas (Quilambaqui & Miguel, 2005), estas pruebas serían útiles solo para tener resultados preliminares, lo óptimo es llevarlas a cabo en los cultivos a campo abierto (Corpas-Hervias et al., 2006). Por otra parte, las especies aisladas de Fusarium pueden tener cierta variación en cuanto a incidencia y severidad en el daño de las plántulas, lo cual depende del grado de patogenicidad y virulencia (Quilambaqui & Miguel, 2005).
La identificación de especies de Fusarium se ha realizado en algunos estudios con los espaciadores internos ITS1 e ITS4 y por amplificación aleatoria de ADN polimórfico (RAPD, Random Amplification of Polymorphic DNA en inglés) en plantas de tomate (Singha et al., 2016); Corpas-Hervias et al. (2006) estudiaron 19 cepas de Fusarium por RAPD, lograron identificar 15 de ellas (F. oxysporum (8), F. proliferatum (4) y F. moniliforme (3), sin embargo con F. solani no se agruparon los dendogramas, esto se debe a la diversidad genética entre estas especies.
Es esencial realizar estudios de identificación morfológica y pruebas de patogenicidad en los hongos de Fusarium que dañan a los espárragos, se ha reportado que el estudio de los síntomas de la enfermedad en las raíces, también indican la virulencia del patógeno (Farahani-Kofoet et al., 2020).
En el estado de Veracruz, el cultivo de espárrago es de reciente introducción, existen alrededor de 100 ha sembradas, se desconocían los agentes patógenos que causaron daño y afectaron la calidad y el rendimiento de la producción, en este primer trabajo de investigación científica se logró elucidar la problemática en la zona de estudio, con el propósito de que se implementen las medidas fitosanitarias para el manejo adecuado de las especies de F. oxysporum y F. proliferatum. Al no aplicar la regulación fitosanitaria los patógenos que causan enfermedades se dispersan con facilidad a través del material vegetativo de un lugar a otro, lo que provoca mayores gastos económicos y contaminación ambiental por excesos de aplicaciones de agroquímicos, para el manejo específico de la fusariosis en espárrago.
4. Conclusiones
En esta investigación se caracterizaron las cepas de F.oxysporum y F. proliferatum, de forma morfológica, por técnicas moleculares y por pruebas de patogenicidad, a las dos especies patógenas causantes de la pudrición y deshidratación en plantas de espárragos en el estado de Veracruz. Esto ayudará al productor en la toma de decisiones para el manejo del cultivo.
Derivado del trabajo en campo, se llevó a cabo la aplicación de composta de ganado bovino por medio de aspersiones foliares, y se observó de forma general en el cultivo de espárrago una baja incidencia de la fusariosis. Por lo que se justifica hacer estudios posteriores que enriquezcan la estrategia, para mejorar la calidad y producción del espárrago.