1. Introducción
La papaya (Carica papaya L.) es uno de los cultivos tropicales con mayor importancia económica por su alto valor nutritivo, propiedades sensoriales y medicinales (Suárez-Quiroz et al., 2013). En 2020, México cosechó 1 118 000 t en 20 100 ha sembradas, con rendimiento de 55,6 t ha-1 y valor de 1 730 mdp (Secretaría de Agricultura y Desarrollo Rural [SADER], 2021). La variedad más cultivada es la “Maradol” y se coloca entre las más importantes y deseadas en el mercado mexicano y de los Estados Unidos (Santamaria et al., 2015). Sin embargo, este genotipo es altamente susceptible a enfermedades y plagas (Mirafuentes & Santamaria, 2014).
Por ello, empresas e instituciones de investigación en México se han dedicado al desarrollo y producción de nuevos genotipos de papaya, con mejor calidad de fruto, alta productividad y mayor tolerancia a enfermedades y plagas (Santamaria et al., 2015). El germoplasma mejorado híbrido “Intenzza” posee productividad que va entre 100 y 150 t por ha, con el 95% de fruta de calidad de exportación. Este material es apreciado por el color amarillo brillante de su cáscara y su pulpa roja con un contenido de azúcares entre 10 y 13 °Brix (Semillas del Caribe, 2020).
Para la producción de papaya, la fase de vivero o producción de planta juega un papel primordial dentro de la cadena productiva, ya que las plantas producidas en vivero permiten un buen desarrollo y adaptación cuando son trasplantadas al suelo (Hidalgo-Loggiodice et al., 2009). En esta etapa, un aspecto importante es la asociación de las plantas con microorganismos benéficos. Esta asociación se ha estudiado y aprovechado para el desarrollo de biofertilizantes o bioinoculantes, representando una alternativa viable para lograr un buen desarrollo de las plantas en etapa de vivero y trasplante (Basilio et al., 2022).
Los biofertilizantes son inoculantes microbianos que generalmente se pueden definir como una preparación que contiene células vivas o latentes de microorganismos eficientes en la fijación de nitrógeno, solubilización de fosfato y potasio; promoción del crecimiento vegetal y protección de la planta a estrés biótico y abiótico. A diferencia de los fertilizantes químicos, los biofertilizantes son microorganismos viables que no son la fuente de nutrientes, pero ayudan a las plantas a acceder a la disponibilidad de ellos en la región rizosférica (Jaber & Enkerli, 2017).
Varios microorganismos se utilizan comúnmente como biofertilizantes, incluidas bacterias del suelo (p. e. Azotobacter y Rhizobium), cianobacterias fijadoras de nitrógeno (p. e. Anabaena sp.), bacterias solubilizadoras de fosfato (p. e. Pseudomonas sp.), hongos micorrízicos arbusculares (p. e. Glomus sp., Entrophospora y Acaulospora sp.) y los hongos microscópicos de suelo (p. e. Trichoderma sp., Paecilomyces sp., Beauveria sp. y Penicillium sp., Bhardwaj et al., 2014; Jasmitha et al., 2022). Los biofertilizantes son fuentes renovables a bajo costo de nutrientes vegetales y se pueden cultivar in vitro, formular e inmovilizar en un soporte inerte acompañado de nutrientes, ácidos húmicos y fúlvicos (Umaru & Simarani, 2022).
Un grupo de microorganismos poco estudiados como biofertilizantes son los hongos entomopatógenos (HE), estos poseen hábito saprobio, parásito y endófito. Este último hábito comprende una relación con la planta, ya que se hospeda dentro de los tejidos sin causar ningún síntoma de enfermedad (Tall & Meyling, 2017). Estos microrganismos endófitos son fuente importante de diversos metabolitos secundarios bioactivos y se sabe que algunos hongos entomopatógenos pueden producir fitohormonas (Toscano-Verduzco et al., 2020; Liu et al., 2022).
La rizosfera del cultivo de papaya es un reservorio de natural de hongos microscópicos. En este sentido, Chan-Cupul et al. (2018) aislaron dos especies de HE de la rizosfera de papaya: Beauveria brongniartii y Purpureocillium lilacinum. Por su hábito saprobio, estas especies suelen aislarse de la rizosfera de diversos cultivos. B. brongniartii (Toscano-Verduzco et al., 2020) y P. lilacinum (Moreno-Salazar et al., 2020) han sido reportadas con habilidad para solubilizar fuentes insolubles de P [Ca3(PO4)2 y FePO4], producir sideróforos y ácido indol-3-acético (auxina). Con estas habilidades bioquímicas ambas especies de HE son potenciales agentes activos para desarrollar bioinoculantes para la producción de plantas de papaya en vivero. Por lo tanto, el objetivo del presente estudio fue evaluar la habilidad de B. brongniartii y P. lilacinum para colonizar tejidos, promover la emergencia y mejorar la calidad de plántula de dos genotipos de papaya en vivero.
2. Materiales y métodos
2.1 Localización del experimento
El experimento se llevó a cabo de junio a septiembre del 2020 en un invernadero tipo gótico situado en la Facultad de Ciencias Biológicas y Agropecuarias de la Universidad de Colima, ubicada en el municipio de Tecomán, Colima, México, a 56 msnm con clima cálido subhúmedo A(w0). El experimento se desarrolló con un promedio de temperatura máxima, media y mínima de 38,5, 34,3 y 30,14 °C, respectivamente. Mientras que los promedios de la humedad relativa máxima, media y mínima fueron de 73,97%, 58,5% y 43,15%, respectivamente.
2.2 Producción masiva de HE
Las conidiosporas de B. brongniartii y P. lilacinum se produjeron en granos de arroz (Oriza sativa L.) dentro de bolsas de polietileno de alta densidad de dos kilogramos. Los granos de arroz se lavaron tres veces con agua potable. Posteriormente, se colocaron en charolas y se secaron con luz solar. Se depositaron 120 g de arroz en las bolsas y se esterilizaron (121 °C, 8,27 kPa, 25 min) en autoclave (Market Forge Indutries, NY, USA). Las bolsas con arroz estéril se enfriaron e inocularon con 5 mL de una solución de 3,9×106 esporas mL-1 de B. brongniartii (cepa SP9) y 2,5×106 de P. lilacinum (SP18), posteriormente se incubaron durante 18 días en un intervalo de 24,7 °C - 29,6 °C, 10:14 h luz: oscuridad y 75% - 90% de humedad relativa (Rodríguez-Alcocer et al., 2014; Toscano-Verduzco et al., 2020). Tanto B. brongniartii y P. lilacinum fueron aislados de muestras de suelo rizosférico de una plantación de papaya de cuatro meses de trasplante y al menos dos años libre de agroquímicos, en el municipio de Tecomán, Colima (18° 51’ 41,8” N, 103° 59’ 57,5” O, Chan-Cupul et al., 2018).
2.3 Inoculación de HE en semillas de C. papaya
Se emplearon dos genotipos de papaya; el híbrido “Intenzza” y la variedad “Maradol roja”. Ambos genotipos fueron adquiridos de la empresa Semillas del Caribe S. A. de C. V. Se realizó un tratamiento pregerminativo a las semillas con una solución de KNO3 (2 g L-1). En 500 mL de solución de KNO3 se aplicaron 7,5 g de arroz colonizado de 16 días de incubación. La solución se agitó y filtró en malla de 2 mm, la concentración de esporas de esta solución se cuantificó y ajustó a una concentración de 1,0×107 conidiosporas mL-1, ambas especies se trabajaron separadamente. En matraces de 500 mL se depositaron 200 mL de la solución de KNO3 y conidiosporas de los inoculantes y se agregaron las semillas de papaya de cada germoplasma. La solución con semillas se incubó por 24 h a 32 °C y 100 rpm. Finalmente, la solución se filtró y se recuperaron las semillas para la siembra en charolas. Además de la inoculación en semilla de los micromicetos a evaluar, se realizaron cinco aplicaciones vía drench con siete días de periodicidad. Las aplicaciones se realizaron a razón de 15 mL planta-1 a una concentración de 1,0×107 conidiosporas mL-1.
2.4 Preparación del semillero
Se utilizaron 12 charolas de plástico de 108 cavidades cada una (9×12 cm), como sustrato se usó turba (Pindstrup plus Orange®) a razón de 1,66 kg charola-1 al 60% de humedad. Posteriormente, se realizó la siembra colocando una semilla de C. papaya por cavidad a una profundidad de 1 cm.
2.5 Manejo del semillero
Se destinaron seis charolas para cada germoplasma; dos para la inoculación de B. brongniartii, dos para P. lilacinum y dos como controles (sin inoculación). Semanalmente se realizaron aplicaciones de fertilizantes; Poly feed (19-19-19) y Greenhow MKP (0-52-34) disueltos en agua de riego (Tabla 1). Se realizaron dos aplicaciones de insecticida Decis Forte® (p. e. deltametrina 10,7%, 1,0 mL L-1) y una aplicación de funguicida Previcure Energy® (i. a. Propamocarb 53% y Fosetilo 31%, 1,25 mL/L-1). Los semilleros se regaron diariamente con 1,5 L de agua (6,5 - 7,0 pH) por charola.
Tabla 1 Plan de fertilización, aplicación de insecticida y funguicida durante el desarrollo de plantas de Carica papaya en vivero
| Días de aplicación (dds) | Decis Forte® (mL L-1) | Previcure® (mL L-1) | Polyfeed® (g L-1) | Green How MKP® (g L-1) |
| 0 | 1 | 1,25 | 0,0 | 0 |
| 8 | 0 | 1,25 | 0,0 | 0 |
| 15 | 1 | 0,00 | 0,0 | 0 |
| 21 | 1 | 1,25 | 0,5 | 1 |
| 28 | 0 | 0,00 | 1,0 | 2 |
| 35 | 1 | 1,25 | 2,0 | 4 |
| 42 | 0 | 0,00 | 4,0 | 6 |
dds = días después de la siembra.
2.6 Variables de respuesta
Porcentaje de emergencia. Durante 7 días se observó continuamente el crecimiento de la radícula y hasta que alcanzó 5 mm de altura se le consideró semilla emergida. Con los datos obtenidos se calculó el porcentaje de emergencia de cada charola al dividir el número de semillas germinadas entre el total de semillas multiplicado por cien.
Altura de planta y diámetro de tallo. Una vez emergidas todas las semillas (7 días después de la siembra = dds) se seleccionaron 30 plantas del centro de cada charola para realizar la evaluación de altura y diámetro del tallo. La altura se determinó con una regla milimétrica, se midió desde la base del tallo hasta el meristemo apical de la planta, mientras que el diámetro de tallo se midió a los 3 cm de la base del sustrato con ayuda de un vernier digital (Truper®, México). Estas variables se midieron semanalmente durante un mes.
Área foliar. Se evaluó a los 7 dds, se midió el área foliar de 10 plantas por tratamiento; se tomaron dos hojas verdaderas de cada planta y se hicieron mediciones de longitud máxima desde la base del peciolo hasta el extremo del foliolo central de las hojas en forma perpendicular, a una longitud máxima con el apoyo de un medidor laser portátil de área foliar (Bioscience®, CI-202, USA).
Biomasa aérea y radicular fresca y seca. Se emplearon las mismas plantas seleccionadas para el área foliar con 42 dds. Se separó y pesó la parte vegetativa y radical en una balanza analítica. La parte radicular se lavó con agua para eliminar residuos del sustrato. Una vez pesada la biomasa fresca, las muestras se colocaron en un horno a 40 °C (Felisa®, México) para su secado hasta peso constante (Quiñonez-Aguilar et al., 2014).
Contenido de clorofilas A, B y total. En hojas de plantas de 37 dds se realizaron cortes de 2×1 cm de tejido eliminando la nervadura central. Posteriormente, se colocó el fragmento de cada muestra en un mortero, se agregaron 15 mL de acetona al 80% para macerar el tejido; se añadieron 10 mL más de acetona para lograr extraer todo el pigmento del tejido. Después, la muestra se filtró con ayuda de un embudo y papel filtro Whatman No. 2; el filtrado obtenido se decantó y aforó a 25 mL con acetona al 80%. Una vez maceradas y aforadas las muestras, se realizó la lectura del contenido de clorofila en un espectrofotómetro (UNICO®, Texas, UU. EE.) a dos longitudes de onda (645 y 663 nm) utilizando acetona al 80% como blanco (Ruiz-Santiago et al., 2019). Para la determinación de clorofila a, b y total se utilizaron las ecuaciones descritas por Arnon (1949):
Clorofila A = (12,7 x Abs 663) - (2,69 x Abs 645)
Clorofila B = (22,9 x Abs 645) - (4,68 x Abs 663)
Clorofila Total= (20,2 x Abs 645) + (8,02 x Abs 663)
Índice de calidad de las plantas. El índice de calidad de las plantas se determinó a los 35 dds. Específicamente, la relación biomasa seca aérea se obtuvo como la relación entre peso seco aéreo (BSA) y peso seco de raíz (BSR), ambos expresados en g. El índice de esbeltez (IE) se determinó entre altura de planta (cm) y el diámetro de tallo (mm); índice de lignificación [ILIG (%)], entre el peso seco de planta y el peso fresco de planta, ambos expresados en g, por 100, índice de calidad de Dickson (IDS) se determinó con la siguiente fórmula = peso seco total de planta / (IE + relación BSA/BSR) (Dickson et al., 1960).
Colonización de tejido vegetal por los hongos entomopatógenos (endofitismo). A los 47 dds se realizó una prueba de endofitismo en hoja, tallo y raíz empleando el método descrito por Bonilla (2012). Cada órgano de la planta fue separado y lavado con agua. Posteriormente, se desinfestaron con etanol 70% durante dos minutos, seguido por un lavado con hipoclorito de sodio 2% por tres minutos y tres enjuagues con agua destilada estéril. Los tejidos se dejaron secar sobre de un disco de papel filtro estéril y luego se cortaron en fragmentos de 1×1 cm. Después, se eligieron aleatoriamente 15 fragmentos de cada planta y se sembraron en tres cajas Petri (cinco fragmentos por placa) en medio de cultivo agar papa dextrosa (PDA). Las placas fueron incubadas por seis días. El porcentaje de colonización se determinó dividiendo el número de fragmentos colonizados entre el total de fragmentos analizados por 100.
2.7 Diseño experimental y análisis de datos
El estudio se estableció bajo un diseño experimental completamente al azar con un arreglo factorial A×B. El factor A consistió en el genotipo de papaya (híbrido “Intenzza” y var. “Maradol”), mientras que el factor B consistió en la inoculación de los HE (inoculación con B. brongniartii, P. lilacinum y sin inoculación), resultando seis tratamientos. Cada tratamiento constó de 216 plántulas que fueron distribuidas en dos charolas de siembra (108 plántulas por charola). De cada charola se seleccionaron 35 plantas, una planta se consideró como unidad experimental. Los datos obtenidos para cada variable de estudio se analizaron con una prueba de Levene para determinar la homogeneidad de varianzas en tre los tratamientos. Posteriormente, se realizó un análisis de varianza de dos vías, al encontrar un P-valor menor o igual a 0,05 se realizó una comparación de medias empleando la Diferencia Mínima Significativa [DMS (α = 0,05)]. Todas las variables de respuesta se analizaron con StatgraPhics Plus®.
3. Resultados y discusión
3.1 Porcentaje de emergencia
El factor variedad mostró un efecto significativo (P < 0,05) en el porcentaje de emergencia (PE). El híbrido “Intenzza” emergió significativamente más rápido que la variedad “Maradol”, esto se pudo observar en los cinco muestreos entre el día 7 y 11 después de la siembra (dds), dónde “Intenzza” emergió 16,36%, 34,57%, 27,48%, 15,75% y 9,10% más rápido en comparación con “Maradol”, a los 7, 8, 9, 10 y 11 dds, respectivamente. En el último muestreo (12 dds) ambas variedades no presentaron diferen cias significativas (P = 0,2114, Tabla 2).
La inoculación de los HE en semillas de C. papaya obtuvo un efecto significativo (P < 0,05) en el PE durante todo el periodo de muestreo (6 días). La inoculación de B. brongniartii en semillas de C. papaya incrementó significativamente (P < 0,05) el PE respecto al control en 6,95%, 10,41%, 16,44%, 11,81%, 9,03% y 6,02% a los 7, 8, 9, 10, 11 y 12 dds, respectivamente. Asimismo, entre las dos especies, B. brongniartii incrementó el PE de las semillas con respecto a P. lilacinum en un 8,6%, 7,0%, 6,2% y 4,0% a los 9, 10, 11 y 12 dds, respectivamente (Tabla 2).
A los 8 y 9 dds, el PE fue significativamente mayor en los tratamientos “Intenzza” + B. brongniartii (59,25% y 87,5%), “Intenzza” + P. lilacinum (59,72% y 84,26%) e “Intenzza” (57,4% y 84,72%), lo que indica claramente un efecto de la variedad. Este patrón se repitió a los 10, 11 y 12 dds. Sin embargo, estos tratamientos también fueron estadísticamente iguales al tratamiento “Maradol” + B. brongniartii, lo cual indica que al inocular a B. brongniartii en semillas var. “Maradol” se incrementa su emergencia igualando a la var. “Intenzza”, e incluso lo superándolo en 5,09% a los 12 dds (Tabla 2).
Las semillas de papaya asimilan fácilmente los compuestos que sintetizan los microorganismos, los cuales son utilizados por la semilla para acelerar el proceso de emergencia. Este incremento puede deberse a la producción de diferentes fitohormonas que promueven el desarrollo y el crecimiento de las plantas, tales como auxinas (ácido indol-3-acético), como lo reportó Toscano-Verduzco et al. (2020). González & Fuentes (2017) mencionaron que otro factor favorable en el aumento del porcentaje de emergencia es la particularidad de las semillas de papaya al poseer una capa de mucílago que rodea y protege la semilla y favorece la adherencia de microorganismos y el contacto con sustancias orgánicas de fácil asimilación por parte de esta, como es el caso de las giberelinas u otras hormonas que facilitan la emergencia de las semillas de papaya. En cuanto a biofertilizantes para la emergencia de semillas de papaya, los estudios se han enfocado mayormente en hongo micorrízicos (Glomus fasciculatum y Glomus intraradices, Constantino et al., 2010; Serbelló-Guzmán et al., 2014) y rizobacterias promotoras del crecimiento vegetal (p. e. Azotobacter chroococcum y Azospirillum brasilense, Constantino et al., 2010) y no en HE y/o saprobios. El presente trabajo corresponde al primer reporte sobre B. brongniartii como estimulador de la germinación de semillas de C. papaya, este resultado posee implicaciones no solo en el control biológico de plagas, también posee implicaciones en la mejora del crecimiento vegetal.
3.2 Altura de planta
La var. “Intenzza” presentó mayor altura (P < 0,05) de planta en comparación con la var. “Maradol”, a los 19, 26 y 35 dds; la var. “Intenzza” obtuvo 0,17, 0,35 y 0,38 cm más que la var. “Maradol”, respectivamente (Tabla 3). La inoculación independiente de B. brongniartii y P. lilacinum incrementó la altura de las plantas de C. papaya (P < 0,05). En los cuatro muestreos ambos HE favorecieron una mayor altura (P < 0,05) de planta respecto a las plantas sin inoculación. Beauveria brongniartii incrementó 0,29, 0,15, 0,24 y 0,38 cm la atura de las plantas de C. papaya, a los 19, 26, 31 y 35 dds, respectivamente. Mientras que los incrementos observados con P. lilacinum fueron de 0,20, 0,15, 0,24 y 0,38 cm, a los 19, 26, 31 y 35 dds, respectivamente (Tabla 3). La interacción entre la variedad y la especie de hongo no presentó diferencia estadística significativa (P > 0,05, Tabla 3). De acuerdo con Andrade-Rodríguez et al. (2008) la aplicación de auxinas en plántulas incrementa el porcentaje de emergencia de semillas de papaya y también incrementa el crecimiento vegetal y reduce el tiempo de la etapa en vivero para la producción de plantas.
Tabla 2 Emergencia (%) de semillas de Carica papaya inoculadas con hongos entomopatógenos
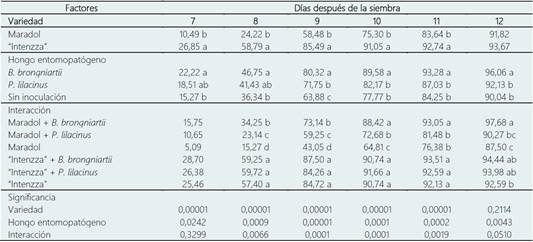
Medias con diferente literal entre filas son significativamente diferentes entre sí, de acuerdo con la diferencia mínima significativa (P ≤ 0,05).
Tabla 3 Altura de plantas (cm) de Carica papaya inoculadas con hongos entomopatógenos
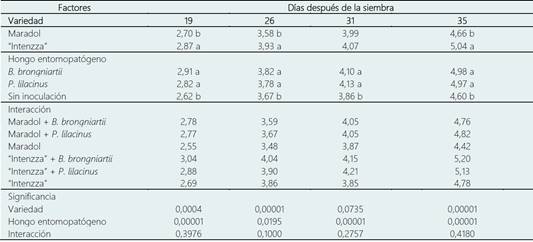
Medias con diferente literal entre filas son significativamente diferentes entre sí, de acuerdo a la diferencia mínima significativa (P ≤ 0,05).
Además, Beltrán-Pineda (2014) mencionó que los hongos no solo tienen la capacidad de producir fitohormonas, también solubilizan N y P. Este último elemento esencial es considerado como el segundo nutriente limitante para el crecimiento de las plantas e influye en diversos procesos metabólicos claves, tales como desarrollo, división celular, transporte de energía.
3.3 Diámetro de tallo
En los dos primeros muestreos (19 y 26 dds) la var. “Maradol” presentó diámetro de tallo significativamente (P < 0,05) mayor respecto a la var. “Intenzza” con 1,43 y 17,8 mm, respectivamente. A los 31 dds, el análisis no mostró diferencias significativas (P > 0,05). Sin embargo, a los 35 dds, la var. “Intenzza” (2,59) mostró un mayor diámetro de tallo respecto a la var. “Maradol” (2,39 mm). Este efecto adverso en las primeras dos mediciones pudo estar dado por características intrínsecas de la variedad (Tabla 4).
Tabla 4 Diámetro de tallo (mm) de plantas de Carica papaya inoculadas con hongos entomopatógenos
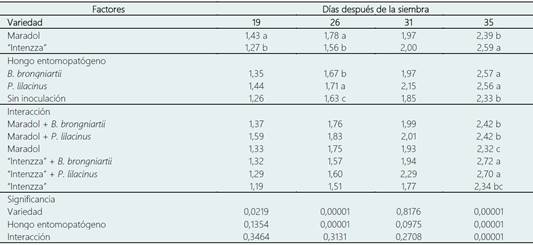
Medias con diferente literal entre filas son significativamente diferentes entre sí, de acuerdo a la diferencia mínima significativa (P ≤ 0,05).
En los muestreos a los 19 y 31 dds no se encontraron diferencias significativas para el factor HE. Sin embargo, a los 26 dds, la inoculación de P. lilacinum (1,71 mm) favoreció un mayor diámetro de tallo respecto a B. brongniartii (1,67 mm) y el control (1,63 mm). Para el último muestreo (35 dds), ambos HE (B. brongniartii=2,57mm y P. lilacinum=2,56 mm) incrementaron el diámetro de tallo en comparación con el control (2,33 mm, Tabla 4).
La interacción entre los dos factores únicamente mostró una diferencia significativa al final del experimento (35 dds). La var. “Intenzza”, tanto con la inoculación de B. brongniartii (2,72 mm) y P. lilacinum (2,70 mm), presentó los mayores diámetros (P < 0,05) comparado con el resto de los tratamientos (rango de 2,32 a 2,42 mm).
Tabla 5 Área foliar (cm2), peso fresco y seco de la biomasa aérea y radicular (g) de plantas de Carica papaya inoculadas con hongos entomopatógenos
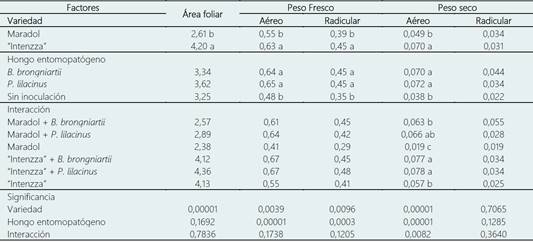
Medias con diferente literal entre filas son significativamente diferentes entre sí, de acuerdo con la diferencia mínima significativa (P ≤ 0,05).
En las interacciones se puede observar que los tratamientos con los HE poseen mayor diámetro de tallo que los tratamientos sin inoculación. Este efecto se observó tanto en “Maradol” como en “Intenzza” (Tabla 4).
Al respecto, Baron et al. (2020) reportaron que la inoculación de P. lilacinum (cepa LSM 24) incrementó la cantidad de P disponible en el suelo de cultivo de Maíz (Zea mays), aumentó la cantidad de N del extracto de raíz de la planta e incrementó la biomasa seca de la raíz. Estos resultados confirman el efecto favorable del P. lilacinum para el crecimiento vegetal a través de la solubilización de P inorgánico del suelo. Otro mecanismo involucrado en la promoción del crecimiento vegetal a través de la solubilización de P es la producción de sideróforos. Estos compuestos son quelantes de hierro de bajo peso molecular y alta afinidad (Patiño-Torres & Sanclemente-Reyes, 2014). Los sideróforos son los encargados de transportar el hierro a través de la membrana celular y son producidos tanto por P. lilacinum (Moreno-Salazar et al., 2020) como por B. brongniartii (Toscano-Verduzco et al., 2020), y están involucrados en la absorción de elementos esenciales.
3.4 Área foliar y biomasa aérea y radicular
Para el área foliar, únicamente el factor variedad obtuvo una diferencia significativa. El híbrido “Intenzza” (4,2 cm2) mostró mayor área foliar en comparación con la var. “Maradol” (2,61 cm2). Para el peso fresco aéreo (0,63 g) y radicular (0,45 g), “Intenzza” mostró los valores más altos (P < 0,05) en comparación con “Maradol” (aéreo = 0,55 g y radicular = 0,45 g). Mientras que, para el peso seco, únicamente la parte aérea en “Intenzza” (0,070 g) fue mayor (P < 0,05) comparado con “Maradol” (0,049 g). El peso seco radicular resultó igual en ambas variedades, sugiriendo una igualdad en biomasa seca (Tabla 5).
La inoculación de B. brongniartii y P. lilacinum no posee efecto (P < 0,05) en el área foliar de los germoplasmas de C. papaya. Por otra parte, para el caso de la biomasa fresca aérea y radicular, la inoculación de ambos HE favoreció un mayor peso en la biomasa comparado con el control. Se encontraron incrementos en la biomasa fresca radicular y aérea de 28,5% y 35,4%, respectivamente, al inocular cualquiera de los dos entomopatógenos. Par la biomasa seca, únicamente la parte aérea mostró un incremento en peso al inocular ambos hongos respecto al control; el incremento de la biomasa seca fue de 84,21% y 89,47% al inocular B. brongniartii y P. lilacinum, respectivamente (Tabla 5).
La interacción entre variedad y biofertilizante únicamente mostró un efecto significativo en el peso seco aéreo. Los tratamientos “Intenzza” + B. brongniartii (0,077 g) e “Intenzza” + P. lilacinum (0,078 g) obtuvieron mayor (P = 0,0082) peso seco aéreo a comparación de los tratamientos “Maradol” + B. brongniartii (0,063 g), “Maradol” (0,019 g) e “Intenzza” (0,057 g). Sin embargo, la inoculación de P. lilacinum en la var. “Maradol” permitió alcanzar los valores más altos e igualar significativamente al híbrido “Intenzza” (0,066 g, Tabla 5).
En un estudio previo, Nesha & Siddiqui (2017) reportaron que P. lilacinum incrementó la biomasa fresca y seca de zanahoria al inocularlo como tratamiento contra la pudrición blanda. En otro estudio similar, Kumar et al. (2018) reportaron que Lecanicillium psalliotae, en plantas de Elettaria cardamomum (cardamomo), aumentó el crecimiento de las plantas liberando fosfatos de forma fija. Asimismo, Gallou et al. (2011) indican que los hongos confieren beneficios a las plantas al aumentar la absorción de P en sus raíces a través de la actividad enzimática de las fosfatasas ácida y alcalina (Jung et al., 2012).
3.5 Contenido de clorofila
El germoplasma no influyó en el contenido de clorofilas A, B y total. Tanto “Maradol” e “Intenzza” sintetizaron bioquímicamente la misma cantidad del pigmento (Tabla 6). La clorofila A en plantas de papaya se incrementó (P = 0,0024) con la inoculación de P. lilacinum (1,52 mg/g peso fresco) en comparación con la inoculación de B. brongniartii (0,80 mg/g peso fresco) y el control (1,06 mg/g peso fresco). La clorofila B no presentó diferencia significativa entre los niveles del factor biofertilizante. Mientras que la clorofila total si presentó diferencia significativa, el valor más bajo se encontró en las plantas inoculadas con B. brongniartii (1,16 mg/g peso fresco) en comparación con la inoculación de P. lilacinum (2,56 mg/g peso fresco) e inclusive con el control (2,05 mg/g peso fresco, Tabla 6). Las interacciones entre los dos factores (Germoplasma y biofertilizante) no presentaron diferencias significativas para el contenido de clorofila (Tabla 6).
De este modo, P. lilacinum favoreció el incremento de la clorofila A en plantas de papaya. Este resultado ha sido reportado en Zanahoria, al inocular P. lilacinum en plantas con presencia de nematodos agalladores, el contenido de clorofila incrementa en las plantas inoculadas en comparación con las no inoculadas (Nesha & Siddiqui 2017). Otros autores reportan resultados similares con otros bioinoculantes. Por ejemplo, Chiquito-Contreras et al. (2018) obtuvieron un incremento del contenido de cloro fila en las plantas de albahaca al inocular los hongos micorrízicos, los cuales incrementaron la tasa foto sintética y la absorción de nutrientes (N, P, K y C) en raíces colonizadas.
3.6 Índices de calidad de las plantas
La relación BSA/BSR resultó estadísticamente significativa (P = 0,00001). El híbrido “Intenzza” obtuvo el valor más alto con 2,28 en relación con la var. “Maradol” con 1,76. El ILIG (P = 0,4753), IE (P = 0,8831) y ICD (P = 0,8881) no mostraron diferencia significativa, asumiendo que ambas variedades poseen la misma calidad de planta (Tabla 7). Ambas especies de micromicetos permitieron una mayor relación BSA/BSR (P = 0,00001) en relación con las plantas sin inoculación. Esto sugiere que la aplicación de B. brongniartii y P. lilacinum en plantas de C. papaya incrementa su biomasa. Esto se refuerza con el ILIG, donde B. brongniartii permitió un mayor (P = 0,0128) valor (10,6%) en comparación a las plantas no inoculadas (7,0%). Sin embargo, resultó estadísticamente igual a las plantas inoculadas con P. lilacinum (9,3%). El IE no presentó diferencia estadística significativa (P = 0,3694). Para el ICD, únicamente el factor HE presentó diferencia significativa (P = 0,0433). Las plantas inoculadas con B. brongniartii (0,031) presentaron mayor calidad que las no inoculadas (0,016), es decir, obtuvieron un 112,5% mayor calidad. Sin embargo, estadísticamente plantas inoculadas con B. brongniartii presentaron la misma calidad que las inoculadas con P. lilacinum (0,021) y estas últimas iguales al control (0,016, Tabla 7).
Tabla 6 Contenido de clorofila (mg/g de peso fresco) en plantas de Carica papaya inoculadas con biofertilizantes
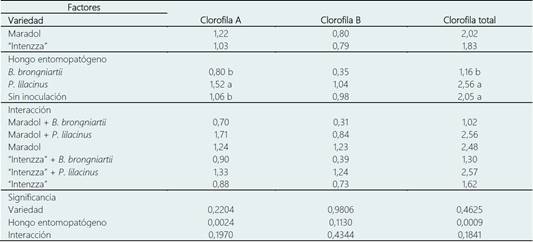
Medias con diferente literal entre filas son significativamente diferentes entre sí, de acuerdo con la diferencia mínima significativa (P ≤ 0,05).
Tabla 7 Índices de calidad de plantas de Carica papaya inoculadas con biofertilizantes
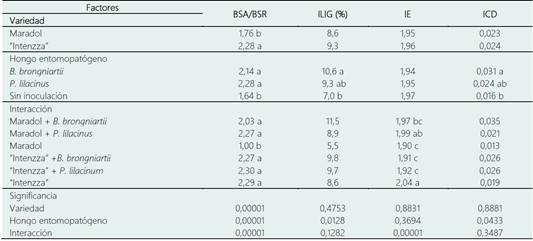
Medias con diferente literal entre filas son significativamente diferentes entre sí, de acuerdo con la diferencia mínima significativa (P ≤ 0,05). BSA = biomasa seca aérea, BSR=biomasa seca radicular, ILIG = índice de lignificación, IE = índice de esbeltez e ICD = índice de calidad de Dickson.
Todas las interacciones y el híbrido “Intenzza” obtuvieron la misma relación BSA/BSR en un rango ente 2,03 y 2,30, estos valores resultaron estadísticamente mayores (P = 0,00001) al obtenido por la var. “Maradol” (0,055). El ILIG no presentó diferen cia estadística significativa (P = 0,1282). En cuanto al IE, se observó diferencias significativas en las interacciones. El híbrido “Intenzza” presentó el mayor IE (2,04) respecto a la mayoría de los tratamientos (rango de 1,90 - 1,97), excepto con “Maradol” + P. lilacinum (1,99); este resultado indica que al aplicar P. lilacinum a la var. “Maradol”, este logra el mismo IE respecto al híbrido “Intenzza”. Finalmente, para el ICD, las interacciones no presentaron diferencia estadística significativa (P = 0,3487, Tabla 7).
Para la producción de plantas de calidad, Caballero-Álvarez (2012) menciona que el uso de materiales orgánicos (lombricomposta, humus de lombriz etc.) o microorganismos benéficos (HE y/o HMA) representa un alto potencial debido a la capacidad de promoción de crecimiento y nutrición de estos microorganismos hacia la planta; es por ello la importancia de buenas prácticas agrícolas desde la fase de vivero. La utilización de semillas de alta calidad genética, fisiológica, física, sanitaria para una buena emergencia y vigor, son otras de las características necesarias para el estableci miento y producción de plantas de calidad. Esto resalta a los resultados obtenidos en el presente es tudio, donde se encontraron diferencias significati vas en las plantas inoculadas B. brongniartii y P. lilacinum en comparación con las plantas no inoculadas.
3.7 Colonización endofítica
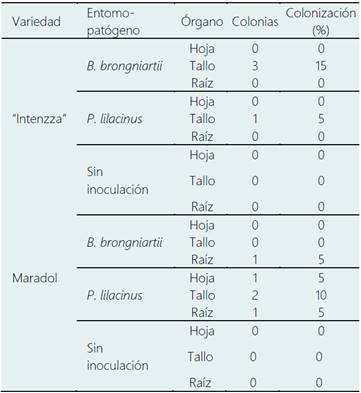
Se observó colonización solo en las plántulas inoculadas, particularmente B. brongniartii (15%) y P. lilacinum (5%) colonizaron los tallos del híbrido “Intenzza”, mientras que en la var. “Maradol”, B. brongniartii colonizó la raíz (5%), entretanto P. lilacinum colonizó hojas (5%), tallos (10%) y raíces (5%) (Tabla 8,Figura 1). Bonilla (2012) reportó que Beauveria bassiana, Metarhizium anisopliae y Lecanicillium lecanii poseen la habilidad para colonizar individualmente hojas de frijol, encontrando porcentajes de colonización entre 4% a 16%.
En el presente estudio, B. brongniartii y P. lilacinum lograron colonizar de 5% a 15% en los diferentes órganos tejidos de C. papaya. La diferencia de resultados podría deberse a la tasa de crecimiento diferencial y capacidad endofítica de cada cepa de hongo asociada con diferente planta hospedera.
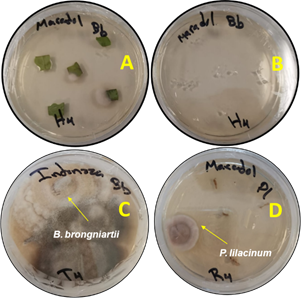
Figura 1 Colonización de Beauveria brongniartii y Purpureocillium lilacinum en hoja y raíz de Carica papaya. A) Crecimiento de micelio endófito en hoja, B) Control de esterilidad, C) Crecimiento de B. brongniartii a partir de raíz y D) crecimiento de P. lilacinum a partir de raíz.
Aunado a esto, Jaber & Enkerli (2017) reportaron que la disminución del porcentaje de colonización endofítica corresponde a la competencia con la microbiota natural presente en el soporte (sustrato o suelo) no estéril o a diversos microorganismos fitopatógenos presentes en el sistema de producción de planta. En el presente estudio, se observó lo anterior, ya que las plantas de papaya presentaron hongos fitopatógenos, los cuales posiblemente impidieron una mayor colonización.
4. Conclusiones
La inoculación de Beauveria brongniartii incrementó el porcentaje de emergencia, altura de planta, diámetro de tallo, peso fresco aéreo y radicular, contenido de clorofila A y total, índice de lignificación, índice de calidad de planta (índice de Dickson) y la relación biomasa aérea y radicular de los genotipos de C. papaya. Mientras que P. lilacinum incrementó la altura de planta, diámetro de tallo, peso fresco aéreo y radicular y la relación biomasa aérea y radicular de los genotipos de C. papaya. Tanto B. brongniartii como P. lilacinum se encontraron colonizando el tallo del híbrido “Intenzza”. En la variedad “Maradol”, B. brongniartii soló colonizó la raíz de la planta, por el contrario, P. lilacinum colonizó la raíz, el tallo y las hojas de la variedad “Maradol”. Estos resultados son útiles para los productores de plantas de papaya en vivero, puesto que las dos especies de entomopatógenos son capaces de mejorar la calidad de plantas de papaya, emplear plantas con hongos endófitos podría ser útil para el manejo integrado de plagas y enfermedades. Por lo tanto, los siguientes estudios con ambos HE se deben enfocar en la formulación de productos biológicos (polvo humectable o solución emulsificable) a base estas o ambas especies para su estudio bajo condiciones in situ en la producción de genotipos de papaya.